2024年舟山市高考化学二轮复习之物质的检验与鉴别(含答案)
文档属性
| 名称 | 2024年舟山市高考化学二轮复习之物质的检验与鉴别(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-24 15:04:11 | ||
图片预览

文档简介
2024年舟山市高考化学二轮复习之物质的检验与鉴别
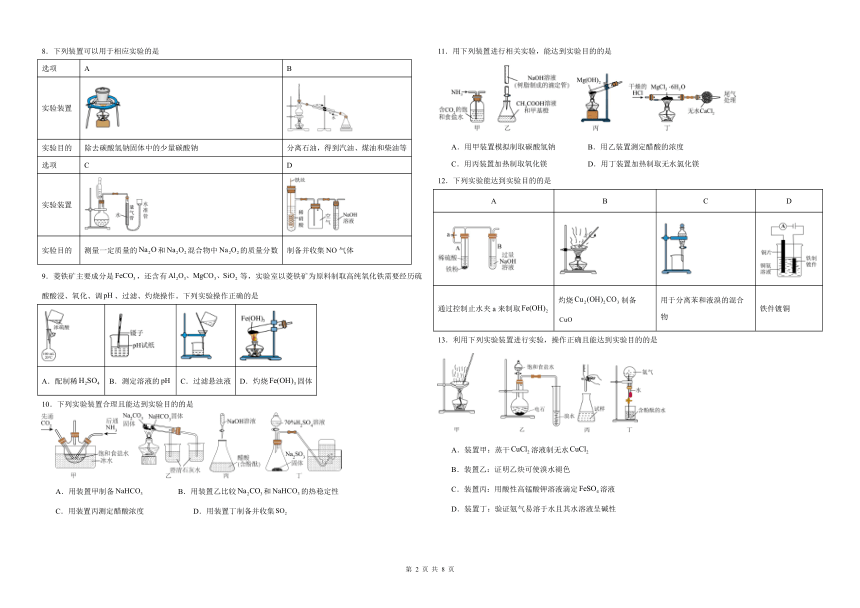
1.用下列仪器或装置进行相应实验,能达到实验目的的是
配置一定物质的量浓度的NaOH溶液 可用于灼烧碎海带 可用于除去SO2中的HCl 可用于测定盐酸浓度
A B C D
2.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)
A B C D
检验溶液中是否有 制备晶体 检验1-氯丁烷中氯元素 加热熔融固体
3.探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案 现象 结论
A 往碘的溶液中加入等体积的浓溶液,振荡 分层,下层由紫红色变为浅粉红色,上层呈棕黄色 碘在浓溶液中的溶解能力大于在中的溶解能力
B 用玻璃棒蘸取次氯酸钠溶液点在试纸上 试纸变白 次氯酸钠溶液呈中性
C 向溶液中先滴加4滴0.1mol L-1KCl溶液,观察现象,振荡试管,再滴加4滴溶液 先产生白色沉淀,再产生黄色沉淀 转化为,溶解度小于溶解度
D 将CH3CH2X(卤代烃)与NaOH溶液共热,冷却后取上层水溶液,加入AgNO3溶液 观察沉淀颜色 证明CH3CH2X中的卤素原子的种类
4.下列装置能达到实验目的的是
A.用甲装置鉴别Br2(g)和NO2(g) B.用乙装置除去水中的苯酚
C.用丙装置收集Cl2 D.用丁装置灼烧Fe(OH)3固体制得Fe2O3
5.化学实验操作是进行科学实验的基础。下列操作合理的是
A.分离乙醇和乙酸 B.由海水制取蒸馏水 C.药品柜中试剂存放 D.由制取无水FeCl3固体
6.下列实验中,能达到相应实验目的的是
A.钠的燃烧反应 B.证明非金属性:S>C> Si C.关闭止水夹a,打开活塞b,可检查装置气密性 D.吸收多余的HCl气体
7.下列操作或装置不能达到实验目的的是
A.定容 B.蒸干硫酸铝溶液制备 C.喷泉实验 D.提纯苯甲酸
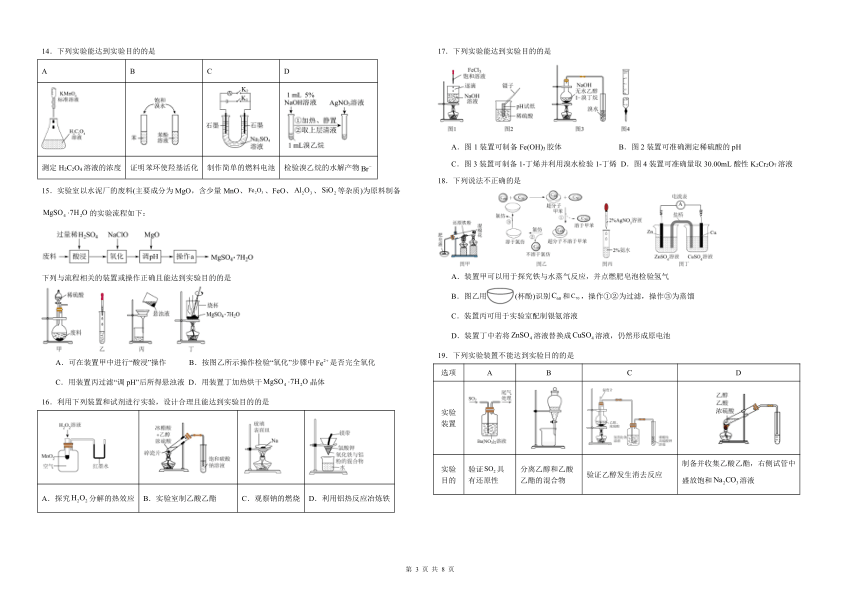
8.下列装置可以用于相应实验的是
选项 A B
实验装置
实验目的 除去碳酸氢钠固体中的少量碳酸钠 分离石油,得到汽油、煤油和柴油等
选项 C D
实验装置
实验目的 测量一定质量的和混合物中的质量分数 制备并收集气体
9.菱铁矿主要成分是,还含有等,实验室以菱铁矿为原料制取高纯氧化铁需要经历硫酸酸浸、氧化、调、过滤、灼烧操作。下列实验操作正确的是
A.配制稀 B.测定溶液的 C.过滤悬浊液 D.灼烧固体
10.下列实验装置合理且能达到实验目的的是
A.用装置甲制备 B.用装置乙比较和的热稳定性
C.用装置丙测定醋酸浓度 D.用装置丁制备并收集
11.用下列装置进行相关实验,能达到实验目的的是
A.用甲装置模拟制取碳酸氢钠 B.用乙装置测定醋酸的浓度
C.用丙装置加热制取氧化镁 D.用丁装置加热制取无水氯化镁
12.下列实验能达到实验目的的是
A B C D
通过控制止水夹a来制取 灼烧制备 用于分离苯和液溴的混合物 铁件镀铜
13.利用下列实验装置进行实验,操作正确且能达到实验目的的是
A.装置甲:蒸干溶液制无水
B.装置乙:证明乙炔可使溴水褪色
C.装置丙:用酸性高锰酸钾溶液滴定溶液
D.装置丁:验证氨气易溶于水且其水溶液呈碱性
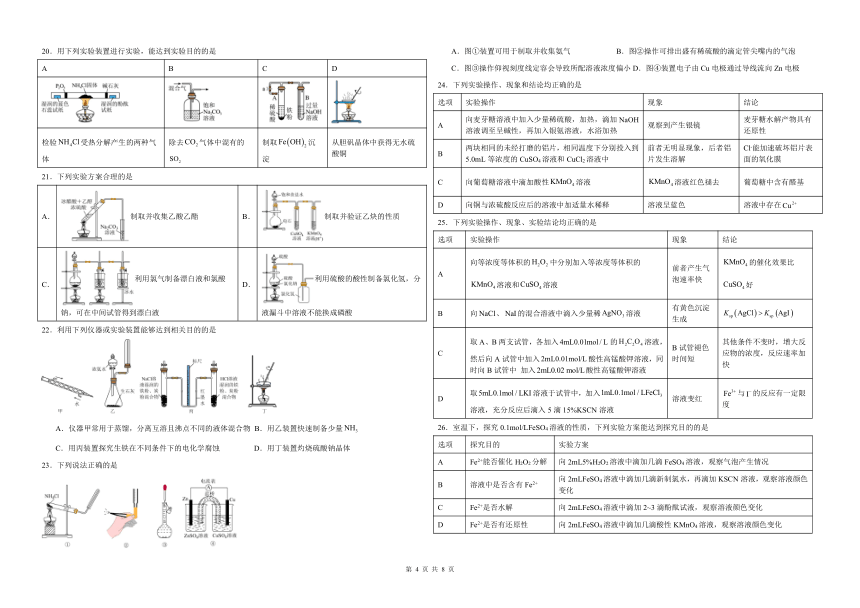
14.下列实验能达到实验目的的是
A B C D
测定H2C2O4溶液的浓度 证明苯环使羟基活化 制作简单的燃料电池 检验溴乙烷的水解产物
15.实验室以水泥厂的废料(主要成分为MgO,含少量MnO、、FeO、、等杂质)为原料制备的实验流程如下:
下列与流程相关的装置或操作正确且能达到实验目的的是
A.可在装置甲中进行“酸浸”操作 B.按图乙所示操作检验“氧化”步骤中是否完全氧化
C.用装置丙过滤“调pH”后所得悬浊液 D.用装置丁加热烘干晶体
16.利用下列装置和试剂进行实验,设计合理且能达到实验目的的是
A.探究分解的热效应 B.实验室制乙酸乙酯 C.观察钠的燃烧 D.利用铝热反应冶炼铁
17.下列实验能达到实验目的的是
A.图1装置可制备Fe(OH)3胶体 B.图2装置可准确测定稀硫酸的pH
C.图3装置可制备1-丁烯并利用溴水检验1-丁烯 D.图4装置可准确量取30.00mL酸性K2Cr2O7溶液
18.下列说法不正确的是
A.装置甲可以用于探究铁与水蒸气反应,并点燃肥皂泡检验氢气
B.图乙用(杯酚)识别和,操作①②为过滤,操作③为蒸馏
C.装置丙可用于实验室配制银氨溶液
D.装置丁中若将溶液替换成溶液,仍然形成原电池
19.下列实验装置不能达到实验目的的是
选项
实验装置
实验目的 验证具有还原性 分离乙醇和乙酸乙酯的混合物 验证乙醇发生消去反应 制备并收集乙酸乙酯,右侧试管中盛放饱和溶液
20.用下列实验装置进行实验,能达到实验目的的是
A B C D
检验受热分解产生的两种气体 除去气体中混有的 制取沉淀 从胆矾晶体中获得无水硫酸铜
21.下列实验方案合理的是
A. 制取并收集乙酸乙酯 B. 制取并验证乙炔的性质
C. 利用氯气制备漂白液和氯酸钠,可在中间试管得到漂白液 D. 利用硫酸的酸性制备氯化氢,分液漏斗中溶液不能换成磷酸
22.利用下列仪器或实验装置能够达到相关目的的是
A.仪器甲常用于蒸馏,分离互溶且沸点不同的液体混合物 B.用乙装置快速制备少量
C.用丙装置探究生铁在不同条件下的电化学腐蚀 D.用丁装置灼烧硫酸钠晶体
23.下列说法正确的是
A.图①装置可用于制取并收集氨气 B.图②操作可排出盛有稀硫酸的滴定管尖嘴内的气泡
C.图③操作仰视刻度线定容会导致所配溶液浓度偏小D.图④装置电子由Cu电极通过导线流向Zn电极
24.下列实验操作、现象和结论均正确的是
选项 实验操作 现象 结论
A 向麦芽糖溶液中加入少量稀硫酸,加热,滴加NaOH溶液调至呈碱性,再加入银氨溶液,水浴加热 观察到产生银镜 麦芽糖水解产物具有还原性
B 两块相同的未经打磨的铝片,相同温度下分别投入到5.0mL等浓度的CuSO4溶液和CuCl2溶液中 前者无明显现象,后者铝片发生溶解 Cl-能加速破坏铝片表面的氧化膜
C 向葡萄糖溶液中滴加酸性溶液 溶液红色褪去 葡萄糖中含有醛基
D 向铜与浓硫酸反应后的溶液中加适量水稀释 溶液呈蓝色 溶液中存在
25.下列实验操作、现象、实验结论均正确的是
选项 实验操作 现象 结论
A 向等浓度等体积的中分别加入等浓度等体积的溶液和溶液 前者产生气泡速率快 的催化效果比好
B 向、的混合溶液中滴入少量稀溶液 有黄色沉淀生成
C 取A、B两支试管,各加入的溶液,然后向A试管中加入酸性高锰酸钾溶液,同时向B试管中 加入酸性高锰酸钾溶液 B试管褪色时间短 其他条件不变时,增大反应物的浓度,反应速率加快
D 取溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液 溶液变红 与的反应有一定限度
26.室温下,探究0.1mol/LFeSO4溶液的性质,下列实验方案能达到探究目的的是
选项 探究目的 实验方案
A Fe2+能否催化H2O2分解 向2mL5%H2O2溶液中滴加几滴FeSO4溶液,观察气泡产生情况
B 溶液中是否含有Fe2+ 向2mLFeSO4溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化
C Fe2+是否水解 向2mLFeSO4溶液中滴加2~3滴酚酞试液,观察溶液颜色变化
D Fe2+是否有还原性 向2mLFeSO4溶液中滴加几滴酸性KMnO4溶液,观察溶液颜色变化
27.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向FeBr2溶液中通入少量Cl2 溶液由浅绿色变为黄色 氧化性:Cl2>Br2
B 向Na2SO3溶液中滴加盐酸 有气体产生 非金属性:Cl>S
C 向pH=3的HA和HB溶液中分别加水稀释至100倍 pH(HA)>pH(HB) 酸性:HA>HB
D 向重晶石中加入饱和碳酸钠溶液 重晶石逐渐溶解 溶度积:Ksp(BaCO3)28.探究铁及其化合物的性质,下列实验方案、现象或结论不正确的是
选项 实验方案 现象 结论
A 溶液滴加浓盐酸 溶液颜色加深 氢离子抑制了的水解
B 乙酰水杨酸水解液中加入过量的除去过量的硫酸,滴加几滴氯化铁溶液 溶液显紫色 说明乙酰水杨酸中含有酚羟基
C 向氢氧化铁胶体中逐滴加入稀硫酸至过量 先产生沉淀后逐渐溶解 先聚集为沉淀,后与应
D 向溶液中加入少许铁粉,静置一段时间 有蓝色沉淀生成 具有氧化性
29.下列实验方案设计、现象和结论都正确的是
实验目的 方案设计 现象或结论
A 探究反应物浓度对化学反应速率的影响 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察现象 浓度大的NaHSO3溶液中气泡产生的速率快
B 测定中和反应的反应热 将50mL0.50mol/L氢氧化钠溶液,分批次倒入盛有50mL0.50mol/L盐酸的量热计内筒中 根据反应前后的温度变化和比热容等数值可计算中和反应的反应热
C 探究影响化学平衡移动的因素 向FeCl3和KSCN的混合溶液中,加入KCl固体 其他条件不变时,增大的浓度,平衡不移动
D 探究KI与FeCl3反应的限度 取1mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3溶液,充分反应后滴入5滴15%KSCN溶液 若溶液变血红色,则KI与FeCl3的反应有一定限度
30.根据下列实验操作和现象所得到的结论错误的是
实验操作和现象 实验结论
A 向2mL溶液中滴加3滴NaOH溶液,再滴加4滴0.1mol.L-1FeCl3溶液,白色沉淀转化为红褐色 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
B 向盛有某溶液的试管中加入NaOH溶液并加热,将湿润的红色石蕊试纸放在试管口,试纸变蓝 某溶液中含有
C 向1-溴丙烷中加入KOH溶液,加热并充分振荡,然后取少量液体滴入AgNO3溶液,出现棕黑色沉淀 1-溴丙烷中混有杂质
D 铜与浓硫酸在加热条件下反应一段时间,冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,溶液颜色为蓝色 铜与浓硫酸生成了硫酸铜
31.下列探究卤族元素单质及其化合物性质的实验方案能达到目的的是
选项 探究目的 实验方案
A 溴乙烷发生消去反应 将溴乙烷和NaOH的乙醇溶液混合后加热,产生的气体经水洗后,再通入酸性溶液中,观察酸性溶液的颜色变化
B Ksp(AgI)C 氯气与水的反应存在限度 取两份新制氯水,分别滴加溶液和淀粉KI溶液,观察生成物的颜色
D NaClO溶液的酸碱性 用玻璃棒蘸取NaClO溶液点滴在pH试纸上,再与标准比色卡对照
32.下列实验操作对应的现象和根据现象得出的结论不正确的是
选项 实验操作 现象 结论
A 向2mL0.1mol/LFeI2溶液中依次滴加少量氯水和CCl4,振荡,静置 溶液分层,下层呈紫红色 还原性:Fe2+<I-
B 往NaAlO2溶液中滴加NaHCO3溶液 产生白色沉淀 结合H+的能力:AlO>CO
C 用pH计测定0.1mol/LNaHCO3溶液和0.1mol/LCH3COONa溶液的pH NaHCO3(aq)为8.3,CH3COONa(aq)为8.9 水解常数:Kh(HCO)<Kh(CH3COO-)
D 甲、乙试管均盛有2mL等浓度银氨溶液,分别加入2滴等浓度的NaCl溶液和NaI溶液 甲中无明显现象,乙中产生黄色沉淀 溶度积常数:Ksp(AgI)<Ksp(AgCl)
33.下列操作能达到目的的是
选项 操作 目的
A 向10 mL0.1 mol·L-1草酸溶液中先滴加1 mL0.1 mol·L-1KMnO4溶液,再滴加1 mL 0.2 mol·L-1KMnO4溶液 探究浓度对反应速率的影响
B 分别用pH计测定0.1 mol·L-1的HOCH2COOH溶液在25 °C、45 °C时的pH(浓度变化不考虑) 探究温度对电离平衡的影响
C 将铁、铜片插入浓硝酸(常温)构成原电池,并连接电流计 验证原电池中较活泼金属为负极
D 向物质的量浓度均为1 mol·L-1的Na2CO3和Na2SO4混合液中加入等体积的过量AgNO3溶液 探究 Ag2CO3和Ag2SO4溶度积的大小
34.下列实验目的、方案设计和现象、结论都正确的是
实验目的 方案设计和现象 结论
A 比较KMnO4、Cl2和Fe3+的氧化性 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 氧化性:KMnO4>Cl2>Fe3+
B 检验某溶液中是否含有Fe2+ 取少量待检液于试管中,先滴加新制氯水,再滴加KSCN溶液,变为红色溶液 该溶液一定含有Fe2+
C 比较Ksp(AgCl)、Ksp(AgI)的大小 向5ml0.1mol.L-1NaCl溶液中滴入一滴0.1mol.L-1AgNO3溶液,出现白色沉淀,继续滴入一滴0.1mol.L-1KI溶液,沉淀变为黄色。 Ksp(AgCl)大于Ksp(AgI)
D 检验某有机物(如图)中含有醛基 取少量待检液于试管中,滴加酸性KMnO4溶液,紫红色褪去 该有机物中含有醛基
35.下列实验操作、现象均正确,且能得到相应实验结论的是
选项 实验操作 实验现象 实验结论
A 将Ag2O分别加入浓氨水和稀硝酸中 Ag2O均溶解 Ag2O属于两性氧化物
B 石蜡油加强热,将产生的气体通入Br2的CCl4溶液 溶液由红棕色变为无色 气体中含有不饱和烃
C 向蔗糖溶液中加入稀硫酸并加热一段时间,然后滴加银氨溶液 无银镜产生 蔗糖未水解
D 取某待测液进行焰色试验,透过蓝色钴玻璃观察火焰颜色 火焰呈紫色 该溶液为钾盐溶液
36.下列实验方案能达到实验目的的是
选项 实验目的 实验方案
A 证明氧化性;Br2>I2 向KI溶液中加入少量溴水,振荡,再加入CCl4充分振荡后,观察下层溶液的颜色
B 检验CH3CH2Br中的溴元素 将CH3CH2Br与NaOH溶液混合加热,静置,向上层清液加入AgNO3溶液,观察是否生成浅黄色沉淀
C 证明蔗糖与浓硫酸反应产生的气体中含CO2 将气体通入澄清石灰水中,观察是否生成白色沉淀
D 用NaCl固体配制100mL1.00mol·L-1NaCl溶液 将5.85gNaCl固体放在烧杯中,加入100mL蒸馏水,搅拌
37.根据实验操作及现象,得出结论正确的是
选项 实验操作及现象 结论
A 向某溶液中加入稀NaOH溶液,将湿润的红色石蕊试纸放在试管口,试纸不变蓝 该溶液中不含
B 在烧瓶中加入木炭颗粒和浓硝酸,加热,烧瓶中有大量红棕色气体产生 浓硝酸具有强氧化性,能氧化木炭,自身被还原为
C 向圆底烧瓶中加入NaOH和无水乙醇,搅拌,再加入1-溴丁烷,微热。将产生的气体通入酸性溶液,溶液褪色 1-溴丁烷消去反应的产物含有碳碳双键
D 将钠在燃烧匙中点燃,伸入到盛有的集气瓶中,产生大量白烟,瓶内有黑色颗粒生成 钠具有强还原性,瓶内发生了置换反应
38.根据下列实验操作和现象能得到相应结论的是
选项 操作和现象 结论
A 向漂白粉溶液中通入SO2,产生白色沉淀 酸性:H2SO3>HClO
B 常温下,分别测定1 mol·L–1CH3COONH4溶液和0.1 mol·L–1 CH3COONH4溶液的pH,测得pH都等于7 同温下,不同浓度CH3COONH4溶液中水的电离程度相同
C 10 mL 0.1 mol·L–1FeCl3溶液和10 mL 0.1 mol·L–1KI溶液充分反应后分成两等份,一份加入2滴KSCN溶液,溶液变红;另一份加入2滴淀粉溶液,溶液变蓝 FeCl3和KI的反应存在限度
D 向露置在空气中的Na2O2固体中加入稀盐酸,产生气泡 Na2O2固体已经变质
39.下列实验方案设计、现象和结论都正确的是
方案设计 现象 结论
A 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液 产生蓝色沉淀 食品脱氧剂样品中没有+3价铁
B 将银和溶液与铜和溶液组成原电池。 连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
C 用玻璃棒蘸取次氯酸钠溶液点在pH试纸上 试纸变白 次氯酸钠溶液呈中性
D 溴乙烷与氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液中 酸性高锰酸钾溶液的紫红色褪去 溴乙烷发生消去反应
40.下列实验设计及现象能达到实验目的的是
选项 实验目的 实验设计及现象
A 证明气体中存在平衡 压缩盛有气体的注射器至原来体积的一半,红棕色变浅
B 比较室温下、溶度积的大小 向溶液中滴加少量NaOH溶液,充分振荡后,再滴加几滴溶液,白色沉淀逐渐转化为蓝色
C 比较和的氧化性强弱 常温下,向溶液中加入溶液,将带火星的木条放在试管口,木条复燃
D 证明反应生成乙烯 乙醇和浓硫酸共热至170℃,将产生的气体通入酸性高锰酸钾溶液中,溶液紫色褪去
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C B A A B B D C C B
题号 11 12 13 14 15 16 17 18 19 20
答案 D A D C A A C C B A
题号 21 22 23 24 25 26 27 28 29 30
答案 B C C B D D C A C C
题号 31 32 33 34 35 36 37 38 39 40
答案 A C B C B A D C B B
1.用下列仪器或装置进行相应实验,能达到实验目的的是
配置一定物质的量浓度的NaOH溶液 可用于灼烧碎海带 可用于除去SO2中的HCl 可用于测定盐酸浓度
A B C D
2.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)
A B C D
检验溶液中是否有 制备晶体 检验1-氯丁烷中氯元素 加热熔融固体
3.探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案 现象 结论
A 往碘的溶液中加入等体积的浓溶液,振荡 分层,下层由紫红色变为浅粉红色,上层呈棕黄色 碘在浓溶液中的溶解能力大于在中的溶解能力
B 用玻璃棒蘸取次氯酸钠溶液点在试纸上 试纸变白 次氯酸钠溶液呈中性
C 向溶液中先滴加4滴0.1mol L-1KCl溶液,观察现象,振荡试管,再滴加4滴溶液 先产生白色沉淀,再产生黄色沉淀 转化为,溶解度小于溶解度
D 将CH3CH2X(卤代烃)与NaOH溶液共热,冷却后取上层水溶液,加入AgNO3溶液 观察沉淀颜色 证明CH3CH2X中的卤素原子的种类
4.下列装置能达到实验目的的是
A.用甲装置鉴别Br2(g)和NO2(g) B.用乙装置除去水中的苯酚
C.用丙装置收集Cl2 D.用丁装置灼烧Fe(OH)3固体制得Fe2O3
5.化学实验操作是进行科学实验的基础。下列操作合理的是
A.分离乙醇和乙酸 B.由海水制取蒸馏水 C.药品柜中试剂存放 D.由制取无水FeCl3固体
6.下列实验中,能达到相应实验目的的是
A.钠的燃烧反应 B.证明非金属性:S>C> Si C.关闭止水夹a,打开活塞b,可检查装置气密性 D.吸收多余的HCl气体
7.下列操作或装置不能达到实验目的的是
A.定容 B.蒸干硫酸铝溶液制备 C.喷泉实验 D.提纯苯甲酸
8.下列装置可以用于相应实验的是
选项 A B
实验装置
实验目的 除去碳酸氢钠固体中的少量碳酸钠 分离石油,得到汽油、煤油和柴油等
选项 C D
实验装置
实验目的 测量一定质量的和混合物中的质量分数 制备并收集气体
9.菱铁矿主要成分是,还含有等,实验室以菱铁矿为原料制取高纯氧化铁需要经历硫酸酸浸、氧化、调、过滤、灼烧操作。下列实验操作正确的是
A.配制稀 B.测定溶液的 C.过滤悬浊液 D.灼烧固体
10.下列实验装置合理且能达到实验目的的是
A.用装置甲制备 B.用装置乙比较和的热稳定性
C.用装置丙测定醋酸浓度 D.用装置丁制备并收集
11.用下列装置进行相关实验,能达到实验目的的是
A.用甲装置模拟制取碳酸氢钠 B.用乙装置测定醋酸的浓度
C.用丙装置加热制取氧化镁 D.用丁装置加热制取无水氯化镁
12.下列实验能达到实验目的的是
A B C D
通过控制止水夹a来制取 灼烧制备 用于分离苯和液溴的混合物 铁件镀铜
13.利用下列实验装置进行实验,操作正确且能达到实验目的的是
A.装置甲:蒸干溶液制无水
B.装置乙:证明乙炔可使溴水褪色
C.装置丙:用酸性高锰酸钾溶液滴定溶液
D.装置丁:验证氨气易溶于水且其水溶液呈碱性
14.下列实验能达到实验目的的是
A B C D
测定H2C2O4溶液的浓度 证明苯环使羟基活化 制作简单的燃料电池 检验溴乙烷的水解产物
15.实验室以水泥厂的废料(主要成分为MgO,含少量MnO、、FeO、、等杂质)为原料制备的实验流程如下:
下列与流程相关的装置或操作正确且能达到实验目的的是
A.可在装置甲中进行“酸浸”操作 B.按图乙所示操作检验“氧化”步骤中是否完全氧化
C.用装置丙过滤“调pH”后所得悬浊液 D.用装置丁加热烘干晶体
16.利用下列装置和试剂进行实验,设计合理且能达到实验目的的是
A.探究分解的热效应 B.实验室制乙酸乙酯 C.观察钠的燃烧 D.利用铝热反应冶炼铁
17.下列实验能达到实验目的的是
A.图1装置可制备Fe(OH)3胶体 B.图2装置可准确测定稀硫酸的pH
C.图3装置可制备1-丁烯并利用溴水检验1-丁烯 D.图4装置可准确量取30.00mL酸性K2Cr2O7溶液
18.下列说法不正确的是
A.装置甲可以用于探究铁与水蒸气反应,并点燃肥皂泡检验氢气
B.图乙用(杯酚)识别和,操作①②为过滤,操作③为蒸馏
C.装置丙可用于实验室配制银氨溶液
D.装置丁中若将溶液替换成溶液,仍然形成原电池
19.下列实验装置不能达到实验目的的是
选项
实验装置
实验目的 验证具有还原性 分离乙醇和乙酸乙酯的混合物 验证乙醇发生消去反应 制备并收集乙酸乙酯,右侧试管中盛放饱和溶液
20.用下列实验装置进行实验,能达到实验目的的是
A B C D
检验受热分解产生的两种气体 除去气体中混有的 制取沉淀 从胆矾晶体中获得无水硫酸铜
21.下列实验方案合理的是
A. 制取并收集乙酸乙酯 B. 制取并验证乙炔的性质
C. 利用氯气制备漂白液和氯酸钠,可在中间试管得到漂白液 D. 利用硫酸的酸性制备氯化氢,分液漏斗中溶液不能换成磷酸
22.利用下列仪器或实验装置能够达到相关目的的是
A.仪器甲常用于蒸馏,分离互溶且沸点不同的液体混合物 B.用乙装置快速制备少量
C.用丙装置探究生铁在不同条件下的电化学腐蚀 D.用丁装置灼烧硫酸钠晶体
23.下列说法正确的是
A.图①装置可用于制取并收集氨气 B.图②操作可排出盛有稀硫酸的滴定管尖嘴内的气泡
C.图③操作仰视刻度线定容会导致所配溶液浓度偏小D.图④装置电子由Cu电极通过导线流向Zn电极
24.下列实验操作、现象和结论均正确的是
选项 实验操作 现象 结论
A 向麦芽糖溶液中加入少量稀硫酸,加热,滴加NaOH溶液调至呈碱性,再加入银氨溶液,水浴加热 观察到产生银镜 麦芽糖水解产物具有还原性
B 两块相同的未经打磨的铝片,相同温度下分别投入到5.0mL等浓度的CuSO4溶液和CuCl2溶液中 前者无明显现象,后者铝片发生溶解 Cl-能加速破坏铝片表面的氧化膜
C 向葡萄糖溶液中滴加酸性溶液 溶液红色褪去 葡萄糖中含有醛基
D 向铜与浓硫酸反应后的溶液中加适量水稀释 溶液呈蓝色 溶液中存在
25.下列实验操作、现象、实验结论均正确的是
选项 实验操作 现象 结论
A 向等浓度等体积的中分别加入等浓度等体积的溶液和溶液 前者产生气泡速率快 的催化效果比好
B 向、的混合溶液中滴入少量稀溶液 有黄色沉淀生成
C 取A、B两支试管,各加入的溶液,然后向A试管中加入酸性高锰酸钾溶液,同时向B试管中 加入酸性高锰酸钾溶液 B试管褪色时间短 其他条件不变时,增大反应物的浓度,反应速率加快
D 取溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液 溶液变红 与的反应有一定限度
26.室温下,探究0.1mol/LFeSO4溶液的性质,下列实验方案能达到探究目的的是
选项 探究目的 实验方案
A Fe2+能否催化H2O2分解 向2mL5%H2O2溶液中滴加几滴FeSO4溶液,观察气泡产生情况
B 溶液中是否含有Fe2+ 向2mLFeSO4溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化
C Fe2+是否水解 向2mLFeSO4溶液中滴加2~3滴酚酞试液,观察溶液颜色变化
D Fe2+是否有还原性 向2mLFeSO4溶液中滴加几滴酸性KMnO4溶液,观察溶液颜色变化
27.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向FeBr2溶液中通入少量Cl2 溶液由浅绿色变为黄色 氧化性:Cl2>Br2
B 向Na2SO3溶液中滴加盐酸 有气体产生 非金属性:Cl>S
C 向pH=3的HA和HB溶液中分别加水稀释至100倍 pH(HA)>pH(HB) 酸性:HA>HB
D 向重晶石中加入饱和碳酸钠溶液 重晶石逐渐溶解 溶度积:Ksp(BaCO3)
选项 实验方案 现象 结论
A 溶液滴加浓盐酸 溶液颜色加深 氢离子抑制了的水解
B 乙酰水杨酸水解液中加入过量的除去过量的硫酸,滴加几滴氯化铁溶液 溶液显紫色 说明乙酰水杨酸中含有酚羟基
C 向氢氧化铁胶体中逐滴加入稀硫酸至过量 先产生沉淀后逐渐溶解 先聚集为沉淀,后与应
D 向溶液中加入少许铁粉,静置一段时间 有蓝色沉淀生成 具有氧化性
29.下列实验方案设计、现象和结论都正确的是
实验目的 方案设计 现象或结论
A 探究反应物浓度对化学反应速率的影响 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察现象 浓度大的NaHSO3溶液中气泡产生的速率快
B 测定中和反应的反应热 将50mL0.50mol/L氢氧化钠溶液,分批次倒入盛有50mL0.50mol/L盐酸的量热计内筒中 根据反应前后的温度变化和比热容等数值可计算中和反应的反应热
C 探究影响化学平衡移动的因素 向FeCl3和KSCN的混合溶液中,加入KCl固体 其他条件不变时,增大的浓度,平衡不移动
D 探究KI与FeCl3反应的限度 取1mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3溶液,充分反应后滴入5滴15%KSCN溶液 若溶液变血红色,则KI与FeCl3的反应有一定限度
30.根据下列实验操作和现象所得到的结论错误的是
实验操作和现象 实验结论
A 向2mL溶液中滴加3滴NaOH溶液,再滴加4滴0.1mol.L-1FeCl3溶液,白色沉淀转化为红褐色 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
B 向盛有某溶液的试管中加入NaOH溶液并加热,将湿润的红色石蕊试纸放在试管口,试纸变蓝 某溶液中含有
C 向1-溴丙烷中加入KOH溶液,加热并充分振荡,然后取少量液体滴入AgNO3溶液,出现棕黑色沉淀 1-溴丙烷中混有杂质
D 铜与浓硫酸在加热条件下反应一段时间,冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,溶液颜色为蓝色 铜与浓硫酸生成了硫酸铜
31.下列探究卤族元素单质及其化合物性质的实验方案能达到目的的是
选项 探究目的 实验方案
A 溴乙烷发生消去反应 将溴乙烷和NaOH的乙醇溶液混合后加热,产生的气体经水洗后,再通入酸性溶液中,观察酸性溶液的颜色变化
B Ksp(AgI)
D NaClO溶液的酸碱性 用玻璃棒蘸取NaClO溶液点滴在pH试纸上,再与标准比色卡对照
32.下列实验操作对应的现象和根据现象得出的结论不正确的是
选项 实验操作 现象 结论
A 向2mL0.1mol/LFeI2溶液中依次滴加少量氯水和CCl4,振荡,静置 溶液分层,下层呈紫红色 还原性:Fe2+<I-
B 往NaAlO2溶液中滴加NaHCO3溶液 产生白色沉淀 结合H+的能力:AlO>CO
C 用pH计测定0.1mol/LNaHCO3溶液和0.1mol/LCH3COONa溶液的pH NaHCO3(aq)为8.3,CH3COONa(aq)为8.9 水解常数:Kh(HCO)<Kh(CH3COO-)
D 甲、乙试管均盛有2mL等浓度银氨溶液,分别加入2滴等浓度的NaCl溶液和NaI溶液 甲中无明显现象,乙中产生黄色沉淀 溶度积常数:Ksp(AgI)<Ksp(AgCl)
33.下列操作能达到目的的是
选项 操作 目的
A 向10 mL0.1 mol·L-1草酸溶液中先滴加1 mL0.1 mol·L-1KMnO4溶液,再滴加1 mL 0.2 mol·L-1KMnO4溶液 探究浓度对反应速率的影响
B 分别用pH计测定0.1 mol·L-1的HOCH2COOH溶液在25 °C、45 °C时的pH(浓度变化不考虑) 探究温度对电离平衡的影响
C 将铁、铜片插入浓硝酸(常温)构成原电池,并连接电流计 验证原电池中较活泼金属为负极
D 向物质的量浓度均为1 mol·L-1的Na2CO3和Na2SO4混合液中加入等体积的过量AgNO3溶液 探究 Ag2CO3和Ag2SO4溶度积的大小
34.下列实验目的、方案设计和现象、结论都正确的是
实验目的 方案设计和现象 结论
A 比较KMnO4、Cl2和Fe3+的氧化性 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 氧化性:KMnO4>Cl2>Fe3+
B 检验某溶液中是否含有Fe2+ 取少量待检液于试管中,先滴加新制氯水,再滴加KSCN溶液,变为红色溶液 该溶液一定含有Fe2+
C 比较Ksp(AgCl)、Ksp(AgI)的大小 向5ml0.1mol.L-1NaCl溶液中滴入一滴0.1mol.L-1AgNO3溶液,出现白色沉淀,继续滴入一滴0.1mol.L-1KI溶液,沉淀变为黄色。 Ksp(AgCl)大于Ksp(AgI)
D 检验某有机物(如图)中含有醛基 取少量待检液于试管中,滴加酸性KMnO4溶液,紫红色褪去 该有机物中含有醛基
35.下列实验操作、现象均正确,且能得到相应实验结论的是
选项 实验操作 实验现象 实验结论
A 将Ag2O分别加入浓氨水和稀硝酸中 Ag2O均溶解 Ag2O属于两性氧化物
B 石蜡油加强热,将产生的气体通入Br2的CCl4溶液 溶液由红棕色变为无色 气体中含有不饱和烃
C 向蔗糖溶液中加入稀硫酸并加热一段时间,然后滴加银氨溶液 无银镜产生 蔗糖未水解
D 取某待测液进行焰色试验,透过蓝色钴玻璃观察火焰颜色 火焰呈紫色 该溶液为钾盐溶液
36.下列实验方案能达到实验目的的是
选项 实验目的 实验方案
A 证明氧化性;Br2>I2 向KI溶液中加入少量溴水,振荡,再加入CCl4充分振荡后,观察下层溶液的颜色
B 检验CH3CH2Br中的溴元素 将CH3CH2Br与NaOH溶液混合加热,静置,向上层清液加入AgNO3溶液,观察是否生成浅黄色沉淀
C 证明蔗糖与浓硫酸反应产生的气体中含CO2 将气体通入澄清石灰水中,观察是否生成白色沉淀
D 用NaCl固体配制100mL1.00mol·L-1NaCl溶液 将5.85gNaCl固体放在烧杯中,加入100mL蒸馏水,搅拌
37.根据实验操作及现象,得出结论正确的是
选项 实验操作及现象 结论
A 向某溶液中加入稀NaOH溶液,将湿润的红色石蕊试纸放在试管口,试纸不变蓝 该溶液中不含
B 在烧瓶中加入木炭颗粒和浓硝酸,加热,烧瓶中有大量红棕色气体产生 浓硝酸具有强氧化性,能氧化木炭,自身被还原为
C 向圆底烧瓶中加入NaOH和无水乙醇,搅拌,再加入1-溴丁烷,微热。将产生的气体通入酸性溶液,溶液褪色 1-溴丁烷消去反应的产物含有碳碳双键
D 将钠在燃烧匙中点燃,伸入到盛有的集气瓶中,产生大量白烟,瓶内有黑色颗粒生成 钠具有强还原性,瓶内发生了置换反应
38.根据下列实验操作和现象能得到相应结论的是
选项 操作和现象 结论
A 向漂白粉溶液中通入SO2,产生白色沉淀 酸性:H2SO3>HClO
B 常温下,分别测定1 mol·L–1CH3COONH4溶液和0.1 mol·L–1 CH3COONH4溶液的pH,测得pH都等于7 同温下,不同浓度CH3COONH4溶液中水的电离程度相同
C 10 mL 0.1 mol·L–1FeCl3溶液和10 mL 0.1 mol·L–1KI溶液充分反应后分成两等份,一份加入2滴KSCN溶液,溶液变红;另一份加入2滴淀粉溶液,溶液变蓝 FeCl3和KI的反应存在限度
D 向露置在空气中的Na2O2固体中加入稀盐酸,产生气泡 Na2O2固体已经变质
39.下列实验方案设计、现象和结论都正确的是
方案设计 现象 结论
A 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液 产生蓝色沉淀 食品脱氧剂样品中没有+3价铁
B 将银和溶液与铜和溶液组成原电池。 连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
C 用玻璃棒蘸取次氯酸钠溶液点在pH试纸上 试纸变白 次氯酸钠溶液呈中性
D 溴乙烷与氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液中 酸性高锰酸钾溶液的紫红色褪去 溴乙烷发生消去反应
40.下列实验设计及现象能达到实验目的的是
选项 实验目的 实验设计及现象
A 证明气体中存在平衡 压缩盛有气体的注射器至原来体积的一半,红棕色变浅
B 比较室温下、溶度积的大小 向溶液中滴加少量NaOH溶液,充分振荡后,再滴加几滴溶液,白色沉淀逐渐转化为蓝色
C 比较和的氧化性强弱 常温下,向溶液中加入溶液,将带火星的木条放在试管口,木条复燃
D 证明反应生成乙烯 乙醇和浓硫酸共热至170℃,将产生的气体通入酸性高锰酸钾溶液中,溶液紫色褪去
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C B A A B B D C C B
题号 11 12 13 14 15 16 17 18 19 20
答案 D A D C A A C C B A
题号 21 22 23 24 25 26 27 28 29 30
答案 B C C B D D C A C C
题号 31 32 33 34 35 36 37 38 39 40
答案 A C B C B A D C B B
同课章节目录
