第六章 化学反应与能量 同步测试(含解析) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第六章 化学反应与能量 同步测试(含解析) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 549.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-23 21:26:40 | ||
图片预览




文档简介
第六章 化学反应与能量 同步测试
一、单选题
1.下列物质不能使淀粉碘化钾试纸变蓝色的是( )
A.双氧水 B.碘酒 C.氯化铁溶液 D.稀硫酸
2.古诗词蕴含丰富的化学知识,下列诗句所涉及的物质变化过程中,包含吸热反应的是( )
A.白日登山望烽火,黄昏饮马傍交河
B.寒野箱氛白,平原烧火红
C.烈火焚烧若等闲,要留清白在人间
D.开窗尽见千山雪,雪未消时月正明
3.下列我国古代的技术应用中,不涉及氧化还原反应的是( )
A.古法炼铁 B.粮食酿醋 C.煅烧贝壳 D.火药爆炸
A.A B.B C.C D.D
4.下列反应既属于氧化还原反应又属于放热反应的是( )
A.浓硫酸的稀释 B. 与水反应
C. 与 反应 D. 受热分解
5.氧化还原反应的实质是( )
A.电子转移
B.元素化合价变化
C.氧元素参加反应
D.原子重新组合
6.一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响生成氢气的量,可向其中加入( )
A.KCl固体 B.铁粉 C.K2SO4溶液 D.KNO3溶液
7.已知Na2S2O3 + H2SO4=Na2SO4 + SO2↑ + S↓ + H2O,下列实验中,化学反应速率最快的是( )
反应温度/oC Na2S2O3 H2SO4 H2O
体积/mL 浓度/mol·L-1 体积/mL 浓度/mol·L-1 体积/mL
A 25 5 0.1 10 0.1 5
B 25 5 0.2 5 0.2 10
C 35 5 0.1 10 0.1 5
D 35 5 0.2 5 0.2 10
A.A B.B C.C D.D
8.某同学用图甲所示装置及器材,测定碳酸盐与一定体积盐酸反应生成V(CO2)随反应时间变化情况,并绘制出图乙所示曲线。有关分析错误的是( )
A.收集气体最多的时间段为
B.将粉碎可以加快反应速率
C.平均反应速率:
D.与盐酸的反应离子方程式为
9.国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:Zn +2CuSO4+2NaOH = Cu2O+ZnSO4+Na2SO4+H2O。该反应的下列说法正确的是( )
A.Zn得到电子
B.CuSO4被氧化
C.NaOH是还原剂
D.CuSO4是氧化剂
10.氢化钠(NaH)可作野外用作生氢剂,其中氢元素为-1价,NaH用作生氢剂时的化学反应原理为:。下列关该反应的说法中,正确的是( )
A.NaH中的氢元素失去电子,作氧化剂
B.该反应属于置换反应
C.生成1个氢分子,转移
D.既是氧化产物又是还原产物
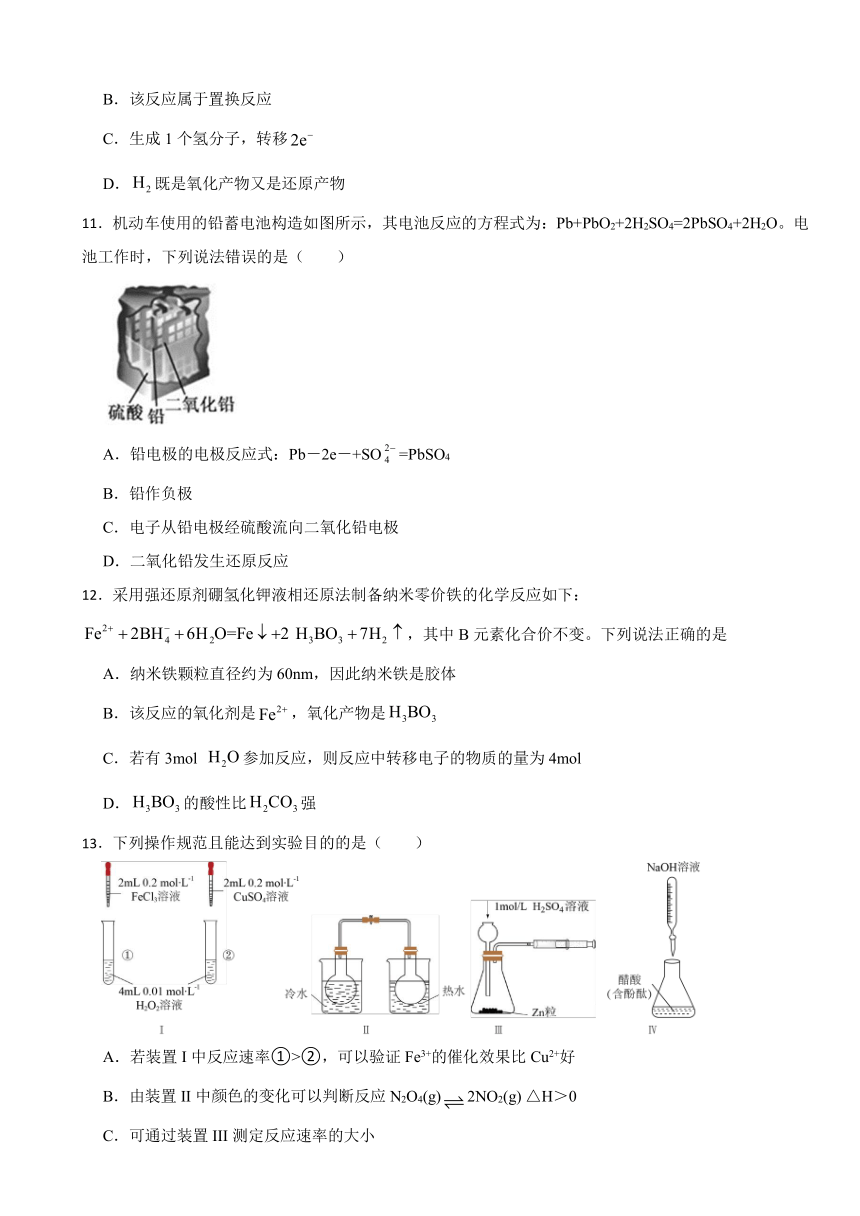
11.机动车使用的铅蓄电池构造如图所示,其电池反应的方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。电池工作时,下列说法错误的是( )
A.铅电极的电极反应式:Pb-2e-+SO=PbSO4
B.铅作负极
C.电子从铅电极经硫酸流向二氧化铅电极
D.二氧化铅发生还原反应
12.采用强还原剂硼氢化钾液相还原法制备纳米零价铁的化学反应如下:,其中B元素化合价不变。下列说法正确的是
A.纳米铁颗粒直径约为60nm,因此纳米铁是胶体
B.该反应的氧化剂是,氧化产物是
C.若有3mol 参加反应,则反应中转移电子的物质的量为4mol
D.的酸性比强
13.下列操作规范且能达到实验目的的是( )
A.若装置I中反应速率①>②,可以验证Fe3+的催化效果比Cu2+好
B.由装置II中颜色的变化可以判断反应N2O4(g)2NO2(g) △H>0
C.可通过装置III测定反应速率的大小
D.可用装置IV来测定醋酸的浓度
14.某铜锌原电池的结构如图所示,下列说法正确的是( )
A.Zn电极为该原电池的正极
B.若盐桥中电解质为KCl,则电池工作时K+向右侧移动
C.电池工作时,电子由Zn电极流出,经溶液和盐桥流入Cu电极
D.Cu电极上的电极反应式为Cu - 2e﹣ = Cu2+
15.少量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O
②加KNO3固体
③滴入几滴浓盐酸
④加入少量铁粉
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用10mL 0.1mol/L盐酸.
A.②⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
16.关于下图所示的原电池,下列说法正确的是( )
A.Cu为正极发生氧化反应 B.负极反应为Zn-2e-=Zn2+
C.电子由铜片通过导线流向锌片 D.该装置能将电能转化为化学能
17.对于可逆反应 ,同时符合如图各曲线,则下列判断正确的是( )
A.,, B.,,
C.,, D.,,
18.已知:①2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1②H2S(g)=H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A.氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B.相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C.由①②知,水的热稳定性小于硫化氢
D.②中若生成固态硫,ΔH将增大
19.已知常温下,在溶液中发生如下发生:
⑴16H++10Z +2XO =2X2++5Z2+8H2O
⑵2A2++B2=2A3++2B
⑶2B +Z2=B2+2Z
由此推断下列说法错误的是( )
A.反应2A3++2Z =Z2+2A2+可以进行
B.Z元素在反应(3)中被还原,在反应(1)中被氧化
C.氧化性由强到弱的顺序是XO 、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B 、Z 、X2+
20.下列根据实验操作和现象所得出的结论正确的是( )
选项 实验操作及实验现象 结论
A 室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱
B 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去 溶液中含有Fe2+,不含Fe3+
C 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊 Na2O2已经变质
D 向浓度均为0.1 mol·L-1NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1AgNO3溶液,先生成白色的AgCl沉淀 Ksp(AgCl)A.A B.B C.C D.D
二、综合题
21.含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2为原料制取Co3O4的一种工艺流程如下:
回答下列问题:
(1)CoC2O4中Co的化合价为 。
(2)步骤②经溶解后过滤,滤渣1的主要成分为 (填化学式),滤液中含有 种阳离子。
(3)步骤③氧化对Fe2+全部转化为Fe3+,反应的离子方程式为 ,检验其是否已完全氧化自方法是 。
(4)步骤国加Na2CO3溶液的目的是 ,滤渣2中含有Na2Fe6(SO4)4(OH)x,则x= ,滤渣2中 (填“含有”或“不含”Al(OH)3。
(5)某工厂用m1kg含钴催化剂废料Co2O3的质量分数为35%)制备Co3O4,最终得到产品m2kg,其产率为 (列出算式即可)。
22.电能是现代社会应用最广泛的能源之一。
(1)某原电池装置如图所示。其中,电极为原电池的 极(填“正”或“负”),电解质溶液中的阴离子向 极(填“铜”或“锌”)移动,铜极上的现象 。
(2)电极的电极反应式是 。
(3)电极上发生的反应属于 (填“氧化”或“还原”)反应。
(4)当铜表面析出氢气(标准状况)时,导线中通过了 电子。
(5)下列反应通过原电池装置,不能实现化学能直接转化为电能的是 (填序号)。
①②③
23.CuCl常用作催化剂,石油工业中脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。某课外学习小组用辉铜矿(主要成分为Cu2S,少量的Fe2O3和SiO2)制取氯化亚铜的流程如下:
(1)“焙烧”过程发生反应的化学方程式 ;为加快浸取速率常采取的措施 (写两条)。
(2)加入“试剂1”可调节浸出液的pH,“试剂1”可以是 ;“滤渣”的成分是 (填化学式)。
(3)①图1是反应体系pH随时间的变化关系图。写出“还原”制备CuCl的离子方程式 。
②制备过程中,当n(Na2SO3)与n(CuCl2)比值过大时CuCl产率会变小,其原因可能是 。
(4)反应完成后经抽滤、洗涤、干燥获得产品。图2为抽滤”装置,抽气泵可使吸滤瓶和安全瓶内压强减小,与普通过滤相比,采用抽滤的优点是 。
(5)CuCl沉淀的“洗涤”需要经过酸洗、水洗和醇洗。用“去氧水洗后再用“乙醇”洗涤的原因是 。
(6)取1.0g制备的CuCl粉末样品,先加入足量FeCl3溶液使其完全溶解,再稀释到100mL,从中取出25.00mL,用0.1mol·L-1Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce2(SO4)3];三次滴定平消耗标准液的体积为22.00mL。则粉末中CuCl的质量分数为 。
24.
(1)相同质量的氢气和二氧化碳的物质的量较多的是 ,同温同压下体积较大的是 。
(2)相同物质的量的碳酸钠和碳酸氢钠与足量的盐酸反应,消耗盐酸较多的是 。相同质量的碳酸钠和碳酸氢钠与足量的盐酸反应,生成二氧化碳较多的是 。
(3)10.6g无水碳酸钠的物质的量为 mol;将它溶于水制成500mL溶液,溶液中Na+的浓度为
mol/L。
(4)实验室用二氧化锰与浓盐酸制取并收集干燥的氯气时,氢氧化钠的作用是 ,浓硫酸的作用是 。
(5)在反应2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物的质量比为 ,SO2做 剂。
25.在下列反应中:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(1)氧化剂: ;还原剂: ; 元素被氧化
(2)氧化产物: ;还原产物: 。
答案解析部分
1.【答案】D
【解析】【解答】A.双氧水中含有H2O2,具有氧化性,能将I-氧化成I2,试纸变蓝色,A不符合题意;
B.碘酒中含有I2,试纸变蓝色,B不符合题意;
C.FeCl3溶液中含有Fe3+,Fe3+具有氧化性,能将I-氧化成I2,试纸变蓝色,C不符合题意;
D.稀硫酸不具有氧化性,不能将I-氧化成I2,试纸不变蓝色,D符合题意;
故答案为:D
【分析】能使淀粉碘化钾试纸变蓝,则反应后生成I2,因此所加试剂需具有氧化性,据此结合选项所给物质的性质分析。
2.【答案】C
【解析】【解答】A.烽火涉及燃烧,燃烧为放热反应,A不符合题意;
B.烧火红涉及燃烧,燃烧为放热反应,B不符合题意;
C.烈火焚烧若等闲,涉及碳酸钙分解生成氧化钙和二氧化碳的反应,该反应为吸热反应,C符合题意;
D.开窗尽见千山雪,雪未消时月正明只涉及物理变化,不涉及化学反应,D不符合题意;
故答案为:C。
【分析】常见的放热反应有:绝大多数的化合反应(灼热的炭与二氧化碳反应除外)、燃烧反应、金属与水或酸的反应、酸碱中和,铝热反应等;
常见的吸热反应有:绝大多数的分解反应、个别的化合反应(如灼热的炭与二氧化碳反应)、少数的复分解反应(如盐酸与碳酸氢钠反应)、以C、CO、H2为还原剂的氧化还原反应反应等。
3.【答案】C
【解析】【解答】A.炼铁中有单质铁生成,属于氧化还原反应,A不符合题意;
B.醋的酿造,存在从乙醇转化为乙酸的过程,为氧化还原反应,B不符合题意;
C.煅烧贝壳,是碳酸钙发生分解反应,没有发生氧化还原反应,C符合题意;
D.火药爆炸,属于剧烈的氧化还原反应,存在元素的化合价变化,D不符合题意;
故答案为:C。
【分析】含元素化合价变化的反应,为氧化还原反应;没有元素的化合价变化,则不属于氧化还原反应,以此来解答。
4.【答案】B
【解析】【解答】A.浓硫酸的稀释属于放热过程,是物理变化,不是化学反应,A不符合题意;
B.Na与水反应生成NaOH和氢气,既属于氧化还原反应又属于放热反应,B符合题意;
C. 与 反应属于吸热反应,且不属于氧化还原反应,C不符合题意;
D. 受热分解属于吸热反应,D不符合题意;
故答案为:B。
【分析】A.浓硫酸稀释放热,但属于物理变化;
B.钠与水反应放热,且有元素的化合价变化;
C. 与 的反应为吸热反应;
D.分解为吸热反应。
5.【答案】A
【解析】【解答】氧化还原反应的特征是化合价的升降,本质是电子转移。
【分析】氧化还原反应的实质为电子的转移。
6.【答案】C
【解析】【解答】A、无影响,A不符合题意;
B、形成Fe和Zn的原电池,加快了反应速率,Fe和H2SO4反应又加大了H2生成量,B不符合题意;
C、加入溶液,溶液中有水,减小了H2SO4的浓度,减小了反应速率,但不减少氢气量,K2SO4对锌无影响,C符合题意;
D、NO3-和H+相遇相当HNO3不会生成H2,减少了氢气的量,D不符合题意。
故答案为:C。
【分析】减慢反应速率,则需要降低氢离子的浓度,不影响氢气的产量,则需要氢离子的物质的量不变,据此分析即可。
7.【答案】D
【解析】【解答】由表格中的数据可知,35℃>25℃,则C、D的反应速率大于A、B中的反应速率,又D中浓度大于C中的浓度,所以D中反应速率最大。
故答案为:D。
【分析】温度越高浓度越大速率越快
8.【答案】C
【解析】【解答】A.根据图示,时间内收集气体的体积为,该时间段收集气体体积最大,故A不符合题意;
B.将粉碎,增大与盐酸的接触面积,反应速率加快,故B不符合题意;
C.根据相同时间内收集气体的体积大小,可知平均反应速率,故C符合题意;
D.与盐酸反应生成氯化钙、二氧化碳、水,反应的反应离子方程式为,故D不符合题意;
故答案为:C。
【分析】A.根据图乙判断;
B.增大反应物的接触面积可加快反应速率;
C.相同时间内收集的气体越多,反应速率越大;
D.碳酸钙与盐酸反应生成氯化钙、二氧化碳和水。
9.【答案】D
【解析】【解答】A、由反应方程式可知,Zn由0价变为+2价,反应过程中失去电子,A不符合题意;
B、反应过程中,铜由+2价变为+1价,化合价降低,被还原,B不符合题意;
C、NaOH在反应过程中,各元素的化合价都没有发生变化,既不是氧化剂,也不是还原剂,C不符合题意;
D、CuSO4在反应过程中,铜元素由+2价变为+1价,化合价降低,被还原,为氧化剂,D符合题意;
故答案为:D
【分析】在该反应中,Zn由0价变为+2价,失去电子,化合价升高,被氧化,为还原剂;CuSO4中铜元素由+2价变为+1价,得到电子,化合价降低,被还原,为氧化剂。据此分析选项。
10.【答案】D
【解析】【解答】A.反应中NaH中的氢元素失去电子,作还原剂,A不符合题意;
B.该反应的反应物都是化合物,所以该反应不属于置换反应,B不符合题意;
C.此反应为归中反应,NaH中-1价H与H2O中+1价H结合生成H2,则当生成1个H2时,有1个电子转移,C不符合题意;
D.NaH是还原剂,H2O是氧化剂,两者发生归中反应生成氢气,则H2既是氧化产物,又是还原产物,D符合题意;
故答案为:D。
【分析】反应 中,NaH中H元素的化合价升高,则NaH为还原剂,水中的氢元素化合价降低,为氧化剂,氢气既是氧化产物也是还原产物。
11.【答案】C
【解析】【解答】A.根据总反应式Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅单质化合价升高,PbO2化合价降低,因此铅单质为负极,铅电极的电极反应式:Pb-2e-+SO=PbSO4,故A不符合题意;
B.根据A选项分析得到铅作负极,故B不符合题意;
C.电子从铅电极经导线流向二氧化铅电极,不会经过电解液,故C符合题意;
D.二氧化铅中铅化合价降低,发生还原反应,故D不符合题意。
故答案为:C。
【分析】根据总反应可知,Pb元素化合价由0价、+4价变为+2价,则Pb作负极、PbO2作正极,负极的电极反应式为Pb-2e-+SO=PbSO4,正极的电极反应式为PbO2+2e-+SO+4H+=PbSO4+2H2O。
12.【答案】C
【解析】【解答】A.胶体是指直径为1~100nm的分散质均匀分布在分散剂中组成的混合物,纳米铁颗粒为纯净物,所以纳米铁不是胶体,A项不符合题意;
B.该反应中氧化剂是和H2O,氧化产物是Fe和H2,B项不符合题意;
C.该反应中是唯一的还原剂,1mol参与反应则失去了4个电子,所以根据化学方程式,若有3mol 参加反应,则反应中转移电子的物质的量为4mol,C项符合题意;
D.根据元素周期律,的酸性比弱,D项不符合题意。
故答案为:C。
【分析】A.纳米铁颗粒为纯净物;
B.氧化剂具有氧化性,得电子、元素化合价降低、被还原、发生还原反应生成还原产物;还原剂具有还原性,失电子、元素化合价升高、被氧化、发生氧化反应生成氧化产物;
C.根据化学方程式中化合价的变化计算;
D.根据元素周期律,非金属性越强,最高价氧化物对应水化物酸性越强。
13.【答案】B
【解析】【解答】A.所加的溶液中阴离子不同,不能排除阴离子的干扰,故不能说明Fe3+的催化效果比Cu2+好,A不符合题意;
B.热水中颜色加深,说明二氧化氮浓度增大,根据升高温度平衡向吸热反应方向移动,所以由装置II中颜色的变化可以判断反应N2O4(g)2NO2(g) △H>0,B符合题意;
C.缺少计时装置,不能试用长颈漏斗,不能测定反应速率的大小,C不符合题意;
D.氢氧化钠溶液应装在碱式滴定管内,D不符合题意;
故答案为:B。
【分析】
A.所加的溶液中阴离子不同,不能排除阴离子的干扰;
B.依据影响化学平衡的因素分析;
C.缺少计时装置,不能试用长颈漏斗;
D.酸性溶液、强氧化性溶液应选用酸式滴定管;碱性溶液应选用碱式滴定管。
14.【答案】B
【解析】【解答】A.根据总反应,Zn失电子,故为该原电池的负极,故A不符合题意;
B.原电池中阳离子移向正极,故电池工作时K+向右侧移动,故B符合题意;
C.电池工作时,电子不能通过溶液和盐桥,故C不符合题意;
D.Cu电极上发生得电子的反应,故电极反应式为Cu2+ +2e﹣ = Cu,故D不符合题意;
故答案为:B。
【分析】原电池中发生总反应Zn+Cu2+= Zn2++Cu。
15.【答案】C
【解析】【解答】①加水,减小了盐酸的浓度,故反应速率变慢,①不符合题意;
②加硝酸钾固体,溶液中相当于含有硝酸,不会生成氢气,②符合题意;
③加浓盐酸,反应速率加快且不改变H2的产量,③不符合题意;
④加入铁粉,铁与盐酸反应生成生成氢气的量增多,④不符合题意;
⑤加氯化钠溶液,相当于稀释盐酸,故反应速率变慢,⑤不符合题意;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量,⑥不符合题意;
⑦升高温度,反应速率加快,⑦符合题意;
⑧改用浓度大的盐酸,反应速率加快,⑧符合题意;
故答案为:C。
【分析】为加快铁与盐酸的反应速率,可增大反应物浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答。
16.【答案】B
【解析】【解答】A、在原电池中负极发生氧化反应,金属性锌强于铜,锌是负极,铜是正极,发生还原反应,A不符合题意;
B、锌是负极,负极反应为Zn-2e-=Zn2+,B符合题意;
C、锌是负极,发生失去电子的氧化反应,则电子从锌出来通过导线流向铜,C不符合题意;
D、原电池是将化学能变化电能的装置,D不符合题意。
故答案为:B。
【分析】将化学能转变为电能的装置称为原电池。在原电池中,发生的化学反应是氧化还原反应。发生氧化反应的一极上有电子流出,做负极,失去电子的物质是还原剂。电子通过原电池的负极经导线流向正极,在正极上氧化剂得到电子,发生还原反应。原电池就是通过化学反应实现化学能向电能转化的。
17.【答案】B
【解析】【解答】由图1知,温度越高,反应速率越快,达到平衡时所需时间越少,故;再依据勒夏特列原理,升温,平衡向吸热反应方向移动,则;再由图2知,加压,平衡向气体体积减小的方向移动,故,B项符合题意。
故答案为:B。
【分析】温度越高,反应速率越快,达到平衡时所需时间越少,升温,平衡向吸热反应方向移动,加压,平衡向气体体积减小的方向移动。
18.【答案】B
【解析】【解答】A.由2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ mol-1,可得:H2(g)+ O2(g)=H2O(g) △H=-241.8kJ mol-1,液态水是稳定氧化物,且氢气的物质的量为1mol,所以-241.8kJ mol-1不是氢气的燃烧热,故A不符合题意;
B.由H2S(g)=H2(g)+S(g) △H=+20.1kJ mol-1可知,1molH2(g)与1molS(g)的混合物的总能量大于1mol H2S(g)的总能量,所以充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1mol H2S(g)放热多20.1kJ,故B符合题意;
C.H2(g)+S(g)=H2S(g) △H=-20.1kJ mol-1,H2(g)+ O2(g)=H2O(g) △H=-241.8kJ mol-1,放出的热量越多,说明物质的总能量越低,物质越稳定,因此水比硫化氢稳定,故C不符合题意;
D.气体变为固体,需要放出热量,则若反应②中生成固态硫,放出的热量大于20.1kJ,ΔH减小,故D不符合题意;
故答案为:B。
【分析】A.燃烧热是1mol纯物质完全燃烧生成稳定氧化物时放出的热量;
B.根据两个方程式的焓变计算;
C.物质的总能量越低,物质越稳定;
D.等量的同种物质气态变为固态时释放能量;
19.【答案】A
【解析】【解答】A.根据上述分析可知,氧化性:Z2>A3+,因此反应2A3++2Z =Z2+2A2+不可以进行,A符合题意;
B.根据上述分析可知,反应(3)中Z2为氧化剂,B 为还原剂,即Z元素在反应(3)中被还原,在反应(1)中被氧化,B不符合题意;
C.氧化性:XO >Z2>B2>A3+,C不符合题意;
D.还原性:A2+>B >Z >X2+,D不符合题意;
故答案为:A。
【分析】根据题干信息,反应(1)中XO 为氧化剂,Z 为还原剂,X2+为还原产物,Z2为氧化产物,反应(2)中,B2为氧化剂,A2+为还原剂,B 为还原产物,A3+为氧化产物,反应(3)中Z2为氧化剂,B 为还原剂,Z 为还原产物,B2为氧化产物,因此氧化性:XO >Z2>B2>A3+,还原性:A2+>B >Z >X2+,据此分析解答。
20.【答案】C
【解析】【解答】A.次氯酸钠溶液具有漂白性,不能用pH试纸测PH,故A不符合题意;
B.向某溶液中滴加KSCN溶液,无明显现象,溶液中不含Fe3+,再滴加少量酸性高锰酸钾溶液,紫色褪去,说明溶液中含有I-等还原性离子,故B不符合题意;
C.取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊,说明放出二氧化碳气体,过氧化钠已变质为碳酸钠,故C符合题意;
D.AgCl与Ag2CrO4的结构不同,不能直接根据沉淀的先后顺序判断溶度积常数的大小,故D不符合题意。
故答案选C。
【分析】A, 次氯酸钠具有漂泊性的原因是次氯酸根离子具有强氧化性,属于氧化性漂泊;
B,Fe3+的检验,滴加KSCN溶液,溶液变为红色,酸性高锰酸钾溶液具有强氧化性,遇到还原性离子,褪色;
C,Na2O2能与二氧化碳气体发生反应;
D,溶度积常数Ksp的运用,直接根据沉淀的先后顺序比较Ksp的大小,要注意这两种或多种物质的结构要相同。
21.【答案】(1)+2
(2)SiO2 和CaSO4;6
(3)6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O;取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案)
(4)调节溶液pH以除去Fe3+、Al3+;12;含有
(5)
【解析】【解答】(1)草酸根离子C2O42-,所以Co的化合价为+2价;
故答案为:+2。(2)加入稀硫酸后,二氧化硅不与酸反应,滤渣为二氧化硅及微溶物硫酸钙;含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2,加入稀硫酸后,生成硫酸亚铁溶液、硫酸铁溶液、硫酸钴溶液、硫酸铝溶液;所以,滤液含有:Fe2+ Fe3+ Co3+ Al3+ H+ Ca2+等6种阳离子;滤渣为SiO2、CaSO4。
故答案为:SiO2 和CaSO4 ; 6 。
中含有6种阳离子。(3)氯酸钠溶液把亚铁离子氧化为铁离子,本身还原为氯离子;反应的离子方程式为:. 6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O;检验亚铁离子是否完全氧化为铁离子方法,加入酸性高锰酸钾溶液,如果溶液不褪色,氧化完全;
故答案为:取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案)。 (4)步骤④加Na2CO3溶液的目的是,调整溶液的pH,使铁离子变为沉淀而除去;滤渣2中含有Na2Fe6(SO4)4(OH)x,根据化合价法则:Na元素为+1价、Fe为+3价、SO42-为-2价,OH-为-1价,所以x=12;根据流程图看出,铝离子也已经沉淀,所以包含Al(OH)3沉淀;
故答案为:调节溶液pH以除去Fe3+ ; 12 ; 含有。(5)根据题给信息,钴元素的量守恒,得到产品的产率为(m2÷241×3)÷(m1×35%÷166) ×2×100%;
故答案为:
【分析】(1)根据化合物中个元素的化合价之和为0可知钴的化合价为+2价;
(2)四氧化三铁、氧化钴和氧化铝都会荣誉硫酸,但是二氧化硅不会溶于硫酸,氧化钙和硫酸反应会得到微溶的硫酸钙,因此滤渣的主要成分是硫酸钙和二氧化硅;
(3)亚铁离子在酸性条件下回被氯酸根氧化为三价铁离子;
(4)为了出去溶液中的铁离子和铝离子,选择用碳酸钠调节溶液的pH,这样才能将二者转化为沉淀除去;
(5)利用钴守恒,以及反应中物质的量的对应关系,可以计算出产率。
22.【答案】(1)负;锌;有气泡产生
(2)
(3)还原
(4)0.4
(5)①
【解析】【解答】(1) Zn比Cu活泼, 电极为原电池的负极,Cu电极为原电池的正极,电解质溶液中的阴离子向锌极(负极)移动,铜极上的现象是:有气泡产生;
(2) 电极为原电池的负极,电极方程式为 ;
(3) Cu电极为原电池的正极,发生的反应属于还原反应;
(4) 标准状况下H2物质的量是0.2mol,导线中通过了0.4mol电子;
(5)②和③是氧化还原反应,能实现化学能直接转化为电能,①不是氧化还原反应,不能实现化学能直接转化为电能,选①;
【分析】(1) Zn比Cu活泼, 电极为原电池的负极,Cu电极为原电池的正极,电解质溶液中的阴离子向锌极(负极)移动;
(2) 负极电极方程式为 ;
(3) 原电池正极发生的反应属于还原反应;
(4) 标准状况下气体物质的量和转移电子数的计算;
(5) 氧化还原反应,能实现化学能直接转化为电能,不是氧化还原反应,不能实现化学能直接转化为电能。
23.【答案】(1)Cu2S+2O2 2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等)
(2)CuO[或Cu(OH)2,或CuCO3];Fe(OH)3、SiO2
(3)2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降
(4)加快过滤速度,避免长时间接触空气
(5)快速去除CuCl沉淀表面的水分,防止其潮湿被氧化
(6)88%
【解析】【解答】(1)“焙烧”过程主要是除去可燃性杂质或使原料初步转化,本题为使原料初步转化,发生的化学反应方程式为:Cu2S+2O2 2CuO+SO2;增大原料浸取速率的措施有:将原料粉碎、搅拌、升高温度、增大盐酸的浓度等,故答案为:Cu2S+2O2 2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等);(2)由流程图可知,加入试剂1可调节浸出液的pH,也可将Fe3+转化为Fe(OH)3沉淀而除去,同时也不引入新的杂质,故符合条件的为CuO[或Cu(OH)2,或CuCO3];由分析可知,滤渣为:Fe(OH)3、SiO2;答案为:CuO[或Cu(OH)2,或CuCO3];Fe(OH)3、SiO2;(3)①由分析可知,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。其离子方程式为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;
②Na2SO3为强碱弱酸盐,水解显碱性,n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;答案为:n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;(4)抽滤的优点为加快过滤速度,避免长时间接触空气;答案为:加快过滤速度,避免长时间接触空气;(5)乙醇易挥发,进而可快速去除CuCl沉淀表面的水分,防止其潮湿被氧化。故答案为:快速去除CuCl沉淀表面的水分,防止其潮湿被氧化;(6)由题可知,涉及的离子反应方程式为:CuCl+Fe3+=Cu2++Fe2++Cl-、Ce4++Fe2+=Ce3++Fe3+,可得关系式:CuCl~Ce4+,则CuCl的质量分数= 。答案为:88%。
【分析】分析题中的流程过程,辉铜矿焙烧,将Cu2S初步转化为CuO和SO2,所得的固体为CuO、Fe2O3、SiO2的混合物,再用稀盐酸对所得固体进行酸浸,得到成分为FeCl3、CuCl2、稀盐酸、SiO2的浸出液。加入试剂1用于调节溶液的pH值,同时将Fe3+转化为Fe(OH)3沉淀而除去,SiO2在这个过程中不参与反应,也以滤渣的形式除去。向滤液中加入Na2SO3,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。将CuCl沉淀洗涤,最终得到CuCl粉末,据此分析。
24.【答案】(1)氢气;氢气
(2)碳酸钠;碳酸氢钠
(3)0.1;0.4
(4)吸收氯气,尾气处理,防止污染空气;干燥氯气
(5)2:1;氧化剂
【解析】【解答】(1)设氢气和二氧化碳的质量为m,则二者的物质的量之比为 =22:1,同温同压下,气体体积之比=物质的量之比,则物质的量较多的是氢气,体积较大的为氢气,故答案为:氢气;氢气;(2)由 和 可知,相同物质的量的碳酸钠和碳酸氢钠与足量的盐酸反应,消耗盐酸较多的是碳酸钠,由 和 可知,相同质量的碳酸钠和碳酸氢钠与足量的盐酸反应,生成二氧化碳较多的是碳酸氢钠,故答案为:碳酸钠;碳酸氢钠;(3)10.6g无水碳酸钠的物质的量为 =0.1mol,Na+的物质的量为0.2mol,则将它溶于水制成500mL溶液,溶液中Na+的浓度为 =0.4mol/L,故答案为:0.1;0.4;(4)实验室制备氯气用NaOH吸收氯气,尾气处理,防止污染空气,浓硫酸的作用是干燥氯气,故答案为:吸收氯气,尾气处理,防止污染空气;干燥氯气;(5)在反应2H2S+SO2=3S↓+2H2O中,H2S中S元素化合价升高,为还原剂,SO2中S元素化合价降低,为氧化剂,氧化产物和还原产物的质量比=H2S和SO2的物质的量之比,即2:1,故答案为:2:1;氧化剂。
【分析】(1)根据n=m/M,当质量相同,摩尔质量越大,物质的量越小,PV=nRT, 同温同压下 压体积之比等于物质的量之比;
(2)根据碳酸钠与盐酸反应时物质的量之比为1:2,碳酸氢钠与盐酸反应时物质的量之比为1:2解答;
根据碳酸钠与碳酸氢钠最后都生成二氧化碳,则同质量的两种物质,含有的碳元素的物质的量越多产生的气体越多解答;
(3)根据n=m/M计算物质的量,c=n/V计算物质的量浓度;
(4)根据氯气属于有毒气体,能够污染环境,做尾气处理使用解答;
浓硫酸具有吸水性,能够干燥氯气;
(5) 2H2S+SO2=3S↓+2H2O ,根据反应中只有S元素的化合价变化,化合价升高做还原剂对应氧化产物,氧化剂对应还原产物解答;
25.【答案】(1)KMnO4;HCl;Cl
(2)Cl2;MnCl2
【解析】【解答】(1)反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,KMnO4→MnCl2,Mn元素化合价降低,KMnO4作氧化剂;HCl→Cl2,Cl元素化合价升高,HCl作还原剂,发生氧化反应,被氧化的元素为Cl元素;
(2)HCl→Cl2,Cl元素化合价升高,发生氧化反应,Cl2为氧化产物;KMnO4→MnCl2,Mn元素化合价降低,发生还原反应,MnCl2为还原产物。
【分析】
反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素化合价降低,KMnO4作氧化剂,Cl元素化合价升高,HCl作还原剂,Cl2为氧化产物,MnCl2为还原产物。
一、单选题
1.下列物质不能使淀粉碘化钾试纸变蓝色的是( )
A.双氧水 B.碘酒 C.氯化铁溶液 D.稀硫酸
2.古诗词蕴含丰富的化学知识,下列诗句所涉及的物质变化过程中,包含吸热反应的是( )
A.白日登山望烽火,黄昏饮马傍交河
B.寒野箱氛白,平原烧火红
C.烈火焚烧若等闲,要留清白在人间
D.开窗尽见千山雪,雪未消时月正明
3.下列我国古代的技术应用中,不涉及氧化还原反应的是( )
A.古法炼铁 B.粮食酿醋 C.煅烧贝壳 D.火药爆炸
A.A B.B C.C D.D
4.下列反应既属于氧化还原反应又属于放热反应的是( )
A.浓硫酸的稀释 B. 与水反应
C. 与 反应 D. 受热分解
5.氧化还原反应的实质是( )
A.电子转移
B.元素化合价变化
C.氧元素参加反应
D.原子重新组合
6.一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响生成氢气的量,可向其中加入( )
A.KCl固体 B.铁粉 C.K2SO4溶液 D.KNO3溶液
7.已知Na2S2O3 + H2SO4=Na2SO4 + SO2↑ + S↓ + H2O,下列实验中,化学反应速率最快的是( )
反应温度/oC Na2S2O3 H2SO4 H2O
体积/mL 浓度/mol·L-1 体积/mL 浓度/mol·L-1 体积/mL
A 25 5 0.1 10 0.1 5
B 25 5 0.2 5 0.2 10
C 35 5 0.1 10 0.1 5
D 35 5 0.2 5 0.2 10
A.A B.B C.C D.D
8.某同学用图甲所示装置及器材,测定碳酸盐与一定体积盐酸反应生成V(CO2)随反应时间变化情况,并绘制出图乙所示曲线。有关分析错误的是( )
A.收集气体最多的时间段为
B.将粉碎可以加快反应速率
C.平均反应速率:
D.与盐酸的反应离子方程式为
9.国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:Zn +2CuSO4+2NaOH = Cu2O+ZnSO4+Na2SO4+H2O。该反应的下列说法正确的是( )
A.Zn得到电子
B.CuSO4被氧化
C.NaOH是还原剂
D.CuSO4是氧化剂
10.氢化钠(NaH)可作野外用作生氢剂,其中氢元素为-1价,NaH用作生氢剂时的化学反应原理为:。下列关该反应的说法中,正确的是( )
A.NaH中的氢元素失去电子,作氧化剂
B.该反应属于置换反应
C.生成1个氢分子,转移
D.既是氧化产物又是还原产物
11.机动车使用的铅蓄电池构造如图所示,其电池反应的方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。电池工作时,下列说法错误的是( )
A.铅电极的电极反应式:Pb-2e-+SO=PbSO4
B.铅作负极
C.电子从铅电极经硫酸流向二氧化铅电极
D.二氧化铅发生还原反应
12.采用强还原剂硼氢化钾液相还原法制备纳米零价铁的化学反应如下:,其中B元素化合价不变。下列说法正确的是
A.纳米铁颗粒直径约为60nm,因此纳米铁是胶体
B.该反应的氧化剂是,氧化产物是
C.若有3mol 参加反应,则反应中转移电子的物质的量为4mol
D.的酸性比强
13.下列操作规范且能达到实验目的的是( )
A.若装置I中反应速率①>②,可以验证Fe3+的催化效果比Cu2+好
B.由装置II中颜色的变化可以判断反应N2O4(g)2NO2(g) △H>0
C.可通过装置III测定反应速率的大小
D.可用装置IV来测定醋酸的浓度
14.某铜锌原电池的结构如图所示,下列说法正确的是( )
A.Zn电极为该原电池的正极
B.若盐桥中电解质为KCl,则电池工作时K+向右侧移动
C.电池工作时,电子由Zn电极流出,经溶液和盐桥流入Cu电极
D.Cu电极上的电极反应式为Cu - 2e﹣ = Cu2+
15.少量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O
②加KNO3固体
③滴入几滴浓盐酸
④加入少量铁粉
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用10mL 0.1mol/L盐酸.
A.②⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
16.关于下图所示的原电池,下列说法正确的是( )
A.Cu为正极发生氧化反应 B.负极反应为Zn-2e-=Zn2+
C.电子由铜片通过导线流向锌片 D.该装置能将电能转化为化学能
17.对于可逆反应 ,同时符合如图各曲线,则下列判断正确的是( )
A.,, B.,,
C.,, D.,,
18.已知:①2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1②H2S(g)=H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A.氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B.相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C.由①②知,水的热稳定性小于硫化氢
D.②中若生成固态硫,ΔH将增大
19.已知常温下,在溶液中发生如下发生:
⑴16H++10Z +2XO =2X2++5Z2+8H2O
⑵2A2++B2=2A3++2B
⑶2B +Z2=B2+2Z
由此推断下列说法错误的是( )
A.反应2A3++2Z =Z2+2A2+可以进行
B.Z元素在反应(3)中被还原,在反应(1)中被氧化
C.氧化性由强到弱的顺序是XO 、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B 、Z 、X2+
20.下列根据实验操作和现象所得出的结论正确的是( )
选项 实验操作及实验现象 结论
A 室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱
B 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去 溶液中含有Fe2+,不含Fe3+
C 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊 Na2O2已经变质
D 向浓度均为0.1 mol·L-1NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1AgNO3溶液,先生成白色的AgCl沉淀 Ksp(AgCl)
二、综合题
21.含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2为原料制取Co3O4的一种工艺流程如下:
回答下列问题:
(1)CoC2O4中Co的化合价为 。
(2)步骤②经溶解后过滤,滤渣1的主要成分为 (填化学式),滤液中含有 种阳离子。
(3)步骤③氧化对Fe2+全部转化为Fe3+,反应的离子方程式为 ,检验其是否已完全氧化自方法是 。
(4)步骤国加Na2CO3溶液的目的是 ,滤渣2中含有Na2Fe6(SO4)4(OH)x,则x= ,滤渣2中 (填“含有”或“不含”Al(OH)3。
(5)某工厂用m1kg含钴催化剂废料Co2O3的质量分数为35%)制备Co3O4,最终得到产品m2kg,其产率为 (列出算式即可)。
22.电能是现代社会应用最广泛的能源之一。
(1)某原电池装置如图所示。其中,电极为原电池的 极(填“正”或“负”),电解质溶液中的阴离子向 极(填“铜”或“锌”)移动,铜极上的现象 。
(2)电极的电极反应式是 。
(3)电极上发生的反应属于 (填“氧化”或“还原”)反应。
(4)当铜表面析出氢气(标准状况)时,导线中通过了 电子。
(5)下列反应通过原电池装置,不能实现化学能直接转化为电能的是 (填序号)。
①②③
23.CuCl常用作催化剂,石油工业中脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。某课外学习小组用辉铜矿(主要成分为Cu2S,少量的Fe2O3和SiO2)制取氯化亚铜的流程如下:
(1)“焙烧”过程发生反应的化学方程式 ;为加快浸取速率常采取的措施 (写两条)。
(2)加入“试剂1”可调节浸出液的pH,“试剂1”可以是 ;“滤渣”的成分是 (填化学式)。
(3)①图1是反应体系pH随时间的变化关系图。写出“还原”制备CuCl的离子方程式 。
②制备过程中,当n(Na2SO3)与n(CuCl2)比值过大时CuCl产率会变小,其原因可能是 。
(4)反应完成后经抽滤、洗涤、干燥获得产品。图2为抽滤”装置,抽气泵可使吸滤瓶和安全瓶内压强减小,与普通过滤相比,采用抽滤的优点是 。
(5)CuCl沉淀的“洗涤”需要经过酸洗、水洗和醇洗。用“去氧水洗后再用“乙醇”洗涤的原因是 。
(6)取1.0g制备的CuCl粉末样品,先加入足量FeCl3溶液使其完全溶解,再稀释到100mL,从中取出25.00mL,用0.1mol·L-1Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce2(SO4)3];三次滴定平消耗标准液的体积为22.00mL。则粉末中CuCl的质量分数为 。
24.
(1)相同质量的氢气和二氧化碳的物质的量较多的是 ,同温同压下体积较大的是 。
(2)相同物质的量的碳酸钠和碳酸氢钠与足量的盐酸反应,消耗盐酸较多的是 。相同质量的碳酸钠和碳酸氢钠与足量的盐酸反应,生成二氧化碳较多的是 。
(3)10.6g无水碳酸钠的物质的量为 mol;将它溶于水制成500mL溶液,溶液中Na+的浓度为
mol/L。
(4)实验室用二氧化锰与浓盐酸制取并收集干燥的氯气时,氢氧化钠的作用是 ,浓硫酸的作用是 。
(5)在反应2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物的质量比为 ,SO2做 剂。
25.在下列反应中:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(1)氧化剂: ;还原剂: ; 元素被氧化
(2)氧化产物: ;还原产物: 。
答案解析部分
1.【答案】D
【解析】【解答】A.双氧水中含有H2O2,具有氧化性,能将I-氧化成I2,试纸变蓝色,A不符合题意;
B.碘酒中含有I2,试纸变蓝色,B不符合题意;
C.FeCl3溶液中含有Fe3+,Fe3+具有氧化性,能将I-氧化成I2,试纸变蓝色,C不符合题意;
D.稀硫酸不具有氧化性,不能将I-氧化成I2,试纸不变蓝色,D符合题意;
故答案为:D
【分析】能使淀粉碘化钾试纸变蓝,则反应后生成I2,因此所加试剂需具有氧化性,据此结合选项所给物质的性质分析。
2.【答案】C
【解析】【解答】A.烽火涉及燃烧,燃烧为放热反应,A不符合题意;
B.烧火红涉及燃烧,燃烧为放热反应,B不符合题意;
C.烈火焚烧若等闲,涉及碳酸钙分解生成氧化钙和二氧化碳的反应,该反应为吸热反应,C符合题意;
D.开窗尽见千山雪,雪未消时月正明只涉及物理变化,不涉及化学反应,D不符合题意;
故答案为:C。
【分析】常见的放热反应有:绝大多数的化合反应(灼热的炭与二氧化碳反应除外)、燃烧反应、金属与水或酸的反应、酸碱中和,铝热反应等;
常见的吸热反应有:绝大多数的分解反应、个别的化合反应(如灼热的炭与二氧化碳反应)、少数的复分解反应(如盐酸与碳酸氢钠反应)、以C、CO、H2为还原剂的氧化还原反应反应等。
3.【答案】C
【解析】【解答】A.炼铁中有单质铁生成,属于氧化还原反应,A不符合题意;
B.醋的酿造,存在从乙醇转化为乙酸的过程,为氧化还原反应,B不符合题意;
C.煅烧贝壳,是碳酸钙发生分解反应,没有发生氧化还原反应,C符合题意;
D.火药爆炸,属于剧烈的氧化还原反应,存在元素的化合价变化,D不符合题意;
故答案为:C。
【分析】含元素化合价变化的反应,为氧化还原反应;没有元素的化合价变化,则不属于氧化还原反应,以此来解答。
4.【答案】B
【解析】【解答】A.浓硫酸的稀释属于放热过程,是物理变化,不是化学反应,A不符合题意;
B.Na与水反应生成NaOH和氢气,既属于氧化还原反应又属于放热反应,B符合题意;
C. 与 反应属于吸热反应,且不属于氧化还原反应,C不符合题意;
D. 受热分解属于吸热反应,D不符合题意;
故答案为:B。
【分析】A.浓硫酸稀释放热,但属于物理变化;
B.钠与水反应放热,且有元素的化合价变化;
C. 与 的反应为吸热反应;
D.分解为吸热反应。
5.【答案】A
【解析】【解答】氧化还原反应的特征是化合价的升降,本质是电子转移。
【分析】氧化还原反应的实质为电子的转移。
6.【答案】C
【解析】【解答】A、无影响,A不符合题意;
B、形成Fe和Zn的原电池,加快了反应速率,Fe和H2SO4反应又加大了H2生成量,B不符合题意;
C、加入溶液,溶液中有水,减小了H2SO4的浓度,减小了反应速率,但不减少氢气量,K2SO4对锌无影响,C符合题意;
D、NO3-和H+相遇相当HNO3不会生成H2,减少了氢气的量,D不符合题意。
故答案为:C。
【分析】减慢反应速率,则需要降低氢离子的浓度,不影响氢气的产量,则需要氢离子的物质的量不变,据此分析即可。
7.【答案】D
【解析】【解答】由表格中的数据可知,35℃>25℃,则C、D的反应速率大于A、B中的反应速率,又D中浓度大于C中的浓度,所以D中反应速率最大。
故答案为:D。
【分析】温度越高浓度越大速率越快
8.【答案】C
【解析】【解答】A.根据图示,时间内收集气体的体积为,该时间段收集气体体积最大,故A不符合题意;
B.将粉碎,增大与盐酸的接触面积,反应速率加快,故B不符合题意;
C.根据相同时间内收集气体的体积大小,可知平均反应速率,故C符合题意;
D.与盐酸反应生成氯化钙、二氧化碳、水,反应的反应离子方程式为,故D不符合题意;
故答案为:C。
【分析】A.根据图乙判断;
B.增大反应物的接触面积可加快反应速率;
C.相同时间内收集的气体越多,反应速率越大;
D.碳酸钙与盐酸反应生成氯化钙、二氧化碳和水。
9.【答案】D
【解析】【解答】A、由反应方程式可知,Zn由0价变为+2价,反应过程中失去电子,A不符合题意;
B、反应过程中,铜由+2价变为+1价,化合价降低,被还原,B不符合题意;
C、NaOH在反应过程中,各元素的化合价都没有发生变化,既不是氧化剂,也不是还原剂,C不符合题意;
D、CuSO4在反应过程中,铜元素由+2价变为+1价,化合价降低,被还原,为氧化剂,D符合题意;
故答案为:D
【分析】在该反应中,Zn由0价变为+2价,失去电子,化合价升高,被氧化,为还原剂;CuSO4中铜元素由+2价变为+1价,得到电子,化合价降低,被还原,为氧化剂。据此分析选项。
10.【答案】D
【解析】【解答】A.反应中NaH中的氢元素失去电子,作还原剂,A不符合题意;
B.该反应的反应物都是化合物,所以该反应不属于置换反应,B不符合题意;
C.此反应为归中反应,NaH中-1价H与H2O中+1价H结合生成H2,则当生成1个H2时,有1个电子转移,C不符合题意;
D.NaH是还原剂,H2O是氧化剂,两者发生归中反应生成氢气,则H2既是氧化产物,又是还原产物,D符合题意;
故答案为:D。
【分析】反应 中,NaH中H元素的化合价升高,则NaH为还原剂,水中的氢元素化合价降低,为氧化剂,氢气既是氧化产物也是还原产物。
11.【答案】C
【解析】【解答】A.根据总反应式Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅单质化合价升高,PbO2化合价降低,因此铅单质为负极,铅电极的电极反应式:Pb-2e-+SO=PbSO4,故A不符合题意;
B.根据A选项分析得到铅作负极,故B不符合题意;
C.电子从铅电极经导线流向二氧化铅电极,不会经过电解液,故C符合题意;
D.二氧化铅中铅化合价降低,发生还原反应,故D不符合题意。
故答案为:C。
【分析】根据总反应可知,Pb元素化合价由0价、+4价变为+2价,则Pb作负极、PbO2作正极,负极的电极反应式为Pb-2e-+SO=PbSO4,正极的电极反应式为PbO2+2e-+SO+4H+=PbSO4+2H2O。
12.【答案】C
【解析】【解答】A.胶体是指直径为1~100nm的分散质均匀分布在分散剂中组成的混合物,纳米铁颗粒为纯净物,所以纳米铁不是胶体,A项不符合题意;
B.该反应中氧化剂是和H2O,氧化产物是Fe和H2,B项不符合题意;
C.该反应中是唯一的还原剂,1mol参与反应则失去了4个电子,所以根据化学方程式,若有3mol 参加反应,则反应中转移电子的物质的量为4mol,C项符合题意;
D.根据元素周期律,的酸性比弱,D项不符合题意。
故答案为:C。
【分析】A.纳米铁颗粒为纯净物;
B.氧化剂具有氧化性,得电子、元素化合价降低、被还原、发生还原反应生成还原产物;还原剂具有还原性,失电子、元素化合价升高、被氧化、发生氧化反应生成氧化产物;
C.根据化学方程式中化合价的变化计算;
D.根据元素周期律,非金属性越强,最高价氧化物对应水化物酸性越强。
13.【答案】B
【解析】【解答】A.所加的溶液中阴离子不同,不能排除阴离子的干扰,故不能说明Fe3+的催化效果比Cu2+好,A不符合题意;
B.热水中颜色加深,说明二氧化氮浓度增大,根据升高温度平衡向吸热反应方向移动,所以由装置II中颜色的变化可以判断反应N2O4(g)2NO2(g) △H>0,B符合题意;
C.缺少计时装置,不能试用长颈漏斗,不能测定反应速率的大小,C不符合题意;
D.氢氧化钠溶液应装在碱式滴定管内,D不符合题意;
故答案为:B。
【分析】
A.所加的溶液中阴离子不同,不能排除阴离子的干扰;
B.依据影响化学平衡的因素分析;
C.缺少计时装置,不能试用长颈漏斗;
D.酸性溶液、强氧化性溶液应选用酸式滴定管;碱性溶液应选用碱式滴定管。
14.【答案】B
【解析】【解答】A.根据总反应,Zn失电子,故为该原电池的负极,故A不符合题意;
B.原电池中阳离子移向正极,故电池工作时K+向右侧移动,故B符合题意;
C.电池工作时,电子不能通过溶液和盐桥,故C不符合题意;
D.Cu电极上发生得电子的反应,故电极反应式为Cu2+ +2e﹣ = Cu,故D不符合题意;
故答案为:B。
【分析】原电池中发生总反应Zn+Cu2+= Zn2++Cu。
15.【答案】C
【解析】【解答】①加水,减小了盐酸的浓度,故反应速率变慢,①不符合题意;
②加硝酸钾固体,溶液中相当于含有硝酸,不会生成氢气,②符合题意;
③加浓盐酸,反应速率加快且不改变H2的产量,③不符合题意;
④加入铁粉,铁与盐酸反应生成生成氢气的量增多,④不符合题意;
⑤加氯化钠溶液,相当于稀释盐酸,故反应速率变慢,⑤不符合题意;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量,⑥不符合题意;
⑦升高温度,反应速率加快,⑦符合题意;
⑧改用浓度大的盐酸,反应速率加快,⑧符合题意;
故答案为:C。
【分析】为加快铁与盐酸的反应速率,可增大反应物浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答。
16.【答案】B
【解析】【解答】A、在原电池中负极发生氧化反应,金属性锌强于铜,锌是负极,铜是正极,发生还原反应,A不符合题意;
B、锌是负极,负极反应为Zn-2e-=Zn2+,B符合题意;
C、锌是负极,发生失去电子的氧化反应,则电子从锌出来通过导线流向铜,C不符合题意;
D、原电池是将化学能变化电能的装置,D不符合题意。
故答案为:B。
【分析】将化学能转变为电能的装置称为原电池。在原电池中,发生的化学反应是氧化还原反应。发生氧化反应的一极上有电子流出,做负极,失去电子的物质是还原剂。电子通过原电池的负极经导线流向正极,在正极上氧化剂得到电子,发生还原反应。原电池就是通过化学反应实现化学能向电能转化的。
17.【答案】B
【解析】【解答】由图1知,温度越高,反应速率越快,达到平衡时所需时间越少,故;再依据勒夏特列原理,升温,平衡向吸热反应方向移动,则;再由图2知,加压,平衡向气体体积减小的方向移动,故,B项符合题意。
故答案为:B。
【分析】温度越高,反应速率越快,达到平衡时所需时间越少,升温,平衡向吸热反应方向移动,加压,平衡向气体体积减小的方向移动。
18.【答案】B
【解析】【解答】A.由2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ mol-1,可得:H2(g)+ O2(g)=H2O(g) △H=-241.8kJ mol-1,液态水是稳定氧化物,且氢气的物质的量为1mol,所以-241.8kJ mol-1不是氢气的燃烧热,故A不符合题意;
B.由H2S(g)=H2(g)+S(g) △H=+20.1kJ mol-1可知,1molH2(g)与1molS(g)的混合物的总能量大于1mol H2S(g)的总能量,所以充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1mol H2S(g)放热多20.1kJ,故B符合题意;
C.H2(g)+S(g)=H2S(g) △H=-20.1kJ mol-1,H2(g)+ O2(g)=H2O(g) △H=-241.8kJ mol-1,放出的热量越多,说明物质的总能量越低,物质越稳定,因此水比硫化氢稳定,故C不符合题意;
D.气体变为固体,需要放出热量,则若反应②中生成固态硫,放出的热量大于20.1kJ,ΔH减小,故D不符合题意;
故答案为:B。
【分析】A.燃烧热是1mol纯物质完全燃烧生成稳定氧化物时放出的热量;
B.根据两个方程式的焓变计算;
C.物质的总能量越低,物质越稳定;
D.等量的同种物质气态变为固态时释放能量;
19.【答案】A
【解析】【解答】A.根据上述分析可知,氧化性:Z2>A3+,因此反应2A3++2Z =Z2+2A2+不可以进行,A符合题意;
B.根据上述分析可知,反应(3)中Z2为氧化剂,B 为还原剂,即Z元素在反应(3)中被还原,在反应(1)中被氧化,B不符合题意;
C.氧化性:XO >Z2>B2>A3+,C不符合题意;
D.还原性:A2+>B >Z >X2+,D不符合题意;
故答案为:A。
【分析】根据题干信息,反应(1)中XO 为氧化剂,Z 为还原剂,X2+为还原产物,Z2为氧化产物,反应(2)中,B2为氧化剂,A2+为还原剂,B 为还原产物,A3+为氧化产物,反应(3)中Z2为氧化剂,B 为还原剂,Z 为还原产物,B2为氧化产物,因此氧化性:XO >Z2>B2>A3+,还原性:A2+>B >Z >X2+,据此分析解答。
20.【答案】C
【解析】【解答】A.次氯酸钠溶液具有漂白性,不能用pH试纸测PH,故A不符合题意;
B.向某溶液中滴加KSCN溶液,无明显现象,溶液中不含Fe3+,再滴加少量酸性高锰酸钾溶液,紫色褪去,说明溶液中含有I-等还原性离子,故B不符合题意;
C.取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊,说明放出二氧化碳气体,过氧化钠已变质为碳酸钠,故C符合题意;
D.AgCl与Ag2CrO4的结构不同,不能直接根据沉淀的先后顺序判断溶度积常数的大小,故D不符合题意。
故答案选C。
【分析】A, 次氯酸钠具有漂泊性的原因是次氯酸根离子具有强氧化性,属于氧化性漂泊;
B,Fe3+的检验,滴加KSCN溶液,溶液变为红色,酸性高锰酸钾溶液具有强氧化性,遇到还原性离子,褪色;
C,Na2O2能与二氧化碳气体发生反应;
D,溶度积常数Ksp的运用,直接根据沉淀的先后顺序比较Ksp的大小,要注意这两种或多种物质的结构要相同。
21.【答案】(1)+2
(2)SiO2 和CaSO4;6
(3)6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O;取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案)
(4)调节溶液pH以除去Fe3+、Al3+;12;含有
(5)
【解析】【解答】(1)草酸根离子C2O42-,所以Co的化合价为+2价;
故答案为:+2。(2)加入稀硫酸后,二氧化硅不与酸反应,滤渣为二氧化硅及微溶物硫酸钙;含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2,加入稀硫酸后,生成硫酸亚铁溶液、硫酸铁溶液、硫酸钴溶液、硫酸铝溶液;所以,滤液含有:Fe2+ Fe3+ Co3+ Al3+ H+ Ca2+等6种阳离子;滤渣为SiO2、CaSO4。
故答案为:SiO2 和CaSO4 ; 6 。
中含有6种阳离子。(3)氯酸钠溶液把亚铁离子氧化为铁离子,本身还原为氯离子;反应的离子方程式为:. 6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O;检验亚铁离子是否完全氧化为铁离子方法,加入酸性高锰酸钾溶液,如果溶液不褪色,氧化完全;
故答案为:取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案)。 (4)步骤④加Na2CO3溶液的目的是,调整溶液的pH,使铁离子变为沉淀而除去;滤渣2中含有Na2Fe6(SO4)4(OH)x,根据化合价法则:Na元素为+1价、Fe为+3价、SO42-为-2价,OH-为-1价,所以x=12;根据流程图看出,铝离子也已经沉淀,所以包含Al(OH)3沉淀;
故答案为:调节溶液pH以除去Fe3+ ; 12 ; 含有。(5)根据题给信息,钴元素的量守恒,得到产品的产率为(m2÷241×3)÷(m1×35%÷166) ×2×100%;
故答案为:
【分析】(1)根据化合物中个元素的化合价之和为0可知钴的化合价为+2价;
(2)四氧化三铁、氧化钴和氧化铝都会荣誉硫酸,但是二氧化硅不会溶于硫酸,氧化钙和硫酸反应会得到微溶的硫酸钙,因此滤渣的主要成分是硫酸钙和二氧化硅;
(3)亚铁离子在酸性条件下回被氯酸根氧化为三价铁离子;
(4)为了出去溶液中的铁离子和铝离子,选择用碳酸钠调节溶液的pH,这样才能将二者转化为沉淀除去;
(5)利用钴守恒,以及反应中物质的量的对应关系,可以计算出产率。
22.【答案】(1)负;锌;有气泡产生
(2)
(3)还原
(4)0.4
(5)①
【解析】【解答】(1) Zn比Cu活泼, 电极为原电池的负极,Cu电极为原电池的正极,电解质溶液中的阴离子向锌极(负极)移动,铜极上的现象是:有气泡产生;
(2) 电极为原电池的负极,电极方程式为 ;
(3) Cu电极为原电池的正极,发生的反应属于还原反应;
(4) 标准状况下H2物质的量是0.2mol,导线中通过了0.4mol电子;
(5)②和③是氧化还原反应,能实现化学能直接转化为电能,①不是氧化还原反应,不能实现化学能直接转化为电能,选①;
【分析】(1) Zn比Cu活泼, 电极为原电池的负极,Cu电极为原电池的正极,电解质溶液中的阴离子向锌极(负极)移动;
(2) 负极电极方程式为 ;
(3) 原电池正极发生的反应属于还原反应;
(4) 标准状况下气体物质的量和转移电子数的计算;
(5) 氧化还原反应,能实现化学能直接转化为电能,不是氧化还原反应,不能实现化学能直接转化为电能。
23.【答案】(1)Cu2S+2O2 2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等)
(2)CuO[或Cu(OH)2,或CuCO3];Fe(OH)3、SiO2
(3)2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降
(4)加快过滤速度,避免长时间接触空气
(5)快速去除CuCl沉淀表面的水分,防止其潮湿被氧化
(6)88%
【解析】【解答】(1)“焙烧”过程主要是除去可燃性杂质或使原料初步转化,本题为使原料初步转化,发生的化学反应方程式为:Cu2S+2O2 2CuO+SO2;增大原料浸取速率的措施有:将原料粉碎、搅拌、升高温度、增大盐酸的浓度等,故答案为:Cu2S+2O2 2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等);(2)由流程图可知,加入试剂1可调节浸出液的pH,也可将Fe3+转化为Fe(OH)3沉淀而除去,同时也不引入新的杂质,故符合条件的为CuO[或Cu(OH)2,或CuCO3];由分析可知,滤渣为:Fe(OH)3、SiO2;答案为:CuO[或Cu(OH)2,或CuCO3];Fe(OH)3、SiO2;(3)①由分析可知,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。其离子方程式为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;
②Na2SO3为强碱弱酸盐,水解显碱性,n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;答案为:n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;(4)抽滤的优点为加快过滤速度,避免长时间接触空气;答案为:加快过滤速度,避免长时间接触空气;(5)乙醇易挥发,进而可快速去除CuCl沉淀表面的水分,防止其潮湿被氧化。故答案为:快速去除CuCl沉淀表面的水分,防止其潮湿被氧化;(6)由题可知,涉及的离子反应方程式为:CuCl+Fe3+=Cu2++Fe2++Cl-、Ce4++Fe2+=Ce3++Fe3+,可得关系式:CuCl~Ce4+,则CuCl的质量分数= 。答案为:88%。
【分析】分析题中的流程过程,辉铜矿焙烧,将Cu2S初步转化为CuO和SO2,所得的固体为CuO、Fe2O3、SiO2的混合物,再用稀盐酸对所得固体进行酸浸,得到成分为FeCl3、CuCl2、稀盐酸、SiO2的浸出液。加入试剂1用于调节溶液的pH值,同时将Fe3+转化为Fe(OH)3沉淀而除去,SiO2在这个过程中不参与反应,也以滤渣的形式除去。向滤液中加入Na2SO3,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。将CuCl沉淀洗涤,最终得到CuCl粉末,据此分析。
24.【答案】(1)氢气;氢气
(2)碳酸钠;碳酸氢钠
(3)0.1;0.4
(4)吸收氯气,尾气处理,防止污染空气;干燥氯气
(5)2:1;氧化剂
【解析】【解答】(1)设氢气和二氧化碳的质量为m,则二者的物质的量之比为 =22:1,同温同压下,气体体积之比=物质的量之比,则物质的量较多的是氢气,体积较大的为氢气,故答案为:氢气;氢气;(2)由 和 可知,相同物质的量的碳酸钠和碳酸氢钠与足量的盐酸反应,消耗盐酸较多的是碳酸钠,由 和 可知,相同质量的碳酸钠和碳酸氢钠与足量的盐酸反应,生成二氧化碳较多的是碳酸氢钠,故答案为:碳酸钠;碳酸氢钠;(3)10.6g无水碳酸钠的物质的量为 =0.1mol,Na+的物质的量为0.2mol,则将它溶于水制成500mL溶液,溶液中Na+的浓度为 =0.4mol/L,故答案为:0.1;0.4;(4)实验室制备氯气用NaOH吸收氯气,尾气处理,防止污染空气,浓硫酸的作用是干燥氯气,故答案为:吸收氯气,尾气处理,防止污染空气;干燥氯气;(5)在反应2H2S+SO2=3S↓+2H2O中,H2S中S元素化合价升高,为还原剂,SO2中S元素化合价降低,为氧化剂,氧化产物和还原产物的质量比=H2S和SO2的物质的量之比,即2:1,故答案为:2:1;氧化剂。
【分析】(1)根据n=m/M,当质量相同,摩尔质量越大,物质的量越小,PV=nRT, 同温同压下 压体积之比等于物质的量之比;
(2)根据碳酸钠与盐酸反应时物质的量之比为1:2,碳酸氢钠与盐酸反应时物质的量之比为1:2解答;
根据碳酸钠与碳酸氢钠最后都生成二氧化碳,则同质量的两种物质,含有的碳元素的物质的量越多产生的气体越多解答;
(3)根据n=m/M计算物质的量,c=n/V计算物质的量浓度;
(4)根据氯气属于有毒气体,能够污染环境,做尾气处理使用解答;
浓硫酸具有吸水性,能够干燥氯气;
(5) 2H2S+SO2=3S↓+2H2O ,根据反应中只有S元素的化合价变化,化合价升高做还原剂对应氧化产物,氧化剂对应还原产物解答;
25.【答案】(1)KMnO4;HCl;Cl
(2)Cl2;MnCl2
【解析】【解答】(1)反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,KMnO4→MnCl2,Mn元素化合价降低,KMnO4作氧化剂;HCl→Cl2,Cl元素化合价升高,HCl作还原剂,发生氧化反应,被氧化的元素为Cl元素;
(2)HCl→Cl2,Cl元素化合价升高,发生氧化反应,Cl2为氧化产物;KMnO4→MnCl2,Mn元素化合价降低,发生还原反应,MnCl2为还原产物。
【分析】
反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素化合价降低,KMnO4作氧化剂,Cl元素化合价升高,HCl作还原剂,Cl2为氧化产物,MnCl2为还原产物。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
