2024北京人大附中高二(下)统练一化学(含答案)
文档属性
| 名称 | 2024北京人大附中高二(下)统练一化学(含答案) |  | |
| 格式 | |||
| 文件大小 | 721.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-24 15:08:08 | ||
图片预览


文档简介
人大附中高二化学
高二年级第二学期化学限时练习(一)
I 卷
选择题(每题只有一个正确答案,每题 2分,共 40分)
1.下列有关物质结构与性质的说法中,不.正.确.的是( )
A.氮气通常条件下很稳定的原因是氮分子中氮氮三键的键能很大
B.金属易传热、能导电的原因是金属中有自由移动的电子
C.熔融氯化钠能导电的原因是其中有自由移动的电子
D.研究物质结构与性质的关系,有助于新材料的研发
2.C60 也称足球烯,其分子的结构如右图所示。
下列关于 C60 的说法中,正确的是( )
A.相对于苯等有机溶剂,更易溶于水
B.其中的 C 原子为 sp3 杂化
C.与金刚石互为同分异构体
D.可在氧气中燃烧
3.下列化学用语表达正确的是( )
A.乙炔分子的球棍模型: B.S2-的结构示意图:
C.丙醛的结构简式:CH3CH2COH D.Cu 的价电子排布式:3d94s2
4.下列化合物中,与 Ne 原子核外电子排布相同的离子跟与 Ar 原子核外电子排
布相同的离子形成的化合物是( )
A.MgBr2 B.Na2O C.KCl D.KF
5.下列各组元素中,第一电离能大小次序不.正.确.的是( )
A.Mg > Al B.O < F C.K < Cs D.S < P
6.某元素的第一至第五电离能(kJ/mol)的数据如下:
I1 I2 I3 I4 I5
578 1817 2745 11575 14830
该元素最有可能位于元素周期表的族是( )
A.IA B.IIA C.IIIA D.IVA
7.已知硒(Se)是一种对人体重要的微量元素,其原子序数是 34。下列关于 Se
的说法中,不.正.确.的是( )
A.原子半径:As > Se > S B.Se 的最高价氧化物为 SeO2
C.Se 的电负性小于 S D.H2Se 的稳定性弱于 H2S
1 / 7
8.已知短周期元素 A2+、 B+、 C2- -a b c 、dD 都具有相同的的电子层结构,则下列
叙述中正确的是( )
A.原子半径:A > B > C > D
B.原子序数:d > c > b > a
- -
C.离子半径:C2 > D > B+ > A2+
D.元素的电负性:A > B > C > D
9.中国科学家首次在月球上发现新矿物,并将其命名为“嫦娥石[(Ca8Y)Fe(PO4)7]”。
Y(钇)是金属元素,下列说法不.正.确.的是( )
A.(Ca8Y)Fe(PO4)7 是一种磷酸盐
B.电负性 O>P,嫦娥石中 P 显正价,O 显负价
C.在元素周期表中,O、P、Fe 均属于 s 区元素
D.原子半径:O<P
10.原子序数依次增大的短周期元素 X、Y、Z、W 的某些性质如下。
元素 X Y Z W
电负性 2.5 3.5 2.5 3.0
最低化合价 -4 -2 -2 -1
下列说法正确的是( )
A.在 XY2 分子中只有 σ 键没有 π 键
B.在 ZY2 分子中 Z 显负价
C.最高价含氧酸的酸性:H2ZO4 > HWO4
D.XW4 分子的空间结构是正四面体形
11.下列各组分子或离子的空间结构相似的是( )
A. - - -BF 23 与 SO3 B.CO 23 与 NO3
C.H2O 与 BeCl2 D.SO2 与 CO2
12.COCl2 又称为光气,是一种重要的有机试剂,其结构如右图,
下列关于 COCl2 的说法不.正.确.的是( )
A.它是一个非极性分子
B.碳原子的杂化方式为 sp2
C.C=O 与 C—Cl 间的排斥大于两个 C—Cl 间的排斥
D.C—Cl 键长更长与 Cl 原子半径较大、C—Cl 键是单键有关
13.很多金属原子可与 CO 形成化学式为 M(CO)n的金属羰基配合物。其中,每
个 CO 提供 1 对电子与金属原子形成配位键,且金属原子的价电子与 CO 提供的
电子总和等于 18。下列化学式中符合上述描述的金属羰基配合物是( )
A.Mn(CO)5 B.Fe(CO)5 C.Co(CO)5 D.Ni(CO)5
2 / 7
14.下列选项中,所列出的物质性质差异主要受范德华力大小影响的是( )
A.HF 的沸点比 HCl 的高
B.氧化镁的熔点高于氯化钠
C.H2O 的分解温度比 H2S 的高
D.常温下 Br2 为液体而 I2 为固体
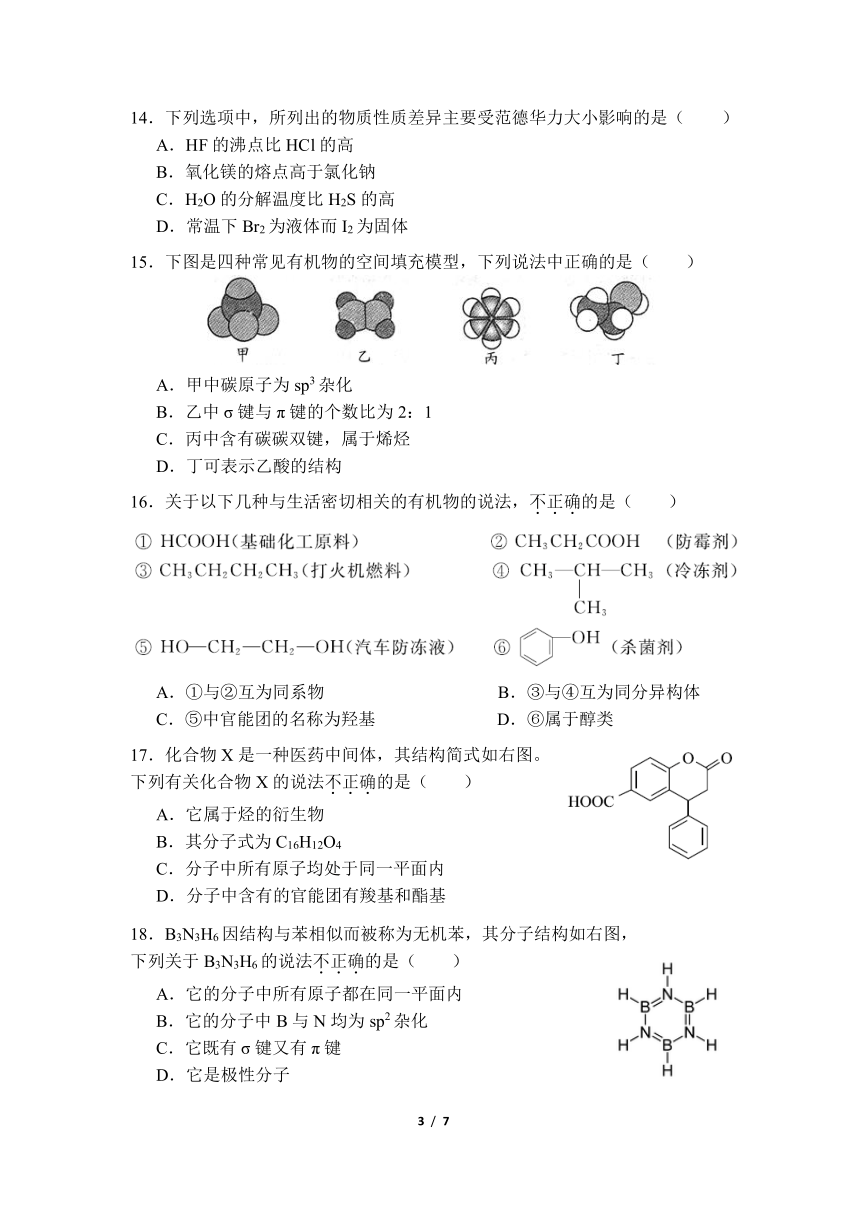
15.下图是四种常见有机物的空间填充模型,下列说法中正确的是( )
A.甲中碳原子为 sp3 杂化
B.乙中 σ 键与 π 键的个数比为 2:1
C.丙中含有碳碳双键,属于烯烃
D.丁可表示乙酸的结构
16.关于以下几种与生活密切相关的有机物的说法,不.正.确.的是( )
A.①与②互为同系物 B.③与④互为同分异构体
C.⑤中官能团的名称为羟基 D.⑥属于醇类
17.化合物 X 是一种医药中间体,其结构简式如右图。
下列有关化合物 X 的说法不.正.确.的是( )
A.它属于烃的衍生物
B.其分子式为 C16H12O4
C.分子中所有原子均处于同一平面内
D.分子中含有的官能团有羧基和酯基
18.B3N3H6 因结构与苯相似而被称为无机苯,其分子结构如右图,
下列关于 B3N3H6 的说法不.正.确.的是( )
A.它的分子中所有原子都在同一平面内
B.它的分子中 B 与 N 均为 sp2 杂化
C.它既有 σ 键又有 π 键
D.它是极性分子
3 / 7
19.在 CuCl2 溶液中存在如下平衡:
- -
[CuCl4]
2 (黄色)+ 4H2O [Cu(H2O) ]2+4 (蓝色)+ 4Cl ΔH < 0
下列说法中不.正.确.的是( )
A.将 CuCl2 溶液加热,可使溶液的颜色变绿
B.向 CuCl2 的浓溶液中加水,溶液将从绿色逐渐变为蓝色
C.向 CuCl2 稀溶液中加入 NaCl 固体,溶液将从蓝色变为绿色
D.向 CuCl2 溶液中加入 AgNO3,可使上述平衡向逆反应方向移动
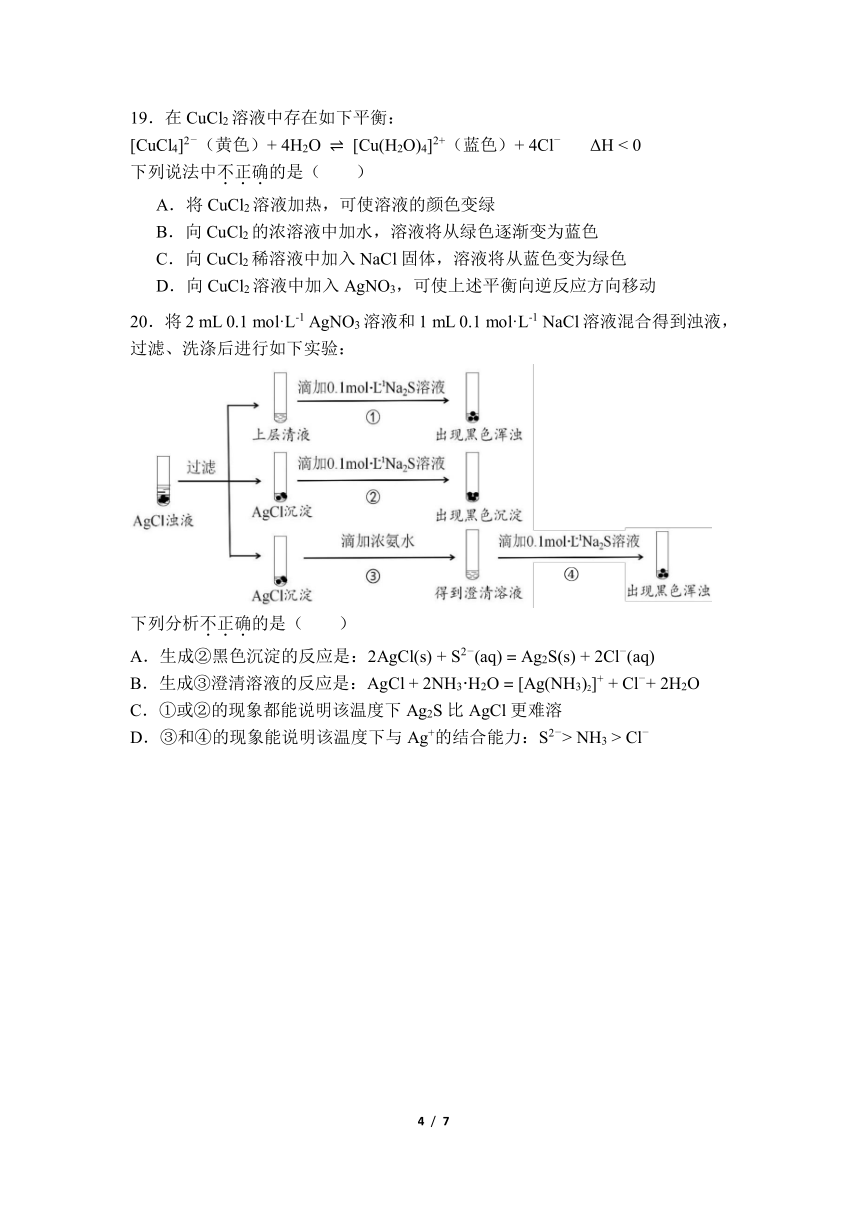
20. 将 2 mL 0.1 mol·L-1 AgNO3 溶液和 1 mL 0.1 mol·L-1 NaCl溶液混合得到浊液,
过滤、洗涤后进行如下实验:
下列分析不.正.确.的是( )
A.生成②黑色沉淀的反应是: - -2AgCl(s) + S2 (aq) = Ag2S(s) + 2Cl (aq)
B.生成③澄清溶液的反应是: -AgCl + 2NH3·H2O = [Ag(NH3)2]+ + Cl + 2H2O
C.①或②的现象都能说明该温度下 Ag2S 比 AgCl 更难溶
D.③和④的现象能说明该温度下与 Ag+的结合能力: 2- -S > NH3 > Cl
4 / 7
II 卷(共 60分)
21.(13 分)现有下列几种常见物质:①N2、②NaCl、③Ca(OH)2、④Na2O2、⑤
CO2、⑥H2O2、⑦H2S、⑧CCl4、⑨C6H6(苯)、⑩[Cu(NH3)4]SO4。
(1)其中,只由非极性键形成的分子是________________(填序号,下同);
(2)只由极性键形成的非极性分子是__________________;
(3)含离子键的化合物是_________________;
(4)既含离子键又含非极性共价键的化合物是____________________;
(5)在⑩中,Cu 元素的价态为_________,配位原子是________,阴离子的空
间结构为__________,向⑩的水溶液中加入过量稀硫酸,溶液由深蓝色变为浅蓝
色,该反应的离子方程式为____________________________________________。
22.(14 分)①、②、③、④是原子序数依次增大的四种短周期元素,①周期表
中原子半径最小的元素,②的最外层电子数比次外层多 1,③的第一电离能比左
右相邻两元素的都要大,④是周期表中电负性最大的元素。元素①和③可形成一
种三角锥形的分子 A,元素②和④可形成一种平面三角形的分子 B。
(1)元素②的基态原子的电子排布式为_________________。
(2)元素③的价电子的轨道表示式为_____________________________。
(3)已知元素①与②形成的化合物中元素①呈负价,将元素①、②、③、④按
电负性由大到小排序:___________________(用元素符号表示)。
(4)分子 A 的电子式为__________,分子 B 的中心原子杂化方式为________;
A 与 B 之间能否形成配位键?若能,用化学用语表示出两者之间的配位键;若
不能,说明理由:____________________________________________________。
(5)这四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、
阳离子各含其中两种元素,写出一种符合要求的化学式:__________________。
5 / 7
23.(19 分)认识有机物组成和结构对有机物的学习非常重要。
I. 下列有机物中:①C2H4 ②C2H2 ③CH3Cl ④C2H5OH ⑤CH3COOH
⑥CH3COOC2H5 ⑦ ⑧ (环己烷)
(1)属于烃的是____________(填序号);
(2)分子中所有原子一定在同一平面内的是____________(填序号);
(3)①中官能团的名称为___________,⑤中官能团的结构简式为_________;
(4)若按官能团种类分类,则⑥所属的物质类别为___________。
II. 以下是小明同学拼插出来的几种烃分子的球棍模型:
A B C D
(5)其中 A 的结构简式为______________,D 的系统命名为______________;
(6)其中互为同分异构体的是_________(填序号,下同),与 C 互为同系物的
是_________,模型拼插不符合有机物基本结构的是_________;
III. 碳正离子是有机反应中一类重要中间体。
(7)CH +3 是最简单的碳正离子,它的中心原子杂化方式为_______,空间结构为
___________。CH +3 并不稳定,原因是___________________________________。
(8)(C6H5)3COH(C6H5-代表苯基)在浓硫酸中会形成一种深黄色的物质,研
究发现该物质含一种较稳定的碳正离子,该离子中最多可以有 34 个原子处于同
一平面内,当该离子中所有原子共平面时,可以形成一个大 π 键,该大 π 键由
______个 p 轨道通过“肩并肩”方式重叠形成,其中共含有_______个电子。
6 / 7
24.(14 分)某实验小组同学用 KSCN 探究久置 FeSO4 固体变质的情况。将 0.3 g
FeSO4 固体用 10mL 蒸馏水溶解,配成待测液,进行实验。
【初步实验】
(1)用 KSCN 检验 Fe3+的原理是__________________(用离子方程式表示)。
(2)甲同学认为 FeSO4 固体几乎未变质,ⅱ中变血红色是由于 Fe2+被______(填
化学式)氧化。结合平衡移动原理解释ⅱ中血红色褪去的可能原因___________
____________________________________________________________________。
(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与
其它因素有关,可能的影响因素是______________。为验证该猜测,乙同学继续
进行了以下实验。
【继续探究】
步骤 操作 现象
Ⅰ 取 2 mL 待测液,加入 5 滴 0.1mol·L
-1
溶液无明显变化
KSCN 溶液,再加入 5 mL 浓 KNO3 溶液
Ⅱ 取 2 mL 待测液,加入 5 滴 0.1mol·L
-1
溶液变为红色
KSCN 溶液,_______________________
Ⅲ 向Ⅱ中所得溶液中逐滴加入浓硝酸,边加 溶液逐渐加深为血红色,
边振荡 继续滴加浓硝酸,溶液褪
色,pH 变化始终不明显
(4)请补全步骤Ⅱ中的操作:________________________。
(5)由Ⅰ~Ⅲ推测 FeSO4 固体变质的情况是_______(填字母序号)。
a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用 KSCN 检验 Fe3+及进行 Fe2+还原性验证实验
时,需要注意的事项有____________________________________(至少 2 条)。
7 / 7
人大附中高二化学
高二年级第二学期化学限时练习(一) 参考答案
1 2 3 4 5 6 7 8 9 10
C D A D C C B C C D
11 12 13 14 15 16 17 18 19 20
B A B D A D C D D C
21.(13 分,若未标注,每空 2 分)
(1)① (2)⑤⑧ (3)②③④⑩ (4)④
(5)+2, N, 正四面体(各 1 分)
[Cu(NH ) ]2+ + 4H+ = Cu2+ 3 4 + 4NH
+
4 或 [Cu(NH3) ]2+4 + 4H+ + 4H O = [Cu(H O) ]2+ 2 2 4 + 4NH +4
22.(14 分,每空 2 分)
(1)1s22s22p1 (2)
(3)F > N > H > B
(4) , sp2; 能,H3N→BF3
-
(5)[NH ]+4 [BF4] (2 分,可不打括号,其他合理答案亦可)
23.(19 分,若未标注,每空 1 分)
(1)①②⑦⑧(2 分) (2)①②⑦(2 分)
(3)碳碳双键, —COOH (4)酯
(5) , 2,2-二甲基丙烷(每空 2 分)
(6)CD, A, B
(7)sp2, 平面三角形, CH +3 中 C 周围只有 6 个电子,未达 8 电子稳定结构。
(8)19, 18
24.(14 分,每空 2 分)
(1)Fe3+
- -
+ 3SCN Fe(SCN)3或 Fe3+ + nSCN [Fe(SCN) ]3-nn
(2)HNO3。
- -
HNO3 过量后,SCN 被其氧化,导致 c(SCN )降低,使 Fe3+与 SCN-的配位平衡逆移。
(3)溶液的酸性或 c(H+)
(4)加入 5 mL 6 mol/L H2SO4
(5)b (6)需在酸性条件下检验;氧化剂需适量/氧化剂浓度不能过高
高二年级第二学期化学限时练习(一)
I 卷
选择题(每题只有一个正确答案,每题 2分,共 40分)
1.下列有关物质结构与性质的说法中,不.正.确.的是( )
A.氮气通常条件下很稳定的原因是氮分子中氮氮三键的键能很大
B.金属易传热、能导电的原因是金属中有自由移动的电子
C.熔融氯化钠能导电的原因是其中有自由移动的电子
D.研究物质结构与性质的关系,有助于新材料的研发
2.C60 也称足球烯,其分子的结构如右图所示。
下列关于 C60 的说法中,正确的是( )
A.相对于苯等有机溶剂,更易溶于水
B.其中的 C 原子为 sp3 杂化
C.与金刚石互为同分异构体
D.可在氧气中燃烧
3.下列化学用语表达正确的是( )
A.乙炔分子的球棍模型: B.S2-的结构示意图:
C.丙醛的结构简式:CH3CH2COH D.Cu 的价电子排布式:3d94s2
4.下列化合物中,与 Ne 原子核外电子排布相同的离子跟与 Ar 原子核外电子排
布相同的离子形成的化合物是( )
A.MgBr2 B.Na2O C.KCl D.KF
5.下列各组元素中,第一电离能大小次序不.正.确.的是( )
A.Mg > Al B.O < F C.K < Cs D.S < P
6.某元素的第一至第五电离能(kJ/mol)的数据如下:
I1 I2 I3 I4 I5
578 1817 2745 11575 14830
该元素最有可能位于元素周期表的族是( )
A.IA B.IIA C.IIIA D.IVA
7.已知硒(Se)是一种对人体重要的微量元素,其原子序数是 34。下列关于 Se
的说法中,不.正.确.的是( )
A.原子半径:As > Se > S B.Se 的最高价氧化物为 SeO2
C.Se 的电负性小于 S D.H2Se 的稳定性弱于 H2S
1 / 7
8.已知短周期元素 A2+、 B+、 C2- -a b c 、dD 都具有相同的的电子层结构,则下列
叙述中正确的是( )
A.原子半径:A > B > C > D
B.原子序数:d > c > b > a
- -
C.离子半径:C2 > D > B+ > A2+
D.元素的电负性:A > B > C > D
9.中国科学家首次在月球上发现新矿物,并将其命名为“嫦娥石[(Ca8Y)Fe(PO4)7]”。
Y(钇)是金属元素,下列说法不.正.确.的是( )
A.(Ca8Y)Fe(PO4)7 是一种磷酸盐
B.电负性 O>P,嫦娥石中 P 显正价,O 显负价
C.在元素周期表中,O、P、Fe 均属于 s 区元素
D.原子半径:O<P
10.原子序数依次增大的短周期元素 X、Y、Z、W 的某些性质如下。
元素 X Y Z W
电负性 2.5 3.5 2.5 3.0
最低化合价 -4 -2 -2 -1
下列说法正确的是( )
A.在 XY2 分子中只有 σ 键没有 π 键
B.在 ZY2 分子中 Z 显负价
C.最高价含氧酸的酸性:H2ZO4 > HWO4
D.XW4 分子的空间结构是正四面体形
11.下列各组分子或离子的空间结构相似的是( )
A. - - -BF 23 与 SO3 B.CO 23 与 NO3
C.H2O 与 BeCl2 D.SO2 与 CO2
12.COCl2 又称为光气,是一种重要的有机试剂,其结构如右图,
下列关于 COCl2 的说法不.正.确.的是( )
A.它是一个非极性分子
B.碳原子的杂化方式为 sp2
C.C=O 与 C—Cl 间的排斥大于两个 C—Cl 间的排斥
D.C—Cl 键长更长与 Cl 原子半径较大、C—Cl 键是单键有关
13.很多金属原子可与 CO 形成化学式为 M(CO)n的金属羰基配合物。其中,每
个 CO 提供 1 对电子与金属原子形成配位键,且金属原子的价电子与 CO 提供的
电子总和等于 18。下列化学式中符合上述描述的金属羰基配合物是( )
A.Mn(CO)5 B.Fe(CO)5 C.Co(CO)5 D.Ni(CO)5
2 / 7
14.下列选项中,所列出的物质性质差异主要受范德华力大小影响的是( )
A.HF 的沸点比 HCl 的高
B.氧化镁的熔点高于氯化钠
C.H2O 的分解温度比 H2S 的高
D.常温下 Br2 为液体而 I2 为固体
15.下图是四种常见有机物的空间填充模型,下列说法中正确的是( )
A.甲中碳原子为 sp3 杂化
B.乙中 σ 键与 π 键的个数比为 2:1
C.丙中含有碳碳双键,属于烯烃
D.丁可表示乙酸的结构
16.关于以下几种与生活密切相关的有机物的说法,不.正.确.的是( )
A.①与②互为同系物 B.③与④互为同分异构体
C.⑤中官能团的名称为羟基 D.⑥属于醇类
17.化合物 X 是一种医药中间体,其结构简式如右图。
下列有关化合物 X 的说法不.正.确.的是( )
A.它属于烃的衍生物
B.其分子式为 C16H12O4
C.分子中所有原子均处于同一平面内
D.分子中含有的官能团有羧基和酯基
18.B3N3H6 因结构与苯相似而被称为无机苯,其分子结构如右图,
下列关于 B3N3H6 的说法不.正.确.的是( )
A.它的分子中所有原子都在同一平面内
B.它的分子中 B 与 N 均为 sp2 杂化
C.它既有 σ 键又有 π 键
D.它是极性分子
3 / 7
19.在 CuCl2 溶液中存在如下平衡:
- -
[CuCl4]
2 (黄色)+ 4H2O [Cu(H2O) ]2+4 (蓝色)+ 4Cl ΔH < 0
下列说法中不.正.确.的是( )
A.将 CuCl2 溶液加热,可使溶液的颜色变绿
B.向 CuCl2 的浓溶液中加水,溶液将从绿色逐渐变为蓝色
C.向 CuCl2 稀溶液中加入 NaCl 固体,溶液将从蓝色变为绿色
D.向 CuCl2 溶液中加入 AgNO3,可使上述平衡向逆反应方向移动
20. 将 2 mL 0.1 mol·L-1 AgNO3 溶液和 1 mL 0.1 mol·L-1 NaCl溶液混合得到浊液,
过滤、洗涤后进行如下实验:
下列分析不.正.确.的是( )
A.生成②黑色沉淀的反应是: - -2AgCl(s) + S2 (aq) = Ag2S(s) + 2Cl (aq)
B.生成③澄清溶液的反应是: -AgCl + 2NH3·H2O = [Ag(NH3)2]+ + Cl + 2H2O
C.①或②的现象都能说明该温度下 Ag2S 比 AgCl 更难溶
D.③和④的现象能说明该温度下与 Ag+的结合能力: 2- -S > NH3 > Cl
4 / 7
II 卷(共 60分)
21.(13 分)现有下列几种常见物质:①N2、②NaCl、③Ca(OH)2、④Na2O2、⑤
CO2、⑥H2O2、⑦H2S、⑧CCl4、⑨C6H6(苯)、⑩[Cu(NH3)4]SO4。
(1)其中,只由非极性键形成的分子是________________(填序号,下同);
(2)只由极性键形成的非极性分子是__________________;
(3)含离子键的化合物是_________________;
(4)既含离子键又含非极性共价键的化合物是____________________;
(5)在⑩中,Cu 元素的价态为_________,配位原子是________,阴离子的空
间结构为__________,向⑩的水溶液中加入过量稀硫酸,溶液由深蓝色变为浅蓝
色,该反应的离子方程式为____________________________________________。
22.(14 分)①、②、③、④是原子序数依次增大的四种短周期元素,①周期表
中原子半径最小的元素,②的最外层电子数比次外层多 1,③的第一电离能比左
右相邻两元素的都要大,④是周期表中电负性最大的元素。元素①和③可形成一
种三角锥形的分子 A,元素②和④可形成一种平面三角形的分子 B。
(1)元素②的基态原子的电子排布式为_________________。
(2)元素③的价电子的轨道表示式为_____________________________。
(3)已知元素①与②形成的化合物中元素①呈负价,将元素①、②、③、④按
电负性由大到小排序:___________________(用元素符号表示)。
(4)分子 A 的电子式为__________,分子 B 的中心原子杂化方式为________;
A 与 B 之间能否形成配位键?若能,用化学用语表示出两者之间的配位键;若
不能,说明理由:____________________________________________________。
(5)这四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、
阳离子各含其中两种元素,写出一种符合要求的化学式:__________________。
5 / 7
23.(19 分)认识有机物组成和结构对有机物的学习非常重要。
I. 下列有机物中:①C2H4 ②C2H2 ③CH3Cl ④C2H5OH ⑤CH3COOH
⑥CH3COOC2H5 ⑦ ⑧ (环己烷)
(1)属于烃的是____________(填序号);
(2)分子中所有原子一定在同一平面内的是____________(填序号);
(3)①中官能团的名称为___________,⑤中官能团的结构简式为_________;
(4)若按官能团种类分类,则⑥所属的物质类别为___________。
II. 以下是小明同学拼插出来的几种烃分子的球棍模型:
A B C D
(5)其中 A 的结构简式为______________,D 的系统命名为______________;
(6)其中互为同分异构体的是_________(填序号,下同),与 C 互为同系物的
是_________,模型拼插不符合有机物基本结构的是_________;
III. 碳正离子是有机反应中一类重要中间体。
(7)CH +3 是最简单的碳正离子,它的中心原子杂化方式为_______,空间结构为
___________。CH +3 并不稳定,原因是___________________________________。
(8)(C6H5)3COH(C6H5-代表苯基)在浓硫酸中会形成一种深黄色的物质,研
究发现该物质含一种较稳定的碳正离子,该离子中最多可以有 34 个原子处于同
一平面内,当该离子中所有原子共平面时,可以形成一个大 π 键,该大 π 键由
______个 p 轨道通过“肩并肩”方式重叠形成,其中共含有_______个电子。
6 / 7
24.(14 分)某实验小组同学用 KSCN 探究久置 FeSO4 固体变质的情况。将 0.3 g
FeSO4 固体用 10mL 蒸馏水溶解,配成待测液,进行实验。
【初步实验】
(1)用 KSCN 检验 Fe3+的原理是__________________(用离子方程式表示)。
(2)甲同学认为 FeSO4 固体几乎未变质,ⅱ中变血红色是由于 Fe2+被______(填
化学式)氧化。结合平衡移动原理解释ⅱ中血红色褪去的可能原因___________
____________________________________________________________________。
(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与
其它因素有关,可能的影响因素是______________。为验证该猜测,乙同学继续
进行了以下实验。
【继续探究】
步骤 操作 现象
Ⅰ 取 2 mL 待测液,加入 5 滴 0.1mol·L
-1
溶液无明显变化
KSCN 溶液,再加入 5 mL 浓 KNO3 溶液
Ⅱ 取 2 mL 待测液,加入 5 滴 0.1mol·L
-1
溶液变为红色
KSCN 溶液,_______________________
Ⅲ 向Ⅱ中所得溶液中逐滴加入浓硝酸,边加 溶液逐渐加深为血红色,
边振荡 继续滴加浓硝酸,溶液褪
色,pH 变化始终不明显
(4)请补全步骤Ⅱ中的操作:________________________。
(5)由Ⅰ~Ⅲ推测 FeSO4 固体变质的情况是_______(填字母序号)。
a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用 KSCN 检验 Fe3+及进行 Fe2+还原性验证实验
时,需要注意的事项有____________________________________(至少 2 条)。
7 / 7
人大附中高二化学
高二年级第二学期化学限时练习(一) 参考答案
1 2 3 4 5 6 7 8 9 10
C D A D C C B C C D
11 12 13 14 15 16 17 18 19 20
B A B D A D C D D C
21.(13 分,若未标注,每空 2 分)
(1)① (2)⑤⑧ (3)②③④⑩ (4)④
(5)+2, N, 正四面体(各 1 分)
[Cu(NH ) ]2+ + 4H+ = Cu2+ 3 4 + 4NH
+
4 或 [Cu(NH3) ]2+4 + 4H+ + 4H O = [Cu(H O) ]2+ 2 2 4 + 4NH +4
22.(14 分,每空 2 分)
(1)1s22s22p1 (2)
(3)F > N > H > B
(4) , sp2; 能,H3N→BF3
-
(5)[NH ]+4 [BF4] (2 分,可不打括号,其他合理答案亦可)
23.(19 分,若未标注,每空 1 分)
(1)①②⑦⑧(2 分) (2)①②⑦(2 分)
(3)碳碳双键, —COOH (4)酯
(5) , 2,2-二甲基丙烷(每空 2 分)
(6)CD, A, B
(7)sp2, 平面三角形, CH +3 中 C 周围只有 6 个电子,未达 8 电子稳定结构。
(8)19, 18
24.(14 分,每空 2 分)
(1)Fe3+
- -
+ 3SCN Fe(SCN)3或 Fe3+ + nSCN [Fe(SCN) ]3-nn
(2)HNO3。
- -
HNO3 过量后,SCN 被其氧化,导致 c(SCN )降低,使 Fe3+与 SCN-的配位平衡逆移。
(3)溶液的酸性或 c(H+)
(4)加入 5 mL 6 mol/L H2SO4
(5)b (6)需在酸性条件下检验;氧化剂需适量/氧化剂浓度不能过高
同课章节目录
