化学人教版(2019)必修第二册7.2.2烃(共70张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.2.2烃(共70张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-23 22:51:14 | ||
图片预览







文档简介
(共70张PPT)
1、汽油、柴油主要成分是什么?
汽油、柴油主要含烃类物质
2、常见燃油标号95、92的含义是什么?
那么对于烃来说它们是如何分类的,不同类别烃的性质有什么不同呢?
异辛烷的含量不同,防爆能力不同
人教版必修第二册
第七章 有机化合物
第二节 乙烯与有机高分子材料
第二课时 烃
只含有碳和氢两种元素的有机化合物称为碳氢化合物,用通式CxHy表示,
也称为烃。
碳 + 氢 =
烃
tàn qīng
tīng
你知道“烃”字的由来吗?
一、烃
【微思考】“一种有机物完全燃烧,产物只有二氧化碳和水,则该有机物一定是烃”这种说法是否正确 为什么
不正确。
由燃烧产物只有二氧化碳和水,
可以确定该有机物中一定含有碳、氢两种元素,
无法确定是否含有氧元素。可能有氧元素,也可能没有。
1.下列物质中不属于烃类的是( )
A、C6H6 B、C8H10
C、C2H4O D、C4H10
C
阅读课本P69,明确烃的概念,
并尝试用树状分类法对烃进行分类。
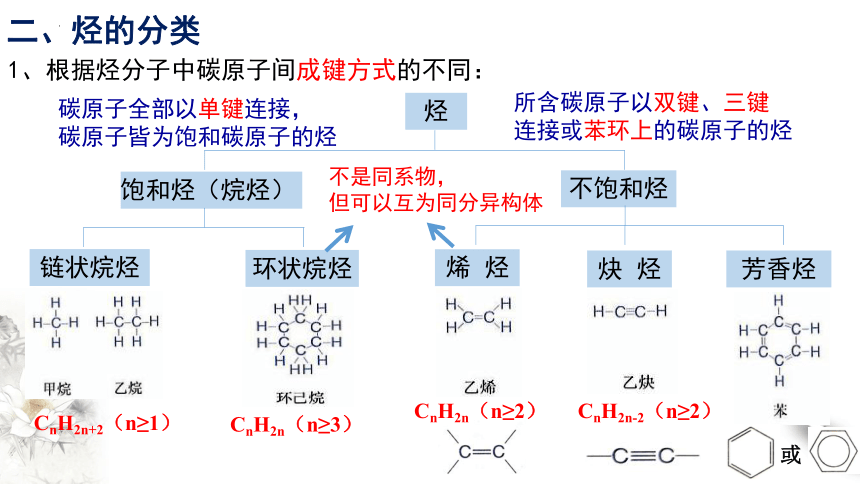
烃
饱和烃(烷烃)
不饱和烃
链状烷烃
环状烷烃
烯 烃
炔 烃
芳香烃
CnH2n+2(n≥1)
CnH2n(n≥3)
CnH2n(n≥2)
CnH2n-2(n≥2)
或
碳原子全部以单键连接,
碳原子皆为饱和碳原子的烃
所含碳原子以双键、三键
连接或苯环上的碳原子的烃
1、根据烃分子中碳原子间成键方式的不同:
二、烃的分类
不是同系物,
但可以互为同分异构体
乙烯的分子式为C2H4,故分子组成为C6H12的烃一定属于烯烃( )
分子组成为C6H12的烃,可以是烯烃,也可能属于环烷烃,如环己烷。
×
烯烃的通式 CnH2n(n≥2)
注意:但符合这个通式的却不一定是烯烃,比如环烷烃 CnH2n(n≥3)
针对训练
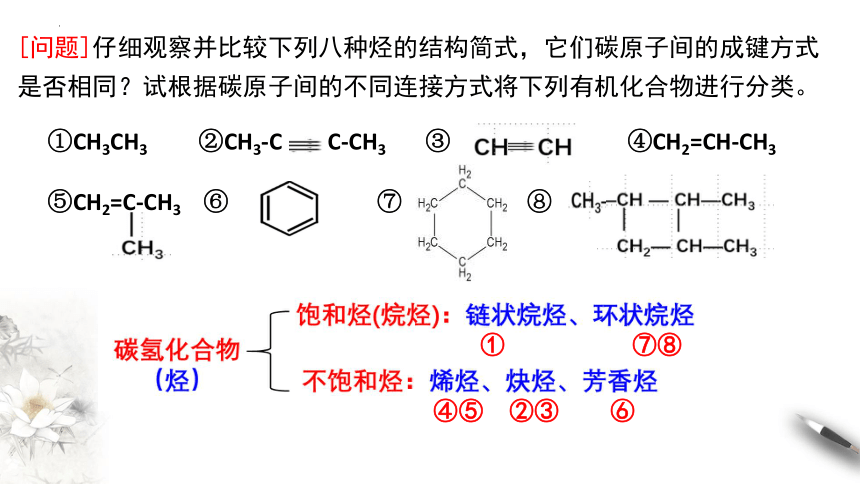
[问题]仔细观察并比较下列八种烃的结构简式,它们碳原子间的成键方式是否相同?试根据碳原子间的不同连接方式将下列有机化合物进行分类。
①CH3CH3 ②CH3-C C-CH3 ③ ④CH2=CH-CH3
⑤CH2=C-CH3 ⑥ ⑦ ⑧
① ⑦⑧
④⑤ ②③ ⑥
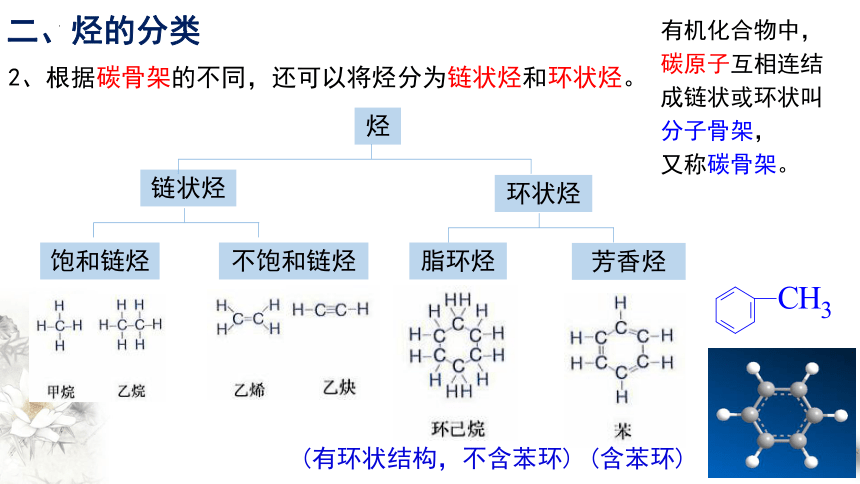
2、根据碳骨架的不同,还可以将烃分为链状烃和环状烃。
烃
链状烃
环状烃
饱和链烃
不饱和链烃
脂环烃
芳香烃
二、烃的分类
(有环状结构,不含苯环)
(含苯环)
有机化合物中,
碳原子互相连结
成链状或环状叫
分子骨架,
又称碳骨架。
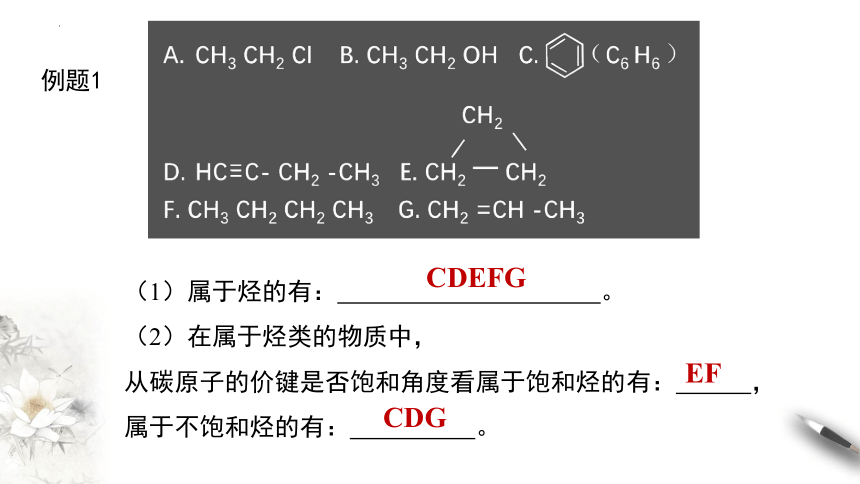
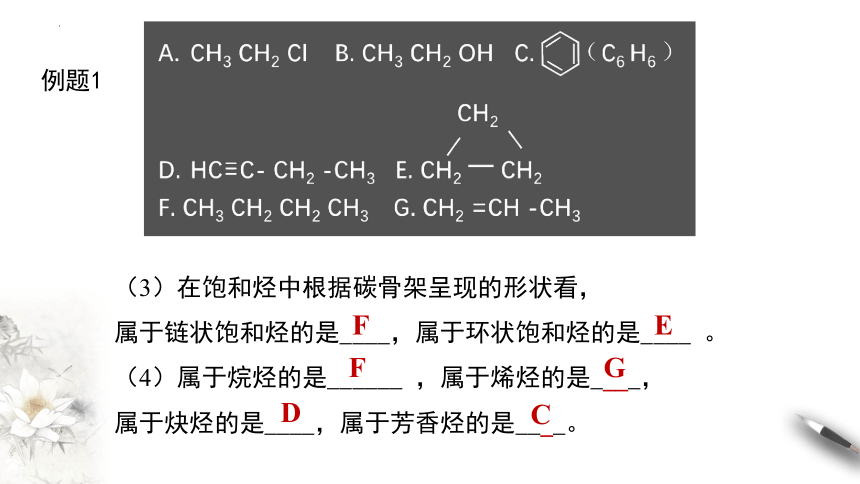
例题1
(1)属于烃的有: 。
(2)在属于烃类的物质中,
从碳原子的价键是否饱和角度看属于饱和烃的有: ,
属于不饱和烃的有: 。
CDEFG
EF
CDG
例题1
(3)在饱和烃中根据碳骨架呈现的形状看,
属于链状饱和烃的是____,属于环状饱和烃的是____ 。
(4)属于烷烃的是______ ,属于烯烃的是____,
属于炔烃的是____,属于芳香烃的是____。
F
E
G
F
D
C
【目的】以甲烷、乙烯和乙炔为例,借助模型认识烃的分子结构。
【活动】 (1) 根据碳原子的成键规律和甲烷、乙烯、乙炔的结构式,写出三者的电子式,并讨论其分子中有哪些类型的化学键。
(2) 结合以上分析,使用分子结构模型(或橡皮泥、黏土、泡沫塑料、牙签等代用品)搭建甲烷、乙烯和乙炔分子的球棍模型。
展示并描述三者的分子结构特点。
课本P70 探究:烃的分子结构
烃 甲 烷 乙 烯 乙 炔
电子式
化学键
球棍模型
分子结构 特点
C—H
C—H
C—H
—C≡C—
碳原子4个单电子完全和4个氢原子形成4个共价单键,形成以碳原子为中心的正四面体结构
碳和碳形成碳碳双键,
剩余价键完全和氢原子
形成C—H单键,键和键夹角为120°,2个碳原子和4个氢原子在同一平面内
碳和碳形成碳碳三键,
剩余价键和氢原子形成C—H单键,键和键夹角为180°,2个氢和2个碳原子成直线结构
问题与讨论(1)比较甲烷和乙烯的化学性质,分析其与二者的分子结构之间存在哪些联系?
物质 甲烷 乙烯
与Br2 反应 Br2试剂 ________ ___________________
反应条件 _____
反应类型 _____ _____
氧化 反应 和O2燃烧 燃烧,火焰呈 色 燃烧,火焰_______________
酸性KMnO4溶液 _______ ____________________
性质和结构关系
Br2蒸气
溴水或溴的CCl4溶液
光照
取代
加成
淡蓝
明亮、伴有黑烟
不反应
酸性KMnO4溶液褪色
性质和结构关系 CH4分子中的碳原子为 结构,所成的键为 ,性质 , 主要发生 反应 CH2==CH2分子中的碳原子为___
结构,所成的键为 ,其中一个键容易断裂,性质活泼,
主要发生 、 反应
问题与讨论(1)比较甲烷和乙烯的化学性质,分析其与二者的分子结构之间存在哪些联系?
饱和
单键
稳定
取代
不饱和
碳碳双键
加成反应
氧化
结论:烷烃、烯烃、均可燃烧;
其中烷烃易取代,而烯烃易加成。
烯烃能与酸性高锰酸钾溶液发生氧化反应。
问题与讨论 (2) 乙炔是甲烷或乙烯的同系物吗?为什么?
不是,结构不相似,在分子组成上也不相差一个或若干个CH2原子团。
同系物是指结构相似,
在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
结构相似是指:
(1)碳和碳存在相同的化学键
(2)结构相似
(3)在组成上相差一个或者n个CH2
分子式 最简式 电子式 结构式 结构简式 空间构型 键角
球棍模型 空间填充模型(比例模型) 直线型
180°
CH ≡ CH
或 HC ≡ CH
H-C ≡ C-H
4个原子共线共平面
三、最简单的炔烃——乙炔
1、乙炔的结构
含有C≡C的烃叫做炔烃。炔烃是不饱和烃,
乙炔俗称电石气,是最简单的炔烃。
C2H2
CH
思考:该分子结构中最多可以有 个原子在同一个平面?
6
例、描述 CH3—C≡C—CH3 分子结构,
下列叙述中正确的是( )
A.4个碳原子有可能都在一条直线上
B.4个碳原子不可能都在一条直线上
C.4个碳原子有可能都在同一平面上
D.4个碳原子不可能都在同一平面上
BC
推论:与碳碳三键上的碳原子直接相连的原子与其在同一个平面
AC
无色、极易燃气体,
三、最简单的炔烃——乙炔
2、乙炔的物理性质
思考:根据乙炔的成键方式和结构推测其可能有哪些化学性质?
类比乙烯
(1) 氧化反应
①与氧气反应:
2C2H2+ 5O2 4CO2+2H2O
点燃
甲烷 乙烯 乙炔
现象:火焰明亮,伴有大量黑烟
放出大量的热,温度达3000℃以上,
用于切割、焊接金属。
3、乙炔的化学性质
密度小于空气,
微溶于水,易溶于苯、乙醇等有机溶剂
能使酸性KMnO4溶液褪色
能使溴水或溴的四氯化碳溶液褪色
(2)加成反应(与H2、X2、HX等)
三、最简单的炔烃——乙炔
(1) 氧化反应
1, 2-二溴乙烯
1,1,2,2-四溴乙烷
少量溴
过量溴
3、乙炔的化学性质
②与氧化剂反应:
请写出乙炔与氢气、氯化氢发生加成反应的化学方程式。
针对训练
少量氢气
过量氢气
少量氯化氢
过量氯化氢
1,2-二氯乙烷
氯乙烯
思考:乙烯能聚合成聚乙烯,乙炔也能发生聚合反应吗?
(3)加聚反应
nCH CH
CH=CH
n
催化剂
聚乙炔:导电塑料
炔烃的结构和性质与乙炔的相似,都含有碳碳三键,能发生氧化反应、加成反应和加聚反应。
三、最简单的炔烃——乙炔
乙炔
3、乙炔的化学性质
(1)乙炔是一种重要的基本有机原料,
可以用来制备氯乙烯、聚氯乙烯和乙醛等。
三、最简单的炔烃——乙炔
4、乙炔的用途
(2)乙炔燃烧时产生的氧炔焰
可用来切割或焊接金属。
乙炔在氧气里燃烧产生的火焰叫氧炔焰
下列关于乙烷、乙烯、乙炔的说法正确的是( )
①它们既不是同系物,也不是同分异构体
②乙烷是饱和烃,乙烯、乙炔是不饱和烃
③乙烯、乙炔能使溴水褪色,乙烷不能使溴水褪色
④它们都能燃烧,乙炔燃烧火焰最明亮,有浓烟
⑤它们都能使酸性高锰酸钾溶液褪色
A. ①③④ B. ①②③⑤ C. ②③④⑤ D. ①②③④
D
针对训练
1、苯:
烃
苯、芳香烃、芳香族化合物
2、芳香烃:分子中含有苯环的烃。
3、芳香族化合物:分子中含有苯环的有机物。
或
苯是最简单的芳香烃。
它们并不一定具有香味
凯库勒发现苯结构的故事
芳香化合物是指含有苯环的化合物,
最简单的芳香化合物是苯,
苯的结构是怎样的?
又是如何确定和发现的呢?
我们一起来看科学史话
凯库勒(1829年-1896年)
1865年,德国化学家凯库勒在一次梦里联想到一条小蛇首尾相咬,他猜测苯可能由6个碳原子首尾相连,环中碳原子以单双键相互交替结合而成。为纪念他在苯环中研究,这一表达式命名为“凯库勒式”。
共价键 碳碳单键 碳碳双键 苯环中的碳碳键
键长/pm 154.1 133.7 139
进入20世纪,科学家用X射线衍射法证实了苯分子结构是平面正六边形;每个碳碳键的键长相等,都是139 pm,介于碳碳单键与碳碳双键的键长之间。
苯是芳香烃的母体,其结构式
习惯上简写为 (凯库勒式)
实际上苯分子中6个碳原子之间的键完全相同,所以也常用来 表示苯分子的结构。
分子式 最简式 结构式 结构简式 球棍模型 空间填充模型 碳碳键角
烃
三、最简单的芳香化合物——苯
1、苯的结构
空间构型:
苯分子具有平面正六边形结构,
化学键:
6个碳原子之间的化学键____________
完全相同
苯环中的碳碳键长介于碳碳单键和碳碳双键的键长之间,
是一种介于碳碳单键和碳碳双键之间的独特的键。
C6H6
CH
120O
6个C原子,6个H原子,
12个原子共平面,
位于对角线位置上的4个原子共直线。
例:下列关于苯的说法错误的是( )
A.分子式为C6H6
B.所有的原子在同一平面上
C.存在碳碳单键与碳碳双键交替出现的结构
D.存在介于碳碳单键与碳碳双键之间的独特的键
C
推论:与苯环上的碳原子直接相连的原子与其在同一个平面
最多几个原子在同一个平面?
13个
三、最简单的芳香化合物——苯
2、苯的物理性质
常温下,纯的苯是无色、有特殊气味的透明液体,有毒,不溶于水。
苯易挥发,沸点80.1℃(低),熔点5.5 ℃(低),
常温下其密度比水小(ρ=0.88g/cm3),
难溶于水,易溶于有机溶剂,
本身也可作为有机溶剂。
C6H14 C6H6
—8H
高度不饱和的结构
结合碳四价理论,苯可能具有哪些不饱和键?
如何设计实验进行验证苯的不饱和键?
化学键 实验操作 预测现象
碳碳双键或 碳碳三建 取少量样品滴加酸性KMnO4溶液 紫色褪去
取少量样品滴加溴水溶液 溴水褪色
探究苯的分子结构
实验操作
实验现象
结论原因 液体分层,上层无色,
下层紫红色
液体分层,上层橙黄色,下层无色
苯不能被酸性高锰酸钾溶液氧化,也不能与溴水反应,
苯分子具有不同于烯烃和炔烃的特殊结构。
苯分子结构中不存在碳碳双键,其原因是
苯不能使酸性KMnO4溶液褪色,不能使溴水或溴的CCl4溶液褪色。
水层显紫色,没有褪色
苯层显黄色,苯能萃取溴水中Br2
(1)为什么两支试管溶液都发生了分层?
(2)右侧试管中上层溶液显黄色,说明苯对Br2溶解有什么规律?
苯不溶于水,密度比水小。
溴能在苯中溶解且溶解度大于水溶液中,苯能萃取溴水中的溴。
(1)氧化反应
②与氧化剂:苯不能使酸性高锰酸钾溶液褪色。
①与氧气反应:
在乙烯、乙炔、苯分子中,含碳的质量分数较甲烷等烷烃高,
乙炔、苯分子中含碳的质量分数相同,均为92.3%,均比乙烯高。
三、最简单的芳香化合物——苯
3、苯的化学性质
乙烯、乙炔、苯在空气中燃烧不完全,易产生黑烟,
乙炔、苯的黑烟更浓。
3、苯的化学性质
苯不能使溴水或溴的CCl4溶液褪色。
三、最简单的芳香化合物——苯
注意:苯能使溴水或溴的CCl4溶液分层,发生的不是化学反应,
而是物理变化,利用溶解度不同,苯对溴水的萃取作用。
苯中的键比较稳定,在通常情况下不易发生加成反应。
+3H2
(2)加成反应
环己烷
环己烷不是平面结构
在以Pt、Ni等催化剂并加热的条件下,苯能与H2发生加成反应。
三、最简单的芳香化合物——苯
4、苯的用途
苯是一种重要的有机化工原料和有机溶剂,
广泛用于生产医药、农药、香料、染料、洗涤剂和合成高分子材料等。
苯的分子式为C6H6,结构简式为 ,分子高度不饱和,
故苯分子中一定含有碳碳双键,属于烯烃( )
×
苯分子中含有 ,结构简式 是一种习惯写法,
分子中不含有 ,不属于烯烃,属于芳香烃。
针对训练
×
×
×
√
总结:分子式符合通式CnH2n+2的烃,一定是烷烃。
但烷烃的通式不一定是CnH2n+2,烷烃除了链状的,
还要考虑环烷烃通式CnH2n(n≥3)
请观察甲烷、乙烯、 乙炔、苯等有机物的球棍模型,
思考碳原子的成键方式与分子的空间构型、键角有什么关系?
原子间成键方式 空间构型 键角 一定共面原子
教学拓展-有机物共面共线问题
碳原子成键方式与空间构型关系规律
四面体形
109°28′
3个
平面形
120°
6个
直线形
180°
4个(共面共线)
平面形
120°
12个
对称轴上原子是共线
特别注意:(单键可旋转,而双键和三键不能旋转)
常见烃分子中原子共平面的判断
1.常见分子的空间结构
(1)甲烷型:
(2)乙烯型:
正四面体→凡是碳原子与4个原子形成4个共价键时,
其空间结构都是四面体形,5个原子中最多有3个原子共平面。
平面结构→与碳碳双键直接相连的4个原子与2个碳原子共平面。
(4)苯型:
(3)乙炔型:—C≡C—
常见烃分子中原子共平面的判断
1.常见分子的空间结构
直线结构→与碳碳三键直接相连的2个原子与2个碳原子共直线。
平面结构→位于苯环上的12个原子共平面,
位于对角线位置上的4个原子共直线。
2.有机物共面问题的解题规律
(1)甲烷、乙烯、苯三种分子中的氢原子如果被其他原子取代,则取代后的分子构型基本不变。
(2)共价单键可以自由旋转,共价双键和共价三键不能旋转。
(3)结构式中有甲基(或饱和碳原子)的有机物,其分子中的所有原子不可能共平面。
常见烃分子中原子共平面的判断
(4)要弄清题目要求的是“可能共面”还是“一定共面”,是“碳原子”还是“所有原子”。
(5)将所给有机物的分子中一定有共面的结构分别确定为平面M
和平面N,若两个平面通过一个碳碳单键相连,则通过旋转任意一个平面,可以使两个平面重合,即该有机物分子中所有原子共平面。
2.下列物质中所有原子都有可能在同一平面上的是 ( )
(A)
( B)
(C)
(D)
B
CH3
Cl
针对训练
1.下列物质的所有原子,不可能处于同一平面内的是( )
A.CH2Cl2 B.CH2==CH2
C. D.
A
思考:该分子结构中最多可以有 个原子在同一个平面?
10
例、描述CH3—CH=CH—C≡C—CF3分子结构,
下列叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
BC
(1)含有碳和氢两元素的有机化合物就属于烃( )
判断正误
×
提示 烃是分子中只含C和H两元素的有机化合物。
(2)属于烃的有机化合物分子中氢原子个数可以为奇数( )
×
提示 根据碳原子的4价键理论,烃分子中的氢原子一定为偶数。
注意:烃分子的相对分子质量一定为偶数还是奇数?
CxHy 相对分子质量为12x+y,
因为烃分子中氢原子个数一定为偶数,故其值一定为偶数。
一、烃完全燃烧的通式
烷烃
烯烃
炔烃
芳香烃
CnH2n+2(n≥1)
CnH2n(n≥2)
CnH2n-2(n≥2)
CnH2n-6(n≥6)
CxHy + (x+)O2 →xCO2 + H2O
CxHy
元素守恒或质量守恒法
例:某烃0.1 mol完全燃烧,将产物通人浓硫酸,增重5.4 g,再通入到NaOH溶液中,增重8.8 g,试确定该烃的分子式。
由碳元素和氢元素守恒可得:
解:设该烃的分子式为 CxHy
所以该烃的分子式是:C2H6
H2O的物质的量为: 5.4g/18g/mol=0.3 mol
CO2的物质的量为: 8.8g/44g/mol=0.2 mol
0.1x=0.2; 0.1y=0.6
x=2; y=6
例1、等物质的量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
二、耗氧量的比较
1、等物质的量的烃(CxHy)完全燃烧
D
【思考】
相同条件下等体积的气态烃完全燃烧 耗氧量最少
CH4
C
H
x+
看分子式
练1、等物质的量的下列烃完全燃烧时,耗氧量由大到下的顺序是 。
①C5H10
②C6H14
③C4H8
④C4H6
⑤C6H6
x+
②>①=⑤>③>④
【规律】等物质的量的烃,耗氧量取决于“x+ ”
此值越大,耗氧量越多。
看分子式
二、耗氧量的比较
2、等质量的烃(CxHy)完全燃烧
例2、等质量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
【思考】
相同条件下等质量的气态烃完全燃烧 耗氧量最多
CH4
A
等质量的C和H比较,H耗氧多或者说H耗氧能力较强
H%越大,耗氧越多。
也可以把分子式化为CH,
练2、等质量的烃完全燃烧需要O2的体积
由大到下的顺序是 。
①C2H6
②C2H4
③C3H8
④C4H6
①>③>②>④
【规律】等质量的烃,耗氧量取决于烃中氢元素的质量分数,即“CHn”,n值越大,耗氧量越多。
n=
看比例式
【拓展练习1】下列各组烃,无论以何种比例混合,
只要物质的量一定,完全燃烧消耗O2的量不变( )
A、C2H2和C6H6
B、正丁烷和异丁烷
C、C5H10和C6H6
D、C3H6和C4H8
BC
x+
看分子式
【练习】下列各组烃,无论以何种比例混合,
只要质量一定,完全燃烧消耗O2的量不变( )
A、C2H2和C6H6
B、C4H6和C3H8
C、C5H10和C6H6
D、C3H6和C4H8
AD
看比例式
练3、等质量的下列烃完全燃烧时,生成CO2最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
D
含碳质量分数越大的烃,
等质量时生成CO2越多。
【规律】等质量的烃,生成CO2的量取决于烃中碳元素的质量分数,即“CmH”,m值越大,生成CO2的量越多。
m=
C ------- O2
12g 32g
看比例式
练4、等质量的下列烃完全燃烧时,生成H2O最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
A
含氢质量分数越大的烃,
等质量时生成H2O越多。
【规律】等质量的烃,生成H2O的量取决于烃中氢元素的质量分数,即“CHn”,n值越大,生成H2O的量越多。
H ------- O
1g ----- 8g
看比例式
n=
练5、CO、CH4 均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,
转移的电子数之比是 。
解析 完全燃烧后CO―→CO2,
C的化合价由+2价升为+4价,变化2价,
而CH4―→CO2,C的化合价由-4价升为+4价,变化8价,
因此等体积的CO和CH4完全燃烧转移的电子数之比为2∶8,
即1∶4。
1∶4
三、气态烃完全燃烧前后气体△V
烃(CxHy)的完全燃烧通式:
CxHy + (x+)O2 →xCO2 + H2O
(1)若燃烧后生成的水为液态(T<100℃) :
△V= V前 - V后
= 1 + x + – x
=1+
由此可见,若燃烧后生成的水为液态,燃烧后气体的体积一定减小,而减小值为 1+
三、气态烃完全燃烧前后气体△V
烃(CxHy)的完全燃烧通式:
CxHy + (x+)O2 →xCO2 + H2O
(2)若燃烧后生成的水为气态(T>100℃) :
△V= V后 - V前
=(x + ) – (1+ x + )
= – 1
则烃分子中氢原子数y
练 习
1、在压强一定,温度150 ℃ 条件下,某有机物完全燃烧,反应前后压强不发生变化,该有机物可能是( )
A、CH4 B、C2H6 C、C2H4 D、C2H2
AC
2、两种气态烃以任意比例混合,在105℃时1 L该混合烃与
9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L,
下列各组混合烃中不符合此条件的是 ( )
A. CH4 C2H4 B. CH4 C3H6
C. C2H4 C3H4 D. C2H2 C3H6
BD
练 习
【注意】注意审题“两种气态烃以任意比例混合”
例.某两种气态烃的1 L混合气体,完全燃烧生成1.4 LCO2和2.0 L水蒸气(体积均在相同状况下测得),该混合物可能是( )
A.乙烷,乙烯 B.甲烷,乙烯
C.甲烷,丙烯 D.乙烷,丙烯
解析:混合烃的平均分子式为C1.4H4
由平均碳原子数可知一定有甲烷。
由平均氢原子数可知一定有乙烯。
B
四、混合烃燃烧的计算
1、平均分子式法
应用平均值规律时,注意:
(1)分子组成中碳原子数≤4 的烃在标准状况下为气体
四、混合烃燃烧的计算
若平均分子组成中,存在1若平均分子组成中,存在2CH4
C2H2
(2)碳原子数小于2的烃只有CH4
(3)氢原子数小于4的烃只有C2H2
平均值规律:
若两个数或多个数的平均值为x,则至少有一个数比x大,一个数比x小。
四、混合烃燃烧的计算
2、平均相对分子质量法
(1)若M混<26,则一定有 ;
(2)若M混<28(烷、烯的混合物),则一定有 。
CH4
CH4
五、相对分子质量的求法:
思路:求1摩尔物质的质量(摩尔质量)
(1)已知标准状况下气体的密度,求分子量
密度的单位是:克/升 (g/L)
摩尔质量=22.4 L/mol g/L
相对分子质量= 22.4
(2)已知相对密度(D),求分子量
相同条件下,气体的分子量之比=密度之比=相对密度
M1
M2
=
1
2
=
D
如:某气体对氢气的相对密度是17,则该气体的分子量为 。
又如:某气体对空气的相对密度是1.5,则该气体的分子量为 。
34
44
五、相对分子质量的求法:
总结:确定相对分子质量的方法有
(2) M = ρ Vm
标准状况下:M = ρg/L 22.4L/mol
(3) M1 = DM2
(1)M = m/n
D:相对密度
五、相对分子质量的求法:
1、汽油、柴油主要成分是什么?
汽油、柴油主要含烃类物质
2、常见燃油标号95、92的含义是什么?
那么对于烃来说它们是如何分类的,不同类别烃的性质有什么不同呢?
异辛烷的含量不同,防爆能力不同
人教版必修第二册
第七章 有机化合物
第二节 乙烯与有机高分子材料
第二课时 烃
只含有碳和氢两种元素的有机化合物称为碳氢化合物,用通式CxHy表示,
也称为烃。
碳 + 氢 =
烃
tàn qīng
tīng
你知道“烃”字的由来吗?
一、烃
【微思考】“一种有机物完全燃烧,产物只有二氧化碳和水,则该有机物一定是烃”这种说法是否正确 为什么
不正确。
由燃烧产物只有二氧化碳和水,
可以确定该有机物中一定含有碳、氢两种元素,
无法确定是否含有氧元素。可能有氧元素,也可能没有。
1.下列物质中不属于烃类的是( )
A、C6H6 B、C8H10
C、C2H4O D、C4H10
C
阅读课本P69,明确烃的概念,
并尝试用树状分类法对烃进行分类。
烃
饱和烃(烷烃)
不饱和烃
链状烷烃
环状烷烃
烯 烃
炔 烃
芳香烃
CnH2n+2(n≥1)
CnH2n(n≥3)
CnH2n(n≥2)
CnH2n-2(n≥2)
或
碳原子全部以单键连接,
碳原子皆为饱和碳原子的烃
所含碳原子以双键、三键
连接或苯环上的碳原子的烃
1、根据烃分子中碳原子间成键方式的不同:
二、烃的分类
不是同系物,
但可以互为同分异构体
乙烯的分子式为C2H4,故分子组成为C6H12的烃一定属于烯烃( )
分子组成为C6H12的烃,可以是烯烃,也可能属于环烷烃,如环己烷。
×
烯烃的通式 CnH2n(n≥2)
注意:但符合这个通式的却不一定是烯烃,比如环烷烃 CnH2n(n≥3)
针对训练
[问题]仔细观察并比较下列八种烃的结构简式,它们碳原子间的成键方式是否相同?试根据碳原子间的不同连接方式将下列有机化合物进行分类。
①CH3CH3 ②CH3-C C-CH3 ③ ④CH2=CH-CH3
⑤CH2=C-CH3 ⑥ ⑦ ⑧
① ⑦⑧
④⑤ ②③ ⑥
2、根据碳骨架的不同,还可以将烃分为链状烃和环状烃。
烃
链状烃
环状烃
饱和链烃
不饱和链烃
脂环烃
芳香烃
二、烃的分类
(有环状结构,不含苯环)
(含苯环)
有机化合物中,
碳原子互相连结
成链状或环状叫
分子骨架,
又称碳骨架。
例题1
(1)属于烃的有: 。
(2)在属于烃类的物质中,
从碳原子的价键是否饱和角度看属于饱和烃的有: ,
属于不饱和烃的有: 。
CDEFG
EF
CDG
例题1
(3)在饱和烃中根据碳骨架呈现的形状看,
属于链状饱和烃的是____,属于环状饱和烃的是____ 。
(4)属于烷烃的是______ ,属于烯烃的是____,
属于炔烃的是____,属于芳香烃的是____。
F
E
G
F
D
C
【目的】以甲烷、乙烯和乙炔为例,借助模型认识烃的分子结构。
【活动】 (1) 根据碳原子的成键规律和甲烷、乙烯、乙炔的结构式,写出三者的电子式,并讨论其分子中有哪些类型的化学键。
(2) 结合以上分析,使用分子结构模型(或橡皮泥、黏土、泡沫塑料、牙签等代用品)搭建甲烷、乙烯和乙炔分子的球棍模型。
展示并描述三者的分子结构特点。
课本P70 探究:烃的分子结构
烃 甲 烷 乙 烯 乙 炔
电子式
化学键
球棍模型
分子结构 特点
C—H
C—H
C—H
—C≡C—
碳原子4个单电子完全和4个氢原子形成4个共价单键,形成以碳原子为中心的正四面体结构
碳和碳形成碳碳双键,
剩余价键完全和氢原子
形成C—H单键,键和键夹角为120°,2个碳原子和4个氢原子在同一平面内
碳和碳形成碳碳三键,
剩余价键和氢原子形成C—H单键,键和键夹角为180°,2个氢和2个碳原子成直线结构
问题与讨论(1)比较甲烷和乙烯的化学性质,分析其与二者的分子结构之间存在哪些联系?
物质 甲烷 乙烯
与Br2 反应 Br2试剂 ________ ___________________
反应条件 _____
反应类型 _____ _____
氧化 反应 和O2燃烧 燃烧,火焰呈 色 燃烧,火焰_______________
酸性KMnO4溶液 _______ ____________________
性质和结构关系
Br2蒸气
溴水或溴的CCl4溶液
光照
取代
加成
淡蓝
明亮、伴有黑烟
不反应
酸性KMnO4溶液褪色
性质和结构关系 CH4分子中的碳原子为 结构,所成的键为 ,性质 , 主要发生 反应 CH2==CH2分子中的碳原子为___
结构,所成的键为 ,其中一个键容易断裂,性质活泼,
主要发生 、 反应
问题与讨论(1)比较甲烷和乙烯的化学性质,分析其与二者的分子结构之间存在哪些联系?
饱和
单键
稳定
取代
不饱和
碳碳双键
加成反应
氧化
结论:烷烃、烯烃、均可燃烧;
其中烷烃易取代,而烯烃易加成。
烯烃能与酸性高锰酸钾溶液发生氧化反应。
问题与讨论 (2) 乙炔是甲烷或乙烯的同系物吗?为什么?
不是,结构不相似,在分子组成上也不相差一个或若干个CH2原子团。
同系物是指结构相似,
在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
结构相似是指:
(1)碳和碳存在相同的化学键
(2)结构相似
(3)在组成上相差一个或者n个CH2
分子式 最简式 电子式 结构式 结构简式 空间构型 键角
球棍模型 空间填充模型(比例模型) 直线型
180°
CH ≡ CH
或 HC ≡ CH
H-C ≡ C-H
4个原子共线共平面
三、最简单的炔烃——乙炔
1、乙炔的结构
含有C≡C的烃叫做炔烃。炔烃是不饱和烃,
乙炔俗称电石气,是最简单的炔烃。
C2H2
CH
思考:该分子结构中最多可以有 个原子在同一个平面?
6
例、描述 CH3—C≡C—CH3 分子结构,
下列叙述中正确的是( )
A.4个碳原子有可能都在一条直线上
B.4个碳原子不可能都在一条直线上
C.4个碳原子有可能都在同一平面上
D.4个碳原子不可能都在同一平面上
BC
推论:与碳碳三键上的碳原子直接相连的原子与其在同一个平面
AC
无色、极易燃气体,
三、最简单的炔烃——乙炔
2、乙炔的物理性质
思考:根据乙炔的成键方式和结构推测其可能有哪些化学性质?
类比乙烯
(1) 氧化反应
①与氧气反应:
2C2H2+ 5O2 4CO2+2H2O
点燃
甲烷 乙烯 乙炔
现象:火焰明亮,伴有大量黑烟
放出大量的热,温度达3000℃以上,
用于切割、焊接金属。
3、乙炔的化学性质
密度小于空气,
微溶于水,易溶于苯、乙醇等有机溶剂
能使酸性KMnO4溶液褪色
能使溴水或溴的四氯化碳溶液褪色
(2)加成反应(与H2、X2、HX等)
三、最简单的炔烃——乙炔
(1) 氧化反应
1, 2-二溴乙烯
1,1,2,2-四溴乙烷
少量溴
过量溴
3、乙炔的化学性质
②与氧化剂反应:
请写出乙炔与氢气、氯化氢发生加成反应的化学方程式。
针对训练
少量氢气
过量氢气
少量氯化氢
过量氯化氢
1,2-二氯乙烷
氯乙烯
思考:乙烯能聚合成聚乙烯,乙炔也能发生聚合反应吗?
(3)加聚反应
nCH CH
CH=CH
n
催化剂
聚乙炔:导电塑料
炔烃的结构和性质与乙炔的相似,都含有碳碳三键,能发生氧化反应、加成反应和加聚反应。
三、最简单的炔烃——乙炔
乙炔
3、乙炔的化学性质
(1)乙炔是一种重要的基本有机原料,
可以用来制备氯乙烯、聚氯乙烯和乙醛等。
三、最简单的炔烃——乙炔
4、乙炔的用途
(2)乙炔燃烧时产生的氧炔焰
可用来切割或焊接金属。
乙炔在氧气里燃烧产生的火焰叫氧炔焰
下列关于乙烷、乙烯、乙炔的说法正确的是( )
①它们既不是同系物,也不是同分异构体
②乙烷是饱和烃,乙烯、乙炔是不饱和烃
③乙烯、乙炔能使溴水褪色,乙烷不能使溴水褪色
④它们都能燃烧,乙炔燃烧火焰最明亮,有浓烟
⑤它们都能使酸性高锰酸钾溶液褪色
A. ①③④ B. ①②③⑤ C. ②③④⑤ D. ①②③④
D
针对训练
1、苯:
烃
苯、芳香烃、芳香族化合物
2、芳香烃:分子中含有苯环的烃。
3、芳香族化合物:分子中含有苯环的有机物。
或
苯是最简单的芳香烃。
它们并不一定具有香味
凯库勒发现苯结构的故事
芳香化合物是指含有苯环的化合物,
最简单的芳香化合物是苯,
苯的结构是怎样的?
又是如何确定和发现的呢?
我们一起来看科学史话
凯库勒(1829年-1896年)
1865年,德国化学家凯库勒在一次梦里联想到一条小蛇首尾相咬,他猜测苯可能由6个碳原子首尾相连,环中碳原子以单双键相互交替结合而成。为纪念他在苯环中研究,这一表达式命名为“凯库勒式”。
共价键 碳碳单键 碳碳双键 苯环中的碳碳键
键长/pm 154.1 133.7 139
进入20世纪,科学家用X射线衍射法证实了苯分子结构是平面正六边形;每个碳碳键的键长相等,都是139 pm,介于碳碳单键与碳碳双键的键长之间。
苯是芳香烃的母体,其结构式
习惯上简写为 (凯库勒式)
实际上苯分子中6个碳原子之间的键完全相同,所以也常用来 表示苯分子的结构。
分子式 最简式 结构式 结构简式 球棍模型 空间填充模型 碳碳键角
烃
三、最简单的芳香化合物——苯
1、苯的结构
空间构型:
苯分子具有平面正六边形结构,
化学键:
6个碳原子之间的化学键____________
完全相同
苯环中的碳碳键长介于碳碳单键和碳碳双键的键长之间,
是一种介于碳碳单键和碳碳双键之间的独特的键。
C6H6
CH
120O
6个C原子,6个H原子,
12个原子共平面,
位于对角线位置上的4个原子共直线。
例:下列关于苯的说法错误的是( )
A.分子式为C6H6
B.所有的原子在同一平面上
C.存在碳碳单键与碳碳双键交替出现的结构
D.存在介于碳碳单键与碳碳双键之间的独特的键
C
推论:与苯环上的碳原子直接相连的原子与其在同一个平面
最多几个原子在同一个平面?
13个
三、最简单的芳香化合物——苯
2、苯的物理性质
常温下,纯的苯是无色、有特殊气味的透明液体,有毒,不溶于水。
苯易挥发,沸点80.1℃(低),熔点5.5 ℃(低),
常温下其密度比水小(ρ=0.88g/cm3),
难溶于水,易溶于有机溶剂,
本身也可作为有机溶剂。
C6H14 C6H6
—8H
高度不饱和的结构
结合碳四价理论,苯可能具有哪些不饱和键?
如何设计实验进行验证苯的不饱和键?
化学键 实验操作 预测现象
碳碳双键或 碳碳三建 取少量样品滴加酸性KMnO4溶液 紫色褪去
取少量样品滴加溴水溶液 溴水褪色
探究苯的分子结构
实验操作
实验现象
结论原因 液体分层,上层无色,
下层紫红色
液体分层,上层橙黄色,下层无色
苯不能被酸性高锰酸钾溶液氧化,也不能与溴水反应,
苯分子具有不同于烯烃和炔烃的特殊结构。
苯分子结构中不存在碳碳双键,其原因是
苯不能使酸性KMnO4溶液褪色,不能使溴水或溴的CCl4溶液褪色。
水层显紫色,没有褪色
苯层显黄色,苯能萃取溴水中Br2
(1)为什么两支试管溶液都发生了分层?
(2)右侧试管中上层溶液显黄色,说明苯对Br2溶解有什么规律?
苯不溶于水,密度比水小。
溴能在苯中溶解且溶解度大于水溶液中,苯能萃取溴水中的溴。
(1)氧化反应
②与氧化剂:苯不能使酸性高锰酸钾溶液褪色。
①与氧气反应:
在乙烯、乙炔、苯分子中,含碳的质量分数较甲烷等烷烃高,
乙炔、苯分子中含碳的质量分数相同,均为92.3%,均比乙烯高。
三、最简单的芳香化合物——苯
3、苯的化学性质
乙烯、乙炔、苯在空气中燃烧不完全,易产生黑烟,
乙炔、苯的黑烟更浓。
3、苯的化学性质
苯不能使溴水或溴的CCl4溶液褪色。
三、最简单的芳香化合物——苯
注意:苯能使溴水或溴的CCl4溶液分层,发生的不是化学反应,
而是物理变化,利用溶解度不同,苯对溴水的萃取作用。
苯中的键比较稳定,在通常情况下不易发生加成反应。
+3H2
(2)加成反应
环己烷
环己烷不是平面结构
在以Pt、Ni等催化剂并加热的条件下,苯能与H2发生加成反应。
三、最简单的芳香化合物——苯
4、苯的用途
苯是一种重要的有机化工原料和有机溶剂,
广泛用于生产医药、农药、香料、染料、洗涤剂和合成高分子材料等。
苯的分子式为C6H6,结构简式为 ,分子高度不饱和,
故苯分子中一定含有碳碳双键,属于烯烃( )
×
苯分子中含有 ,结构简式 是一种习惯写法,
分子中不含有 ,不属于烯烃,属于芳香烃。
针对训练
×
×
×
√
总结:分子式符合通式CnH2n+2的烃,一定是烷烃。
但烷烃的通式不一定是CnH2n+2,烷烃除了链状的,
还要考虑环烷烃通式CnH2n(n≥3)
请观察甲烷、乙烯、 乙炔、苯等有机物的球棍模型,
思考碳原子的成键方式与分子的空间构型、键角有什么关系?
原子间成键方式 空间构型 键角 一定共面原子
教学拓展-有机物共面共线问题
碳原子成键方式与空间构型关系规律
四面体形
109°28′
3个
平面形
120°
6个
直线形
180°
4个(共面共线)
平面形
120°
12个
对称轴上原子是共线
特别注意:(单键可旋转,而双键和三键不能旋转)
常见烃分子中原子共平面的判断
1.常见分子的空间结构
(1)甲烷型:
(2)乙烯型:
正四面体→凡是碳原子与4个原子形成4个共价键时,
其空间结构都是四面体形,5个原子中最多有3个原子共平面。
平面结构→与碳碳双键直接相连的4个原子与2个碳原子共平面。
(4)苯型:
(3)乙炔型:—C≡C—
常见烃分子中原子共平面的判断
1.常见分子的空间结构
直线结构→与碳碳三键直接相连的2个原子与2个碳原子共直线。
平面结构→位于苯环上的12个原子共平面,
位于对角线位置上的4个原子共直线。
2.有机物共面问题的解题规律
(1)甲烷、乙烯、苯三种分子中的氢原子如果被其他原子取代,则取代后的分子构型基本不变。
(2)共价单键可以自由旋转,共价双键和共价三键不能旋转。
(3)结构式中有甲基(或饱和碳原子)的有机物,其分子中的所有原子不可能共平面。
常见烃分子中原子共平面的判断
(4)要弄清题目要求的是“可能共面”还是“一定共面”,是“碳原子”还是“所有原子”。
(5)将所给有机物的分子中一定有共面的结构分别确定为平面M
和平面N,若两个平面通过一个碳碳单键相连,则通过旋转任意一个平面,可以使两个平面重合,即该有机物分子中所有原子共平面。
2.下列物质中所有原子都有可能在同一平面上的是 ( )
(A)
( B)
(C)
(D)
B
CH3
Cl
针对训练
1.下列物质的所有原子,不可能处于同一平面内的是( )
A.CH2Cl2 B.CH2==CH2
C. D.
A
思考:该分子结构中最多可以有 个原子在同一个平面?
10
例、描述CH3—CH=CH—C≡C—CF3分子结构,
下列叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
BC
(1)含有碳和氢两元素的有机化合物就属于烃( )
判断正误
×
提示 烃是分子中只含C和H两元素的有机化合物。
(2)属于烃的有机化合物分子中氢原子个数可以为奇数( )
×
提示 根据碳原子的4价键理论,烃分子中的氢原子一定为偶数。
注意:烃分子的相对分子质量一定为偶数还是奇数?
CxHy 相对分子质量为12x+y,
因为烃分子中氢原子个数一定为偶数,故其值一定为偶数。
一、烃完全燃烧的通式
烷烃
烯烃
炔烃
芳香烃
CnH2n+2(n≥1)
CnH2n(n≥2)
CnH2n-2(n≥2)
CnH2n-6(n≥6)
CxHy + (x+)O2 →xCO2 + H2O
CxHy
元素守恒或质量守恒法
例:某烃0.1 mol完全燃烧,将产物通人浓硫酸,增重5.4 g,再通入到NaOH溶液中,增重8.8 g,试确定该烃的分子式。
由碳元素和氢元素守恒可得:
解:设该烃的分子式为 CxHy
所以该烃的分子式是:C2H6
H2O的物质的量为: 5.4g/18g/mol=0.3 mol
CO2的物质的量为: 8.8g/44g/mol=0.2 mol
0.1x=0.2; 0.1y=0.6
x=2; y=6
例1、等物质的量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
二、耗氧量的比较
1、等物质的量的烃(CxHy)完全燃烧
D
【思考】
相同条件下等体积的气态烃完全燃烧 耗氧量最少
CH4
C
H
x+
看分子式
练1、等物质的量的下列烃完全燃烧时,耗氧量由大到下的顺序是 。
①C5H10
②C6H14
③C4H8
④C4H6
⑤C6H6
x+
②>①=⑤>③>④
【规律】等物质的量的烃,耗氧量取决于“x+ ”
此值越大,耗氧量越多。
看分子式
二、耗氧量的比较
2、等质量的烃(CxHy)完全燃烧
例2、等质量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
【思考】
相同条件下等质量的气态烃完全燃烧 耗氧量最多
CH4
A
等质量的C和H比较,H耗氧多或者说H耗氧能力较强
H%越大,耗氧越多。
也可以把分子式化为CH,
练2、等质量的烃完全燃烧需要O2的体积
由大到下的顺序是 。
①C2H6
②C2H4
③C3H8
④C4H6
①>③>②>④
【规律】等质量的烃,耗氧量取决于烃中氢元素的质量分数,即“CHn”,n值越大,耗氧量越多。
n=
看比例式
【拓展练习1】下列各组烃,无论以何种比例混合,
只要物质的量一定,完全燃烧消耗O2的量不变( )
A、C2H2和C6H6
B、正丁烷和异丁烷
C、C5H10和C6H6
D、C3H6和C4H8
BC
x+
看分子式
【练习】下列各组烃,无论以何种比例混合,
只要质量一定,完全燃烧消耗O2的量不变( )
A、C2H2和C6H6
B、C4H6和C3H8
C、C5H10和C6H6
D、C3H6和C4H8
AD
看比例式
练3、等质量的下列烃完全燃烧时,生成CO2最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
D
含碳质量分数越大的烃,
等质量时生成CO2越多。
【规律】等质量的烃,生成CO2的量取决于烃中碳元素的质量分数,即“CmH”,m值越大,生成CO2的量越多。
m=
C ------- O2
12g 32g
看比例式
练4、等质量的下列烃完全燃烧时,生成H2O最多的是( )
A、CH4
B、C2H6
C、C3H6
D、C6H6
A
含氢质量分数越大的烃,
等质量时生成H2O越多。
【规律】等质量的烃,生成H2O的量取决于烃中氢元素的质量分数,即“CHn”,n值越大,生成H2O的量越多。
H ------- O
1g ----- 8g
看比例式
n=
练5、CO、CH4 均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,
转移的电子数之比是 。
解析 完全燃烧后CO―→CO2,
C的化合价由+2价升为+4价,变化2价,
而CH4―→CO2,C的化合价由-4价升为+4价,变化8价,
因此等体积的CO和CH4完全燃烧转移的电子数之比为2∶8,
即1∶4。
1∶4
三、气态烃完全燃烧前后气体△V
烃(CxHy)的完全燃烧通式:
CxHy + (x+)O2 →xCO2 + H2O
(1)若燃烧后生成的水为液态(T<100℃) :
△V= V前 - V后
= 1 + x + – x
=1+
由此可见,若燃烧后生成的水为液态,燃烧后气体的体积一定减小,而减小值为 1+
三、气态烃完全燃烧前后气体△V
烃(CxHy)的完全燃烧通式:
CxHy + (x+)O2 →xCO2 + H2O
(2)若燃烧后生成的水为气态(T>100℃) :
△V= V后 - V前
=(x + ) – (1+ x + )
= – 1
则烃分子中氢原子数y
练 习
1、在压强一定,温度150 ℃ 条件下,某有机物完全燃烧,反应前后压强不发生变化,该有机物可能是( )
A、CH4 B、C2H6 C、C2H4 D、C2H2
AC
2、两种气态烃以任意比例混合,在105℃时1 L该混合烃与
9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L,
下列各组混合烃中不符合此条件的是 ( )
A. CH4 C2H4 B. CH4 C3H6
C. C2H4 C3H4 D. C2H2 C3H6
BD
练 习
【注意】注意审题“两种气态烃以任意比例混合”
例.某两种气态烃的1 L混合气体,完全燃烧生成1.4 LCO2和2.0 L水蒸气(体积均在相同状况下测得),该混合物可能是( )
A.乙烷,乙烯 B.甲烷,乙烯
C.甲烷,丙烯 D.乙烷,丙烯
解析:混合烃的平均分子式为C1.4H4
由平均碳原子数可知一定有甲烷。
由平均氢原子数可知一定有乙烯。
B
四、混合烃燃烧的计算
1、平均分子式法
应用平均值规律时,注意:
(1)分子组成中碳原子数≤4 的烃在标准状况下为气体
四、混合烃燃烧的计算
若平均分子组成中,存在1
C2H2
(2)碳原子数小于2的烃只有CH4
(3)氢原子数小于4的烃只有C2H2
平均值规律:
若两个数或多个数的平均值为x,则至少有一个数比x大,一个数比x小。
四、混合烃燃烧的计算
2、平均相对分子质量法
(1)若M混<26,则一定有 ;
(2)若M混<28(烷、烯的混合物),则一定有 。
CH4
CH4
五、相对分子质量的求法:
思路:求1摩尔物质的质量(摩尔质量)
(1)已知标准状况下气体的密度,求分子量
密度的单位是:克/升 (g/L)
摩尔质量=22.4 L/mol g/L
相对分子质量= 22.4
(2)已知相对密度(D),求分子量
相同条件下,气体的分子量之比=密度之比=相对密度
M1
M2
=
1
2
=
D
如:某气体对氢气的相对密度是17,则该气体的分子量为 。
又如:某气体对空气的相对密度是1.5,则该气体的分子量为 。
34
44
五、相对分子质量的求法:
总结:确定相对分子质量的方法有
(2) M = ρ Vm
标准状况下:M = ρg/L 22.4L/mol
(3) M1 = DM2
(1)M = m/n
D:相对密度
五、相对分子质量的求法:
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
