3.2分子晶体与共价晶体课件 (共37张PPT)人教版(2019)选择性必修2
文档属性
| 名称 | 3.2分子晶体与共价晶体课件 (共37张PPT)人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 49.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-24 00:00:00 | ||
图片预览





文档简介
(共37张PPT)
分子晶体与共价晶体
TITLE TITLE
选择性必修2 第三章 第二节
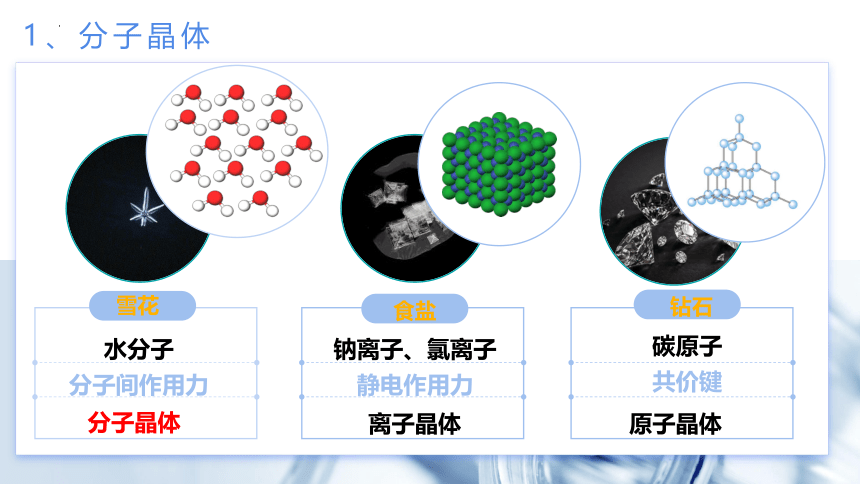
1、分子晶体
请判断下列固体是否属于晶体?并说明理由?
雪花
食盐
钻石
玻璃
晶体
晶体
晶体
非晶体
思考:这些晶体有什么不同呢?
内容内容内容
1、分子晶体
雪花
分子间作用力
水分子
分子晶体
食盐
静电作用力
钠离子、氯离子
离子晶体
钻石
共价键
碳原子
原子晶体
只含_____的晶体,或者分子间以______________结合形成的晶体叫分子晶体。
1、分子晶体
概念
分子晶体中的粒子及粒子间的相互作用
分子
分子间作用力
构成微粒
分子
相互作用
分子内:共价键
分子间:分子间作用力
(氢键
范德华力)
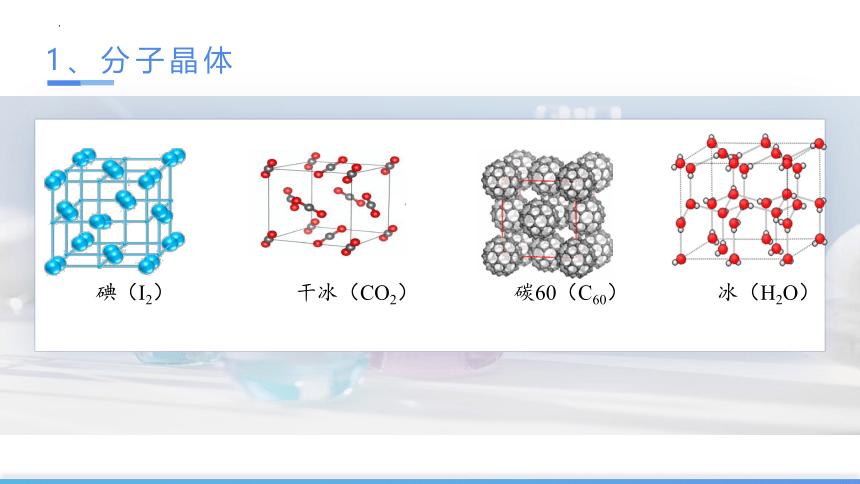
1、分子晶体
碘(I2) 干冰(CO2) 碳60(C60) 冰(H2O)
1、分子晶体
常见的典型分子晶体
(1)所有非金属氢化物:H2O、H2S、NH3、CH4等;
(2)部分非金属单质:X2(卤素)、O2、H2、S8、P4、C60、稀有气体等;
(除B、Si、金刚石等)
(3)部分非金属氧化物:CO2、SO2、NO2、P4O6、P4O10等;
(除 SiO2 等)
(4)几乎所有的酸: H2SO4、HNO3、H3PO4、H2SiO3等;
(5)绝大多数有机物:苯、四氯化碳、乙醇、冰醋酸、蔗糖等;
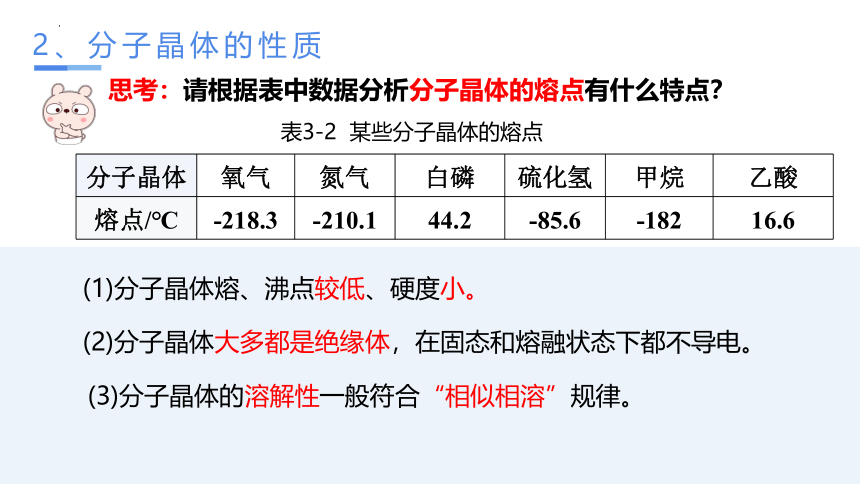
2、分子晶体的性质
思考:请根据表中数据分析分子晶体的熔点有什么特点?
表3-2 某些分子晶体的熔点
分子晶体 氧气 氮气 白磷 硫化氢 甲烷 乙酸
熔点/℃ -218.3 -210.1 44.2 -85.6 -182 16.6
(1)分子晶体熔、沸点较低、硬度小。
(2)分子晶体大多都是绝缘体,在固态和熔融状态下都不导电。
(3)分子晶体的溶解性一般符合“相似相溶”规律。
2、分子晶体的性质
分子晶体熔、沸点高低的判断
①组成和结构相似,不含氢键的,M越大,范德华力越强,熔、沸点越高,
I2>Br2>Cl2>F2,HI>HBr>HCl。
②组成和结构不相似的 (M接近),分子的极性越大,熔、沸点越高,
③含有分子间氢键的,熔、沸点反常升高,
如H2O>H2Te>H2Se>H2S。
如CH3OH>CH3CH3。
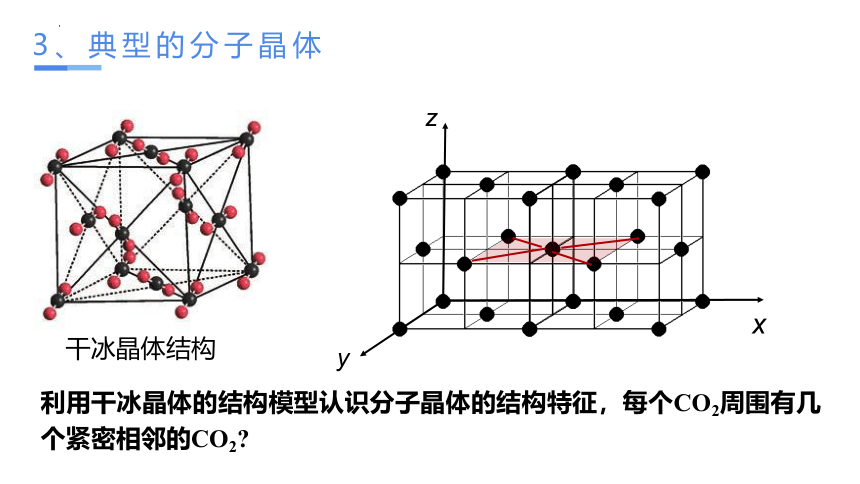
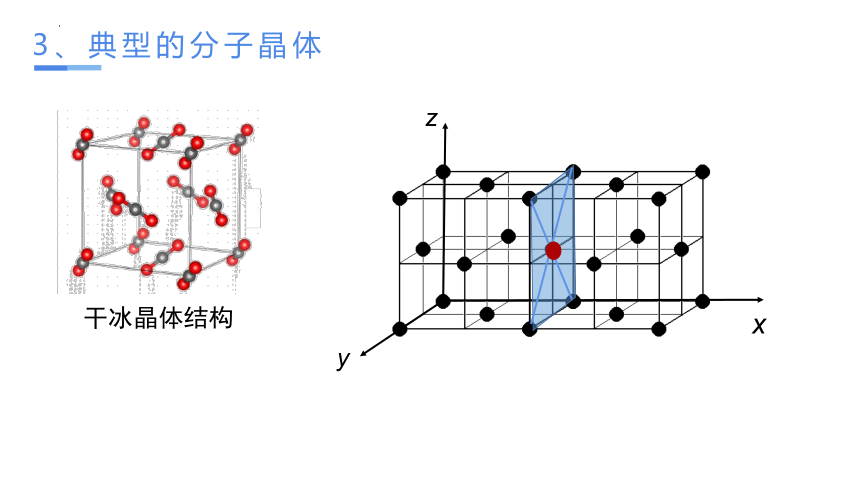
3、典型的分子晶体
x
y
z
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
干冰晶体结构
3、典型的分子晶体
x
y
z
干冰晶体结构
干冰晶体结构
x
y
z
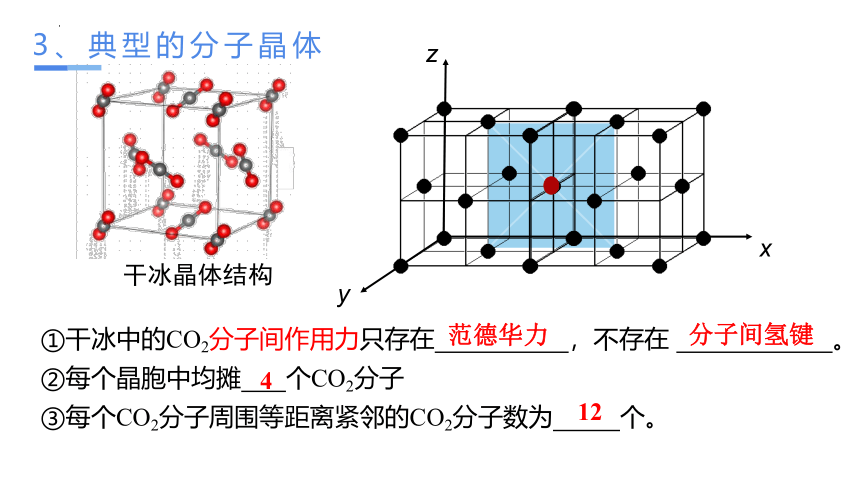
①干冰中的CO2分子间作用力只存在 ,不存在 。
②每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
分子间氢键
3、典型的分子晶体
3、典型的分子晶体
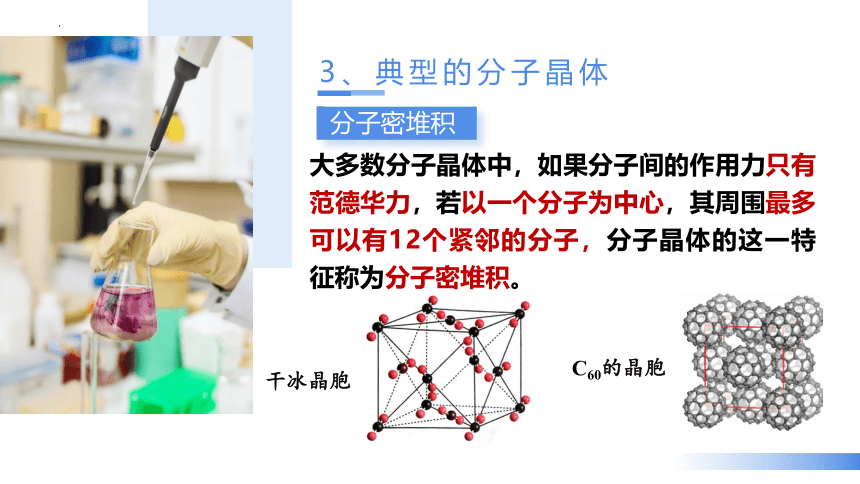
大多数分子晶体中,如果分子间的作用力只有范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。
分子密堆积
干冰晶胞
C60的晶胞
3、典型的分子晶体
若分子间除了存在范德华力,还存在氢键,那么,这对分子晶体的结构有什么影响呢?
3、典型的分子晶体
晶体
非晶体
冰晶体中,每个H2O周围有几个紧密相邻的H2O?和干冰晶体一样吗?若不一样,可能的原因是什么?
4个,不一样
3、典型的分子晶体
晶体
非晶体
冰晶体中,每个H2O周围有几个紧密相邻的H2O?和干冰晶体一样吗?若不一样,可能的原因是什么?
原因 :冰晶体中,每个水分子周围只有4个紧密相邻的水分子,因为水分子间除范德华力还存在氢键,氢键具有方向性和饱和性,由于氢键具有方向性,迫使在四面体中心的每个水分子与四面体顶点方向的4个相邻水分子相互吸引。
3、典型的分子晶体
分子非密堆积
分子晶体中,如果分子间的作用力除了范德华力,还存在氢键,导致每个分子周围紧邻的分子少于12个,这一排列使得晶体的空间利用率不高,留有相当大的空隙,分子晶体的这一特征称为分子非密堆积。
4、拓展延伸
天然气水合物—— 一种潜在的能源
许多气体可以与水形成水合物晶体。最早发现这类水合物晶体的是19世纪初的英国化学家戴维,他发现氯可形成化学式为Cl2·8H2O的水合物晶体。20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气分子藏在水分子笼内
水分子笼是多种多样的
【练习】
1、下列分子晶体的熔、沸点由高到低的顺序是( )
①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2
A.①②③④⑤⑥
B.③②①⑤④⑥
C.③②①④⑤⑥
D.⑥⑤④③②①
C
【练习】
2、干冰(CO2)的晶胞结构如下图所示。下列说法不正确的是 ( )
A.干冰晶体属于分子晶体
B.干冰晶胞中,含有4个CO2分子
C.干冰晶体中,每个CO2周围等距且紧邻的CO2有6个
D.干冰晶体中CO2分子间作用力较小,常压下易升华
C
【练习】
3、如图为干冰的晶胞结构示意图。
(1)通过观察分析,有____种取向不同的CO2分子。将CO2
分子视作质点,设晶胞边长为a pm,则紧邻的两个CO2
分子的距离为____ pm。
(2)其密度ρ为___________________(1 pm=10-10 cm)。
4
5、共价晶体
碳元素和硅元素处于元素周期表中同一主族,CO2和SiO2熔沸点为什么差距那么大?
熔点/oC 状态(室温)
CO2 -56.2 气态
SiO2 1723 固态
干冰
SiO2
内容内容内容
5、共价晶体
通过金刚石晶体的结构认识共价晶体结构组成共价晶体的粒子和粒子间的作用力是什么?
金刚石的多面体外形
组成的粒子:_______
粒子间的作用力: _______
晶体结构
晶胞示意图
晶胞示意图
原子
共价键
相邻原子间以_______相结合形成共价键三维骨架结构
(空间立体网状)的晶体。
概念
共价晶体中的粒子及粒子间的相互作用
共价键
构成微粒
原子
微粒间作用
共价键
5、共价晶体
5、共价晶体
常见的共价晶体
某些单质
极少数金属氧化物
某些非金属化合物
硼
刚玉
碳化硅
其他:
硅(Si)、金刚石(C) 、锗(Ge)等
其他:
七氧化二锰(Mn2O7) 、三氧化二铬(Cr2O3) 等
其他:
二氧化硅(SiO2)、氮化硼(BN)、氮化硅(Si3N4)等
6、典型的共价晶体
金刚石晶体
每个C以共价单键对称地与相邻的4个C结合
C—C—C夹角为109°28′
(2)晶体中最小的碳环由 个碳原子组成,且不在同一平面内,最多有 个碳原子在同一平面。
(1)在晶体中每个碳原子以 个共价单键对称地与相邻的 个碳原子结合,C—C—C夹角为 ,即金刚石中的碳采取 杂化轨道形成共价键三维骨架结构。
109°28′
sp3
6
4
正四面体
四
4
最小环为六元环
6、典型的共价晶体
金刚石晶体
(4)每个C原子被 个六元环共用,1个碳环占有的碳原子为 个。
(3)每个C形成4个C—C,每个C—C占有 个C,即C原子与C—C数目之比为 。
2
1∶2
12
0.5
正四面体
最小环为六元环
6、典型的共价晶体
金刚石晶体
6、典型的共价晶体
二氧化硅晶体
晶体硅的结构
二氧化硅的结构
SiO2晶体结构相当于在晶体硅结构中每2个Si原子中间插入1个O原子
(1) 在SiO2晶体中,每个硅原子采取sp3杂化与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 。
单个的SiO2分子存在。
(2)在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
(3)在SiO2 晶体中,最小环为 元环,由 个Si原子和 个O原子构成。
2
1:2
4
2
12
没有
4
6
6
6、典型的共价晶体
二氧化硅晶体
(4)每个十二元环中平均含有硅原子
1:4
1:2
= 6× =
Si原子个数与Si-O 共价键个数之是 ;
O原子个数与Si-O 共价键个数之比是 。
每个十二元环中平均含有Si-O键
= 12× =2
(5)60 g 二氧化硅含有_____个Si原子
含有_____个O原子
含有_____ 个Si-O键
NA
2NA
4NA
1 mol SiO2中含 mol Si-O键
4
6、典型的共价晶体
二氧化硅晶体
在低温石英的结构中,顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
二氧化硅晶体——低温石英
石英晶体中的硅氧四面体相连构成的螺旋链
石英的左、右型晶体
石英手表
6、典型的共价晶体
二氧化硅晶体
二氧化硅——重要用途
水泥
单晶硅
玻璃
单晶硅制的芯片
硅太阳能
电池
二氧化硅
光导纤维
6、典型的共价晶体
7、共价晶体的性质
思考:比较下表中共价晶体熔点和硬度,它们有什么特点?
某些共价晶体的熔点和硬度
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
熔点很高;硬度很大
为什么共价晶体熔点很高?
熔化破坏共价键,需要很高的能量。
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
7、共价晶体的性质
思考:比较下表中共价晶体熔点和硬度,它们有什么特点?
某些共价晶体的熔点和硬度
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
问题1:与分子晶体相比,共价晶体的熔点普遍较高,为什么
分子晶体中分子间是以较弱的分子间作用力(部分含氢键)相互作用的,而共价晶体中原子间是通过较强的共价键相互作用的,并且形成空间网状结构,所以熔点普遍较高。
7、共价晶体的性质
问题2:由表中可知,金刚石、硅和锗的熔点和硬度均依次降低,如何解释
三者的组成元素为同一主族元素,形成的晶体结构类似,结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
问题3:从哪些角度可以区分共价晶体与分子晶体
可以从构成微粒、微粒间作用力强弱、熔沸点、硬度等角度区分。
共价
晶体
分子
晶体
有氢键
只有
范德华力
方 法
依据组成晶体的粒子和粒子间的作用力判断
依据性质判断
判断
晶体的类型
键能越大
熔点越高
氢键的
数目多少
相对分子
质量大小
判断
键能的大小
判断
分子间的作用力
7、共价晶体的性质
比较物质的熔点的方法
【练习】
5. 金刚石晶胞结构如图所示,回答下列问题。
(1)一个金刚石晶胞中含有________个碳原子。
(2)已知晶胞参数为a pm,则金刚石的密度为______________ g·cm-3。
(3)晶体中两个最近的碳原子之间的距离为______ pm。
(4)碳原子的半径为r,则a、r有什么关系?
8
分子晶体与共价晶体
TITLE TITLE
选择性必修2 第三章 第二节
1、分子晶体
请判断下列固体是否属于晶体?并说明理由?
雪花
食盐
钻石
玻璃
晶体
晶体
晶体
非晶体
思考:这些晶体有什么不同呢?
内容内容内容
1、分子晶体
雪花
分子间作用力
水分子
分子晶体
食盐
静电作用力
钠离子、氯离子
离子晶体
钻石
共价键
碳原子
原子晶体
只含_____的晶体,或者分子间以______________结合形成的晶体叫分子晶体。
1、分子晶体
概念
分子晶体中的粒子及粒子间的相互作用
分子
分子间作用力
构成微粒
分子
相互作用
分子内:共价键
分子间:分子间作用力
(氢键
范德华力)
1、分子晶体
碘(I2) 干冰(CO2) 碳60(C60) 冰(H2O)
1、分子晶体
常见的典型分子晶体
(1)所有非金属氢化物:H2O、H2S、NH3、CH4等;
(2)部分非金属单质:X2(卤素)、O2、H2、S8、P4、C60、稀有气体等;
(除B、Si、金刚石等)
(3)部分非金属氧化物:CO2、SO2、NO2、P4O6、P4O10等;
(除 SiO2 等)
(4)几乎所有的酸: H2SO4、HNO3、H3PO4、H2SiO3等;
(5)绝大多数有机物:苯、四氯化碳、乙醇、冰醋酸、蔗糖等;
2、分子晶体的性质
思考:请根据表中数据分析分子晶体的熔点有什么特点?
表3-2 某些分子晶体的熔点
分子晶体 氧气 氮气 白磷 硫化氢 甲烷 乙酸
熔点/℃ -218.3 -210.1 44.2 -85.6 -182 16.6
(1)分子晶体熔、沸点较低、硬度小。
(2)分子晶体大多都是绝缘体,在固态和熔融状态下都不导电。
(3)分子晶体的溶解性一般符合“相似相溶”规律。
2、分子晶体的性质
分子晶体熔、沸点高低的判断
①组成和结构相似,不含氢键的,M越大,范德华力越强,熔、沸点越高,
I2>Br2>Cl2>F2,HI>HBr>HCl。
②组成和结构不相似的 (M接近),分子的极性越大,熔、沸点越高,
③含有分子间氢键的,熔、沸点反常升高,
如H2O>H2Te>H2Se>H2S。
如CH3OH>CH3CH3。
3、典型的分子晶体
x
y
z
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
干冰晶体结构
3、典型的分子晶体
x
y
z
干冰晶体结构
干冰晶体结构
x
y
z
①干冰中的CO2分子间作用力只存在 ,不存在 。
②每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
分子间氢键
3、典型的分子晶体
3、典型的分子晶体
大多数分子晶体中,如果分子间的作用力只有范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。
分子密堆积
干冰晶胞
C60的晶胞
3、典型的分子晶体
若分子间除了存在范德华力,还存在氢键,那么,这对分子晶体的结构有什么影响呢?
3、典型的分子晶体
晶体
非晶体
冰晶体中,每个H2O周围有几个紧密相邻的H2O?和干冰晶体一样吗?若不一样,可能的原因是什么?
4个,不一样
3、典型的分子晶体
晶体
非晶体
冰晶体中,每个H2O周围有几个紧密相邻的H2O?和干冰晶体一样吗?若不一样,可能的原因是什么?
原因 :冰晶体中,每个水分子周围只有4个紧密相邻的水分子,因为水分子间除范德华力还存在氢键,氢键具有方向性和饱和性,由于氢键具有方向性,迫使在四面体中心的每个水分子与四面体顶点方向的4个相邻水分子相互吸引。
3、典型的分子晶体
分子非密堆积
分子晶体中,如果分子间的作用力除了范德华力,还存在氢键,导致每个分子周围紧邻的分子少于12个,这一排列使得晶体的空间利用率不高,留有相当大的空隙,分子晶体的这一特征称为分子非密堆积。
4、拓展延伸
天然气水合物—— 一种潜在的能源
许多气体可以与水形成水合物晶体。最早发现这类水合物晶体的是19世纪初的英国化学家戴维,他发现氯可形成化学式为Cl2·8H2O的水合物晶体。20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气分子藏在水分子笼内
水分子笼是多种多样的
【练习】
1、下列分子晶体的熔、沸点由高到低的顺序是( )
①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2
A.①②③④⑤⑥
B.③②①⑤④⑥
C.③②①④⑤⑥
D.⑥⑤④③②①
C
【练习】
2、干冰(CO2)的晶胞结构如下图所示。下列说法不正确的是 ( )
A.干冰晶体属于分子晶体
B.干冰晶胞中,含有4个CO2分子
C.干冰晶体中,每个CO2周围等距且紧邻的CO2有6个
D.干冰晶体中CO2分子间作用力较小,常压下易升华
C
【练习】
3、如图为干冰的晶胞结构示意图。
(1)通过观察分析,有____种取向不同的CO2分子。将CO2
分子视作质点,设晶胞边长为a pm,则紧邻的两个CO2
分子的距离为____ pm。
(2)其密度ρ为___________________(1 pm=10-10 cm)。
4
5、共价晶体
碳元素和硅元素处于元素周期表中同一主族,CO2和SiO2熔沸点为什么差距那么大?
熔点/oC 状态(室温)
CO2 -56.2 气态
SiO2 1723 固态
干冰
SiO2
内容内容内容
5、共价晶体
通过金刚石晶体的结构认识共价晶体结构组成共价晶体的粒子和粒子间的作用力是什么?
金刚石的多面体外形
组成的粒子:_______
粒子间的作用力: _______
晶体结构
晶胞示意图
晶胞示意图
原子
共价键
相邻原子间以_______相结合形成共价键三维骨架结构
(空间立体网状)的晶体。
概念
共价晶体中的粒子及粒子间的相互作用
共价键
构成微粒
原子
微粒间作用
共价键
5、共价晶体
5、共价晶体
常见的共价晶体
某些单质
极少数金属氧化物
某些非金属化合物
硼
刚玉
碳化硅
其他:
硅(Si)、金刚石(C) 、锗(Ge)等
其他:
七氧化二锰(Mn2O7) 、三氧化二铬(Cr2O3) 等
其他:
二氧化硅(SiO2)、氮化硼(BN)、氮化硅(Si3N4)等
6、典型的共价晶体
金刚石晶体
每个C以共价单键对称地与相邻的4个C结合
C—C—C夹角为109°28′
(2)晶体中最小的碳环由 个碳原子组成,且不在同一平面内,最多有 个碳原子在同一平面。
(1)在晶体中每个碳原子以 个共价单键对称地与相邻的 个碳原子结合,C—C—C夹角为 ,即金刚石中的碳采取 杂化轨道形成共价键三维骨架结构。
109°28′
sp3
6
4
正四面体
四
4
最小环为六元环
6、典型的共价晶体
金刚石晶体
(4)每个C原子被 个六元环共用,1个碳环占有的碳原子为 个。
(3)每个C形成4个C—C,每个C—C占有 个C,即C原子与C—C数目之比为 。
2
1∶2
12
0.5
正四面体
最小环为六元环
6、典型的共价晶体
金刚石晶体
6、典型的共价晶体
二氧化硅晶体
晶体硅的结构
二氧化硅的结构
SiO2晶体结构相当于在晶体硅结构中每2个Si原子中间插入1个O原子
(1) 在SiO2晶体中,每个硅原子采取sp3杂化与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 。
单个的SiO2分子存在。
(2)在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
(3)在SiO2 晶体中,最小环为 元环,由 个Si原子和 个O原子构成。
2
1:2
4
2
12
没有
4
6
6
6、典型的共价晶体
二氧化硅晶体
(4)每个十二元环中平均含有硅原子
1:4
1:2
= 6× =
Si原子个数与Si-O 共价键个数之是 ;
O原子个数与Si-O 共价键个数之比是 。
每个十二元环中平均含有Si-O键
= 12× =2
(5)60 g 二氧化硅含有_____个Si原子
含有_____个O原子
含有_____ 个Si-O键
NA
2NA
4NA
1 mol SiO2中含 mol Si-O键
4
6、典型的共价晶体
二氧化硅晶体
在低温石英的结构中,顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
二氧化硅晶体——低温石英
石英晶体中的硅氧四面体相连构成的螺旋链
石英的左、右型晶体
石英手表
6、典型的共价晶体
二氧化硅晶体
二氧化硅——重要用途
水泥
单晶硅
玻璃
单晶硅制的芯片
硅太阳能
电池
二氧化硅
光导纤维
6、典型的共价晶体
7、共价晶体的性质
思考:比较下表中共价晶体熔点和硬度,它们有什么特点?
某些共价晶体的熔点和硬度
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
熔点很高;硬度很大
为什么共价晶体熔点很高?
熔化破坏共价键,需要很高的能量。
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
7、共价晶体的性质
思考:比较下表中共价晶体熔点和硬度,它们有什么特点?
某些共价晶体的熔点和硬度
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
问题1:与分子晶体相比,共价晶体的熔点普遍较高,为什么
分子晶体中分子间是以较弱的分子间作用力(部分含氢键)相互作用的,而共价晶体中原子间是通过较强的共价键相互作用的,并且形成空间网状结构,所以熔点普遍较高。
7、共价晶体的性质
问题2:由表中可知,金刚石、硅和锗的熔点和硬度均依次降低,如何解释
三者的组成元素为同一主族元素,形成的晶体结构类似,结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
问题3:从哪些角度可以区分共价晶体与分子晶体
可以从构成微粒、微粒间作用力强弱、熔沸点、硬度等角度区分。
共价
晶体
分子
晶体
有氢键
只有
范德华力
方 法
依据组成晶体的粒子和粒子间的作用力判断
依据性质判断
判断
晶体的类型
键能越大
熔点越高
氢键的
数目多少
相对分子
质量大小
判断
键能的大小
判断
分子间的作用力
7、共价晶体的性质
比较物质的熔点的方法
【练习】
5. 金刚石晶胞结构如图所示,回答下列问题。
(1)一个金刚石晶胞中含有________个碳原子。
(2)已知晶胞参数为a pm,则金刚石的密度为______________ g·cm-3。
(3)晶体中两个最近的碳原子之间的距离为______ pm。
(4)碳原子的半径为r,则a、r有什么关系?
8
