化学人教版(2019)必修第二册5.3无机非金属材料-硅二氧化硅硅酸硅酸盐(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.3无机非金属材料-硅二氧化硅硅酸硅酸盐(共33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-24 16:52:36 | ||
图片预览











文档简介
(共33张PPT)
第五章 化工生产中的重要非金属元素
第三节 无机非金属材料
硅 二氧化硅 硅酸 硅酸盐
想一想:它们用到哪些材料?列举生活中有哪些材料?
材料按照化学组成和特性来分:
复合材料:由两种或两种以上的材料按照一定方式组成的材料。
高分子材料:纤维、橡胶、树脂、塑料
材料
金属材料:纯金属材料和合金材料
无机非金属材料:传统和新型无机非金属材料
三大传统硅酸盐材料:玻璃、陶瓷、水泥
传统无机非金属材料-硅酸盐材料
结构:在硅酸盐中,Si和O构成了硅氧四面体。
性质:硬度大、熔点高、难溶于水、化学性质稳定等。
硅酸盐概念:由硅、氧和金属组成的化合物的总称
玻璃
制备原理:
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
纯碱、石灰石、石英沙(SiO2)
Na2SiO3、CaSiO3和SiO2
建筑材料、光学仪器、各种器皿、
玻璃纤维
原料:
成分:
用途:
性能:
透光性好、硬度大、无固定熔点
水泥
黏土和石灰石,适量石膏(调节水泥硬化速率)
水泥回转窖(复杂的物理和化学变化)
设备:
原料:
水泥、沙子和碎石等与水混合可以得到混凝土,大量用于建筑和水利工程
用途:
成分: 硅酸盐,包括硅酸三钙(3CaO·SiO2) 硅酸二钙 (2CaO·SiO2)、 铝酸三钙(3CaO·Al2O3)
黏土(含水的铝硅酸盐)
高温烧结(复杂的物理和化学变化)
建筑材料、绝缘材料、日用器皿、卫生洁具
原料:
条件:
用途:
陶瓷
我国具有悠久的陶瓷制造历史,在新石器时代,我们的祖先已能烧制陶器,至唐宋时期,我国的陶瓷制品已经享誉海内外。
玻璃,水泥,陶瓷的原料有哪些区别?组成成分上玻璃与水泥和陶瓷相比有什么不同
成分: 含水的铝硅酸盐
玻璃的成分含有二氧化硅
1.湖南省博物院被国家文物局列为首批“国家一级博物馆”,现有院藏文物18万余件。下列文物的主要成分为硅酸盐材料的是
C
2“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法正确的是( )
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
C
硅谷最早是研究和生产以硅为基础的半导体芯片的地方,因此得名。
新型无机非金属材料
硅在地壳中的含量:
地壳中含量前五位的元素
氧、硅、铝、铁、钙
仅次于氧,排在第二位。
一.硅
1.硅的存在:
硅是亲氧元素,没有游离态,只有化合态。
硅在自然界中主要以:硅酸盐(如地壳中的大多数矿物)和 氧化物(如水晶、玛瑙)的形式存在。
硅酸盐——石榴石
氧化物——水晶
是构成矿物和岩石的基本元素。
氧化物——沙子
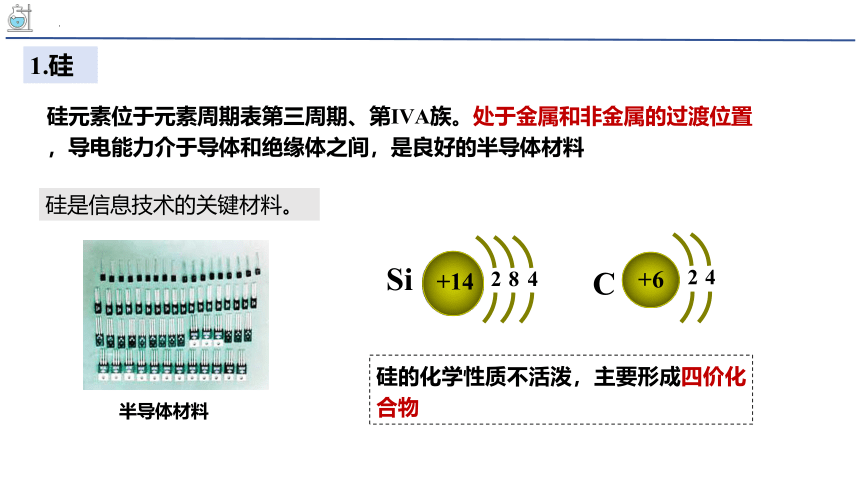
硅元素位于元素周期表第三周期、第ⅣA族。处于金属和非金属的过渡位置
,导电能力介于导体和绝缘体之间,是良好的半导体材料
1.硅
硅是信息技术的关键材料。
半导体材料
Si
+14
8
4
2
+6
4
2
C
硅的化学性质不活泼,主要形成四价化合物
单质硅是灰黑色具有金属光泽的固体,结构类似金刚石,熔沸点很高、硬度大
2.硅的物理性质
硅的类型:分为晶体硅和不定型硅
晶 体 硅
不 定 型 硅
正四面体形网状结构的晶体,与金刚石结构相似
并非所有的原子都与其它原子严格地按照正四面体排列 (不稳定性)
3.硅单质的化学性质
(1)常温下,硅的化学性质不活泼,除氢氟酸、氟气、强碱外不跟其他物质反应。
与氟气反应:
Si+2F2 = SiF4
与氢氟酸反应:
Si+4HF = SiF4↑+2H2↑
与强碱溶液反应:
Si+2NaOH+H2O =Na2SiO3+2H2↑
(2)加热条件下,硅也能和一些非金属反应。
Si+2Cl2 SiCl4
Si + O2 SiO2
Si + C SiC
高温
3.硅的用途
良好的半导体材料可制成硅芯片和太阳能电池极板
半导体发光二极管
思考:如何理解工业上的“从沙滩到用户”?怎么获得高纯硅呢?
SiO2+2C Si+2CO↑
4.高纯硅的制备
其中涉及的主要化学反应为
①________________________________
②_________________________
③__________________________
制备原理:
用焦炭还原石英砂,得到含少量杂质的粗硅,然后转化为三氯硅烷,再经氢气还原。
能否通过该反应证明C、Si的还原性强弱?
氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
SiO2是硅的重要化合物,地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
二,二氧化硅
玛瑙
水晶
石英
结晶形
无定形
2.SiO2的结构
空间构型:硅氧四面体(空间网状)
物理性质:难溶于水,熔点高,硬度大 化学性质:化学稳定性好
①1mol SiO2中含4mol Si-O键
②SiO2是不是分子式,SiO2是由原子组成的,没有SiO2分子
二氧化硅中氧原子与硅原子个数比为2:1,用SiO2来表示二氧化硅的组成,表示O与Si的原子个数比,不是分子式是化学式
导入:光导纤维被认为是20世纪最伟大的发明之一,它使信息高速公路在全球迅猛发展。光导纤维的主要成分是SiO2,碱性环境下,光导纤维为什么会失去传播信号的能力?
思考:SiO2具有酸性氧化物的通性,你能否说出CO2能与哪类物质发生反应?
CO2能与水反应,与碱反应,与碱性氧化物反应,SiO2能与这些物质反应吗?
a.酸性氧化物
①与碱溶液反应:
SiO2 + 2NaOH = Na2SiO3 + H2O
②与碱性氧化物反应:
SiO2 + CaO CaSiO3
③与某些盐反应:工业制玻璃
3.SiO2的化学性质
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
【思考】为什么实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞?
因为玻璃中含有SiO2,会与NaOH溶液反应生成硅酸钠,硅酸钠具有黏性,会使瓶塞与瓶口粘在一起而打不开。但此反应在成型的玻璃表面进行时很慢的,几乎不会影响瓶子本身。所以可以用玻璃瓶
SiO2 + 4HF = SiF4 ↑+2H2O
用途:刻蚀玻璃
b.特性:与酸反应(只能与HF反应)
注意:盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶
思考:某同学根据SiO2既可与碱反应,也能与氢氟酸反应推断SiO2为两性氧化物,是否正确
不是,二氧化硅和其他酸不反应,只能与HF酸反应,且生成的SiF4不是盐
加热熔融烧碱时应使用下列哪种坩埚( )
A.石英坩埚 B.普通玻璃坩埚
C.铁坩埚 D.氧化铝坩埚
C
练一练:
解析: 陶瓷和石英的主要成分都含有SiO2,SiO2能与NaOH反应,铝坩埚的主要成分是氧化铝,也能与NaOH反应。
4.二氧化硅的用途
光导纤维
石英坩埚
玻璃仪器
水晶、玛瑙饰品
还可以用于工业制粗硅:
SiO2+2C Si+2CO↑
高温
3.新型陶瓷:高温陶瓷,压电陶瓷,透明陶瓷,超导陶瓷
碳化硅(SiC)俗称金刚砂,硬度很大,可用作砂纸和砂轮的磨料还具有优异的高温抗氧化性能,可以用作耐高温结构材料、耐高温半导体材料等。
三,其他新型非金属材料
富勒烯C60
石墨烯
碳纳米管
4.碳纳米材料:碳单质的同素异形体
在能源、信息、医药等领域有着广阔的应用前景
硅胶是什么?为什么可以用作干燥剂呢?
透明小球是硅酸逐渐聚合而形成的胶体-硅酸溶胶,硅酸浓度较大时,则形成软而透明的、胶冻状的硅酸凝胶。硅酸凝胶经干燥脱水就形成硅酸干胶,称为“硅胶”。硅胶多孔,吸附水分能力强,常用做实验室和袋装食品、瓶装药品等的干燥剂,也可以用作催化剂的载体。
1. H2SiO3物理性质:
白色胶状固体不溶于水
四:硅酸
2. H2SiO3化学性质:
①硅酸是一种不溶于水的弱酸,酸性比碳酸H2CO3 弱,不能使指示剂变色
3. H2SiO3的制备:(强酸制弱酸)可溶性硅酸盐与酸反应制备H2SiO3
Na2SiO3+2HCl = 2NaCl+H2SiO3↓
Na2SiO3+H2O+CO2 (少)= Na2CO3+H2SiO3↓
Na2SiO3+2H2O+2CO2(过) =2NaHCO3+H2SiO3↓
②H2SiO3不稳定,受热易分解
H2SiO3 SiO2 + H2O
【例】下列关于硅酸的说法正确的是( )
A.硅酸可以通过SiO2和水的化合反应直接制得
B.用反应Na2SiO3+2HCl=2NaCl+H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.硅胶可用作袋装食品的干燥剂
D
1.概念:由硅、氧和金属组成的化合物的总称(Na2SiO3 )
结构:在硅酸盐中硅原子和氧原子构成了硅氧四面体
性质:硬度高、难溶于水、耐高温、耐腐蚀等特点
五、硅酸盐
2.简单的硅酸盐——Na2SiO3
①物理性质:俗称泡花碱,白色固体,可溶于水,水溶液俗称水玻璃
②化学性质:Na2SiO3+2HCl = 2NaCl+H2SiO3↓
③硅酸钠的用途:制硅酸、黏合剂、耐火阻燃材料(防火剂)
3.硅酸盐的组成表示:
用氧化物形式表示:硅酸钠Na2SiO3 :Na2O · SiO2
书写顺序:活泼金属氧化物·较活泼金属氧化物·SiO2·H2O
在氧化物前面按化学式中的比例添加系数,计量数以整数书写!
黏土:Al2Si2H4O9
长石:KAlSi3O8
钾云母:K(Al3Si3O10)(OH)2
Al2O3·2SiO2·2H2O
K2O·Al2O3·6SiO2
K2O·3Al2O3·6SiO2·2H2O
钙沸石:Ca(Al2Si3O10) ·3H2O
CaO ·Al2O3 ·3SiO2·3H2O
练习.将下列硅酸盐改写为氧化物
练习:青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉是一种硅酸盐产品
B.青石棉能完全溶解在NaOH溶液中
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1 mol青石棉能使1 mol HNO3被还原
B
Si
Na2SiO3
SiO2
H2SiO3
O2 /△
Na2O、NaOH
H2O+CO2/HCl
NaOH
物质类别
化
合
价
单质
氧化物
盐
含氧酸
0
+4
Na2CO3
C/高温
SiF4
HF
NaOH
SiCl4
氯化物
△
硅元素的价类图
+2
1.二氧化硅是玻璃的主要成分之一。下列说法不正确的是( )
A.二氧化硅是一种立体网状结构的晶体,熔点高、硬度大
B.二氧化硅为酸性氧化物,能与水反应生成硅酸
C.实验室不能用磨口玻璃塞试剂瓶盛放氢氧化钠溶液
D.氢氟酸能雕刻玻璃,不能用玻璃瓶盛放氢氟酸
B
2.下列物品或设备的成分中含有二氧化硅的是( )
①门窗玻璃 ②水晶镜片 ③石英钟表 ④玛瑙首饰
⑤硅太阳能电池 ⑥光导纤维 ⑦计算机芯片
A.①②③④⑥ B.全部 C.⑤⑦ D.①②⑥⑦
A
3.下列关于硅酸的说法正确的是( )
A.硅酸可以通过 SiO2 和 H2O 化合反应直接制得
B.可用反应 Na2SiO3+2HCl = 2NaCl + H2SiO3↓ 制取硅酸
C.因为硅酸难溶于水,所以它不能与 NaOH 溶液反应
D.干燥剂“硅胶”的主要成分是硅酸钠
B
4.下列叙述正确的是( )
A.SiO2既和NaOH溶液反应,又和HF反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2 Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
C.CO2和SiO2都能与碳反应,且都作氧化剂
D.CO2和SiO2都是由分子构成的化合物,所以两者物理性质相似
C
5.利用“强酸制弱酸”原理可用来设计酸性强弱比较的实验,如比较HCl、H2CO3、H2SiO3酸性强弱:
①分液漏斗所盛试剂是稀盐酸,锥形瓶所盛试剂是______________,装置A中反应的化学方程式是____________________________________。
②装置B所盛试剂是饱和NaHCO3溶液,其作用是:
_____________________________________。
③装置C所盛试剂是_____________,C中反应的
离子方程式是______________________。
④结论:HCl、H2CO3、H2SiO3酸性强弱:_____>______>______。
能否说明非金属性:Cl > C > Si ?
Na2CO3溶液
Na2CO3 + 2HCl === 2NaCl + CO2↑+ H2O
除去盐酸中挥发出的HCl气体
Na2SiO3溶液
HCl H2CO3 H2SiO3
第五章 化工生产中的重要非金属元素
第三节 无机非金属材料
硅 二氧化硅 硅酸 硅酸盐
想一想:它们用到哪些材料?列举生活中有哪些材料?
材料按照化学组成和特性来分:
复合材料:由两种或两种以上的材料按照一定方式组成的材料。
高分子材料:纤维、橡胶、树脂、塑料
材料
金属材料:纯金属材料和合金材料
无机非金属材料:传统和新型无机非金属材料
三大传统硅酸盐材料:玻璃、陶瓷、水泥
传统无机非金属材料-硅酸盐材料
结构:在硅酸盐中,Si和O构成了硅氧四面体。
性质:硬度大、熔点高、难溶于水、化学性质稳定等。
硅酸盐概念:由硅、氧和金属组成的化合物的总称
玻璃
制备原理:
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
纯碱、石灰石、石英沙(SiO2)
Na2SiO3、CaSiO3和SiO2
建筑材料、光学仪器、各种器皿、
玻璃纤维
原料:
成分:
用途:
性能:
透光性好、硬度大、无固定熔点
水泥
黏土和石灰石,适量石膏(调节水泥硬化速率)
水泥回转窖(复杂的物理和化学变化)
设备:
原料:
水泥、沙子和碎石等与水混合可以得到混凝土,大量用于建筑和水利工程
用途:
成分: 硅酸盐,包括硅酸三钙(3CaO·SiO2) 硅酸二钙 (2CaO·SiO2)、 铝酸三钙(3CaO·Al2O3)
黏土(含水的铝硅酸盐)
高温烧结(复杂的物理和化学变化)
建筑材料、绝缘材料、日用器皿、卫生洁具
原料:
条件:
用途:
陶瓷
我国具有悠久的陶瓷制造历史,在新石器时代,我们的祖先已能烧制陶器,至唐宋时期,我国的陶瓷制品已经享誉海内外。
玻璃,水泥,陶瓷的原料有哪些区别?组成成分上玻璃与水泥和陶瓷相比有什么不同
成分: 含水的铝硅酸盐
玻璃的成分含有二氧化硅
1.湖南省博物院被国家文物局列为首批“国家一级博物馆”,现有院藏文物18万余件。下列文物的主要成分为硅酸盐材料的是
C
2“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法正确的是( )
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
C
硅谷最早是研究和生产以硅为基础的半导体芯片的地方,因此得名。
新型无机非金属材料
硅在地壳中的含量:
地壳中含量前五位的元素
氧、硅、铝、铁、钙
仅次于氧,排在第二位。
一.硅
1.硅的存在:
硅是亲氧元素,没有游离态,只有化合态。
硅在自然界中主要以:硅酸盐(如地壳中的大多数矿物)和 氧化物(如水晶、玛瑙)的形式存在。
硅酸盐——石榴石
氧化物——水晶
是构成矿物和岩石的基本元素。
氧化物——沙子
硅元素位于元素周期表第三周期、第ⅣA族。处于金属和非金属的过渡位置
,导电能力介于导体和绝缘体之间,是良好的半导体材料
1.硅
硅是信息技术的关键材料。
半导体材料
Si
+14
8
4
2
+6
4
2
C
硅的化学性质不活泼,主要形成四价化合物
单质硅是灰黑色具有金属光泽的固体,结构类似金刚石,熔沸点很高、硬度大
2.硅的物理性质
硅的类型:分为晶体硅和不定型硅
晶 体 硅
不 定 型 硅
正四面体形网状结构的晶体,与金刚石结构相似
并非所有的原子都与其它原子严格地按照正四面体排列 (不稳定性)
3.硅单质的化学性质
(1)常温下,硅的化学性质不活泼,除氢氟酸、氟气、强碱外不跟其他物质反应。
与氟气反应:
Si+2F2 = SiF4
与氢氟酸反应:
Si+4HF = SiF4↑+2H2↑
与强碱溶液反应:
Si+2NaOH+H2O =Na2SiO3+2H2↑
(2)加热条件下,硅也能和一些非金属反应。
Si+2Cl2 SiCl4
Si + O2 SiO2
Si + C SiC
高温
3.硅的用途
良好的半导体材料可制成硅芯片和太阳能电池极板
半导体发光二极管
思考:如何理解工业上的“从沙滩到用户”?怎么获得高纯硅呢?
SiO2+2C Si+2CO↑
4.高纯硅的制备
其中涉及的主要化学反应为
①________________________________
②_________________________
③__________________________
制备原理:
用焦炭还原石英砂,得到含少量杂质的粗硅,然后转化为三氯硅烷,再经氢气还原。
能否通过该反应证明C、Si的还原性强弱?
氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
SiO2是硅的重要化合物,地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
二,二氧化硅
玛瑙
水晶
石英
结晶形
无定形
2.SiO2的结构
空间构型:硅氧四面体(空间网状)
物理性质:难溶于水,熔点高,硬度大 化学性质:化学稳定性好
①1mol SiO2中含4mol Si-O键
②SiO2是不是分子式,SiO2是由原子组成的,没有SiO2分子
二氧化硅中氧原子与硅原子个数比为2:1,用SiO2来表示二氧化硅的组成,表示O与Si的原子个数比,不是分子式是化学式
导入:光导纤维被认为是20世纪最伟大的发明之一,它使信息高速公路在全球迅猛发展。光导纤维的主要成分是SiO2,碱性环境下,光导纤维为什么会失去传播信号的能力?
思考:SiO2具有酸性氧化物的通性,你能否说出CO2能与哪类物质发生反应?
CO2能与水反应,与碱反应,与碱性氧化物反应,SiO2能与这些物质反应吗?
a.酸性氧化物
①与碱溶液反应:
SiO2 + 2NaOH = Na2SiO3 + H2O
②与碱性氧化物反应:
SiO2 + CaO CaSiO3
③与某些盐反应:工业制玻璃
3.SiO2的化学性质
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
【思考】为什么实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞?
因为玻璃中含有SiO2,会与NaOH溶液反应生成硅酸钠,硅酸钠具有黏性,会使瓶塞与瓶口粘在一起而打不开。但此反应在成型的玻璃表面进行时很慢的,几乎不会影响瓶子本身。所以可以用玻璃瓶
SiO2 + 4HF = SiF4 ↑+2H2O
用途:刻蚀玻璃
b.特性:与酸反应(只能与HF反应)
注意:盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶
思考:某同学根据SiO2既可与碱反应,也能与氢氟酸反应推断SiO2为两性氧化物,是否正确
不是,二氧化硅和其他酸不反应,只能与HF酸反应,且生成的SiF4不是盐
加热熔融烧碱时应使用下列哪种坩埚( )
A.石英坩埚 B.普通玻璃坩埚
C.铁坩埚 D.氧化铝坩埚
C
练一练:
解析: 陶瓷和石英的主要成分都含有SiO2,SiO2能与NaOH反应,铝坩埚的主要成分是氧化铝,也能与NaOH反应。
4.二氧化硅的用途
光导纤维
石英坩埚
玻璃仪器
水晶、玛瑙饰品
还可以用于工业制粗硅:
SiO2+2C Si+2CO↑
高温
3.新型陶瓷:高温陶瓷,压电陶瓷,透明陶瓷,超导陶瓷
碳化硅(SiC)俗称金刚砂,硬度很大,可用作砂纸和砂轮的磨料还具有优异的高温抗氧化性能,可以用作耐高温结构材料、耐高温半导体材料等。
三,其他新型非金属材料
富勒烯C60
石墨烯
碳纳米管
4.碳纳米材料:碳单质的同素异形体
在能源、信息、医药等领域有着广阔的应用前景
硅胶是什么?为什么可以用作干燥剂呢?
透明小球是硅酸逐渐聚合而形成的胶体-硅酸溶胶,硅酸浓度较大时,则形成软而透明的、胶冻状的硅酸凝胶。硅酸凝胶经干燥脱水就形成硅酸干胶,称为“硅胶”。硅胶多孔,吸附水分能力强,常用做实验室和袋装食品、瓶装药品等的干燥剂,也可以用作催化剂的载体。
1. H2SiO3物理性质:
白色胶状固体不溶于水
四:硅酸
2. H2SiO3化学性质:
①硅酸是一种不溶于水的弱酸,酸性比碳酸H2CO3 弱,不能使指示剂变色
3. H2SiO3的制备:(强酸制弱酸)可溶性硅酸盐与酸反应制备H2SiO3
Na2SiO3+2HCl = 2NaCl+H2SiO3↓
Na2SiO3+H2O+CO2 (少)= Na2CO3+H2SiO3↓
Na2SiO3+2H2O+2CO2(过) =2NaHCO3+H2SiO3↓
②H2SiO3不稳定,受热易分解
H2SiO3 SiO2 + H2O
【例】下列关于硅酸的说法正确的是( )
A.硅酸可以通过SiO2和水的化合反应直接制得
B.用反应Na2SiO3+2HCl=2NaCl+H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.硅胶可用作袋装食品的干燥剂
D
1.概念:由硅、氧和金属组成的化合物的总称(Na2SiO3 )
结构:在硅酸盐中硅原子和氧原子构成了硅氧四面体
性质:硬度高、难溶于水、耐高温、耐腐蚀等特点
五、硅酸盐
2.简单的硅酸盐——Na2SiO3
①物理性质:俗称泡花碱,白色固体,可溶于水,水溶液俗称水玻璃
②化学性质:Na2SiO3+2HCl = 2NaCl+H2SiO3↓
③硅酸钠的用途:制硅酸、黏合剂、耐火阻燃材料(防火剂)
3.硅酸盐的组成表示:
用氧化物形式表示:硅酸钠Na2SiO3 :Na2O · SiO2
书写顺序:活泼金属氧化物·较活泼金属氧化物·SiO2·H2O
在氧化物前面按化学式中的比例添加系数,计量数以整数书写!
黏土:Al2Si2H4O9
长石:KAlSi3O8
钾云母:K(Al3Si3O10)(OH)2
Al2O3·2SiO2·2H2O
K2O·Al2O3·6SiO2
K2O·3Al2O3·6SiO2·2H2O
钙沸石:Ca(Al2Si3O10) ·3H2O
CaO ·Al2O3 ·3SiO2·3H2O
练习.将下列硅酸盐改写为氧化物
练习:青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉是一种硅酸盐产品
B.青石棉能完全溶解在NaOH溶液中
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1 mol青石棉能使1 mol HNO3被还原
B
Si
Na2SiO3
SiO2
H2SiO3
O2 /△
Na2O、NaOH
H2O+CO2/HCl
NaOH
物质类别
化
合
价
单质
氧化物
盐
含氧酸
0
+4
Na2CO3
C/高温
SiF4
HF
NaOH
SiCl4
氯化物
△
硅元素的价类图
+2
1.二氧化硅是玻璃的主要成分之一。下列说法不正确的是( )
A.二氧化硅是一种立体网状结构的晶体,熔点高、硬度大
B.二氧化硅为酸性氧化物,能与水反应生成硅酸
C.实验室不能用磨口玻璃塞试剂瓶盛放氢氧化钠溶液
D.氢氟酸能雕刻玻璃,不能用玻璃瓶盛放氢氟酸
B
2.下列物品或设备的成分中含有二氧化硅的是( )
①门窗玻璃 ②水晶镜片 ③石英钟表 ④玛瑙首饰
⑤硅太阳能电池 ⑥光导纤维 ⑦计算机芯片
A.①②③④⑥ B.全部 C.⑤⑦ D.①②⑥⑦
A
3.下列关于硅酸的说法正确的是( )
A.硅酸可以通过 SiO2 和 H2O 化合反应直接制得
B.可用反应 Na2SiO3+2HCl = 2NaCl + H2SiO3↓ 制取硅酸
C.因为硅酸难溶于水,所以它不能与 NaOH 溶液反应
D.干燥剂“硅胶”的主要成分是硅酸钠
B
4.下列叙述正确的是( )
A.SiO2既和NaOH溶液反应,又和HF反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2 Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
C.CO2和SiO2都能与碳反应,且都作氧化剂
D.CO2和SiO2都是由分子构成的化合物,所以两者物理性质相似
C
5.利用“强酸制弱酸”原理可用来设计酸性强弱比较的实验,如比较HCl、H2CO3、H2SiO3酸性强弱:
①分液漏斗所盛试剂是稀盐酸,锥形瓶所盛试剂是______________,装置A中反应的化学方程式是____________________________________。
②装置B所盛试剂是饱和NaHCO3溶液,其作用是:
_____________________________________。
③装置C所盛试剂是_____________,C中反应的
离子方程式是______________________。
④结论:HCl、H2CO3、H2SiO3酸性强弱:_____>______>______。
能否说明非金属性:Cl > C > Si ?
Na2CO3溶液
Na2CO3 + 2HCl === 2NaCl + CO2↑+ H2O
除去盐酸中挥发出的HCl气体
Na2SiO3溶液
HCl H2CO3 H2SiO3
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
