化学人教版(2019)选择性必修2 3.2.1分子晶体(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.1分子晶体(共26张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-24 00:00:00 | ||
图片预览




文档简介
(共26张PPT)
第二节
分子晶体与共价晶体
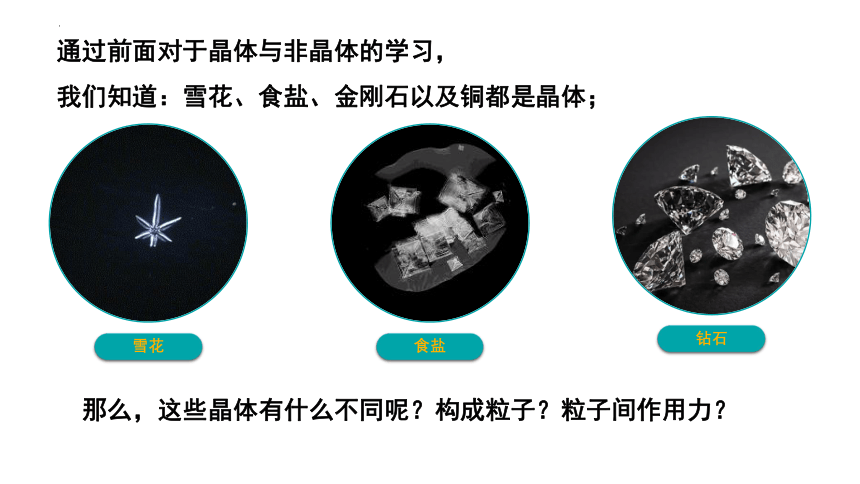
雪花
食盐
钻石
通过前面对于晶体与非晶体的学习,
我们知道:雪花、食盐、金刚石以及铜都是晶体;
那么,这些晶体有什么不同呢?构成粒子?粒子间作用力?
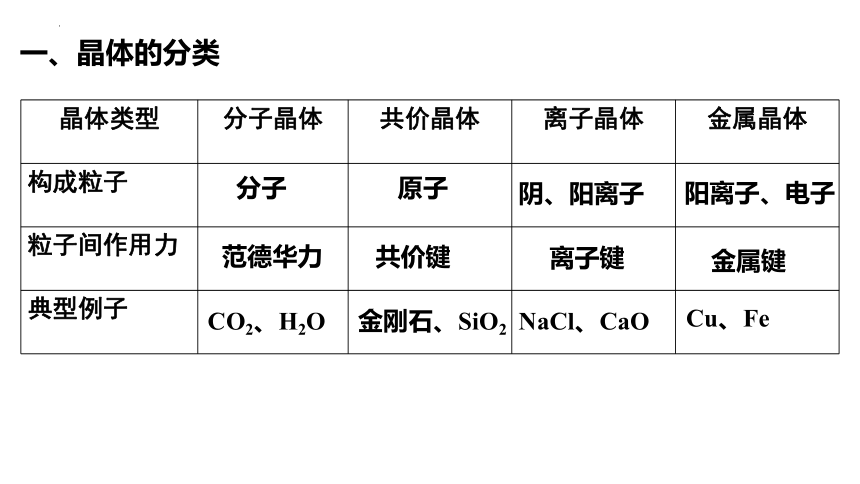
一、晶体的分类
晶体类型 分子晶体 共价晶体 离子晶体 金属晶体
构成粒子
粒子间作用力
典型例子
分子
原子
阴、阳离子
阳离子、电子
范德华力
共价键
离子键
金属键
CO2、H2O
金刚石、SiO2
NaCl、CaO
Cu、Fe
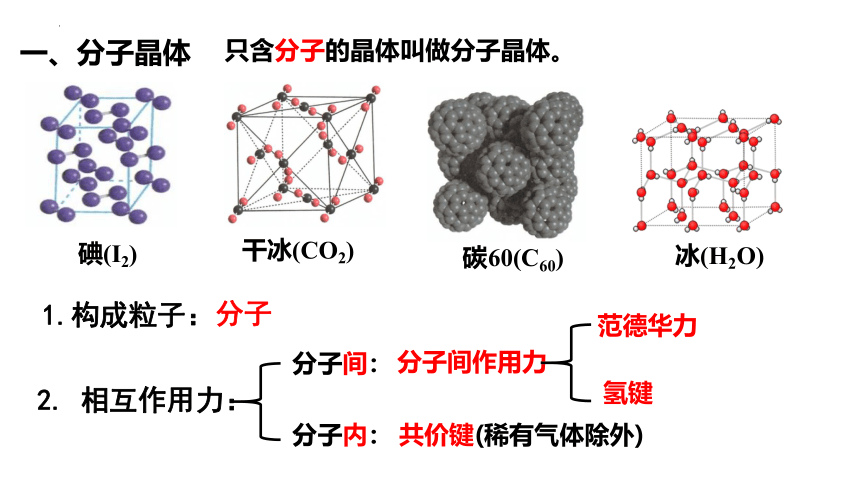
一、分子晶体
碘(I2)
干冰(CO2)
碳60(C60)
冰(H2O)
只含分子的晶体叫做分子晶体。
1.构成粒子:
分子
2. 相互作用力:
分子间:
分子内:
分子间作用力
范德华力
氢键
共价键(稀有气体除外)
3.典型的分子晶体:
①所有非金属氢化物:H2O、H2S、NH3、CH4、HX
②部分非金属单质:X2、O2、H2、S8、P4、C60
例外:金刚石、晶体硅等
③部分非金属氧化物: CO2、SO2、NO2、P4O6、P4O10
例外:SiO2等
④稀有气体为单原子分子,固态时为分子晶体
⑤几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等
⑥绝大多数有机物:乙醇、冰醋酸、蔗糖、蛋白质、尿素等
→下列晶体是否属于分子晶体?
√
√
√
√
√
╳
╳
H2S、O2、 SO2、 H2SO4、乙醇、 He、 NaCl、Cu、SiO2、C(金刚石)
√
╳
╳
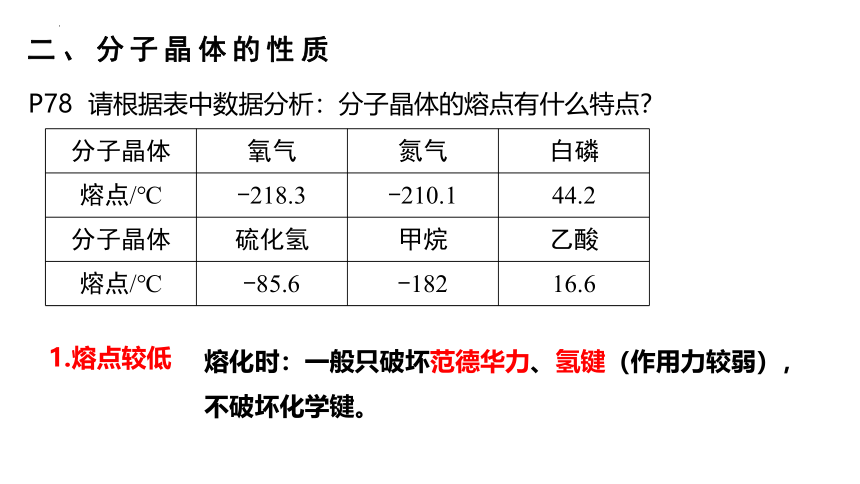
二、分子晶体的性质
P78 请根据表中数据分析:分子晶体的熔点有什么特点?
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
1.熔点较低
熔化时:一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
2.硬度小
分子间作用力较弱,容易被克服
构成分子晶体的微粒是分子,没有产生自由移动的离子。
酒精
3.本身不导电
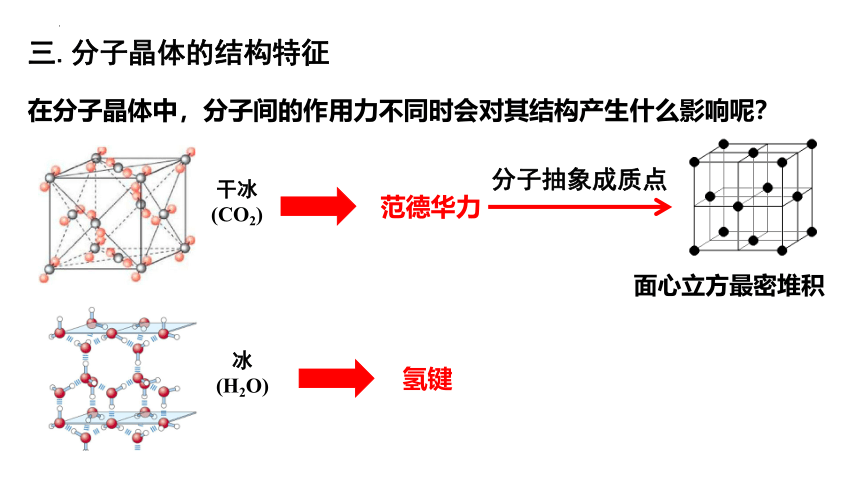
三.分子晶体的结构特征
在分子晶体中,分子间的作用力不同时会对其结构产生什么影响呢?
干冰
(CO2)
冰
(H2O)
范德华力
氢键
分子抽象成质点
面心立方最密堆积
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
0
1
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
4
1
2
3
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
1
2
3
4
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
1
2
3
4
12
三.分子晶体的结构特征
①干冰中的CO2分子间只存在 ,不存在 。
②干冰晶胞是一种面心立方结构,每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
氢键
1:干冰晶体的结构特征
只存在范德华力,分子密堆积,每个分子周围有12个紧邻的分子
干冰可用作舞台烟雾特效
三.分子晶体的结构特征
2:冰晶体的结构特征
冰
(H2O)
氢键:0.177nm
每个H2O周围紧密相邻的H2O只有4个
非密堆积
冰(H2O)
尽管氢键比共价键弱得多,不属于化学键,却跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
2:冰晶体的结构特征
①水分子之间的作用力有范德华力、氢键,且主要是氢键。
②由于氢键具有方向性,
使四面体中心的每个水分子与4个相邻的水分子相互吸引。
③水分子以氢键相连接,含1 mol H2O的冰中,最多可形成 2 mol“氢键”
冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
结合冰的结构解释,为何水凝结成冰后密度减小?
→氢键具有方向性,迫使在四面体中心的水分子与位于四面体顶角的四个水分子吸引,水分子间留有相当大的空隙,空间利用率低,密度减小。
→当冰刚刚融化成液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,由于热运动加剧,分子间距离加大,密度逐渐减小。所以4℃时水的密度最大。
为什么水在4℃时的密度最大?
冰融化,分子间空隙减小
总结:分子晶体的结构特征
①分子间只有范德华力
→分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、O2
→分子非密堆积(每个分子周围紧邻的分子少于12个)
②分子间存在氢键
如:HF 、NH3、冰。
③分子晶体中存在单个分子,化学式代表真实的分子组成。
为什么干冰的熔沸点比冰低,而密度却比冰大?
由于干冰中的CO2之间只存在范德华力,一个分子周围有12个紧邻分子,∴密度比冰的高。
冰存在分子间氢键,CO2之间只存在范德华力,∴ 干冰的熔沸点比冰低。
干冰:密堆积
冰:非密堆积
1.下列属于分子晶体的一组物质是( )
A. CaO、NO、CO B. CCl4、H2O、He
C. CO2、SO2、NaCl D. CH4、O2、Na2O
B
2.下列分子晶体的熔、沸点由高到低的顺序是( )
①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2
A. ①②③④⑤⑥
B. ③②①⑤④⑥
C. ③②①④⑤⑥
D. ⑥⑤④③②①
C
3.干冰熔点很低是由于( )
A. CO2是非极性分子 B. C==O的键能很小
C. CO2化学性质不活泼 D. CO2分子间的作用力较弱
D
第二节
分子晶体与共价晶体
雪花
食盐
钻石
通过前面对于晶体与非晶体的学习,
我们知道:雪花、食盐、金刚石以及铜都是晶体;
那么,这些晶体有什么不同呢?构成粒子?粒子间作用力?
一、晶体的分类
晶体类型 分子晶体 共价晶体 离子晶体 金属晶体
构成粒子
粒子间作用力
典型例子
分子
原子
阴、阳离子
阳离子、电子
范德华力
共价键
离子键
金属键
CO2、H2O
金刚石、SiO2
NaCl、CaO
Cu、Fe
一、分子晶体
碘(I2)
干冰(CO2)
碳60(C60)
冰(H2O)
只含分子的晶体叫做分子晶体。
1.构成粒子:
分子
2. 相互作用力:
分子间:
分子内:
分子间作用力
范德华力
氢键
共价键(稀有气体除外)
3.典型的分子晶体:
①所有非金属氢化物:H2O、H2S、NH3、CH4、HX
②部分非金属单质:X2、O2、H2、S8、P4、C60
例外:金刚石、晶体硅等
③部分非金属氧化物: CO2、SO2、NO2、P4O6、P4O10
例外:SiO2等
④稀有气体为单原子分子,固态时为分子晶体
⑤几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等
⑥绝大多数有机物:乙醇、冰醋酸、蔗糖、蛋白质、尿素等
→下列晶体是否属于分子晶体?
√
√
√
√
√
╳
╳
H2S、O2、 SO2、 H2SO4、乙醇、 He、 NaCl、Cu、SiO2、C(金刚石)
√
╳
╳
二、分子晶体的性质
P78 请根据表中数据分析:分子晶体的熔点有什么特点?
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
1.熔点较低
熔化时:一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
2.硬度小
分子间作用力较弱,容易被克服
构成分子晶体的微粒是分子,没有产生自由移动的离子。
酒精
3.本身不导电
三.分子晶体的结构特征
在分子晶体中,分子间的作用力不同时会对其结构产生什么影响呢?
干冰
(CO2)
冰
(H2O)
范德华力
氢键
分子抽象成质点
面心立方最密堆积
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
0
1
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
4
1
2
3
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
1
2
3
4
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
x
y
z
a
1
2
3
4
12
三.分子晶体的结构特征
①干冰中的CO2分子间只存在 ,不存在 。
②干冰晶胞是一种面心立方结构,每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
氢键
1:干冰晶体的结构特征
只存在范德华力,分子密堆积,每个分子周围有12个紧邻的分子
干冰可用作舞台烟雾特效
三.分子晶体的结构特征
2:冰晶体的结构特征
冰
(H2O)
氢键:0.177nm
每个H2O周围紧密相邻的H2O只有4个
非密堆积
冰(H2O)
尽管氢键比共价键弱得多,不属于化学键,却跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
2:冰晶体的结构特征
①水分子之间的作用力有范德华力、氢键,且主要是氢键。
②由于氢键具有方向性,
使四面体中心的每个水分子与4个相邻的水分子相互吸引。
③水分子以氢键相连接,含1 mol H2O的冰中,最多可形成 2 mol“氢键”
冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
结合冰的结构解释,为何水凝结成冰后密度减小?
→氢键具有方向性,迫使在四面体中心的水分子与位于四面体顶角的四个水分子吸引,水分子间留有相当大的空隙,空间利用率低,密度减小。
→当冰刚刚融化成液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,由于热运动加剧,分子间距离加大,密度逐渐减小。所以4℃时水的密度最大。
为什么水在4℃时的密度最大?
冰融化,分子间空隙减小
总结:分子晶体的结构特征
①分子间只有范德华力
→分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、O2
→分子非密堆积(每个分子周围紧邻的分子少于12个)
②分子间存在氢键
如:HF 、NH3、冰。
③分子晶体中存在单个分子,化学式代表真实的分子组成。
为什么干冰的熔沸点比冰低,而密度却比冰大?
由于干冰中的CO2之间只存在范德华力,一个分子周围有12个紧邻分子,∴密度比冰的高。
冰存在分子间氢键,CO2之间只存在范德华力,∴ 干冰的熔沸点比冰低。
干冰:密堆积
冰:非密堆积
1.下列属于分子晶体的一组物质是( )
A. CaO、NO、CO B. CCl4、H2O、He
C. CO2、SO2、NaCl D. CH4、O2、Na2O
B
2.下列分子晶体的熔、沸点由高到低的顺序是( )
①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2
A. ①②③④⑤⑥
B. ③②①⑤④⑥
C. ③②①④⑤⑥
D. ⑥⑤④③②①
C
3.干冰熔点很低是由于( )
A. CO2是非极性分子 B. C==O的键能很小
C. CO2化学性质不活泼 D. CO2分子间的作用力较弱
D
