2023-2024 人教版化学 九年级下册 第九单元 课题3 溶液的浓度 课件(共23张PPT)
文档属性
| 名称 | 2023-2024 人教版化学 九年级下册 第九单元 课题3 溶液的浓度 课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 438.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-25 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
课题3 溶液的浓度
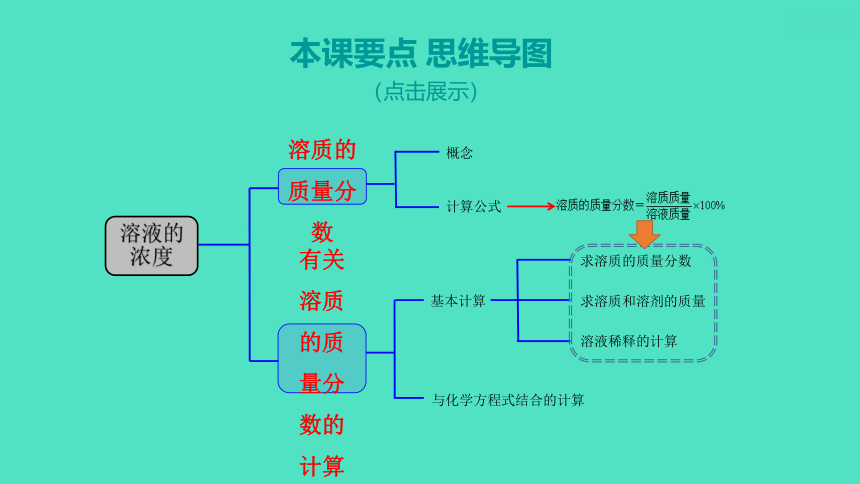
本课要点 思维导图
(点击展示)
溶液的浓度
溶质的质量分数
有关溶质的质量分数的计算
概念
基本计算
与化学方程式结合的计算
计算公式
求溶质的质量分数
求溶质和溶剂的质量
溶液稀释的计算
一、溶质质量分数
1.概念:溶液中______________与______________之比。
2.计算公式:
溶质质量分数=_________________
其中溶液的质量=______________+______________=溶液体积×溶液密度
基础·主干落实
溶质质量
溶液质量
溶质质量
溶剂质量
【漫画解读】 计算溶质质量分数的不变规律
(1)溶质质量是指溶解在溶剂中形成溶液的溶质质量,不包括未溶解或结晶析出的部分。
(2)溶质质量分数是质量之比,一般与温度无关。
(3)溶质质量分数是溶液浓度的定量表示,溶质质量分数越大,表示溶液越浓。
二、有关溶质质量分数的计算
1.已知溶质和溶剂的质量,求溶质质量分数:
依据:溶质质量分数的计算公式。
2.已知溶液的质量和溶质质量分数,求溶质和溶剂的质量:
(1)溶质的质量= __________________________。
(2)溶剂的质量=_________________________。
3.溶液稀释的相关计算:
依据:稀释前后________________不变。
溶液的质量×溶质质量分数
溶质的质量
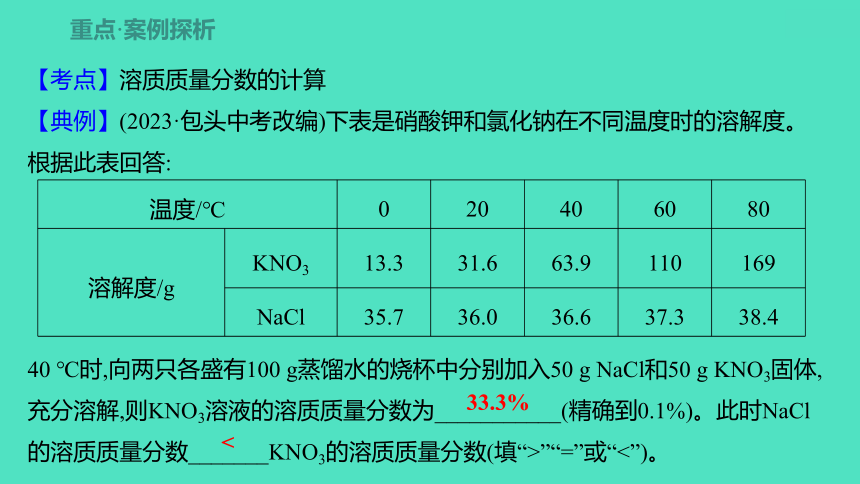
【考点】溶质质量分数的计算
【典例】(2023·包头中考改编)下表是硝酸钾和氯化钠在不同温度时的溶解度。根据此表回答:
40 ℃时,向两只各盛有100 g蒸馏水的烧杯中分别加入50 g NaCl和50 g KNO3固体,充分溶解,则KNO3溶液的溶质质量分数为___________(精确到0.1%)。此时NaCl的溶质质量分数_______KNO3的溶质质量分数(填“>”“=”或“<”)。
重点·案例探析
温度/℃ 0 20 40 60 80
溶解度/g KNO3 13.3 31.6 63.9 110 169
NaCl 35.7 36.0 36.6 37.3 38.4
33.3%
<
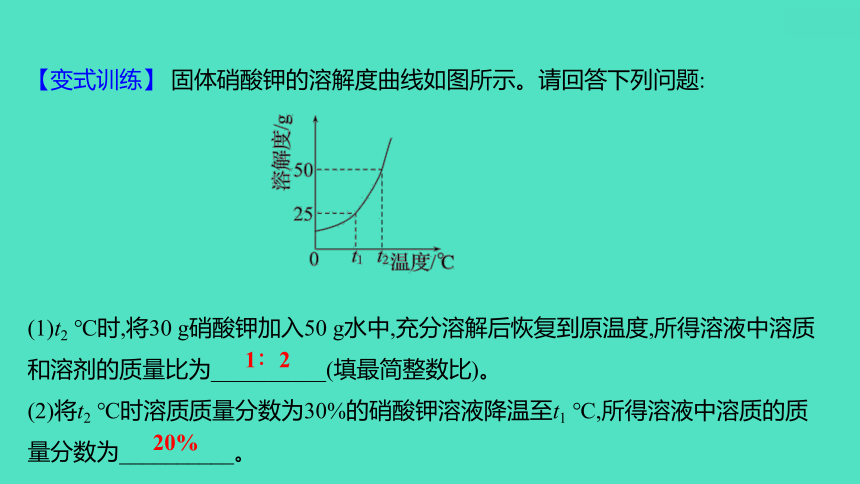
【变式训练】 固体硝酸钾的溶解度曲线如图所示。请回答下列问题:
(1)t2 ℃时,将30 g硝酸钾加入50 g水中,充分溶解后恢复到原温度,所得溶液中溶质和溶剂的质量比为__________(填最简整数比)。
(2)将t2 ℃时溶质质量分数为30%的硝酸钾溶液降温至t1 ℃,所得溶液中溶质的质量分数为__________。
1∶2
20%
【方法点拨】 溶质质量分数的计算方法
(1)溶质的质量、溶液的质量(或溶剂的质量)、溶质质量分数之间的换算,直接应用公式。
(2)溶液去水浓缩或加水稀释的计算,解此类题目抓住一点即可:浓缩或稀释前后溶质质量不变。
即m(浓)·w(浓)=m(稀)·w(稀)或m(浓)·w(浓)=[m(浓)+m(水)]·w(稀)
【A层 基础练】
【知识点1】溶质质量分数
1.用氯化钠固体和蒸馏水配制1 000 g 0.9%的氯化钠溶液,需要氯化钠的质量是( )
A.900 g B.90 g C.9 g D.0.9 g
2.5%的葡萄糖溶液可用于补充人体所需能量,“5%”不能表示( )
A.葡萄糖的质量分数
B.每100 g溶液中含5 g葡萄糖
C.葡萄糖的溶解度为5 g
D.葡萄糖与水的质量比为5∶95
素养·分层评价
C
C
3.(2023·重庆永川区质检)某溶液的溶质质量分数为20%,则下列质量比不正确的是( )
A.溶质∶溶剂=1∶4 B.溶质∶溶剂=1∶5
C.溶质∶溶液=1∶5 D.溶剂∶溶液=4∶5
B
4.(2022·金华中考)学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯中分别加入50 g、
25 g、5 g同种固体物质,充分溶解后,静置,现象如图所示。回答下列问题:
(1)小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是______________
__________;
(2)A、B、C三只烧杯中,溶液的溶质质量分数大小关系是____________。
A中有不溶解
的固体
A≥B>C
【知识点2】溶液的稀释与浓缩
5.硝酸钾可作为无土栽培的一种营养液。现将25%的硝酸钾溶液稀释成200 g 10%的溶液来用于培植营养液,则需加水( )
A.80 g B.300 g C.120 g D.100 g
C
6. 【建构模型】(2023·上海黄浦区期末)建立模型是解决问题的一种方法。甲是50 mL 10%的蔗糖溶液,其中“ ”表示所含的蔗糖分子。在该溶液中加入一定量的水,成为5%的蔗糖溶液。能表示稀释后蔗糖溶液模型的是( )
甲. A. B.
C. D.
B
7.(2023·株洲中考改编)化学实验室现有98%的浓硫酸,但在实验室中常需要用较稀的硫酸。要把100 g上述浓硫酸稀释成质量分数为5%~14%的硫酸。请计算:
(1)稀释后的溶液中溶质的质量是_________。
(2)至少需要水的质量是__________。
98 g
600 g
【易错点】不能正确分析溶质质量分数的变化
8.将50 ℃时一定质量的饱和硝酸钾溶液(不含结晶)分别进行如下实验后,所得结论正确的是_______。
A.升温至60 ℃时,溶液中溶质质量分数不变
B.降温至40 ℃时,溶液中溶质质量分数不变
C.保持温度不变,蒸发10 g水后,溶液中溶质质量分数减小
D.保持温度不变,加入10 g硝酸钾后,溶液中溶质质量分数增大
A
【易错点拨】 溶质质量分数的变化规律
1.温度改变
①若无溶质析出,则溶质质量分数不变;
②若有溶质析出,则溶质质量分数减小。
2.温度不变
①向饱和溶液中加该溶质,溶质质量分数不变;
②饱和溶液蒸发溶剂,溶质质量分数不变。
【B层 能力练】
9.(2022·杭州中考)40 ℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量
B.溶质的质量
C.溶液中溶质的质量分数
D.食盐的溶解度
D
10.(2023·安徽中考)煤化工废水中含有NaCl、Na2SO4、NaNO3,这三种盐的溶解度曲线如图所示。下列有关说法正确的是( )
A.与NaNO3相比,NaCl更适合通过饱和溶液降温结晶得到
B.a1 ℃时,NaNO3的饱和溶液,溶质的质量分数为80%
C.a2 ℃时,NaCl和Na2SO4的饱和溶液,溶质质量分数相等
D.40 ℃时,Na2SO4的饱和溶液,升温到60 ℃变为不饱和溶液
C
11.(2023·自贡中考)如图1为某兴趣小组用硝酸钾进行的系列实验,图2为硝酸钾溶解度与温度的关系。
(1)B中溶液为__________(填“饱和”或“不饱和”)溶液。
(2)C中固体__________(填“增加”或“减少”)。
(3)D中________(填“有”或“无”)固体。
(4)E中溶液的溶质质量分数为__________。
饱和
增加
无
25%
12.将300 g溶质质量分数为10%的硝酸钾溶液分成等质量的三份。
(1)在第1份溶液中再溶解5 g硝酸钾固体,所得溶液的溶质质量分数为__________。(精确到0.1%,下同)
(2)在第2份溶液中加入20 g水,所得溶液的溶质质量分数为__________。
(3)在第3份溶液中再溶解5 g氯化钠固体,所得溶液中氯化钠的质量分数为
__________,硝酸钾的质量分数为__________。
14.3%
8.3%
4.8%
9.5%
课题3 溶液的浓度
本课要点 思维导图
(点击展示)
溶液的浓度
溶质的质量分数
有关溶质的质量分数的计算
概念
基本计算
与化学方程式结合的计算
计算公式
求溶质的质量分数
求溶质和溶剂的质量
溶液稀释的计算
一、溶质质量分数
1.概念:溶液中______________与______________之比。
2.计算公式:
溶质质量分数=_________________
其中溶液的质量=______________+______________=溶液体积×溶液密度
基础·主干落实
溶质质量
溶液质量
溶质质量
溶剂质量
【漫画解读】 计算溶质质量分数的不变规律
(1)溶质质量是指溶解在溶剂中形成溶液的溶质质量,不包括未溶解或结晶析出的部分。
(2)溶质质量分数是质量之比,一般与温度无关。
(3)溶质质量分数是溶液浓度的定量表示,溶质质量分数越大,表示溶液越浓。
二、有关溶质质量分数的计算
1.已知溶质和溶剂的质量,求溶质质量分数:
依据:溶质质量分数的计算公式。
2.已知溶液的质量和溶质质量分数,求溶质和溶剂的质量:
(1)溶质的质量= __________________________。
(2)溶剂的质量=_________________________。
3.溶液稀释的相关计算:
依据:稀释前后________________不变。
溶液的质量×溶质质量分数
溶质的质量
【考点】溶质质量分数的计算
【典例】(2023·包头中考改编)下表是硝酸钾和氯化钠在不同温度时的溶解度。根据此表回答:
40 ℃时,向两只各盛有100 g蒸馏水的烧杯中分别加入50 g NaCl和50 g KNO3固体,充分溶解,则KNO3溶液的溶质质量分数为___________(精确到0.1%)。此时NaCl的溶质质量分数_______KNO3的溶质质量分数(填“>”“=”或“<”)。
重点·案例探析
温度/℃ 0 20 40 60 80
溶解度/g KNO3 13.3 31.6 63.9 110 169
NaCl 35.7 36.0 36.6 37.3 38.4
33.3%
<
【变式训练】 固体硝酸钾的溶解度曲线如图所示。请回答下列问题:
(1)t2 ℃时,将30 g硝酸钾加入50 g水中,充分溶解后恢复到原温度,所得溶液中溶质和溶剂的质量比为__________(填最简整数比)。
(2)将t2 ℃时溶质质量分数为30%的硝酸钾溶液降温至t1 ℃,所得溶液中溶质的质量分数为__________。
1∶2
20%
【方法点拨】 溶质质量分数的计算方法
(1)溶质的质量、溶液的质量(或溶剂的质量)、溶质质量分数之间的换算,直接应用公式。
(2)溶液去水浓缩或加水稀释的计算,解此类题目抓住一点即可:浓缩或稀释前后溶质质量不变。
即m(浓)·w(浓)=m(稀)·w(稀)或m(浓)·w(浓)=[m(浓)+m(水)]·w(稀)
【A层 基础练】
【知识点1】溶质质量分数
1.用氯化钠固体和蒸馏水配制1 000 g 0.9%的氯化钠溶液,需要氯化钠的质量是( )
A.900 g B.90 g C.9 g D.0.9 g
2.5%的葡萄糖溶液可用于补充人体所需能量,“5%”不能表示( )
A.葡萄糖的质量分数
B.每100 g溶液中含5 g葡萄糖
C.葡萄糖的溶解度为5 g
D.葡萄糖与水的质量比为5∶95
素养·分层评价
C
C
3.(2023·重庆永川区质检)某溶液的溶质质量分数为20%,则下列质量比不正确的是( )
A.溶质∶溶剂=1∶4 B.溶质∶溶剂=1∶5
C.溶质∶溶液=1∶5 D.溶剂∶溶液=4∶5
B
4.(2022·金华中考)学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯中分别加入50 g、
25 g、5 g同种固体物质,充分溶解后,静置,现象如图所示。回答下列问题:
(1)小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是______________
__________;
(2)A、B、C三只烧杯中,溶液的溶质质量分数大小关系是____________。
A中有不溶解
的固体
A≥B>C
【知识点2】溶液的稀释与浓缩
5.硝酸钾可作为无土栽培的一种营养液。现将25%的硝酸钾溶液稀释成200 g 10%的溶液来用于培植营养液,则需加水( )
A.80 g B.300 g C.120 g D.100 g
C
6. 【建构模型】(2023·上海黄浦区期末)建立模型是解决问题的一种方法。甲是50 mL 10%的蔗糖溶液,其中“ ”表示所含的蔗糖分子。在该溶液中加入一定量的水,成为5%的蔗糖溶液。能表示稀释后蔗糖溶液模型的是( )
甲. A. B.
C. D.
B
7.(2023·株洲中考改编)化学实验室现有98%的浓硫酸,但在实验室中常需要用较稀的硫酸。要把100 g上述浓硫酸稀释成质量分数为5%~14%的硫酸。请计算:
(1)稀释后的溶液中溶质的质量是_________。
(2)至少需要水的质量是__________。
98 g
600 g
【易错点】不能正确分析溶质质量分数的变化
8.将50 ℃时一定质量的饱和硝酸钾溶液(不含结晶)分别进行如下实验后,所得结论正确的是_______。
A.升温至60 ℃时,溶液中溶质质量分数不变
B.降温至40 ℃时,溶液中溶质质量分数不变
C.保持温度不变,蒸发10 g水后,溶液中溶质质量分数减小
D.保持温度不变,加入10 g硝酸钾后,溶液中溶质质量分数增大
A
【易错点拨】 溶质质量分数的变化规律
1.温度改变
①若无溶质析出,则溶质质量分数不变;
②若有溶质析出,则溶质质量分数减小。
2.温度不变
①向饱和溶液中加该溶质,溶质质量分数不变;
②饱和溶液蒸发溶剂,溶质质量分数不变。
【B层 能力练】
9.(2022·杭州中考)40 ℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量
B.溶质的质量
C.溶液中溶质的质量分数
D.食盐的溶解度
D
10.(2023·安徽中考)煤化工废水中含有NaCl、Na2SO4、NaNO3,这三种盐的溶解度曲线如图所示。下列有关说法正确的是( )
A.与NaNO3相比,NaCl更适合通过饱和溶液降温结晶得到
B.a1 ℃时,NaNO3的饱和溶液,溶质的质量分数为80%
C.a2 ℃时,NaCl和Na2SO4的饱和溶液,溶质质量分数相等
D.40 ℃时,Na2SO4的饱和溶液,升温到60 ℃变为不饱和溶液
C
11.(2023·自贡中考)如图1为某兴趣小组用硝酸钾进行的系列实验,图2为硝酸钾溶解度与温度的关系。
(1)B中溶液为__________(填“饱和”或“不饱和”)溶液。
(2)C中固体__________(填“增加”或“减少”)。
(3)D中________(填“有”或“无”)固体。
(4)E中溶液的溶质质量分数为__________。
饱和
增加
无
25%
12.将300 g溶质质量分数为10%的硝酸钾溶液分成等质量的三份。
(1)在第1份溶液中再溶解5 g硝酸钾固体,所得溶液的溶质质量分数为__________。(精确到0.1%,下同)
(2)在第2份溶液中加入20 g水,所得溶液的溶质质量分数为__________。
(3)在第3份溶液中再溶解5 g氯化钠固体,所得溶液中氯化钠的质量分数为
__________,硝酸钾的质量分数为__________。
14.3%
8.3%
4.8%
9.5%
同课章节目录
