化学人教版(2019)选择性必修2 2.2分子的空间结构(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.2分子的空间结构(共17张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-25 09:03:07 | ||
图片预览




文档简介
(共17张PPT)
第二节 分子的空间结构
学习内容
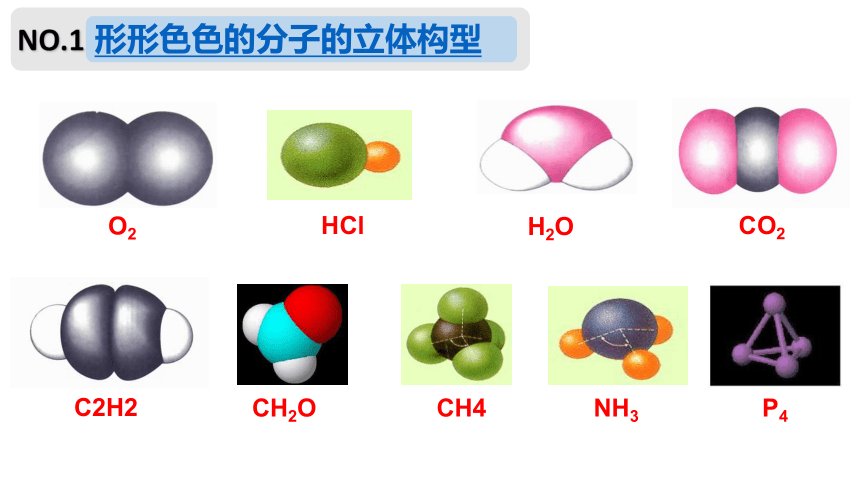
形形色色的分子的立体构型
NO.1
ABn型分子立体构型的判定方法
NO.2
O2
HCl
H2O
CO2
C2H2
CH2O
NH3
P4
CH4
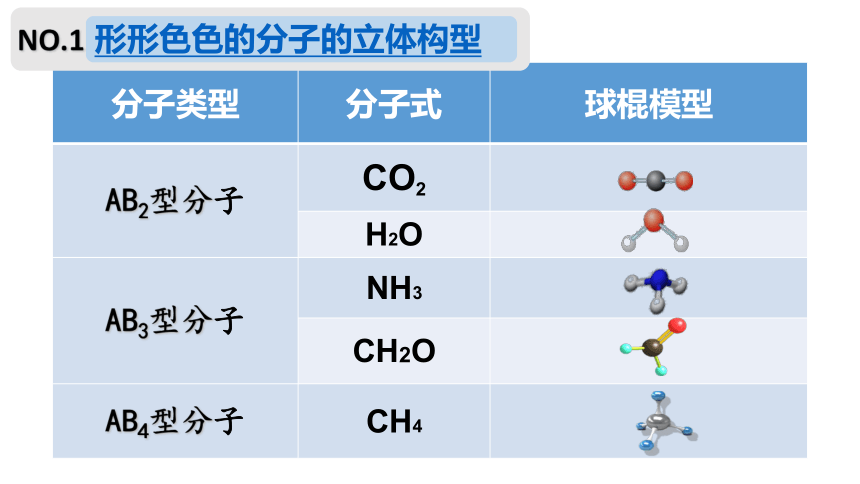
形形色色的分子的立体构型
NO.1
分子类型 分子式 球棍模型
AB2型分子 CO2
H2O
AB3型分子 NH3
CH2O
AB4型分子 CH4
形形色色的分子的立体构型
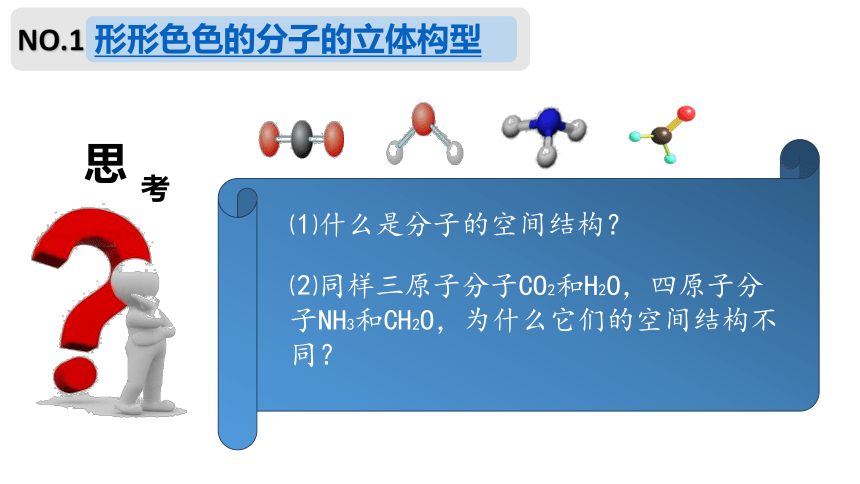
NO.1
⑵同样三原子分子CO2和H2O,四原子分子NH3和CH2O,为什么它们的空间结构不同?
⑴什么是分子的空间结构?
考
思
讨论交流
1、写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;
3、根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的分子结构。
2、讨论H、C、N、O原子分别可以形成几个共价键;
形形色色的分子的立体构型
NO.1
形形色色的分子的立体构型
NO.1
讨论交流
1、写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;
3、根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的分子结构。
2、讨论H、C、N、O原子分别可以形成几个共价键;
H—C=O
讨论交流
1、写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;
分子式 电子式 结构式
CO2
H2O
NH3
CH4
CH2O
形形色色的分子的立体构型
NO.1
讨论交流
2、讨论H、C、N、O原子分别可以形成几个共价键;
3、根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的分子结构。
1
4
3
2
ABn型分子立体构型的判定方法
NO.2
分子式 球棍模型 电子式
CO2
H2O
NH3
CH4
CH2O
形形色色的分子的立体构型
NO.1
模型研究
CO2、H2O、NH3、CH2O、CH4的球棍模型 ,对照其电子式云内分类对比的方法,分析结构不同的原因。
测分子体结构:红外光谱仪→吸收峰→分析
法一:红外光谱仪
测分子体结构:红外光谱仪→吸收峰→分析
法一:红外光谱仪
法二:
如果没有仪器可否根据相关理论对分子立体构型进行预测呢?
中心原子价层电子对互斥理论
ABn型分子立体构型的判定方法
NO.2
包括_________电子对和__________的孤电子对
ABn型分子或离子的空间构型主要由中心原子(A)的价层电子对的空间构型决定,中心原子(A)的价层电子对的相互排斥作用,使分子的几何构型总是采取电子对相互排斥最小的那种构型存在,即分子尽可能采取对称的空间构型。
中心原子:
形成化学键最多的原子。
中心原子价层电子对:
δ键
未成键
内容
ABn型分子立体构型的判定方法
NO.2
ABn型分子立体构型的判定方法
NO.2
价层电子对 =δ键电子对 + 中心原子上的孤电子对
δ键电子对 = 与中心原子结合的原子数
中心原子上的孤电子对 = (a -xb)/2
如何确定中心原子价层电子对数?
为与中心原子结合的原子数(成键原子数)
X:
为与中心原子结合的原子(成键原子)最多能接受的电子数
(除H为1,其他原子为“8-该原子的最外层电子数)
b:
中心原子的价电子数
对于阳离子: a为中心原子的价电子数 - 离子的电荷数
对于阴离子: a为中心原子 的价电子数 + 离子的电荷数
a:
中心原子孤电子对的计算: (a-xb)/2
分子或离子 中心 原子 a x b 孤电子 对数 价层电
子对数
SO2 S
NH4+ N
CO32- C
1
0
0
6
1
3
由价层电子对的相互排斥,得到可能含有孤电子对的VSEPR模型即价层电子对在核外空间运动的轮廓图!
2
2
5-1=4
4
4+2=6
2
3
4
3
价层电子对互斥模型——中心原子上的价电子都用于形成共价键
例:CO2、CH2O、CH4等分子中的C原子。它们的立体结构可用中心原子周围的原子数来预测
分子类型 分子式 球棍模型 立体结构
AB2型分子 CO2 直线型
AB3型分子 CH2O 平面三角形
AB4型分子 CH4 正四面体形
ABn型分子立体构型的判定方法
NO.2
价层电子对互斥模型——中心原子上的价电子都用于形成共价键
例:CO2、CH2O、CH4等分子中的C原子。它们的立体结构可用中心原子周围的原子数来预测
分子类型 分子式 球棍模型 立体结构
AB2型分子 CO2 直线型
AB3型分子 CH2O 平面三角形
AB4型分子 CH4 正四面体形
ABn型分子立体构型的判定方法
NO.2
价层电子对互斥模型——中心原子上有孤对电子(未用于形成共价键的电子对)的分子
例:H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。因而H2O分子呈V型,NH3分子呈三角锥型。
ABn型分子立体构型的判定方法
NO.2
化学式 中心原子含有孤对电子对数 中心原子结合的原子数 空间构型
H2S 2 2 V形
NH2- 2 2 V形
BF3 0 3 正三角形
CHCl3 0 4 四面体
SiF4 0 4 正四面体
运用
例:应用VSEPR理论判断下表中分子或离子的构型。进一步认识多原子分子的立体结构。
ABn型分子立体构型的判定方法
NO.2
谢 谢 聆 听
第二节 分子的空间结构
学习内容
形形色色的分子的立体构型
NO.1
ABn型分子立体构型的判定方法
NO.2
O2
HCl
H2O
CO2
C2H2
CH2O
NH3
P4
CH4
形形色色的分子的立体构型
NO.1
分子类型 分子式 球棍模型
AB2型分子 CO2
H2O
AB3型分子 NH3
CH2O
AB4型分子 CH4
形形色色的分子的立体构型
NO.1
⑵同样三原子分子CO2和H2O,四原子分子NH3和CH2O,为什么它们的空间结构不同?
⑴什么是分子的空间结构?
考
思
讨论交流
1、写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;
3、根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的分子结构。
2、讨论H、C、N、O原子分别可以形成几个共价键;
形形色色的分子的立体构型
NO.1
形形色色的分子的立体构型
NO.1
讨论交流
1、写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;
3、根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的分子结构。
2、讨论H、C、N、O原子分别可以形成几个共价键;
H—C=O
讨论交流
1、写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;
分子式 电子式 结构式
CO2
H2O
NH3
CH4
CH2O
形形色色的分子的立体构型
NO.1
讨论交流
2、讨论H、C、N、O原子分别可以形成几个共价键;
3、根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的分子结构。
1
4
3
2
ABn型分子立体构型的判定方法
NO.2
分子式 球棍模型 电子式
CO2
H2O
NH3
CH4
CH2O
形形色色的分子的立体构型
NO.1
模型研究
CO2、H2O、NH3、CH2O、CH4的球棍模型 ,对照其电子式云内分类对比的方法,分析结构不同的原因。
测分子体结构:红外光谱仪→吸收峰→分析
法一:红外光谱仪
测分子体结构:红外光谱仪→吸收峰→分析
法一:红外光谱仪
法二:
如果没有仪器可否根据相关理论对分子立体构型进行预测呢?
中心原子价层电子对互斥理论
ABn型分子立体构型的判定方法
NO.2
包括_________电子对和__________的孤电子对
ABn型分子或离子的空间构型主要由中心原子(A)的价层电子对的空间构型决定,中心原子(A)的价层电子对的相互排斥作用,使分子的几何构型总是采取电子对相互排斥最小的那种构型存在,即分子尽可能采取对称的空间构型。
中心原子:
形成化学键最多的原子。
中心原子价层电子对:
δ键
未成键
内容
ABn型分子立体构型的判定方法
NO.2
ABn型分子立体构型的判定方法
NO.2
价层电子对 =δ键电子对 + 中心原子上的孤电子对
δ键电子对 = 与中心原子结合的原子数
中心原子上的孤电子对 = (a -xb)/2
如何确定中心原子价层电子对数?
为与中心原子结合的原子数(成键原子数)
X:
为与中心原子结合的原子(成键原子)最多能接受的电子数
(除H为1,其他原子为“8-该原子的最外层电子数)
b:
中心原子的价电子数
对于阳离子: a为中心原子的价电子数 - 离子的电荷数
对于阴离子: a为中心原子 的价电子数 + 离子的电荷数
a:
中心原子孤电子对的计算: (a-xb)/2
分子或离子 中心 原子 a x b 孤电子 对数 价层电
子对数
SO2 S
NH4+ N
CO32- C
1
0
0
6
1
3
由价层电子对的相互排斥,得到可能含有孤电子对的VSEPR模型即价层电子对在核外空间运动的轮廓图!
2
2
5-1=4
4
4+2=6
2
3
4
3
价层电子对互斥模型——中心原子上的价电子都用于形成共价键
例:CO2、CH2O、CH4等分子中的C原子。它们的立体结构可用中心原子周围的原子数来预测
分子类型 分子式 球棍模型 立体结构
AB2型分子 CO2 直线型
AB3型分子 CH2O 平面三角形
AB4型分子 CH4 正四面体形
ABn型分子立体构型的判定方法
NO.2
价层电子对互斥模型——中心原子上的价电子都用于形成共价键
例:CO2、CH2O、CH4等分子中的C原子。它们的立体结构可用中心原子周围的原子数来预测
分子类型 分子式 球棍模型 立体结构
AB2型分子 CO2 直线型
AB3型分子 CH2O 平面三角形
AB4型分子 CH4 正四面体形
ABn型分子立体构型的判定方法
NO.2
价层电子对互斥模型——中心原子上有孤对电子(未用于形成共价键的电子对)的分子
例:H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。因而H2O分子呈V型,NH3分子呈三角锥型。
ABn型分子立体构型的判定方法
NO.2
化学式 中心原子含有孤对电子对数 中心原子结合的原子数 空间构型
H2S 2 2 V形
NH2- 2 2 V形
BF3 0 3 正三角形
CHCl3 0 4 四面体
SiF4 0 4 正四面体
运用
例:应用VSEPR理论判断下表中分子或离子的构型。进一步认识多原子分子的立体结构。
ABn型分子立体构型的判定方法
NO.2
谢 谢 聆 听
