1.2离子反应课件(共23张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2离子反应课件(共23张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-25 13:58:16 | ||
图片预览






文档简介
(共23张PPT)
离子反应
人教版/必修一
第1章物质及其变化
目 录
电离的定义
电离方程式的书写
酸碱盐的电离
电解质和非电解质
巩固练习
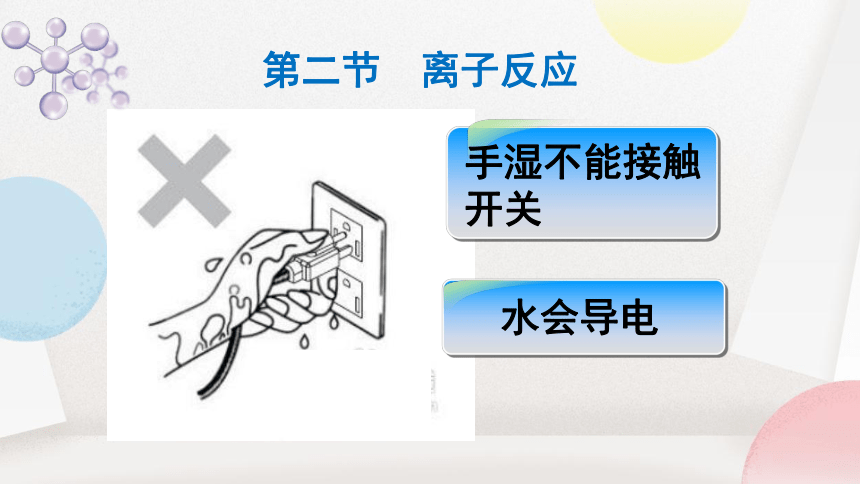
第二节 离子反应
水会导电
手湿不能接触
开关
NaCl加入水中
水分子与NaCl
晶体作用
NaCl溶液并电离
NaCl溶于水微观示意图
水分子
氯离子
钠离子
电离
物质溶于水
离解成自由
移动的离子
溶液中存在
自由移动的
离子
溶液导电?
思考与交流
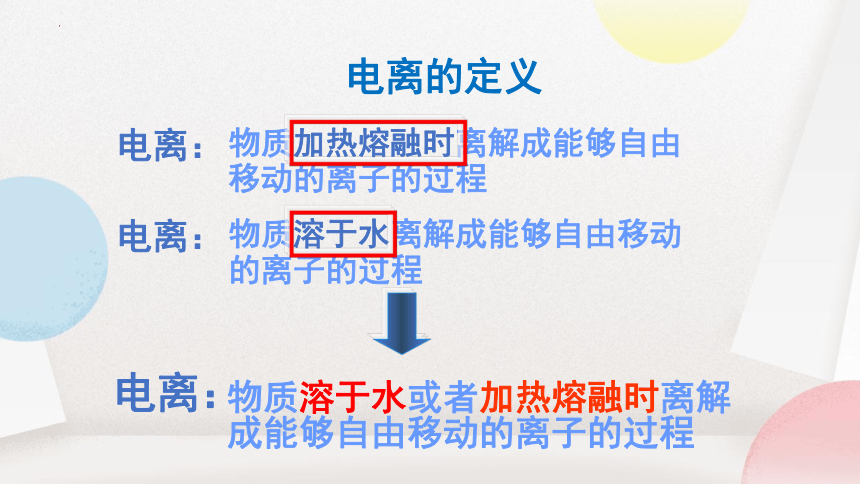
电离的定义
电离:
物质加热熔融时离解成能够自由
移动的离子的过程
电离:
物质溶于水离解成能够自由移动
的离子的过程
电离:
物质溶于水或者加热熔融时离解
成能够自由移动的离子的过程
溶液导电性实验
0.5mol/L盐酸 0.5mol/L氨水 0.5mol/L醋酸 0.5mol/L NaCl
亮
暗
暗
亮
为什么有些灯泡亮了?
有些灯泡没有亮?
导电性实验
溶液导电?
在水溶液(或
熔融状态)电
离出自由移动
的离子
溶液不导电?
在水溶液(或
熔融状态)没
有电离出自由
移动的离子
导电性实验
电解质与非电解质
电解质
在水溶液或熔融状态下能导电的
化合物,称为电解质。
非电解质
在水溶液和熔融状态下都不能导电
的化合物,称为电解质。
物质
混合物
纯净物
单质
化合物
酸
氧化物
碱
盐
电解质与非电解质
电解质
非电解质
电解质与非电解质
物质 铜 CO2 98% H2SO4 KNO3 (NH4)2SO4
是否为电解质
既不是电解质也不是非电解质
非电解质
既不是电解质也不是非电解质
电解质
电解质
电解质与非电解质判断的前提:
必须是化合物
必须是自身电离
电解质与非电解质
电解质与非电解质
下列物质哪些是电解质,
哪些是非电解质?
①铁 ②KCL固体 ③ H2C2O4
④20% HCl ⑤酒精 ⑥ 氢氧化铜
⑦熔融氯化钠 ⑧H2S
非电解质:⑤⑧
电解质:②③⑥⑦
既不是电解质也不是非电解质:①④⑤
答案
电离方程式
NaCl → Na+ + Cl-
NaCl = Na+ + Cl-
电离方程式:
用化学式和离子符号表示电离过程的式子
酸、碱、盐的电离
HCl = + Cl-
H2SO4 = + SO42-
H+
2H+
酸:电离时生成的阳离子全部都是H+的化
合物
NaOH = Na++
KOH = K+ +
OH-
OH-
碱:电离时生成的阴离子全部都是OH-的化合物
酸、碱、盐的电离
KCl = K+ + Cl-
Na2SO4 = 2Na+ + SO42-
盐:电离生成的阳离子是金属离子
阴离子是酸根离子的化合物
酸、碱、盐的电离
NH4Cl = NH4+ + Cl-
注意:铵盐是例外
盐:电离生成的阳离子是金属离子(NH4+)阴离子是酸根离子的化合物
酸、碱、盐的电离
酸
碱
盐
电离时生成的阳离子全部是H+的化合物
酸、碱、盐的定义
电离时生成的阴离子全部是OH-的化合物
电离生成的阳离子是金属离子或
(NH4+)阴离子是酸根离子的化合物
科普视频:醋酸的电离
课堂训练
下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是
A.MnO4-, K+, Na+, SO42-
B.Na+, K+, HCO3-, CI-
C.Mg2+, NH+, Cl-, NO3-,
D.Ba2+, K+, S2-, SO42-
课堂训练
与量有关的离子反应方程式的书写
(1)向硫酸氢钠溶液中,逐滴加入氢氧化钡溶液至中性,写出反应的离子方程式。
Ba2++ 20H- +2H+ +SO42-=BaSO4↓+2H2O
(2)向(1)的溶液中,继续滴入氢氧化钡溶液,写出此反应的离子方程式Ba2++ SO42-=BaSO4↓
离子反应
人教版/必修一
第1章物质及其变化
目 录
电离的定义
电离方程式的书写
酸碱盐的电离
电解质和非电解质
巩固练习
第二节 离子反应
水会导电
手湿不能接触
开关
NaCl加入水中
水分子与NaCl
晶体作用
NaCl溶液并电离
NaCl溶于水微观示意图
水分子
氯离子
钠离子
电离
物质溶于水
离解成自由
移动的离子
溶液中存在
自由移动的
离子
溶液导电?
思考与交流
电离的定义
电离:
物质加热熔融时离解成能够自由
移动的离子的过程
电离:
物质溶于水离解成能够自由移动
的离子的过程
电离:
物质溶于水或者加热熔融时离解
成能够自由移动的离子的过程
溶液导电性实验
0.5mol/L盐酸 0.5mol/L氨水 0.5mol/L醋酸 0.5mol/L NaCl
亮
暗
暗
亮
为什么有些灯泡亮了?
有些灯泡没有亮?
导电性实验
溶液导电?
在水溶液(或
熔融状态)电
离出自由移动
的离子
溶液不导电?
在水溶液(或
熔融状态)没
有电离出自由
移动的离子
导电性实验
电解质与非电解质
电解质
在水溶液或熔融状态下能导电的
化合物,称为电解质。
非电解质
在水溶液和熔融状态下都不能导电
的化合物,称为电解质。
物质
混合物
纯净物
单质
化合物
酸
氧化物
碱
盐
电解质与非电解质
电解质
非电解质
电解质与非电解质
物质 铜 CO2 98% H2SO4 KNO3 (NH4)2SO4
是否为电解质
既不是电解质也不是非电解质
非电解质
既不是电解质也不是非电解质
电解质
电解质
电解质与非电解质判断的前提:
必须是化合物
必须是自身电离
电解质与非电解质
电解质与非电解质
下列物质哪些是电解质,
哪些是非电解质?
①铁 ②KCL固体 ③ H2C2O4
④20% HCl ⑤酒精 ⑥ 氢氧化铜
⑦熔融氯化钠 ⑧H2S
非电解质:⑤⑧
电解质:②③⑥⑦
既不是电解质也不是非电解质:①④⑤
答案
电离方程式
NaCl → Na+ + Cl-
NaCl = Na+ + Cl-
电离方程式:
用化学式和离子符号表示电离过程的式子
酸、碱、盐的电离
HCl = + Cl-
H2SO4 = + SO42-
H+
2H+
酸:电离时生成的阳离子全部都是H+的化
合物
NaOH = Na++
KOH = K+ +
OH-
OH-
碱:电离时生成的阴离子全部都是OH-的化合物
酸、碱、盐的电离
KCl = K+ + Cl-
Na2SO4 = 2Na+ + SO42-
盐:电离生成的阳离子是金属离子
阴离子是酸根离子的化合物
酸、碱、盐的电离
NH4Cl = NH4+ + Cl-
注意:铵盐是例外
盐:电离生成的阳离子是金属离子(NH4+)阴离子是酸根离子的化合物
酸、碱、盐的电离
酸
碱
盐
电离时生成的阳离子全部是H+的化合物
酸、碱、盐的定义
电离时生成的阴离子全部是OH-的化合物
电离生成的阳离子是金属离子或
(NH4+)阴离子是酸根离子的化合物
科普视频:醋酸的电离
课堂训练
下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是
A.MnO4-, K+, Na+, SO42-
B.Na+, K+, HCO3-, CI-
C.Mg2+, NH+, Cl-, NO3-,
D.Ba2+, K+, S2-, SO42-
课堂训练
与量有关的离子反应方程式的书写
(1)向硫酸氢钠溶液中,逐滴加入氢氧化钡溶液至中性,写出反应的离子方程式。
Ba2++ 20H- +2H+ +SO42-=BaSO4↓+2H2O
(2)向(1)的溶液中,继续滴入氢氧化钡溶液,写出此反应的离子方程式Ba2++ SO42-=BaSO4↓
