6.2 化学反应的限度与速率 课时测验(含解析) 2023-2024学年高一下学期人教版(2019)必修第二册
文档属性
| 名称 | 6.2 化学反应的限度与速率 课时测验(含解析) 2023-2024学年高一下学期人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 465.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-25 15:21:56 | ||
图片预览



文档简介
6.2 化学反应的限度与速率 课时测验
一、单选题
1.在一密闭容器中,反应达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原平衡时的60%,则( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增大了 D.
2.化学与生产、生活密切相关。下列事实与化学反应速率无关的是( )
A.食品、蔬菜贮存在冰箱或冰柜里
B.家用铁锅、铁铲等餐具保持干燥
C.制造蜂窝煤时加入生石灰
D.把块状煤碾成粉状再燃烧
3.下列措施对加快反应速率有明显效果的是( )
A.Na与水反应时,增加水的用量
B.Al与稀硫酸反应制取H2时,改用浓硫酸
C.Na2SO4与BaCl2两种溶液反应时,增大压强
D.大理石和盐酸反应制取CO2时,将块状大理石改为粉末状
4.对于在一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.升高温度 B.增大压强
C.减小反应物浓度 D.增大反应物浓度
5.一定条件下反应2SO2(g)+O2(g)2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为( )
A.v(O2)=0.03mol·L-1·s-1 B.v(O2)=0.3mol·L-1·s-1
C.v(SO2)=0.03mol·L-1·s-1 D.v(SO3)=0.03mol·L-1·s-1
6.把在空气中久置的铝片5.0g投入盛有50mL 0.1mol L﹣1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡
D.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降
7.反应:A(气)+3B(气) 2C(气)△H<0达平衡后,将气体混合物的温度降低.下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
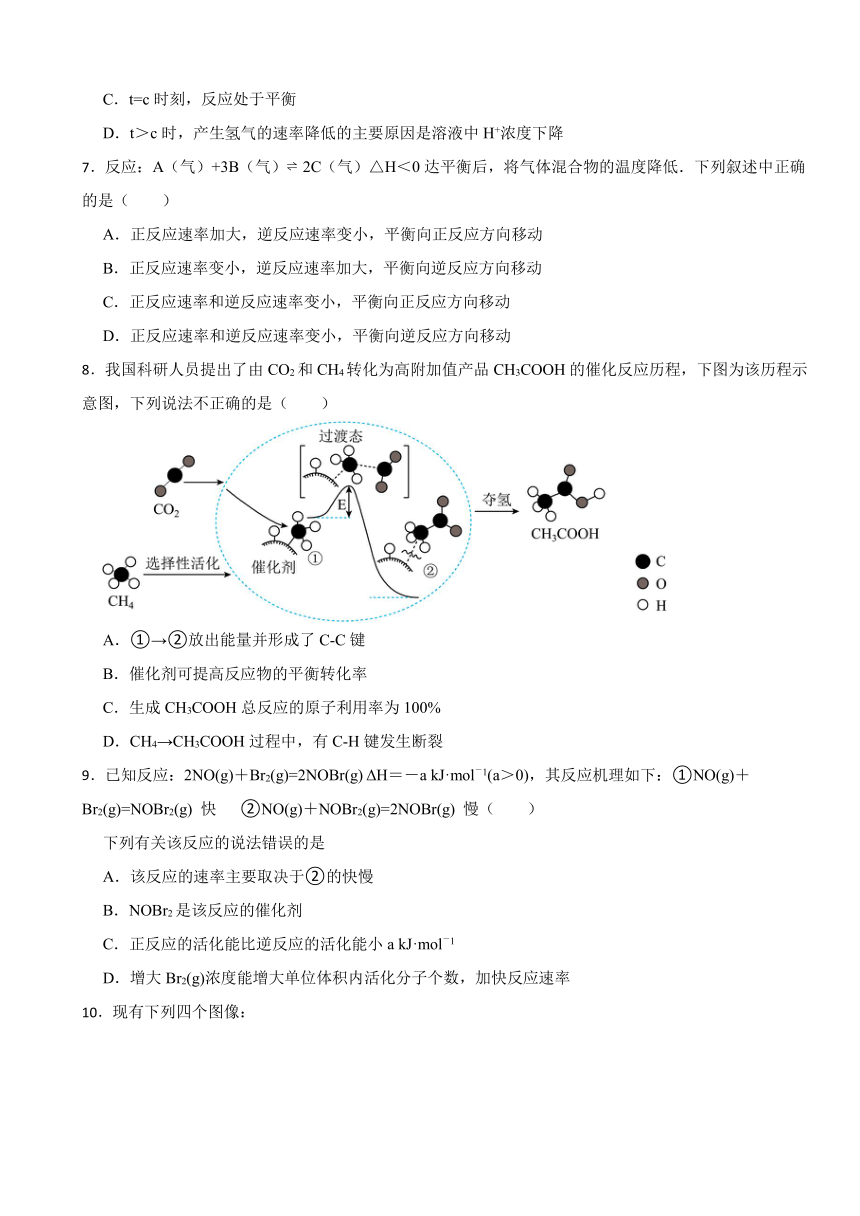
8.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,下图为该历程示意图,下列说法不正确的是( )
A.①→②放出能量并形成了C-C键
B.催化剂可提高反应物的平衡转化率
C.生成CH3COOH总反应的原子利用率为100%
D.CH4→CH3COOH过程中,有C-H键发生断裂
9.已知反应:2NO(g)+Br2(g)=2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下:①NO(g)+Br2(g)=NOBr2(g) 快 ②NO(g)+NOBr2(g)=2NOBr(g) 慢( )
下列有关该反应的说法错误的是
A.该反应的速率主要取决于②的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2(g)浓度能增大单位体积内活化分子个数,加快反应速率
10.现有下列四个图像:
下列反应中全部符合上述图像的反应是( )
A.N2(g)+3H2(g) 2NH3(g)△H1<0
B.2SO3(g) 2SO2(g)+O2(g)△H2>0
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H3<0
D.H2(g)+CO(g) C(s)+H2O(g)△H4>0
11.右图曲线a表示放热反应 2X(g)+Y(g) 2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.加催化剂 B.加大X的投入量
C.升高温度 D.增大体积
12.已知次氯酸是比碳酸还弱的酸,反应:达平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体 B.固体 C.NaOH固体 D.固体
13.下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是( )
A.升高温度 B.用Zn粉代替Zn粒
C.滴加少量的CuSO4溶液 D.改用0.1mol/LH2SO4与Zn反应
14.关于反应速率、反应限度的下列说法中错误的是( )
A.其他条件不变时,升高温度,化学反应速率加快
B.其他条件不变时,增大浓度,化学反应速率加快
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,同一物质的正反应速率与逆反应速率相等
15.溴水与甲酸可以发生如下反应:。生成二氧化碳的初始速率与反应物起始浓度的关系如下:
实验序号 开始浓度/ 初始速率/()
1 0.01 0.02
2 0.02 0.04
3 0.03 0.02
现将的溴水和的溶液等体积混合,此时生成二氧化碳的初始速率()应为( )
A. B. C. D.
16.对于碳酸钙分解反应:CaCO3(s)CaO(s)+CO2(g),最不利于其自发进行的是( )
A.低温低压 B.低温高压 C.高温高压 D.高温低压
17.常温下,向某容积为1L的恒容密闭容器中通入和,发生应:。反应后,测得容器中剩余0.06mol,则下列反应速率的表达正确的是( )
A. B.
C. D.
18.一定条件下,在体积为2L的密闭容器中,3molX和3molY发生反应:3X(g)+Y(g)2Z(g) ΔH>0,经60s达到平衡,生成0.4molZ。下列说法正确的是( )
A.60s内平均反应速率v(X)=0.05mol/(L·s)
B.其他条件不变,升高温度,正反应速率增大,逆反应速率减小
C.其他条件不变,若初始投入2molX和2molY,则物质Y的转化率减小
D.其他条件不变,将容器体积变为4L,Z的平衡浓度变为原来的一半
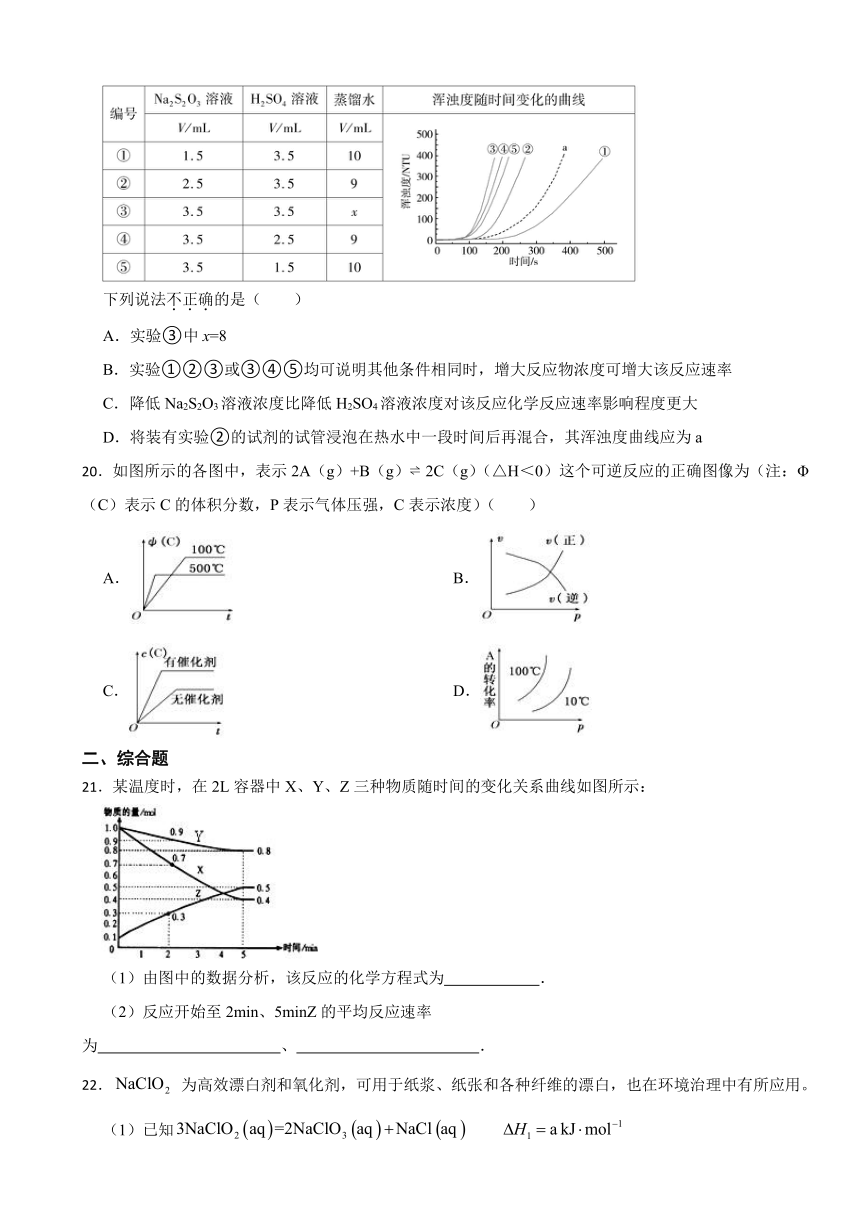
19.室温下,用0.1 mol·L-1Na2S2O3溶液、0.1 mol·L-1H2SO4溶液和蒸馏水进行如下表所示的5个实验,分别测量浑浊度随时间的变化。
下列说法不正确的是( )
A.实验③中x=8
B.实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度可增大该反应速率
C.降低Na2S2O3溶液浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大
D.将装有实验②的试剂的试管浸泡在热水中一段时间后再混合,其浑浊度曲线应为a
20.如图所示的各图中,表示2A(g)+B(g) 2C(g)(△H<0)这个可逆反应的正确图像为(注:Φ(C)表示C的体积分数,P表示气体压强,C表示浓度)( )
A. B.
C. D.
二、综合题
21.某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:
(1)由图中的数据分析,该反应的化学方程式为 .
(2)反应开始至2min、5minZ的平均反应速率为 、 .
22. 为高效漂白剂和氧化剂,可用于纸浆、纸张和各种纤维的漂白,也在环境治理中有所应用。
(1)已知
则 (用含a、b式子表示)。
(2)浓度均为0.1 和混合溶液呈酸性,则溶液中微粒浓度大小关系: (填“>”“<”或“=”)。
(3)工业上可用电解法制备,其工作原理如图所示(NaCl足量),电解一段时间后,将Pt(A)电极区的溶液除去微量二氧化氯后,喷雾干燥即得粗品。
M处是外接直流电源的 极(填“正”或“负”);离子交换膜应选择 (填“阴”或“阳”)离子交换膜;当外电路转移0.1mol电子时,理论上Pt(B)电极区电解质溶液质量减少 g。
(4)以为氧化剂是一种新型脱除NO方法,其原理为:
第一步:NO在碱性环境中被氧化为,反应为:;
第二步:继续被氧化为,反应为:。
①溶液吸收NO的过程中,适当增加压强,对NO的脱除率的影响是 (填“提高”“无影响”或“降低”)。
②在50℃时,将NO匀速通过足量浓度为 碱性溶液,3min后,测得溶液中浓度为。则该时间段内平均反应速率 (反应前后溶液的体积变化忽略不计)。
23.已知:2X(g)+Y(g) a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
(1)a= ;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为 mol/(L min).
(2)平衡时,Y在混合物中的物质的量分数是
(3)其他条件不变时,下列措施可以提高Y的转化率的是 (选填字母).
A.使用适当的催化剂 B.分离出Z C.增大容器体积.
24.T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
(1)写出该反应的化学方程式 .
(2)反应开始至3min时,用D表示的平均反应速率为 mol/(L min).
(3)若升高温度,则v(正) ,v(逆) (填“加快”或“减慢”)。
(4)若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1,乙中v(B)=0.2 mol·L-1·min-1,则 容器中反应更快。
25.
(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol·L-1 V(H2SO4)/mL 反应前溶液温度/℃ 金属消失的时间/s
1 0.10 丝 0.5 50 20 500
2 0.10 粉末 0.5 50 20 50
3 0.10 丝 1.0 50 20 125
4 0.10 丝 1.0 50 35 50
①对比实验1和3,表明影响化学反应速率的因素是 ;反应规律为: ,反应速率越快。
②仅表明固体反应物的表面积对化学反应速率产生影响的实验有 (填实验序号)。
③本实验中影响化学反应速率的其他因素还有 。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作 (填“负极”或“正极”),铁的电极反应式是 ,在铁电极上发生 反应(填“氧化”或“还原”)。
答案解析部分
1.【答案】C
【解析】【解答】A、由分析可知,平衡向正反应方向移动了,故A错误;
B、由分析可知,平衡正向移动,A的转化率增大,故B错误;
C、反应正向移动,B的物质的量分数增大,故C正确;
D、由分析可知,减小压强,平衡逆向移动,则a故答案为:C。
【分析】保持温度不变,将容器体积增加一倍,若a=b,B的浓度应当均为原来的一半,当达到新的平衡时,B的浓度是原平衡时的60%,说明减小压强,平衡正向移动。
2.【答案】C
【解析】【解答】A.低温冷藏使食品延缓变质,是降低温度使反应速率减慢,A项排除;
B.在潮湿的情况下,铁锅、铁铲易发生电化学腐蚀,腐蚀速率较快,保持其干燥,可以极大减缓其腐蚀速率,B项排除;
C.制造蜂窝煤时加入生石灰,是为了减少二氧化硫的排放,发生反应为:2CaO+O2+2SO2 2CaSO4,与反应速率无关,C项可选;
D.把块状煤碾成粉状再燃烧,能够增大反应物之间的接触面积,增大反应速率,D项排除。
故答案为:C。
【分析】A.温度低,蔬菜贮存时间长;
B.在干燥条件下铁的腐蚀速率较慢;
C.煤中加入氧化钙是减少二氧化硫的排放;
D.块煤碾碎增大接触面积,加快反应速率。
3.【答案】D
【解析】【解答】A.水为纯液体,增加水的用量,反应速率不变,A不选;
B.Al与浓硫酸发生钝化,不生成氢气,反应速率减小,B不选;
C.反应没有气体参加,则增大压强,反应速率不变,C不选;
D.块状大理石改为粉末状,增大了接触面积,反应速率加快,D选;
故答案为:D。
【分析】可以加快反应速率的措施有:增大反应物的浓度,但是纯液体和固体不考虑浓度;改变压强,但是必须改变物质的浓度;加快反应物的接触面积;以及加催化剂等。
4.【答案】A
【解析】【解答】升高温度可提高反应物中的活化分子百分数,但增大压强、压缩使容器体积变小、增大反应物浓度只增大活化分子的浓度,不改变活化分子百分数,
故答案为:A。
【分析】活化分子是能量达到可以发生反应的分子,提高温度能量可以增加,或者使用催化剂,降低分子的活化能
5.【答案】A
【解析】【解答】从反应开始至10s时,O2的浓度减少了0.3mol/L,则用氧气的浓度变化表示反应速率v(O2)==0.03mol/(L·s),选项A符合题意,选项B不符合题意;由于同一化学反应,用不同物质表示的反应速率,速率比等于化学计量数的比,则v(SO2):v(O2):v(SO3)=2:1:2,因此v(SO3)=v(SO2)=2v(O2)=0.06 mol/(L·s),选项C、D不符合题意;
故答案为:A。
【分析】先根据10s内氧气浓度的变化计算氧气的反应速率,然后根据速率比等于化学计量数的比计算v(SO2)、v(SO3),进行判断。
6.【答案】C
【解析】【解答】解:A.因铝的表面有一层致密的Al2O3能与盐酸反应得到盐和水,无氢气放出,故A正确;
B.在反应过程中,浓度减小,反应速率减小,但反应放热,溶液温度升高,反应速率加快,且后者为主要因素,故B正确;
C.反应不是可逆反应,t=c时刻,没有达到平衡状态,故C错误;
D.随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小,故D正确.
故选C.
【分析】由图可知,开始不生成氢气,为氧化铝与盐酸的反应,然后Al与盐酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.
7.【答案】C
【解析】【解答】解:A、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故A错误;
B、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故B错误;
C、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故C正确;
D、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故D错误;
故选C.
【分析】对于该正反应为放热的化学反应来说,降低温度,该反应的正逆反应速率都减小,化学平衡向放热的方向移动,以此来解答.
8.【答案】B
【解析】【解答】A、由分析可知,①→②为放热反应,则①→②放出能量并形成了C-C键,故A正确;
B、催化剂只能改变反应速率,不影响平衡状态,不能提高反应物的平衡转化率,故B错误;
C、该过程的总反应为CH4+CO2→CH3COOH,该反应的原子利用率为100%,故C正确;
D、由图可知,CH4→CH3COOH过程中,有C-H键发生断裂,故D正确;
故答案为:B。
【分析】A、①的能量高于②,则①→②为放热反应;
B、催化剂不影响平衡状态;
C、总反应为甲烷和二氧化碳反应生成乙酸;
D、甲烷中只含C-H键。
9.【答案】B
【解析】【解答】A.慢反应决定整个反应速率,则该反应的速率主要取决于②的快慢,故A不符合题意;
B.NOBr2为中间产物,开始不存在,不能作催化剂,故B符合题意;
C.焓变等于正逆反应活化能之差,焓变为负,则正反应的活化能比逆反应的活化能小a kJ·mol-1,故C不符合题意;
D.增大Br2(g)浓度,单位体积内活化分子数目增多,加快反应速率,故D不符合题意;
故答案为:B。
【分析】B、催化剂与中间产物的区别是:催化剂是前面参与反应,后面生成的。中间产物是在前面生成,后面参与反应。
10.【答案】B
【解析】【解答】解:由第一个和第二个图像可知升高温度生成物的浓度增大,说明平衡向正反应方向移动,说明正反应吸热,可排除A、C选项,
由第一个、第三个和第四个图像可知压强增大生成物的浓度减小,说明压强增大平衡向逆反应方向移动,则反应物的气体的计量数之和小于生成物气体的化学计量数之和,可排除D选项,
故选B.
【分析】由前两个图像可知,温度越高生成物的浓度越高,则正反应为吸热反应,由后两个图像可知,压强越大,平均相对分子质量越大,且平衡后加压逆反应速率大于正反应速率,则加压化学平衡逆向移动,则反应物的气体的计量数之和小于生成物气体的化学计量数之和,然后依据此两点来分析反应.
11.【答案】A
【解析】【解答】解:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,
A、加入催化剂,反应速率加快,催化剂不影响平衡移动,x的转化率不变,故A正确;
B、加大X的投入量,X浓度增大,反应速率加快,平衡向正反应移动,但X的转化率减小,故B错误;
C、该反应正反应是放热反应,升高温度,反应速率加快,平衡向逆反应移动,x的转化率减小,故C错误;
D、增大体积,压强减小,该反应前后气体的物质的量不变,压强降低平衡不移动,但反应速率降低,故D错误;
故选A.
【分析】由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,据此结合选项判断.
12.【答案】D
【解析】【解答】A.加入NaCl固体,溶液中c(Cl-)增大,平衡向逆反应方向进行,HClO浓度降低,故A不符合题意;
B.HClO具有强氧化性,能将亚硫酸钠氧化成硫酸钠,HClO浓度降低,故B不符合题意;
C.氢氧化钠能与HCl、HClO反应,HClO浓度降低,故C不符合题意;
D.次氯酸酸性比碳酸的酸性弱,只有HCl与CaCO3反应,促使平衡向正反应进行,HClO的浓度增大,故D符合题意;
故答案为:D。
【分析】要使HClO浓度增大,应使平衡正向移动。
13.【答案】D
【解析】【解答】解:A.升高温度,反应速率加快,故A不选;
B.用Zn粉代替Zn粒,接触面积增大,反应速率加快,故B不选;
C.滴加少量的CuSO4溶液,构成原电池,反应速率加快,故C不选;
D.改用0.1mol/LH2SO4与Zn反应,浓度减小,反应速率减小,故D选;
故选D.
【分析】升高温度、增大接触面积、增大氢离子浓度、构成原电池等均可加快生成氢气的速率,减小浓度反应速率减慢,以此来解答.
14.【答案】C
【解析】【解答】A.其他条件不变时,温度升高,反应速率加快,选项正确,A不符合题意;
B.其他条件不变时,浓度增大,反应速率加快,选项正确,B不符合题意;
C.当可逆反应达到反应限度,即达到平衡状态时,体系中反应物和生成物的浓度保持不变,但不一定相等,选项错误,C符合题意;
D.当可逆反应达到反应限度,即达到平衡状态时,用同一种物质表示的正逆反应速率相等,选项正确,D不符合题意;
故答案为:C
【分析】此题是对反应速率的影响因素和平衡状态的考查,结合反应速率的影响因素和平衡特点进行分析。
15.【答案】A
【解析】【解答】由表中数据1、3可知, 的初始速率与c(Br2)成正比,再结合1、2可知,的初始速率成正比,0.02的溴水和0.02的HCOOH溶液等体积混合,c(Br2)=0.01mol/L,=0.01mol/L,结合1中实验数据可知此时初始=2.0×10-6×=,
故答案为:A。
【分析】 的溴水和的溶液等体积混合后c(Br2)=0.01mol/L,=0.01mol/L。
16.【答案】B
【解析】【解答】碳酸钙的分解反应为吸热反应,则该反应的,该反应正反应是气体体积增大的反应,,要想反应能自发进行,应满足,T越大,越有利于,因此高温时该反应能自发,当T较小时,压强越低越有利于实现,因此最不利于其自发进行的条件是低温高压,故B符合题意;
故答案为:B。
【分析】反应能够自发进行的条件是△G=△H-T△S<0,该反应为吸热反应,且正反应的气体体积增大,据此分析。
17.【答案】C
【解析】【解答】,故AD不符合题意;则根据反应速率之比等于化学计量数之比得:,故B不符合题意;,故C符合题意;
故答案为:C。
【分析】依据和反应速率之比等于化学计量数之比分析计算即可。
18.【答案】C
【解析】【解答】A. 变化量之比等于计量数之比,因此X的变化量为0.6mol,因此v===0.005mol/(L s),A项不符合题意;
B. 升高温度,反应速率加快,正逆反应速率均加快,B项不符合题意;
C. 其他条件不变,若初始改为投入2molX和2molY,相当于减小压强,平衡逆向移动,Y的转化率减小,C项符合题意;
D. 容器体积加倍,浓度减小为原来的,压强减小,平衡逆向移动,Z的平衡浓度小于原来的一半,D项不符合题意;
故答案为:C。
【分析】A.根据物质的量变化量之比等于化学计量数之比和v=计算;
B.升温正逆反应速率均加快;
D.容器体积加倍,浓度减小为原来的,压强减小,平衡逆向移动。
19.【答案】D
【解析】【解答】A.根据控制变量法,控制总体积相等,即可得到 实验③中x=8 ,故A不符合题意;
B. 实验①②③控制硫酸的体积相同,硫代硫酸钠的浓度依次增大或③④⑤控制硫代硫酸钠浓度相等,依次减小硫酸的浓度,可以说明浓度增大,速率增大,故B不符合题意;
C.实验①②③控制硫酸的体积相同,硫代硫酸钠的浓度依次增大或③④⑤控制硫代硫酸钠浓度相等,依次减小硫酸的浓度,发现降低Na2S2O3溶液浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大 ,故C不符合题意;
D.温度越高,速率越快,不能是a,故D符合题意;
故答案为:D
【分析】根据题意可知,实验①②③控制硫酸的体积相同,硫代硫酸钠的浓度依次增大或③④⑤控制硫代硫酸钠浓度相等,依次减小硫酸的浓度,通过比较硫代硫酸钠浓度与硫酸浓度对反应影响,温度升高,速率加快,结合选项判断。
20.【答案】A
【解析】【解答】A. 温度高,反应速率加快,先到达平衡;升高温度,平衡向吸热方向移动,即向逆反应方向移动,C的体积分数降低,A项符合题意;
B. 压强增大,正逆反应速率都增大,B项不符合题意;
C. 使用催化剂,加快反应,到达平衡的时间短,但不影响平衡的移动,平衡时C的浓度不变,C项不符合题意;
D. 增大压强反应向体积减小方向移动,即向正反应方向移动,A的转化率增大;升高温度,平衡向吸热方向移动,即向逆反应方向移动,A的转化率降低,D项不符合题意;
故答案为:A。
【分析】A.升高温度反应速率增大,到达平衡需要的时间变短,平衡向逆反应方向移动,C的体积分数降低;
B.随压强的增大,正逆反应速率都增大;
C.催化剂不能是平衡发生移动,只能改变反应速率;
D.相同压强下温度越高A的转化率越低。
21.【答案】(1)3X+Y 2Z
(2)0.05 mol/(L min);0.04 mol/(L min)
【解析】【解答】解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=(1﹣0.4)mol:(1﹣08)mol:(0.5﹣0.1)mol=0.6mol:0.2mol:0.4mol=3:1:2,则反应的化学方程式为:3X+Y 2Z,
故答案为:3X+Y 2Z;(2)反应开始至2min时v(Z)= = = =0.05mol/(L min),
反应开始至5min时v(Z)= = = =0.04 mol/(L min),
故答案为:0.05 mol/(L min);0.04 mol/(L min).
【分析】(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;(2)依据化学反应速率计算公式v= = 计算.
22.【答案】(1)(2a+3b)
(2)<
(3)负;阳;5.85
(4)提高;
【解析】【解答】(1)根据盖斯定律,已知反应;①×2+②×3,可得目标方程 ,
(2) 和混合溶液,根据电荷守恒:=,因为,所以<;
(3)Pt(A)电极上,,发生还原反应,M为电源的负极,Pt(B)电极上,发生反应:,钠离子通过离子交换膜向Pt(A)电极移动,所以离子交换膜为阳离子交换膜;当外电路转移0.1mol电子时,有0.1mol氯离子发生反应,有0.1mol钠离子转移至Pt(A)电极区,故,Pt(B)电极区电解质溶液质量减少0.1mol氯化钠,质量为5.85g。
(4)增加压强,第一步反应平衡正向移动,NO的脱除率提高;,反应速率之比等于化学计量数之比,所以
【分析】(1)根据盖斯定律,观察已知方程和目标方程,消除无关物质即可得到。
(2)弄清楚溶液中的化学平衡,判断粒子存在形式,根据电荷守恒和物料守恒判断即可。
(3)(1)判断电池类型→确认电池原理→核实电子、离子移动方向。(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。(3)充电电池→放电时为原电池→失去电子的一极为负极。(4)电极反应→根据电荷守恒、原子守恒配平电极方程式
23.【答案】(1)1;0.075
(2)10%
(3)B
【解析】【解答】解:(1)在体积为2L的密闭容器中充入6molX和2molY,X、Y的起始浓度分别为3mol/L、1mol/L,平衡时X、Y、Z浓度变化之比为△c(x):(1.00mol/L﹣0.25mol/l):0.75mol/L=2:1:1,故a=1,△c(x)=1.5mol/L,用Y的浓度变化表示从反应开始到平衡时的平均反应速率为 = =0.075mol/L,
故答案为:1;0.075mol/(L min);
(2.)平衡时n(X)=(3mol/L﹣1.5mol/L)×2L=3mol,n(Y)=0.25mol/L×2L=0.5mol,n(Z)=0.75mol/L×2L=1.5mol,则Y在混合物中的物质的量分数= = ×100%=10%,
故答案为:10%;
(3.)反应2X(g)+Y(g) Z(g),提高Y的转化率,即使平衡正向移动,
A.催化剂不影响平衡平衡,故A错误;
B.分离出Z,平衡正向移动,Y转化率增大,故B正确;
C.增大容器体积,压强减小平衡逆向移动,Y转化率减小,故C错误;
故答案为:B.
【分析】(1)各物质的化学计量数之比等于浓度变化量之比;根据反应速率v= 计算;(2)根据Y在混合物中的物质的量分数= 计算;(3)可以提高Y的转化率,平衡正向进行.
24.【答案】(1)2A(g)+B(g) 3D(g)+E(s)
(2)0.1
(3)加快;加快
(4)乙
【解析】【解答】(1)根据图象曲线变化可以知道A、B为反应物,C、D为生成物,A的物质的量变化为1.0mol-0.6mol=0.4mol,B的物质的量变化为1.0mol-0.8mol=0.2mol,D的物质的量变化为0.6mol,E的物质的量变化为0.2mol,根据物质的量变化与化学计量数成正比可以知道A、BD、E的计量数之比为0.4mol:0.2mol:0.6mol:0.2mol=2:1:3:1,所以该反应的化学方程式为:2A(g)+B(g) 3D(g)+E(s),因此,本题正确答案是:2A(g)+B(g) 3D(g)+E(s);(2)反应开始至3min时,D的物质的量变化为0.6mol,则用D表示的平均反应速率为v(D)= mol/(L min)=0.1 mol/(L min),故答案为:0.1;(3)若升高温度,则增加活化分子数,正逆反应速率均增大,故答案为:加快;加快;(4)甲中v(A)=0.3 mol·L-1·min-1;乙中v(B)=0.2 mol·L-1·min-1,换算成v(A)=0.4mol·L-1·min-1,则乙容器中反应更快,故答案为:乙。
【分析】(1)根据达到平衡时各物质的物质的量变化关系,得出化学方程式中各物质的计量数之比,据此写出化学方程式;
(2)利用图象得出3min时D的物质的量变化,再根据v=计算出答案;
(3)升温正逆反应速率均增大;
(4)将乙容器中的速率转化为用A来表示,从而比较两容器中的速率大小。
25.【答案】(1)浓度;反应物浓度越大;1、2;温度
(2)正极;Fe-2e-=Fe2+;氧化
【解析】【解答】①对比实验1和3,其余条件均相同、只有硫酸浓度不同,3中硫酸浓度大、金属消失时间短、反应速率大,则实验1和3表明影响化学反应速率的因素是浓度;反应规律为:反应物浓度越大,反应速率越快。
②对比实验1和2,其余条件均相同、只有金属状态不同,2中金属为粉末、金属消失时间短、反应速率大,则仅表明固体反应物的表面积对化学反应速率产生影响的实验有1、2。
③对比实验1和4可以发现,本实验中影响化学反应速率的其他因素还有温度。
(2)如图原电池装置中,铜作正极,铜离子在正极上得到电子生成铜,铁作负极,铁失去电子转化为亚铁离子,铁的电极反应式是Fe-2e-=Fe2+,在铁电极上发生氧化反应。
【分析】(1)①根据①和③的变量不同即可找出影响因素和规律
②根据找出控制表面积的实验即可
③常见的控制速率的因素有接触面积、浓度和温度找出即可
(2)根据题意即可知道铜做负极发生铜离子得到电子变为铜单质,铁失去电子变为铁离子发生氧化反应
一、单选题
1.在一密闭容器中,反应达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原平衡时的60%,则( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增大了 D.
2.化学与生产、生活密切相关。下列事实与化学反应速率无关的是( )
A.食品、蔬菜贮存在冰箱或冰柜里
B.家用铁锅、铁铲等餐具保持干燥
C.制造蜂窝煤时加入生石灰
D.把块状煤碾成粉状再燃烧
3.下列措施对加快反应速率有明显效果的是( )
A.Na与水反应时,增加水的用量
B.Al与稀硫酸反应制取H2时,改用浓硫酸
C.Na2SO4与BaCl2两种溶液反应时,增大压强
D.大理石和盐酸反应制取CO2时,将块状大理石改为粉末状
4.对于在一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.升高温度 B.增大压强
C.减小反应物浓度 D.增大反应物浓度
5.一定条件下反应2SO2(g)+O2(g)2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为( )
A.v(O2)=0.03mol·L-1·s-1 B.v(O2)=0.3mol·L-1·s-1
C.v(SO2)=0.03mol·L-1·s-1 D.v(SO3)=0.03mol·L-1·s-1
6.把在空气中久置的铝片5.0g投入盛有50mL 0.1mol L﹣1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡
D.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降
7.反应:A(气)+3B(气) 2C(气)△H<0达平衡后,将气体混合物的温度降低.下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
8.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,下图为该历程示意图,下列说法不正确的是( )
A.①→②放出能量并形成了C-C键
B.催化剂可提高反应物的平衡转化率
C.生成CH3COOH总反应的原子利用率为100%
D.CH4→CH3COOH过程中,有C-H键发生断裂
9.已知反应:2NO(g)+Br2(g)=2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下:①NO(g)+Br2(g)=NOBr2(g) 快 ②NO(g)+NOBr2(g)=2NOBr(g) 慢( )
下列有关该反应的说法错误的是
A.该反应的速率主要取决于②的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2(g)浓度能增大单位体积内活化分子个数,加快反应速率
10.现有下列四个图像:
下列反应中全部符合上述图像的反应是( )
A.N2(g)+3H2(g) 2NH3(g)△H1<0
B.2SO3(g) 2SO2(g)+O2(g)△H2>0
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H3<0
D.H2(g)+CO(g) C(s)+H2O(g)△H4>0
11.右图曲线a表示放热反应 2X(g)+Y(g) 2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.加催化剂 B.加大X的投入量
C.升高温度 D.增大体积
12.已知次氯酸是比碳酸还弱的酸,反应:达平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体 B.固体 C.NaOH固体 D.固体
13.下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是( )
A.升高温度 B.用Zn粉代替Zn粒
C.滴加少量的CuSO4溶液 D.改用0.1mol/LH2SO4与Zn反应
14.关于反应速率、反应限度的下列说法中错误的是( )
A.其他条件不变时,升高温度,化学反应速率加快
B.其他条件不变时,增大浓度,化学反应速率加快
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,同一物质的正反应速率与逆反应速率相等
15.溴水与甲酸可以发生如下反应:。生成二氧化碳的初始速率与反应物起始浓度的关系如下:
实验序号 开始浓度/ 初始速率/()
1 0.01 0.02
2 0.02 0.04
3 0.03 0.02
现将的溴水和的溶液等体积混合,此时生成二氧化碳的初始速率()应为( )
A. B. C. D.
16.对于碳酸钙分解反应:CaCO3(s)CaO(s)+CO2(g),最不利于其自发进行的是( )
A.低温低压 B.低温高压 C.高温高压 D.高温低压
17.常温下,向某容积为1L的恒容密闭容器中通入和,发生应:。反应后,测得容器中剩余0.06mol,则下列反应速率的表达正确的是( )
A. B.
C. D.
18.一定条件下,在体积为2L的密闭容器中,3molX和3molY发生反应:3X(g)+Y(g)2Z(g) ΔH>0,经60s达到平衡,生成0.4molZ。下列说法正确的是( )
A.60s内平均反应速率v(X)=0.05mol/(L·s)
B.其他条件不变,升高温度,正反应速率增大,逆反应速率减小
C.其他条件不变,若初始投入2molX和2molY,则物质Y的转化率减小
D.其他条件不变,将容器体积变为4L,Z的平衡浓度变为原来的一半
19.室温下,用0.1 mol·L-1Na2S2O3溶液、0.1 mol·L-1H2SO4溶液和蒸馏水进行如下表所示的5个实验,分别测量浑浊度随时间的变化。
下列说法不正确的是( )
A.实验③中x=8
B.实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度可增大该反应速率
C.降低Na2S2O3溶液浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大
D.将装有实验②的试剂的试管浸泡在热水中一段时间后再混合,其浑浊度曲线应为a
20.如图所示的各图中,表示2A(g)+B(g) 2C(g)(△H<0)这个可逆反应的正确图像为(注:Φ(C)表示C的体积分数,P表示气体压强,C表示浓度)( )
A. B.
C. D.
二、综合题
21.某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:
(1)由图中的数据分析,该反应的化学方程式为 .
(2)反应开始至2min、5minZ的平均反应速率为 、 .
22. 为高效漂白剂和氧化剂,可用于纸浆、纸张和各种纤维的漂白,也在环境治理中有所应用。
(1)已知
则 (用含a、b式子表示)。
(2)浓度均为0.1 和混合溶液呈酸性,则溶液中微粒浓度大小关系: (填“>”“<”或“=”)。
(3)工业上可用电解法制备,其工作原理如图所示(NaCl足量),电解一段时间后,将Pt(A)电极区的溶液除去微量二氧化氯后,喷雾干燥即得粗品。
M处是外接直流电源的 极(填“正”或“负”);离子交换膜应选择 (填“阴”或“阳”)离子交换膜;当外电路转移0.1mol电子时,理论上Pt(B)电极区电解质溶液质量减少 g。
(4)以为氧化剂是一种新型脱除NO方法,其原理为:
第一步:NO在碱性环境中被氧化为,反应为:;
第二步:继续被氧化为,反应为:。
①溶液吸收NO的过程中,适当增加压强,对NO的脱除率的影响是 (填“提高”“无影响”或“降低”)。
②在50℃时,将NO匀速通过足量浓度为 碱性溶液,3min后,测得溶液中浓度为。则该时间段内平均反应速率 (反应前后溶液的体积变化忽略不计)。
23.已知:2X(g)+Y(g) a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
(1)a= ;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为 mol/(L min).
(2)平衡时,Y在混合物中的物质的量分数是
(3)其他条件不变时,下列措施可以提高Y的转化率的是 (选填字母).
A.使用适当的催化剂 B.分离出Z C.增大容器体积.
24.T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
(1)写出该反应的化学方程式 .
(2)反应开始至3min时,用D表示的平均反应速率为 mol/(L min).
(3)若升高温度,则v(正) ,v(逆) (填“加快”或“减慢”)。
(4)若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1,乙中v(B)=0.2 mol·L-1·min-1,则 容器中反应更快。
25.
(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol·L-1 V(H2SO4)/mL 反应前溶液温度/℃ 金属消失的时间/s
1 0.10 丝 0.5 50 20 500
2 0.10 粉末 0.5 50 20 50
3 0.10 丝 1.0 50 20 125
4 0.10 丝 1.0 50 35 50
①对比实验1和3,表明影响化学反应速率的因素是 ;反应规律为: ,反应速率越快。
②仅表明固体反应物的表面积对化学反应速率产生影响的实验有 (填实验序号)。
③本实验中影响化学反应速率的其他因素还有 。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作 (填“负极”或“正极”),铁的电极反应式是 ,在铁电极上发生 反应(填“氧化”或“还原”)。
答案解析部分
1.【答案】C
【解析】【解答】A、由分析可知,平衡向正反应方向移动了,故A错误;
B、由分析可知,平衡正向移动,A的转化率增大,故B错误;
C、反应正向移动,B的物质的量分数增大,故C正确;
D、由分析可知,减小压强,平衡逆向移动,则a
【分析】保持温度不变,将容器体积增加一倍,若a=b,B的浓度应当均为原来的一半,当达到新的平衡时,B的浓度是原平衡时的60%,说明减小压强,平衡正向移动。
2.【答案】C
【解析】【解答】A.低温冷藏使食品延缓变质,是降低温度使反应速率减慢,A项排除;
B.在潮湿的情况下,铁锅、铁铲易发生电化学腐蚀,腐蚀速率较快,保持其干燥,可以极大减缓其腐蚀速率,B项排除;
C.制造蜂窝煤时加入生石灰,是为了减少二氧化硫的排放,发生反应为:2CaO+O2+2SO2 2CaSO4,与反应速率无关,C项可选;
D.把块状煤碾成粉状再燃烧,能够增大反应物之间的接触面积,增大反应速率,D项排除。
故答案为:C。
【分析】A.温度低,蔬菜贮存时间长;
B.在干燥条件下铁的腐蚀速率较慢;
C.煤中加入氧化钙是减少二氧化硫的排放;
D.块煤碾碎增大接触面积,加快反应速率。
3.【答案】D
【解析】【解答】A.水为纯液体,增加水的用量,反应速率不变,A不选;
B.Al与浓硫酸发生钝化,不生成氢气,反应速率减小,B不选;
C.反应没有气体参加,则增大压强,反应速率不变,C不选;
D.块状大理石改为粉末状,增大了接触面积,反应速率加快,D选;
故答案为:D。
【分析】可以加快反应速率的措施有:增大反应物的浓度,但是纯液体和固体不考虑浓度;改变压强,但是必须改变物质的浓度;加快反应物的接触面积;以及加催化剂等。
4.【答案】A
【解析】【解答】升高温度可提高反应物中的活化分子百分数,但增大压强、压缩使容器体积变小、增大反应物浓度只增大活化分子的浓度,不改变活化分子百分数,
故答案为:A。
【分析】活化分子是能量达到可以发生反应的分子,提高温度能量可以增加,或者使用催化剂,降低分子的活化能
5.【答案】A
【解析】【解答】从反应开始至10s时,O2的浓度减少了0.3mol/L,则用氧气的浓度变化表示反应速率v(O2)==0.03mol/(L·s),选项A符合题意,选项B不符合题意;由于同一化学反应,用不同物质表示的反应速率,速率比等于化学计量数的比,则v(SO2):v(O2):v(SO3)=2:1:2,因此v(SO3)=v(SO2)=2v(O2)=0.06 mol/(L·s),选项C、D不符合题意;
故答案为:A。
【分析】先根据10s内氧气浓度的变化计算氧气的反应速率,然后根据速率比等于化学计量数的比计算v(SO2)、v(SO3),进行判断。
6.【答案】C
【解析】【解答】解:A.因铝的表面有一层致密的Al2O3能与盐酸反应得到盐和水,无氢气放出,故A正确;
B.在反应过程中,浓度减小,反应速率减小,但反应放热,溶液温度升高,反应速率加快,且后者为主要因素,故B正确;
C.反应不是可逆反应,t=c时刻,没有达到平衡状态,故C错误;
D.随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小,故D正确.
故选C.
【分析】由图可知,开始不生成氢气,为氧化铝与盐酸的反应,然后Al与盐酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.
7.【答案】C
【解析】【解答】解:A、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故A错误;
B、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故B错误;
C、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故C正确;
D、降低温度,正逆反应速率都减小,平衡向正反应方向移动,故D错误;
故选C.
【分析】对于该正反应为放热的化学反应来说,降低温度,该反应的正逆反应速率都减小,化学平衡向放热的方向移动,以此来解答.
8.【答案】B
【解析】【解答】A、由分析可知,①→②为放热反应,则①→②放出能量并形成了C-C键,故A正确;
B、催化剂只能改变反应速率,不影响平衡状态,不能提高反应物的平衡转化率,故B错误;
C、该过程的总反应为CH4+CO2→CH3COOH,该反应的原子利用率为100%,故C正确;
D、由图可知,CH4→CH3COOH过程中,有C-H键发生断裂,故D正确;
故答案为:B。
【分析】A、①的能量高于②,则①→②为放热反应;
B、催化剂不影响平衡状态;
C、总反应为甲烷和二氧化碳反应生成乙酸;
D、甲烷中只含C-H键。
9.【答案】B
【解析】【解答】A.慢反应决定整个反应速率,则该反应的速率主要取决于②的快慢,故A不符合题意;
B.NOBr2为中间产物,开始不存在,不能作催化剂,故B符合题意;
C.焓变等于正逆反应活化能之差,焓变为负,则正反应的活化能比逆反应的活化能小a kJ·mol-1,故C不符合题意;
D.增大Br2(g)浓度,单位体积内活化分子数目增多,加快反应速率,故D不符合题意;
故答案为:B。
【分析】B、催化剂与中间产物的区别是:催化剂是前面参与反应,后面生成的。中间产物是在前面生成,后面参与反应。
10.【答案】B
【解析】【解答】解:由第一个和第二个图像可知升高温度生成物的浓度增大,说明平衡向正反应方向移动,说明正反应吸热,可排除A、C选项,
由第一个、第三个和第四个图像可知压强增大生成物的浓度减小,说明压强增大平衡向逆反应方向移动,则反应物的气体的计量数之和小于生成物气体的化学计量数之和,可排除D选项,
故选B.
【分析】由前两个图像可知,温度越高生成物的浓度越高,则正反应为吸热反应,由后两个图像可知,压强越大,平均相对分子质量越大,且平衡后加压逆反应速率大于正反应速率,则加压化学平衡逆向移动,则反应物的气体的计量数之和小于生成物气体的化学计量数之和,然后依据此两点来分析反应.
11.【答案】A
【解析】【解答】解:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,
A、加入催化剂,反应速率加快,催化剂不影响平衡移动,x的转化率不变,故A正确;
B、加大X的投入量,X浓度增大,反应速率加快,平衡向正反应移动,但X的转化率减小,故B错误;
C、该反应正反应是放热反应,升高温度,反应速率加快,平衡向逆反应移动,x的转化率减小,故C错误;
D、增大体积,压强减小,该反应前后气体的物质的量不变,压强降低平衡不移动,但反应速率降低,故D错误;
故选A.
【分析】由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,据此结合选项判断.
12.【答案】D
【解析】【解答】A.加入NaCl固体,溶液中c(Cl-)增大,平衡向逆反应方向进行,HClO浓度降低,故A不符合题意;
B.HClO具有强氧化性,能将亚硫酸钠氧化成硫酸钠,HClO浓度降低,故B不符合题意;
C.氢氧化钠能与HCl、HClO反应,HClO浓度降低,故C不符合题意;
D.次氯酸酸性比碳酸的酸性弱,只有HCl与CaCO3反应,促使平衡向正反应进行,HClO的浓度增大,故D符合题意;
故答案为:D。
【分析】要使HClO浓度增大,应使平衡正向移动。
13.【答案】D
【解析】【解答】解:A.升高温度,反应速率加快,故A不选;
B.用Zn粉代替Zn粒,接触面积增大,反应速率加快,故B不选;
C.滴加少量的CuSO4溶液,构成原电池,反应速率加快,故C不选;
D.改用0.1mol/LH2SO4与Zn反应,浓度减小,反应速率减小,故D选;
故选D.
【分析】升高温度、增大接触面积、增大氢离子浓度、构成原电池等均可加快生成氢气的速率,减小浓度反应速率减慢,以此来解答.
14.【答案】C
【解析】【解答】A.其他条件不变时,温度升高,反应速率加快,选项正确,A不符合题意;
B.其他条件不变时,浓度增大,反应速率加快,选项正确,B不符合题意;
C.当可逆反应达到反应限度,即达到平衡状态时,体系中反应物和生成物的浓度保持不变,但不一定相等,选项错误,C符合题意;
D.当可逆反应达到反应限度,即达到平衡状态时,用同一种物质表示的正逆反应速率相等,选项正确,D不符合题意;
故答案为:C
【分析】此题是对反应速率的影响因素和平衡状态的考查,结合反应速率的影响因素和平衡特点进行分析。
15.【答案】A
【解析】【解答】由表中数据1、3可知, 的初始速率与c(Br2)成正比,再结合1、2可知,的初始速率成正比,0.02的溴水和0.02的HCOOH溶液等体积混合,c(Br2)=0.01mol/L,=0.01mol/L,结合1中实验数据可知此时初始=2.0×10-6×=,
故答案为:A。
【分析】 的溴水和的溶液等体积混合后c(Br2)=0.01mol/L,=0.01mol/L。
16.【答案】B
【解析】【解答】碳酸钙的分解反应为吸热反应,则该反应的,该反应正反应是气体体积增大的反应,,要想反应能自发进行,应满足,T越大,越有利于,因此高温时该反应能自发,当T较小时,压强越低越有利于实现,因此最不利于其自发进行的条件是低温高压,故B符合题意;
故答案为:B。
【分析】反应能够自发进行的条件是△G=△H-T△S<0,该反应为吸热反应,且正反应的气体体积增大,据此分析。
17.【答案】C
【解析】【解答】,故AD不符合题意;则根据反应速率之比等于化学计量数之比得:,故B不符合题意;,故C符合题意;
故答案为:C。
【分析】依据和反应速率之比等于化学计量数之比分析计算即可。
18.【答案】C
【解析】【解答】A. 变化量之比等于计量数之比,因此X的变化量为0.6mol,因此v===0.005mol/(L s),A项不符合题意;
B. 升高温度,反应速率加快,正逆反应速率均加快,B项不符合题意;
C. 其他条件不变,若初始改为投入2molX和2molY,相当于减小压强,平衡逆向移动,Y的转化率减小,C项符合题意;
D. 容器体积加倍,浓度减小为原来的,压强减小,平衡逆向移动,Z的平衡浓度小于原来的一半,D项不符合题意;
故答案为:C。
【分析】A.根据物质的量变化量之比等于化学计量数之比和v=计算;
B.升温正逆反应速率均加快;
D.容器体积加倍,浓度减小为原来的,压强减小,平衡逆向移动。
19.【答案】D
【解析】【解答】A.根据控制变量法,控制总体积相等,即可得到 实验③中x=8 ,故A不符合题意;
B. 实验①②③控制硫酸的体积相同,硫代硫酸钠的浓度依次增大或③④⑤控制硫代硫酸钠浓度相等,依次减小硫酸的浓度,可以说明浓度增大,速率增大,故B不符合题意;
C.实验①②③控制硫酸的体积相同,硫代硫酸钠的浓度依次增大或③④⑤控制硫代硫酸钠浓度相等,依次减小硫酸的浓度,发现降低Na2S2O3溶液浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大 ,故C不符合题意;
D.温度越高,速率越快,不能是a,故D符合题意;
故答案为:D
【分析】根据题意可知,实验①②③控制硫酸的体积相同,硫代硫酸钠的浓度依次增大或③④⑤控制硫代硫酸钠浓度相等,依次减小硫酸的浓度,通过比较硫代硫酸钠浓度与硫酸浓度对反应影响,温度升高,速率加快,结合选项判断。
20.【答案】A
【解析】【解答】A. 温度高,反应速率加快,先到达平衡;升高温度,平衡向吸热方向移动,即向逆反应方向移动,C的体积分数降低,A项符合题意;
B. 压强增大,正逆反应速率都增大,B项不符合题意;
C. 使用催化剂,加快反应,到达平衡的时间短,但不影响平衡的移动,平衡时C的浓度不变,C项不符合题意;
D. 增大压强反应向体积减小方向移动,即向正反应方向移动,A的转化率增大;升高温度,平衡向吸热方向移动,即向逆反应方向移动,A的转化率降低,D项不符合题意;
故答案为:A。
【分析】A.升高温度反应速率增大,到达平衡需要的时间变短,平衡向逆反应方向移动,C的体积分数降低;
B.随压强的增大,正逆反应速率都增大;
C.催化剂不能是平衡发生移动,只能改变反应速率;
D.相同压强下温度越高A的转化率越低。
21.【答案】(1)3X+Y 2Z
(2)0.05 mol/(L min);0.04 mol/(L min)
【解析】【解答】解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=(1﹣0.4)mol:(1﹣08)mol:(0.5﹣0.1)mol=0.6mol:0.2mol:0.4mol=3:1:2,则反应的化学方程式为:3X+Y 2Z,
故答案为:3X+Y 2Z;(2)反应开始至2min时v(Z)= = = =0.05mol/(L min),
反应开始至5min时v(Z)= = = =0.04 mol/(L min),
故答案为:0.05 mol/(L min);0.04 mol/(L min).
【分析】(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;(2)依据化学反应速率计算公式v= = 计算.
22.【答案】(1)(2a+3b)
(2)<
(3)负;阳;5.85
(4)提高;
【解析】【解答】(1)根据盖斯定律,已知反应;①×2+②×3,可得目标方程 ,
(2) 和混合溶液,根据电荷守恒:=,因为,所以<;
(3)Pt(A)电极上,,发生还原反应,M为电源的负极,Pt(B)电极上,发生反应:,钠离子通过离子交换膜向Pt(A)电极移动,所以离子交换膜为阳离子交换膜;当外电路转移0.1mol电子时,有0.1mol氯离子发生反应,有0.1mol钠离子转移至Pt(A)电极区,故,Pt(B)电极区电解质溶液质量减少0.1mol氯化钠,质量为5.85g。
(4)增加压强,第一步反应平衡正向移动,NO的脱除率提高;,反应速率之比等于化学计量数之比,所以
【分析】(1)根据盖斯定律,观察已知方程和目标方程,消除无关物质即可得到。
(2)弄清楚溶液中的化学平衡,判断粒子存在形式,根据电荷守恒和物料守恒判断即可。
(3)(1)判断电池类型→确认电池原理→核实电子、离子移动方向。(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。(3)充电电池→放电时为原电池→失去电子的一极为负极。(4)电极反应→根据电荷守恒、原子守恒配平电极方程式
23.【答案】(1)1;0.075
(2)10%
(3)B
【解析】【解答】解:(1)在体积为2L的密闭容器中充入6molX和2molY,X、Y的起始浓度分别为3mol/L、1mol/L,平衡时X、Y、Z浓度变化之比为△c(x):(1.00mol/L﹣0.25mol/l):0.75mol/L=2:1:1,故a=1,△c(x)=1.5mol/L,用Y的浓度变化表示从反应开始到平衡时的平均反应速率为 = =0.075mol/L,
故答案为:1;0.075mol/(L min);
(2.)平衡时n(X)=(3mol/L﹣1.5mol/L)×2L=3mol,n(Y)=0.25mol/L×2L=0.5mol,n(Z)=0.75mol/L×2L=1.5mol,则Y在混合物中的物质的量分数= = ×100%=10%,
故答案为:10%;
(3.)反应2X(g)+Y(g) Z(g),提高Y的转化率,即使平衡正向移动,
A.催化剂不影响平衡平衡,故A错误;
B.分离出Z,平衡正向移动,Y转化率增大,故B正确;
C.增大容器体积,压强减小平衡逆向移动,Y转化率减小,故C错误;
故答案为:B.
【分析】(1)各物质的化学计量数之比等于浓度变化量之比;根据反应速率v= 计算;(2)根据Y在混合物中的物质的量分数= 计算;(3)可以提高Y的转化率,平衡正向进行.
24.【答案】(1)2A(g)+B(g) 3D(g)+E(s)
(2)0.1
(3)加快;加快
(4)乙
【解析】【解答】(1)根据图象曲线变化可以知道A、B为反应物,C、D为生成物,A的物质的量变化为1.0mol-0.6mol=0.4mol,B的物质的量变化为1.0mol-0.8mol=0.2mol,D的物质的量变化为0.6mol,E的物质的量变化为0.2mol,根据物质的量变化与化学计量数成正比可以知道A、BD、E的计量数之比为0.4mol:0.2mol:0.6mol:0.2mol=2:1:3:1,所以该反应的化学方程式为:2A(g)+B(g) 3D(g)+E(s),因此,本题正确答案是:2A(g)+B(g) 3D(g)+E(s);(2)反应开始至3min时,D的物质的量变化为0.6mol,则用D表示的平均反应速率为v(D)= mol/(L min)=0.1 mol/(L min),故答案为:0.1;(3)若升高温度,则增加活化分子数,正逆反应速率均增大,故答案为:加快;加快;(4)甲中v(A)=0.3 mol·L-1·min-1;乙中v(B)=0.2 mol·L-1·min-1,换算成v(A)=0.4mol·L-1·min-1,则乙容器中反应更快,故答案为:乙。
【分析】(1)根据达到平衡时各物质的物质的量变化关系,得出化学方程式中各物质的计量数之比,据此写出化学方程式;
(2)利用图象得出3min时D的物质的量变化,再根据v=计算出答案;
(3)升温正逆反应速率均增大;
(4)将乙容器中的速率转化为用A来表示,从而比较两容器中的速率大小。
25.【答案】(1)浓度;反应物浓度越大;1、2;温度
(2)正极;Fe-2e-=Fe2+;氧化
【解析】【解答】①对比实验1和3,其余条件均相同、只有硫酸浓度不同,3中硫酸浓度大、金属消失时间短、反应速率大,则实验1和3表明影响化学反应速率的因素是浓度;反应规律为:反应物浓度越大,反应速率越快。
②对比实验1和2,其余条件均相同、只有金属状态不同,2中金属为粉末、金属消失时间短、反应速率大,则仅表明固体反应物的表面积对化学反应速率产生影响的实验有1、2。
③对比实验1和4可以发现,本实验中影响化学反应速率的其他因素还有温度。
(2)如图原电池装置中,铜作正极,铜离子在正极上得到电子生成铜,铁作负极,铁失去电子转化为亚铁离子,铁的电极反应式是Fe-2e-=Fe2+,在铁电极上发生氧化反应。
【分析】(1)①根据①和③的变量不同即可找出影响因素和规律
②根据找出控制表面积的实验即可
③常见的控制速率的因素有接触面积、浓度和温度找出即可
(2)根据题意即可知道铜做负极发生铜离子得到电子变为铜单质,铁失去电子变为铁离子发生氧化反应
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
