第10-12单元 综合复习检测题 2023-2024学年人教版九年级化学下册(含答案)
文档属性
| 名称 | 第10-12单元 综合复习检测题 2023-2024学年人教版九年级化学下册(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 198.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-25 00:00:00 | ||
图片预览


文档简介
第10~12单元 综合复习检测题
基础强化
一、选择题
1.长期挑食、偏食不利于中学生的健康,每天的食物必须注意合理搭配,下列食物中富含维生素的是( )
A.西红柿 B.鱼 C.米饭 D.鸡蛋
2.下列关于浓盐酸和浓硫酸的叙述不正确的是( )
A.浓硫酸具有吸水性,所以常用作干燥剂
B.浓硫酸能够使蔗糖炭化,说明浓硫酸具有吸水性
C.浓硫酸溶于水,溶液的温度升高
D.浓盐酸、浓硫酸敞口放置在空气中一段时间后,溶质的质量分数都会减小
3.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法正确的是( )
A.为保证高产尽量多施用化肥
B.将氯化铵与碱性物质混合施用
C.CO(NH2)2是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
4.分类是学习化学的一种重要方法。现有氢气、一氧化碳、二氧化碳、甲烷四种物质,可将氢气、一氧化碳、甲烷归为一类;剩下的是二氧化碳。这样分类的依据是( )
A.是否为单质 B.是否为气体 C.是否具有可燃性 D.是否为有机物
5.小玉用一种茶花花瓣的酒精浸出液自制了酸碱指示剂,经实验得出其在不同酸碱性溶液中的显色情况如表。日常生活的下列物质能使该自制酸碱指示剂显红色的是( )
溶液酸碱性 酸性 中性 碱性
指示剂变色 红色 橙色 绿色
A.石灰水 B.矿泉水 C.可乐 D.食盐
6.学好化学,掌握物质的性质和用途,为人类开启智慧之旅。下列说法不正确的是( )
A.摄入糖类和维生素都能为人体提供能量
B.用灼烧闻气味的方法可以鉴别羊毛和合成纤维
C.研制、生产可降解塑料可以解决“白色污染”问题
D.包装食品的聚乙烯塑料袋可用加热的方法封口
二、填空与简答题
7.请回答下列化学与人类生活相关的问题。
(1)下列服装主要用有机合成材料制成的是____________(填字母)。
A.真丝衬衫 B.涤纶连衣裙 C.腈纶运动衣 D.纯棉T恤
(2)自热米饭是一种快餐食品。请根据图1、2及表中信息,回答下列问题:
图1 图2
自热米饭的营养成分
营养素 每份含量
蛋白质 29.6 g
油脂 23.5 g
糖类 104.7 g
钠 814 mg
钙 130 mg
①自热米饭的营养素中,主要提供能量的是_________,构成细胞的基础物质是_________。
②图2中菜肴包的包装材料是符合卫生标准的铝箔。铝可以压制成铝箔,说明铝具有良好的__________。
③该自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为__________。
(3)糖类主要是给人体提供能量。写出葡萄糖(C6H12O6)在酶的作用下缓慢氧化的化学方程式:
__________。
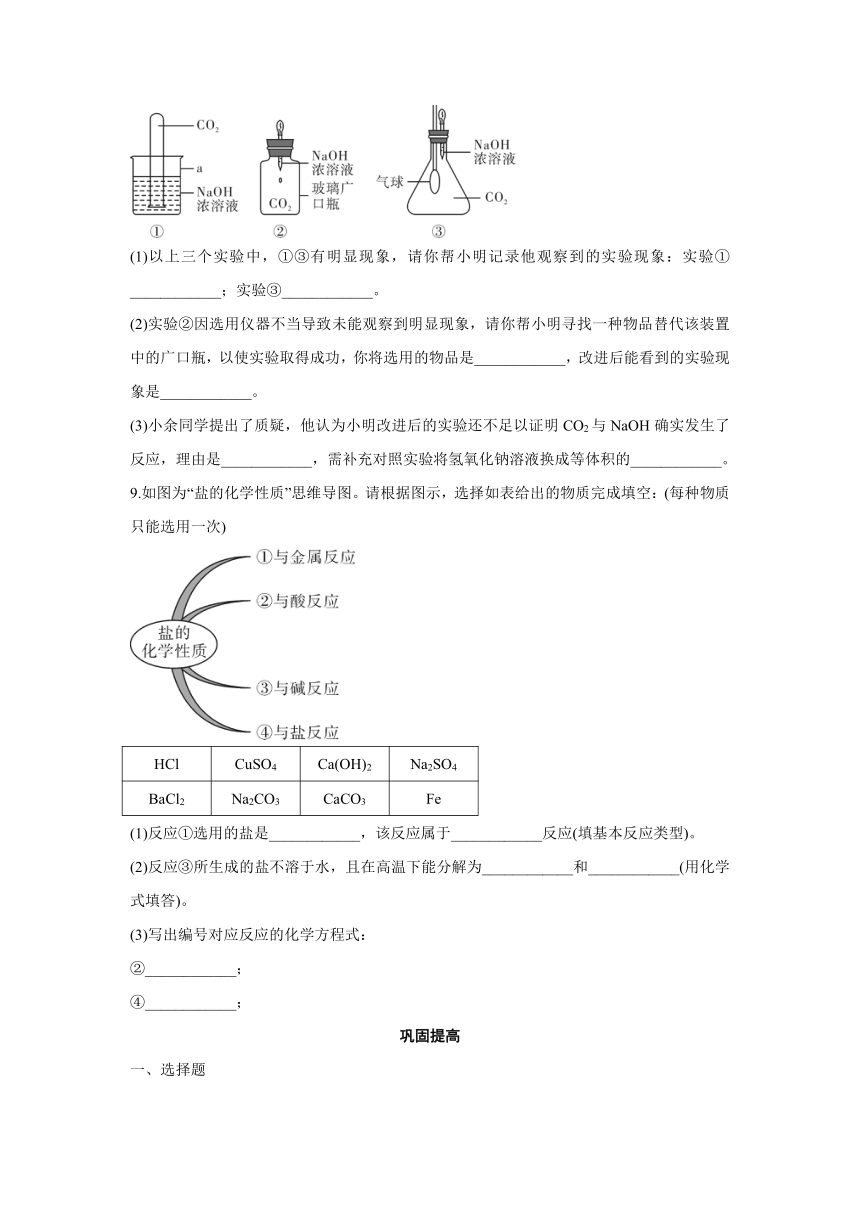
8.小明在探究CO2和NaOH是否发生反应时,设计出下列三种装置进行实验,请回答以下几个问题:
(1)以上三个实验中,①③有明显现象,请你帮小明记录他观察到的实验现象:实验①____________;实验③____________。
(2)实验②因选用仪器不当导致未能观察到明显现象,请你帮小明寻找一种物品替代该装置中的广口瓶,以使实验取得成功,你将选用的物品是____________,改进后能看到的实验现象是____________。
(3)小余同学提出了质疑,他认为小明改进后的实验还不足以证明CO2与NaOH确实发生了反应,理由是____________,需补充对照实验将氢氧化钠溶液换成等体积的____________。
9.如图为“盐的化学性质”思维导图。请根据图示,选择如表给出的物质完成填空:(每种物质只能选用一次)
HCl CuSO4 Ca(OH)2 Na2SO4
BaCl2 Na2CO3 CaCO3 Fe
(1)反应①选用的盐是____________,该反应属于____________反应(填基本反应类型)。
(2)反应③所生成的盐不溶于水,且在高温下能分解为____________和____________(用化学式填答)。
(3)写出编号对应反应的化学方程式:
②____________;
④____________;
巩固提高
一、选择题
10.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A.图中b点所示溶液中,溶质是NaCl
B.向图中c点所示溶液中滴加无色酚酞,溶液不变色
C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
11.将粗盐溶解、过滤,除去泥沙后,溶液中仍含有少量的CaCl2、MgC12、Na2SO4,为除去这些杂质,需用到①BaC12溶液 ②Na2 CO3溶液 ③NaOH溶液三种试剂(为将杂质除尽所加试剂均稍过量,且过量物质须在后续操作中被除去),充分反应后,过滤,冉向滤液中加入适量的稀盐酸,加热蒸发,即可获得较为纯净的NaC1固体。以上三种试剂的加入顺序不正确的是( )
A.①②③ B.①③② C.②③① D.③①②
12.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是( )
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
二、填空与计算题
13.归纳是学习化学的重要方法。小明总结出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应)。
(1)在图中空白方框中可填写指示剂或____________(填物质类别)。
(2)若图中的酸为盐酸,反应④中有白色沉淀生成,则对应的盐为____________(填化学式)。
(3)写出一个符合反应⑦的化学方程式:____________。
(4)验证反应①,可选择下列____________(填字母)两种物质进行反应。
A.Na2SO4 B.KNO3 C.Ba(OH)2 D.NaOH
(5)碱具有相似化学性质的原因是____________。
14.工业纯碱中常含有少量的氯化钠。某学习小组对其组成展开探究。现取24g纯碱样品,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀20g。完成下列问题:
(1)反应后溶液中含有的溶质是_________(写化学式)。
(2)通过已知数据,能求出的量有_________(写字母序号)。
A.反应后溶液的总质量 B.参加反应的氯化钙的质量
C.样品中碳酸钠的质量分数 D.氯化钙溶液中溶质的质量分数
(3)计算反应后溶液中氯化钠的质量分数。(写出计算过程,结果保留到0.1%)
参考答案
基础强化
1.A 2.B 3.D 4.C 5.C 6.A
7.(1)BC (2)①糖类 蛋白质 ②延展性 ③CaO+H2O=Ca(OH)2 (3)C6H12O6+6O26CO2 +6H2O
8.(1)试管内液面升高 气球鼓起 (2)软塑料瓶 软塑料瓶变瘪 (3)二氧化碳能和水反应 水
9.(1)CuSO4 置换 (2)CaO CO2 (3)②CaCO3+2HCl=CaCl2+H2O+CO2↑ ④BaCl2+Na2SO4 =BaSO4↓+2NaCl
巩固提高
10.B 11.C 12.C
13.(1)非金属氧化物 (2)AgNO3 (3)Fe2O3+6HCl=2FeCl3+3H2O(合理即可) (4)AC (5)碱溶液中都含有OH-
14.(1)CaCl2、NaCl (2)ABC
(3)根据质量守恒定律可得,反应后溶液的质量为24g+100g+96g-20g=200g,反应生成的沉淀20g即为反应生成的碳酸钙的质量,参加反应的氯化钙的质量为x,碳酸钠的质量为y,生成的氯化钠的质量为z。
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
x y 20g z
===
x=22.2g y=21.2g z=23.4g
反应后溶液中氯化钠的质量分数为×100%=13.1%。
答:略。
基础强化
一、选择题
1.长期挑食、偏食不利于中学生的健康,每天的食物必须注意合理搭配,下列食物中富含维生素的是( )
A.西红柿 B.鱼 C.米饭 D.鸡蛋
2.下列关于浓盐酸和浓硫酸的叙述不正确的是( )
A.浓硫酸具有吸水性,所以常用作干燥剂
B.浓硫酸能够使蔗糖炭化,说明浓硫酸具有吸水性
C.浓硫酸溶于水,溶液的温度升高
D.浓盐酸、浓硫酸敞口放置在空气中一段时间后,溶质的质量分数都会减小
3.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法正确的是( )
A.为保证高产尽量多施用化肥
B.将氯化铵与碱性物质混合施用
C.CO(NH2)2是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
4.分类是学习化学的一种重要方法。现有氢气、一氧化碳、二氧化碳、甲烷四种物质,可将氢气、一氧化碳、甲烷归为一类;剩下的是二氧化碳。这样分类的依据是( )
A.是否为单质 B.是否为气体 C.是否具有可燃性 D.是否为有机物
5.小玉用一种茶花花瓣的酒精浸出液自制了酸碱指示剂,经实验得出其在不同酸碱性溶液中的显色情况如表。日常生活的下列物质能使该自制酸碱指示剂显红色的是( )
溶液酸碱性 酸性 中性 碱性
指示剂变色 红色 橙色 绿色
A.石灰水 B.矿泉水 C.可乐 D.食盐
6.学好化学,掌握物质的性质和用途,为人类开启智慧之旅。下列说法不正确的是( )
A.摄入糖类和维生素都能为人体提供能量
B.用灼烧闻气味的方法可以鉴别羊毛和合成纤维
C.研制、生产可降解塑料可以解决“白色污染”问题
D.包装食品的聚乙烯塑料袋可用加热的方法封口
二、填空与简答题
7.请回答下列化学与人类生活相关的问题。
(1)下列服装主要用有机合成材料制成的是____________(填字母)。
A.真丝衬衫 B.涤纶连衣裙 C.腈纶运动衣 D.纯棉T恤
(2)自热米饭是一种快餐食品。请根据图1、2及表中信息,回答下列问题:
图1 图2
自热米饭的营养成分
营养素 每份含量
蛋白质 29.6 g
油脂 23.5 g
糖类 104.7 g
钠 814 mg
钙 130 mg
①自热米饭的营养素中,主要提供能量的是_________,构成细胞的基础物质是_________。
②图2中菜肴包的包装材料是符合卫生标准的铝箔。铝可以压制成铝箔,说明铝具有良好的__________。
③该自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为__________。
(3)糖类主要是给人体提供能量。写出葡萄糖(C6H12O6)在酶的作用下缓慢氧化的化学方程式:
__________。
8.小明在探究CO2和NaOH是否发生反应时,设计出下列三种装置进行实验,请回答以下几个问题:
(1)以上三个实验中,①③有明显现象,请你帮小明记录他观察到的实验现象:实验①____________;实验③____________。
(2)实验②因选用仪器不当导致未能观察到明显现象,请你帮小明寻找一种物品替代该装置中的广口瓶,以使实验取得成功,你将选用的物品是____________,改进后能看到的实验现象是____________。
(3)小余同学提出了质疑,他认为小明改进后的实验还不足以证明CO2与NaOH确实发生了反应,理由是____________,需补充对照实验将氢氧化钠溶液换成等体积的____________。
9.如图为“盐的化学性质”思维导图。请根据图示,选择如表给出的物质完成填空:(每种物质只能选用一次)
HCl CuSO4 Ca(OH)2 Na2SO4
BaCl2 Na2CO3 CaCO3 Fe
(1)反应①选用的盐是____________,该反应属于____________反应(填基本反应类型)。
(2)反应③所生成的盐不溶于水,且在高温下能分解为____________和____________(用化学式填答)。
(3)写出编号对应反应的化学方程式:
②____________;
④____________;
巩固提高
一、选择题
10.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A.图中b点所示溶液中,溶质是NaCl
B.向图中c点所示溶液中滴加无色酚酞,溶液不变色
C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
11.将粗盐溶解、过滤,除去泥沙后,溶液中仍含有少量的CaCl2、MgC12、Na2SO4,为除去这些杂质,需用到①BaC12溶液 ②Na2 CO3溶液 ③NaOH溶液三种试剂(为将杂质除尽所加试剂均稍过量,且过量物质须在后续操作中被除去),充分反应后,过滤,冉向滤液中加入适量的稀盐酸,加热蒸发,即可获得较为纯净的NaC1固体。以上三种试剂的加入顺序不正确的是( )
A.①②③ B.①③② C.②③① D.③①②
12.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是( )
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
二、填空与计算题
13.归纳是学习化学的重要方法。小明总结出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应)。
(1)在图中空白方框中可填写指示剂或____________(填物质类别)。
(2)若图中的酸为盐酸,反应④中有白色沉淀生成,则对应的盐为____________(填化学式)。
(3)写出一个符合反应⑦的化学方程式:____________。
(4)验证反应①,可选择下列____________(填字母)两种物质进行反应。
A.Na2SO4 B.KNO3 C.Ba(OH)2 D.NaOH
(5)碱具有相似化学性质的原因是____________。
14.工业纯碱中常含有少量的氯化钠。某学习小组对其组成展开探究。现取24g纯碱样品,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀20g。完成下列问题:
(1)反应后溶液中含有的溶质是_________(写化学式)。
(2)通过已知数据,能求出的量有_________(写字母序号)。
A.反应后溶液的总质量 B.参加反应的氯化钙的质量
C.样品中碳酸钠的质量分数 D.氯化钙溶液中溶质的质量分数
(3)计算反应后溶液中氯化钠的质量分数。(写出计算过程,结果保留到0.1%)
参考答案
基础强化
1.A 2.B 3.D 4.C 5.C 6.A
7.(1)BC (2)①糖类 蛋白质 ②延展性 ③CaO+H2O=Ca(OH)2 (3)C6H12O6+6O26CO2 +6H2O
8.(1)试管内液面升高 气球鼓起 (2)软塑料瓶 软塑料瓶变瘪 (3)二氧化碳能和水反应 水
9.(1)CuSO4 置换 (2)CaO CO2 (3)②CaCO3+2HCl=CaCl2+H2O+CO2↑ ④BaCl2+Na2SO4 =BaSO4↓+2NaCl
巩固提高
10.B 11.C 12.C
13.(1)非金属氧化物 (2)AgNO3 (3)Fe2O3+6HCl=2FeCl3+3H2O(合理即可) (4)AC (5)碱溶液中都含有OH-
14.(1)CaCl2、NaCl (2)ABC
(3)根据质量守恒定律可得,反应后溶液的质量为24g+100g+96g-20g=200g,反应生成的沉淀20g即为反应生成的碳酸钙的质量,参加反应的氯化钙的质量为x,碳酸钠的质量为y,生成的氯化钠的质量为z。
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
x y 20g z
===
x=22.2g y=21.2g z=23.4g
反应后溶液中氯化钠的质量分数为×100%=13.1%。
答:略。
同课章节目录
