7.1.3 烷烃的性质 课件(共40张PPT含视频) 化学人教版(2019)必修第二册
文档属性
| 名称 | 7.1.3 烷烃的性质 课件(共40张PPT含视频) 化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 34.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-25 16:49:46 | ||
图片预览










文档简介
(共40张PPT)
第一节 认识有机化合物
第3课时:烷烃的性质
第七章 有机化合物
烷烃的物理性质
01
烷烃的化学性质
02
学习目标
1.通过甲烷的燃料实验和现象观察及原理分析,由甲烷的燃烧实验现象,推测烷烃燃烧反应的特点和规律,感受化学在生活、生产、科学技术中的作用。
2.通过对几种简单烷烃物理性质的数据分析,归纳总结、整理掌握烷烃物理性质的递变性和相似性,初步理解烷烃组成、结构与性质的关系。
3.通过视频演示甲烷的取代反应,认识甲烷与氯气的取代反应原理,知道取代产物的名称及物理性质和用途、有机反应的特点等;树立以客观事实为依据分析问题、解决问题的科学态度和科学方法。
通过前面的学习,我们知道甲烷分子的空间构型为正四面体,C原子位于正四面体的中心,H原子位于四面体的顶点,四个C-H键的键长、键能、键角都相同。甲烷是一种重要的清洁能源,与甲烷相似的多含碳的烷烃在我们的日常生活种也有着广泛的用途。
结构决定性质,本节课我们将在学习甲烷的性质的基础上,进一步认识烷烃的性质。
烷烃的物理性质
烷烃的物理性质
任务一、认识甲烷的物理性质
学生活动1:阅读教材P63页“思考与讨论”,氢结合生活经验和
初中化学的有关知识,思考烷烃在自然界的存在
①甲烷是最简单的烷烃,在自然界主要存在于天然气田、煤矿坑道、池沼等。植物在隔绝空气情况下分解能够产生甲烷,我国是世界上最早发现和利用天然气的国家,比西方要早一千三百年。
②现在我国天然气利用发展很快,常与石油和煤炭伴生,在油田和煤矿附近往往有天然气,它们都是“清洁”的燃料,无毒并且热能高。很多城市由烧煤改烧天然气后,酸雨的危害明显减弱。
③护肤品、医用软膏中的“凡士林”和蜡烛、蜡笔中的石蜡,其主要成分是含碳原子数较多的烷烃。
烷烃的物理性质
任务一、认识甲烷的物理性质
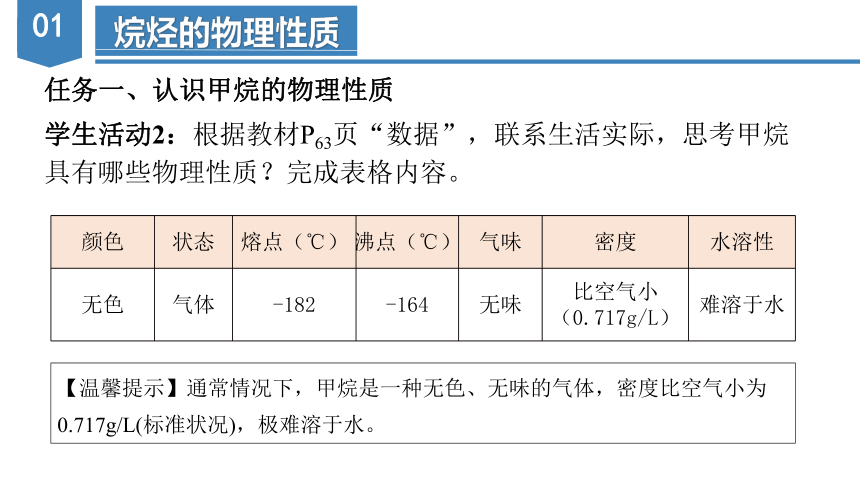
学生活动2:根据教材P63页“数据”,联系生活实际,思考甲烷
具有哪些物理性质?完成表格内容。
颜色 状态 熔点(℃) 沸点(℃) 气味 密度 水溶性
无色 气体 -182 -164 无味 比空气小(0.717g/L) 难溶于水
【温馨提示】通常情况下,甲烷是一种无色、无味的气体,密度比空气小为0.717g/L(标准状况),极难溶于水。
烷烃的物理性质
【典例1】煤矿瓦斯爆炸往往与甲烷有关,下列叙述中错误的是( ) A.点燃甲烷不必事先进行验纯 B.甲烷燃烧放出大量的热,所以是一种很好的气体燃料 C.煤矿的矿井要注意通风并严禁烟火,以防爆炸事故的发生 D.点燃混有空气的甲烷不一定会爆炸
【解析】甲烷的爆炸极限为5%~15.4%(即甲烷体积在空气中含量为5%~15.4%)。若甲烷中混有空气,点燃时可能会发生爆炸,因此点燃之前必须验纯。
A
烷烃的物理性质
【典例2】鉴别甲烷、一氧化碳和氢气3种无色气体的方法是,将它们( )
A.先后通入溴水和澄清石灰水
B.点燃后罩上涂有澄清石灰水的烧杯
C.点燃,先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯
D.点燃后罩上涂有澄清石灰水的烧杯,通入溴水
【解析】CH4、CO和H2与溴水、澄清石灰水都不反应,A项不可选。CH4和CO燃烧都生成CO2,B、D项不可选。干燥的冷烧杯可检验燃烧产物中是否有水生成,涂有澄清石灰水的烧杯可检验燃烧产物中是否有CO2生成。
C
烷烃的物理性质
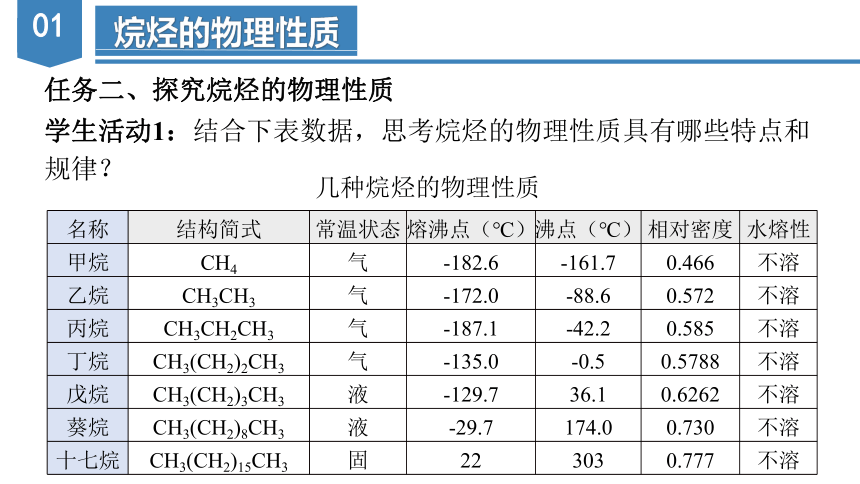
任务二、探究烷烃的物理性质
学生活动1:结合下表数据,思考烷烃的物理性质具有哪些特点和
规律?
几种烷烃的物理性质
名称 结构简式 常温状态 熔沸点(℃) 沸点(℃) 相对密度 水熔性
甲烷 CH4 气 -182.6 -161.7 0.466 不溶
乙烷 CH3CH3 气 -172.0 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -187.1 -42.2 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -135.0 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -129.7 36.1 0.6262 不溶
葵烷 CH3(CH2)8CH3 液 -29.7 174.0 0.730 不溶
十七烷 CH3(CH2)15CH3 固 22 303 0.777 不溶
烷烃的物理性质
任务二、探究烷烃的物理性质
①随分子中碳原子数增加(相对分子质量也在增大),熔、沸点逐渐升高。
②随分子中碳原子数增加,状态由气态→液态→固态,其中常温、常压下碳原子数小于或等于4的烷烃为气态。
③随分子中碳原子数增加(相对分子质量也在增大),密度逐渐增大且均比水的密度小,均难溶于水,易溶于汽油、乙醇、苯等有机溶剂。
④根据教材P63页图7-7可知,当碳原子数相同时,一般支链越多,沸点越低。如沸点:正丁烷>异丁烷。
C1~C4为气态
C5~C16为液态
C17及以上为固态
结构相似,随相对分子质量增大,范德华力逐渐增大
烷烃的物理性质
任务二、探究烷烃的物理性质
学生活动1:探究常温常压下,CH4、C2H6和C3H8一定为气体,C4H10、
C5H12、C6H14一定呈液态吗?
①常温常压下,分子中碳原子数n≤4的烷烃为气态,故C4H10为气态。
②戊烷(C5H12)有三种同分异构体:正戊烷[CH3(CH2)3CH3]熔点-129.7℃、沸点36.1℃、异戊烷[CH3CH2CH(CH3)2]熔点-159.6℃、沸点27.8℃、新戊烷[C(CH3)4]熔点-20℃、沸点9.5℃,因此戊烷中的新戊烷在常温常压下为气体,其余两种为液体
正戊烷
异
戊
烷
新
戊
烷
烷烃的物理性质
【典例1】在1.013×105 Pa下,测得某些烷烃的沸点见下表。据表分
析,下列选项正确的是( )
【解析】由题表信息可知,新戊烷的沸点是9.5 ℃,标准状况下是液体,20 ℃时是气体,A、B项错误;烷烃随碳原子数的增加,熔点升高,C项错误;C5H12的三种同分异构体中,随支链数的增加,沸点降低,D项正确。
D
物质名称及结构简式 沸点/℃
正丁烷CH3(CH2)2CH3 -0.5
正戊烷CH3(CH2)3CH3 36.1
异戊烷 27.8
新戊烷C(CH3)4 9.5
正己烷CH3(CH2)4CH3 69.0
A.在标准状况下,新戊烷是气体B.在1.013×105 Pa、20 ℃时,戊烷
都是液体C.烷烃随碳原子数的增加,熔点降低D.分子式为C5H12的烷烃的同分异构
体中,随支链的增加,沸点降低
烷烃的物理性质
【典例2】在下列5种物质沸点的排列顺序中,正确的是( )
①正丁烷 ②2 甲基丙烷[CH3CH(CH3)CH3] ③戊烷 ④2 甲基丁烷
[CH3CH(CH3)CH2CH3] ⑤2,2 二甲基丙烷[C(CH3)4]
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
【解析】有机物同系物中,随着碳原子数的增加,相对分子质量增大,分子间作用力增大,熔、沸点逐渐升高;分子式相同的烃,支链越多,熔、沸点越低。分析各选项,①②均有4个C原子,③④⑤均有5个碳原子,故①②的沸点小于③④⑤的沸点;②有1个支链,而①无,故①>②;③无支链,④有1个支链,⑤有2个支链,故③>④>⑤。综上所述:③>④>⑤>①>②。
C
烷烃的化学性质
烷烃的化学性质
任务一、探究甲烷的化学性质
烷烃的化学性质
任务一、探究甲烷的化学性质
学生活动1:根据实验视频,阅读教材P64页内容,结合初中学习的
甲烷燃烧实验,回答甲烷具有哪些化学性质?
①通常状况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
②在点燃的条件下,甲烷可以燃烧(氧化反应),产生淡蓝色火焰,产物为CO2和H2O,氧气不足时会生成CO和H2O。化学方程式:CH4+2O2 CO2+2H2O。
③煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。因此,点燃甲烷前,要先检验甲烷的纯度。
注意通风、验纯;玻璃导管点燃呈黄色
烷烃的化学性质
任务一、探究甲烷的化学性质
烷烃的化学性质
任务一、探究甲烷的化学性质
学生活动2:实验探究:观看实验视频,结合教材P64页【实验7-1】,
思考什么是取代反应?甲烷与Cl2的取代反应的条件及原理是什么?
填写表格内容。
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处 实验装置
实验现象
a.试管内气体颜色逐渐变浅;b.试管壁出现油状液滴;c.试管内,水面上升
在室温下,无光照时,无明显现象
烷烃的化学性质
任务一、探究甲烷的化学性质
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处
实验原理
光
H
C
H
H
H
Cl Cl
+
H
C
H
H
Cl
+ H Cl
一氯甲烷(沸点:-24.2℃)—气体
+ Cl-Cl
H-C-Cl
Cl
H
+ H-Cl
光
二氯甲烷(沸点:39.8℃—油状液体)
H-C-Cl
H
H
烷烃的化学性质
任务一、探究甲烷的化学性质
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处
实验原理
光
H-C-Cl
Cl
H
+ Cl-Cl
H-C-Cl
Cl
Cl
+ H-Cl
三氯甲烷(沸点:61.7℃—油状液体)
H—C—Cl
Cl
Cl
+ Cl—Cl
Cl—C—Cl
Cl
Cl
+ H—Cl
光
四氯甲烷(沸点:76.5℃—油状液体)
烷烃的化学性质
任务一、探究甲烷的化学性质
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处
实验原理
实验结论
条件:光照。类型:取代反应。产物:五种(四种有机物,一种无机物)
注意:CH3Cl(一氯甲烷)、CH2Cl2(二氯甲烷)、CHCl3(三氯甲烷或氯仿)、CCl4(四氯甲烷或四氯化碳)均不溶于水;常温下除CH3Cl是气态,其余三种均为液态;CHCl3和CCl4是工业上重要的有机溶剂。
CHCl3+Cl2 CCl4+HCl
光
CH3Cl+Cl2 CH2Cl2+HCl
光
CH2Cl2+Cl2 CHCl3+HCl
光
CH4+Cl2 CH3Cl+HCl
光
烷烃的化学性质
任务一、探究甲烷的化学性质
定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫取代反应。
【温馨提示】①取代反应条件为光照,室温或暗处不发生反应,但不能用强光直接照射,以免引起爆炸。②甲烷与溴蒸气、碘蒸气等纯卤素单质也能发生类似反应,但不能与溴水、碘水发生反应。③甲烷与氯气的反应是一种连锁反应,不会停留在某一步,因此产物一般是五种物质的混合物。④1 mol有机物CxHy与Cl2发生完全取代反应时,消耗Cl2的物质的量为y mol,同时生成y mol HCl,产物中HCl的物质的量最多。
烷烃的化学性质
【典例1】下列有关甲烷的取代反应的叙述正确的是( ) A.甲烷与氯气的物质的量之比为1∶1,混合发生取代反应只生
成CH3Cl B.甲烷与氯气的取代反应,生成的产物中CH3Cl的量最多 C.甲烷与氯气的取代反应生成的产物为混合物 D.1 mol甲烷生成CCl4最多消耗2 mol氯气
【解析】甲烷与氯气发生取代反应生成四种氯代物和HCl,故得不到纯净的CH3Cl,A错误,C正确;甲烷与氯气的反应中每取代1 mol氢原子,消耗1 mol氯气,生成1 mol HCl,故产物中HCl的量最多,B错误;1 mol甲烷生成CCl4最多消耗4 mol氯气,D错误。
C
烷烃的化学性质
【典例2】实验室中用如图所示的装置进行甲烷与氯气在光照下反
应的实验,光照下反应一段时间后,下列说法正确的是( )
A.反应后的混合气体能使湿润的石蕊试纸
变红说明生成的一氯甲烷具有酸性
B.产物之一氯仿在常温下为液态
C.甲烷和氯气在光照条件下反应,只能生成四种含氯的化合物
D.CH4和Cl2完全反应后液面上升,液体可能会充满试管
B
烷烃的化学性质
【解析】A. 甲烷与氯气在光照下反应后的混合气体中,只有HCl能使湿润的石蕊试纸变红,不是一氯甲烷,故A错误;B. 氯仿在常温下为液态,故B正确;C. 甲烷和氯气在光照条件下反应,生成HCl和四种氯代烃,共五种含氯的化合物,故C错误;D. 反应生成的一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷均难溶于水,一氯甲烷为气体,二氯甲烷、三氯甲烷、四氯甲烷为油状液体,氯化氢极易溶于水,故CH4和Cl2完全反应后液面上升,但是液体不会充满试管,故D错误;故选B。
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动1:根据结构决定性质的原理,与甲烷相似,烷烃应该具
有与甲烷相似的化学性质,思考烷烃的化学性质有何规律和特点?
①稳定性:在通常情况下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不发生反应。
②可燃性(氧化反应):烷烃可以在空气中完全燃烧,生成二氧化碳和水,并放出大量的热。如丙烷燃烧:C3H8+5O2 3CO2+4H2O。
③取代反应:烷烃在一定条件(光照)下,可以与卤素单质发生取代反应。如CH3CH3+Cl2 CH3CH2Cl+HCl
光
④受热分解:
C4H10 CH4+C3H6或C4H10 C2H6+C2H4
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动2:问题探究1—烃的燃烧有何规律?
①气态烃完全燃烧体积变化的规律
ΔV=V后-V前
1 x+y/4 x y/2
CxHy + O2 x CO2 + H2O
点燃
y
4
( x+ )
y
2
—
若水为气态,ΔV=y/4-1。
当y>4,ΔV>0,气体总体积变大;当y=4,ΔV=0,气体总体积不变,CH4、C2H4、C3H4符合;当y<4,ΔV<0,气体总体积变小,只有C2H2符合
若水为液态,ΔV=-(1+y/4),气体体积始终减小,且量只与氢原子数有关。
烷烃的化学性质
任务二、探究烷烃的化学性质
②等量的不同烃(CxHy)完全燃烧时的耗氧量与产物的量的关系
等质量 等物质的量
耗氧量 y/x越大,耗氧量越多 (x+y/4)越大,耗氧量越多
产物量 y/x越大,生成的CO2越少而水越多 x值越大,生成的CO2越多;y越大,生成的水越多
【温馨提示】y/x越大,则烃中含氢元素的质量分数会越大,质量一定的烃,氢元素的质量就越多,碳元素的质量就越小,而等质量的氢元素和碳元素相比显然氢元素耗氧量多,所以等质量的烃,氢元素质量分数越大,耗氧量就越多,生成的水就越多。同理可以得出最简式相同的不同烃(或它们的混合物),质量一定时,耗氧量为定值,与各烃的含量无关。
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动2:问题探究2—烷烃的取代反应与置换反应有何异同?
取代反应 置换反应
概念
通式
(分别断键,重新组合,C、D可以相同,也可以不同)
单质+化合物→单质+化合物
一种单质和一种化合物反应生成另一种单质和另一种化合物的反应
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动2:问题探究2—烷烃的取代反应与置换反应有何异同?
取代反应 置换反应
比较
实例
①反应物中可以有单质,也可以没有单质;②反应能否进行受催化剂、温度、光照等外界条件影响;③逐步取代。由于共价键断裂而交换原子或原子团,一般生成两种新化合物。
①反应物、产物中一定有单质;②在水溶液中进行的置换反应遵循金属或非金属活动性顺序;③反应一般单向进行。单质与化合物通过电子的转移而发生氧化还原反应。
CH3CH3+Cl2 CH3CH2Cl+HCl
光
H2+CuO Cu+H2O
Cl2+2KI===2KCl+I2
烷烃的化学性质
【典例1】下列有关烷烃的叙述中,错误的是( )
A. 正戊烷、异戊烷和新戊烷的熔、沸点依次升高
B. 烷烃在光照条件下能与发生取代反应
C. 烷烃的分子通式为CnH2n+2,符合该通式的烃一定是烷烃
D. 烷烃分子中的化学键只有单键
【解析】相同碳原子的烷烃,支链越多,沸点越低,则正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次降低,A错;烷烃为饱和烃,能与氯气在光照条件下发生取代反应,B正确;分子通式为CnH2n+2的烃,一定属于烷烃,C正确;烷烃分子中碳原子形成四个共价键全是单键,形成的烷烃为饱和链烃,每个碳原子都形成四个单键,D正确;故选A。
A
烷烃的化学性质
【典例2】下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键;②烷烃中除甲烷外,
很多都能使酸性的高锰酸钾溶液褪色;③分子通式为CnH2n+2
的烃不一定是烷烃;④所有的烷烃在光照条件下都能和氯气发
生取代反应;⑤光照条件下,乙烷通入溴水中,可使溴水褪色;
⑥随着碳原子数的依次增加,烷烃中碳的质量分数逐渐增大,
无限趋近于6/7。
A.①③⑤ B.②③④
C.①④⑥ D.②④⑥
C
烷烃的化学性质
【解析】①在烷烃分子中,都存在C-H键,除甲烷外其余烷烃分子中还存在C-C键,C-H及C-C键都是单键,①正确;②烷烃性质稳定,所有的烷烃都不能使酸性的高锰酸钾溶液褪色,②错误;③分子通式为CnH2n+2的烃一定是烷烃,③错误;④烷烃的特种反应是取代反应,所有的烷烃在光照条件下都能和氯气发生取代反应,④正确;⑤光照条件下,乙烷通入溴水中,不能发生反应,因此不能使溴水褪色,⑤错误;⑥烷烃分子式通式是CnH2n+2,其分子中C元素的含量为12n/(14n+2),当n趋于无穷时,14n+2≈14n,此时C元素的含量为6/7,即随着碳原子数的依次增加,烷烃中碳的质量分数逐渐增大,无限趋近于6/7,⑥正确;综上所述可知:有关烷烃的叙述中,正确的是①④⑥,故合理选项是C。
1.天然气主要成分为甲烷。下列关于甲烷叙述中错误的是( )
A.通常情况下,甲烷与强酸、强碱、强氧化剂都不反应
B.甲烷的化学性质比较稳定,点燃前不必验纯
C.甲烷与氯气反应,生成CH3Cl、CH2Cl2、CHCl3或CCl4,都属
于取代反应
D.甲烷的四种有机氯代产物都难溶于水
B
【解析】A项,通常情况下,CH4性质稳定,不与强酸、强碱、强氧化剂反应,正确;B项,可燃性气体在加热或点燃前都要验纯,以防发生爆炸,错误;C项,CH4与Cl2的反应是逐步进行的,每步都属于取代反应,正确;D项,CH3Cl、CH2Cl2、CHCl3、CCl4都属于卤代烃,难溶于水,正确。
2.下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以,CH2Cl2有两种不同
构型
B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色
C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安
全的重要威胁之一
D.甲烷能使酸性KMnO4溶液褪色
C
【解析】A项,由于甲烷是正四面体结构,四个顶点中任意两个氢原子都是相邻关系,故CH2Cl2只有一种构型。B项,CH4只能跟氯气在光照下反应,与氯水不反应。D项,CH4比较稳定,不能被酸性KMnO4溶液氧化。
3.下列关于甲烷及烷烃的结构及性质的说法错误的是( )
A.烷烃均难溶于水,相对密度均小于1
B.烷烃不能使酸性高锰酸钾溶液褪色,因此,不能发生氧化反应
C.物质的沸点:正戊烷>异戊烷>正丁烷>丙烷
D.甲烷分子中的4个C—H键的长度相同,相互之间的夹角相等,
所以甲烷的空间结构为正四面体
B
【解析】烃类由C、H两种元素组成,密度均小于水,而烷烃均难溶于水,相对密度均小于1,A正确;烷烃可以燃烧,能发生氧化反应,B错;碳原子数越多、沸点越高;相同碳原子数的烷烃,支链越多、沸点越低,则沸点正戊烷>异戊烷、丁烷>丙烷、正戊烷>异戊烷>正丁烷>丙烷,C正确;甲烷分子中的4个C—H键的长度相同,相互之间的夹角相等,甲烷的空间结构为正四面体,D正确。
4.丁烷(分子式C4H10)广泛应用于家用液化石油气,也用于打火机
中作燃料。下列关于丁烷的叙述不正确的是( )
A.在常温常压下,C4H10是气体
B.丁烷有正丁烷与异丁烷两种同分异构体
C.C4H10与CH4互称为同系物
D.C4H10进行一氯取代后生成3种沸点不同的产物
D
【解析】烃分子中C原子数小于等于4时,在常温为气态,故在常温常压下,C4H10是气体,A正确;丁烷分为正丁烷和异丁烷两种不同结构,二者互为同分异构体,B正确;C4H10与CH4结构相似,在分子组成上相差3个CH2原子团,二者互称为同系物,C正确;C4H10有正丁烷、异丁烷两种不同结构,每种物质分子中都存在两种不同位置的H原子,因此分子式是C4H10的物质进行一氯取代后生成4种沸点不同的产物,D错误;故选D。
延时符
烷烃的性质
难溶于水,随碳原子数递增,熔沸点、密度逐渐增大;
碳原子数相同,含支链越多,熔沸点越低;状态:气(C≤4)→液→固(C≥17)
①稳定性:与强酸、强碱或高锰酸钾等强氧化剂不反应;②氧化反应:可燃烧(CH4 :淡蓝色火焰);③高温分解;④取代反应:与卤素单质光照取代(多种产物)。
化学性质
物理性质
第3课时 烷烃的性质
第一节 认识有机化合物
第3课时:烷烃的性质
第七章 有机化合物
烷烃的物理性质
01
烷烃的化学性质
02
学习目标
1.通过甲烷的燃料实验和现象观察及原理分析,由甲烷的燃烧实验现象,推测烷烃燃烧反应的特点和规律,感受化学在生活、生产、科学技术中的作用。
2.通过对几种简单烷烃物理性质的数据分析,归纳总结、整理掌握烷烃物理性质的递变性和相似性,初步理解烷烃组成、结构与性质的关系。
3.通过视频演示甲烷的取代反应,认识甲烷与氯气的取代反应原理,知道取代产物的名称及物理性质和用途、有机反应的特点等;树立以客观事实为依据分析问题、解决问题的科学态度和科学方法。
通过前面的学习,我们知道甲烷分子的空间构型为正四面体,C原子位于正四面体的中心,H原子位于四面体的顶点,四个C-H键的键长、键能、键角都相同。甲烷是一种重要的清洁能源,与甲烷相似的多含碳的烷烃在我们的日常生活种也有着广泛的用途。
结构决定性质,本节课我们将在学习甲烷的性质的基础上,进一步认识烷烃的性质。
烷烃的物理性质
烷烃的物理性质
任务一、认识甲烷的物理性质
学生活动1:阅读教材P63页“思考与讨论”,氢结合生活经验和
初中化学的有关知识,思考烷烃在自然界的存在
①甲烷是最简单的烷烃,在自然界主要存在于天然气田、煤矿坑道、池沼等。植物在隔绝空气情况下分解能够产生甲烷,我国是世界上最早发现和利用天然气的国家,比西方要早一千三百年。
②现在我国天然气利用发展很快,常与石油和煤炭伴生,在油田和煤矿附近往往有天然气,它们都是“清洁”的燃料,无毒并且热能高。很多城市由烧煤改烧天然气后,酸雨的危害明显减弱。
③护肤品、医用软膏中的“凡士林”和蜡烛、蜡笔中的石蜡,其主要成分是含碳原子数较多的烷烃。
烷烃的物理性质
任务一、认识甲烷的物理性质
学生活动2:根据教材P63页“数据”,联系生活实际,思考甲烷
具有哪些物理性质?完成表格内容。
颜色 状态 熔点(℃) 沸点(℃) 气味 密度 水溶性
无色 气体 -182 -164 无味 比空气小(0.717g/L) 难溶于水
【温馨提示】通常情况下,甲烷是一种无色、无味的气体,密度比空气小为0.717g/L(标准状况),极难溶于水。
烷烃的物理性质
【典例1】煤矿瓦斯爆炸往往与甲烷有关,下列叙述中错误的是( ) A.点燃甲烷不必事先进行验纯 B.甲烷燃烧放出大量的热,所以是一种很好的气体燃料 C.煤矿的矿井要注意通风并严禁烟火,以防爆炸事故的发生 D.点燃混有空气的甲烷不一定会爆炸
【解析】甲烷的爆炸极限为5%~15.4%(即甲烷体积在空气中含量为5%~15.4%)。若甲烷中混有空气,点燃时可能会发生爆炸,因此点燃之前必须验纯。
A
烷烃的物理性质
【典例2】鉴别甲烷、一氧化碳和氢气3种无色气体的方法是,将它们( )
A.先后通入溴水和澄清石灰水
B.点燃后罩上涂有澄清石灰水的烧杯
C.点燃,先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯
D.点燃后罩上涂有澄清石灰水的烧杯,通入溴水
【解析】CH4、CO和H2与溴水、澄清石灰水都不反应,A项不可选。CH4和CO燃烧都生成CO2,B、D项不可选。干燥的冷烧杯可检验燃烧产物中是否有水生成,涂有澄清石灰水的烧杯可检验燃烧产物中是否有CO2生成。
C
烷烃的物理性质
任务二、探究烷烃的物理性质
学生活动1:结合下表数据,思考烷烃的物理性质具有哪些特点和
规律?
几种烷烃的物理性质
名称 结构简式 常温状态 熔沸点(℃) 沸点(℃) 相对密度 水熔性
甲烷 CH4 气 -182.6 -161.7 0.466 不溶
乙烷 CH3CH3 气 -172.0 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -187.1 -42.2 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -135.0 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -129.7 36.1 0.6262 不溶
葵烷 CH3(CH2)8CH3 液 -29.7 174.0 0.730 不溶
十七烷 CH3(CH2)15CH3 固 22 303 0.777 不溶
烷烃的物理性质
任务二、探究烷烃的物理性质
①随分子中碳原子数增加(相对分子质量也在增大),熔、沸点逐渐升高。
②随分子中碳原子数增加,状态由气态→液态→固态,其中常温、常压下碳原子数小于或等于4的烷烃为气态。
③随分子中碳原子数增加(相对分子质量也在增大),密度逐渐增大且均比水的密度小,均难溶于水,易溶于汽油、乙醇、苯等有机溶剂。
④根据教材P63页图7-7可知,当碳原子数相同时,一般支链越多,沸点越低。如沸点:正丁烷>异丁烷。
C1~C4为气态
C5~C16为液态
C17及以上为固态
结构相似,随相对分子质量增大,范德华力逐渐增大
烷烃的物理性质
任务二、探究烷烃的物理性质
学生活动1:探究常温常压下,CH4、C2H6和C3H8一定为气体,C4H10、
C5H12、C6H14一定呈液态吗?
①常温常压下,分子中碳原子数n≤4的烷烃为气态,故C4H10为气态。
②戊烷(C5H12)有三种同分异构体:正戊烷[CH3(CH2)3CH3]熔点-129.7℃、沸点36.1℃、异戊烷[CH3CH2CH(CH3)2]熔点-159.6℃、沸点27.8℃、新戊烷[C(CH3)4]熔点-20℃、沸点9.5℃,因此戊烷中的新戊烷在常温常压下为气体,其余两种为液体
正戊烷
异
戊
烷
新
戊
烷
烷烃的物理性质
【典例1】在1.013×105 Pa下,测得某些烷烃的沸点见下表。据表分
析,下列选项正确的是( )
【解析】由题表信息可知,新戊烷的沸点是9.5 ℃,标准状况下是液体,20 ℃时是气体,A、B项错误;烷烃随碳原子数的增加,熔点升高,C项错误;C5H12的三种同分异构体中,随支链数的增加,沸点降低,D项正确。
D
物质名称及结构简式 沸点/℃
正丁烷CH3(CH2)2CH3 -0.5
正戊烷CH3(CH2)3CH3 36.1
异戊烷 27.8
新戊烷C(CH3)4 9.5
正己烷CH3(CH2)4CH3 69.0
A.在标准状况下,新戊烷是气体B.在1.013×105 Pa、20 ℃时,戊烷
都是液体C.烷烃随碳原子数的增加,熔点降低D.分子式为C5H12的烷烃的同分异构
体中,随支链的增加,沸点降低
烷烃的物理性质
【典例2】在下列5种物质沸点的排列顺序中,正确的是( )
①正丁烷 ②2 甲基丙烷[CH3CH(CH3)CH3] ③戊烷 ④2 甲基丁烷
[CH3CH(CH3)CH2CH3] ⑤2,2 二甲基丙烷[C(CH3)4]
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
【解析】有机物同系物中,随着碳原子数的增加,相对分子质量增大,分子间作用力增大,熔、沸点逐渐升高;分子式相同的烃,支链越多,熔、沸点越低。分析各选项,①②均有4个C原子,③④⑤均有5个碳原子,故①②的沸点小于③④⑤的沸点;②有1个支链,而①无,故①>②;③无支链,④有1个支链,⑤有2个支链,故③>④>⑤。综上所述:③>④>⑤>①>②。
C
烷烃的化学性质
烷烃的化学性质
任务一、探究甲烷的化学性质
烷烃的化学性质
任务一、探究甲烷的化学性质
学生活动1:根据实验视频,阅读教材P64页内容,结合初中学习的
甲烷燃烧实验,回答甲烷具有哪些化学性质?
①通常状况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
②在点燃的条件下,甲烷可以燃烧(氧化反应),产生淡蓝色火焰,产物为CO2和H2O,氧气不足时会生成CO和H2O。化学方程式:CH4+2O2 CO2+2H2O。
③煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。因此,点燃甲烷前,要先检验甲烷的纯度。
注意通风、验纯;玻璃导管点燃呈黄色
烷烃的化学性质
任务一、探究甲烷的化学性质
烷烃的化学性质
任务一、探究甲烷的化学性质
学生活动2:实验探究:观看实验视频,结合教材P64页【实验7-1】,
思考什么是取代反应?甲烷与Cl2的取代反应的条件及原理是什么?
填写表格内容。
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处 实验装置
实验现象
a.试管内气体颜色逐渐变浅;b.试管壁出现油状液滴;c.试管内,水面上升
在室温下,无光照时,无明显现象
烷烃的化学性质
任务一、探究甲烷的化学性质
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处
实验原理
光
H
C
H
H
H
Cl Cl
+
H
C
H
H
Cl
+ H Cl
一氯甲烷(沸点:-24.2℃)—气体
+ Cl-Cl
H-C-Cl
Cl
H
+ H-Cl
光
二氯甲烷(沸点:39.8℃—油状液体)
H-C-Cl
H
H
烷烃的化学性质
任务一、探究甲烷的化学性质
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处
实验原理
光
H-C-Cl
Cl
H
+ Cl-Cl
H-C-Cl
Cl
Cl
+ H-Cl
三氯甲烷(沸点:61.7℃—油状液体)
H—C—Cl
Cl
Cl
+ Cl—Cl
Cl—C—Cl
Cl
Cl
+ H—Cl
光
四氯甲烷(沸点:76.5℃—油状液体)
烷烃的化学性质
任务一、探究甲烷的化学性质
实验操作 取两支试管,均通过排饱和食盐水的方法,收集半试管CH4和半试管Cl2。将其中一支试管用铝箔套套上,另一支试管放在光亮处
实验原理
实验结论
条件:光照。类型:取代反应。产物:五种(四种有机物,一种无机物)
注意:CH3Cl(一氯甲烷)、CH2Cl2(二氯甲烷)、CHCl3(三氯甲烷或氯仿)、CCl4(四氯甲烷或四氯化碳)均不溶于水;常温下除CH3Cl是气态,其余三种均为液态;CHCl3和CCl4是工业上重要的有机溶剂。
CHCl3+Cl2 CCl4+HCl
光
CH3Cl+Cl2 CH2Cl2+HCl
光
CH2Cl2+Cl2 CHCl3+HCl
光
CH4+Cl2 CH3Cl+HCl
光
烷烃的化学性质
任务一、探究甲烷的化学性质
定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫取代反应。
【温馨提示】①取代反应条件为光照,室温或暗处不发生反应,但不能用强光直接照射,以免引起爆炸。②甲烷与溴蒸气、碘蒸气等纯卤素单质也能发生类似反应,但不能与溴水、碘水发生反应。③甲烷与氯气的反应是一种连锁反应,不会停留在某一步,因此产物一般是五种物质的混合物。④1 mol有机物CxHy与Cl2发生完全取代反应时,消耗Cl2的物质的量为y mol,同时生成y mol HCl,产物中HCl的物质的量最多。
烷烃的化学性质
【典例1】下列有关甲烷的取代反应的叙述正确的是( ) A.甲烷与氯气的物质的量之比为1∶1,混合发生取代反应只生
成CH3Cl B.甲烷与氯气的取代反应,生成的产物中CH3Cl的量最多 C.甲烷与氯气的取代反应生成的产物为混合物 D.1 mol甲烷生成CCl4最多消耗2 mol氯气
【解析】甲烷与氯气发生取代反应生成四种氯代物和HCl,故得不到纯净的CH3Cl,A错误,C正确;甲烷与氯气的反应中每取代1 mol氢原子,消耗1 mol氯气,生成1 mol HCl,故产物中HCl的量最多,B错误;1 mol甲烷生成CCl4最多消耗4 mol氯气,D错误。
C
烷烃的化学性质
【典例2】实验室中用如图所示的装置进行甲烷与氯气在光照下反
应的实验,光照下反应一段时间后,下列说法正确的是( )
A.反应后的混合气体能使湿润的石蕊试纸
变红说明生成的一氯甲烷具有酸性
B.产物之一氯仿在常温下为液态
C.甲烷和氯气在光照条件下反应,只能生成四种含氯的化合物
D.CH4和Cl2完全反应后液面上升,液体可能会充满试管
B
烷烃的化学性质
【解析】A. 甲烷与氯气在光照下反应后的混合气体中,只有HCl能使湿润的石蕊试纸变红,不是一氯甲烷,故A错误;B. 氯仿在常温下为液态,故B正确;C. 甲烷和氯气在光照条件下反应,生成HCl和四种氯代烃,共五种含氯的化合物,故C错误;D. 反应生成的一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷均难溶于水,一氯甲烷为气体,二氯甲烷、三氯甲烷、四氯甲烷为油状液体,氯化氢极易溶于水,故CH4和Cl2完全反应后液面上升,但是液体不会充满试管,故D错误;故选B。
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动1:根据结构决定性质的原理,与甲烷相似,烷烃应该具
有与甲烷相似的化学性质,思考烷烃的化学性质有何规律和特点?
①稳定性:在通常情况下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不发生反应。
②可燃性(氧化反应):烷烃可以在空气中完全燃烧,生成二氧化碳和水,并放出大量的热。如丙烷燃烧:C3H8+5O2 3CO2+4H2O。
③取代反应:烷烃在一定条件(光照)下,可以与卤素单质发生取代反应。如CH3CH3+Cl2 CH3CH2Cl+HCl
光
④受热分解:
C4H10 CH4+C3H6或C4H10 C2H6+C2H4
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动2:问题探究1—烃的燃烧有何规律?
①气态烃完全燃烧体积变化的规律
ΔV=V后-V前
1 x+y/4 x y/2
CxHy + O2 x CO2 + H2O
点燃
y
4
( x+ )
y
2
—
若水为气态,ΔV=y/4-1。
当y>4,ΔV>0,气体总体积变大;当y=4,ΔV=0,气体总体积不变,CH4、C2H4、C3H4符合;当y<4,ΔV<0,气体总体积变小,只有C2H2符合
若水为液态,ΔV=-(1+y/4),气体体积始终减小,且量只与氢原子数有关。
烷烃的化学性质
任务二、探究烷烃的化学性质
②等量的不同烃(CxHy)完全燃烧时的耗氧量与产物的量的关系
等质量 等物质的量
耗氧量 y/x越大,耗氧量越多 (x+y/4)越大,耗氧量越多
产物量 y/x越大,生成的CO2越少而水越多 x值越大,生成的CO2越多;y越大,生成的水越多
【温馨提示】y/x越大,则烃中含氢元素的质量分数会越大,质量一定的烃,氢元素的质量就越多,碳元素的质量就越小,而等质量的氢元素和碳元素相比显然氢元素耗氧量多,所以等质量的烃,氢元素质量分数越大,耗氧量就越多,生成的水就越多。同理可以得出最简式相同的不同烃(或它们的混合物),质量一定时,耗氧量为定值,与各烃的含量无关。
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动2:问题探究2—烷烃的取代反应与置换反应有何异同?
取代反应 置换反应
概念
通式
(分别断键,重新组合,C、D可以相同,也可以不同)
单质+化合物→单质+化合物
一种单质和一种化合物反应生成另一种单质和另一种化合物的反应
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应
烷烃的化学性质
任务二、探究烷烃的化学性质
学生活动2:问题探究2—烷烃的取代反应与置换反应有何异同?
取代反应 置换反应
比较
实例
①反应物中可以有单质,也可以没有单质;②反应能否进行受催化剂、温度、光照等外界条件影响;③逐步取代。由于共价键断裂而交换原子或原子团,一般生成两种新化合物。
①反应物、产物中一定有单质;②在水溶液中进行的置换反应遵循金属或非金属活动性顺序;③反应一般单向进行。单质与化合物通过电子的转移而发生氧化还原反应。
CH3CH3+Cl2 CH3CH2Cl+HCl
光
H2+CuO Cu+H2O
Cl2+2KI===2KCl+I2
烷烃的化学性质
【典例1】下列有关烷烃的叙述中,错误的是( )
A. 正戊烷、异戊烷和新戊烷的熔、沸点依次升高
B. 烷烃在光照条件下能与发生取代反应
C. 烷烃的分子通式为CnH2n+2,符合该通式的烃一定是烷烃
D. 烷烃分子中的化学键只有单键
【解析】相同碳原子的烷烃,支链越多,沸点越低,则正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次降低,A错;烷烃为饱和烃,能与氯气在光照条件下发生取代反应,B正确;分子通式为CnH2n+2的烃,一定属于烷烃,C正确;烷烃分子中碳原子形成四个共价键全是单键,形成的烷烃为饱和链烃,每个碳原子都形成四个单键,D正确;故选A。
A
烷烃的化学性质
【典例2】下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键;②烷烃中除甲烷外,
很多都能使酸性的高锰酸钾溶液褪色;③分子通式为CnH2n+2
的烃不一定是烷烃;④所有的烷烃在光照条件下都能和氯气发
生取代反应;⑤光照条件下,乙烷通入溴水中,可使溴水褪色;
⑥随着碳原子数的依次增加,烷烃中碳的质量分数逐渐增大,
无限趋近于6/7。
A.①③⑤ B.②③④
C.①④⑥ D.②④⑥
C
烷烃的化学性质
【解析】①在烷烃分子中,都存在C-H键,除甲烷外其余烷烃分子中还存在C-C键,C-H及C-C键都是单键,①正确;②烷烃性质稳定,所有的烷烃都不能使酸性的高锰酸钾溶液褪色,②错误;③分子通式为CnH2n+2的烃一定是烷烃,③错误;④烷烃的特种反应是取代反应,所有的烷烃在光照条件下都能和氯气发生取代反应,④正确;⑤光照条件下,乙烷通入溴水中,不能发生反应,因此不能使溴水褪色,⑤错误;⑥烷烃分子式通式是CnH2n+2,其分子中C元素的含量为12n/(14n+2),当n趋于无穷时,14n+2≈14n,此时C元素的含量为6/7,即随着碳原子数的依次增加,烷烃中碳的质量分数逐渐增大,无限趋近于6/7,⑥正确;综上所述可知:有关烷烃的叙述中,正确的是①④⑥,故合理选项是C。
1.天然气主要成分为甲烷。下列关于甲烷叙述中错误的是( )
A.通常情况下,甲烷与强酸、强碱、强氧化剂都不反应
B.甲烷的化学性质比较稳定,点燃前不必验纯
C.甲烷与氯气反应,生成CH3Cl、CH2Cl2、CHCl3或CCl4,都属
于取代反应
D.甲烷的四种有机氯代产物都难溶于水
B
【解析】A项,通常情况下,CH4性质稳定,不与强酸、强碱、强氧化剂反应,正确;B项,可燃性气体在加热或点燃前都要验纯,以防发生爆炸,错误;C项,CH4与Cl2的反应是逐步进行的,每步都属于取代反应,正确;D项,CH3Cl、CH2Cl2、CHCl3、CCl4都属于卤代烃,难溶于水,正确。
2.下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以,CH2Cl2有两种不同
构型
B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色
C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安
全的重要威胁之一
D.甲烷能使酸性KMnO4溶液褪色
C
【解析】A项,由于甲烷是正四面体结构,四个顶点中任意两个氢原子都是相邻关系,故CH2Cl2只有一种构型。B项,CH4只能跟氯气在光照下反应,与氯水不反应。D项,CH4比较稳定,不能被酸性KMnO4溶液氧化。
3.下列关于甲烷及烷烃的结构及性质的说法错误的是( )
A.烷烃均难溶于水,相对密度均小于1
B.烷烃不能使酸性高锰酸钾溶液褪色,因此,不能发生氧化反应
C.物质的沸点:正戊烷>异戊烷>正丁烷>丙烷
D.甲烷分子中的4个C—H键的长度相同,相互之间的夹角相等,
所以甲烷的空间结构为正四面体
B
【解析】烃类由C、H两种元素组成,密度均小于水,而烷烃均难溶于水,相对密度均小于1,A正确;烷烃可以燃烧,能发生氧化反应,B错;碳原子数越多、沸点越高;相同碳原子数的烷烃,支链越多、沸点越低,则沸点正戊烷>异戊烷、丁烷>丙烷、正戊烷>异戊烷>正丁烷>丙烷,C正确;甲烷分子中的4个C—H键的长度相同,相互之间的夹角相等,甲烷的空间结构为正四面体,D正确。
4.丁烷(分子式C4H10)广泛应用于家用液化石油气,也用于打火机
中作燃料。下列关于丁烷的叙述不正确的是( )
A.在常温常压下,C4H10是气体
B.丁烷有正丁烷与异丁烷两种同分异构体
C.C4H10与CH4互称为同系物
D.C4H10进行一氯取代后生成3种沸点不同的产物
D
【解析】烃分子中C原子数小于等于4时,在常温为气态,故在常温常压下,C4H10是气体,A正确;丁烷分为正丁烷和异丁烷两种不同结构,二者互为同分异构体,B正确;C4H10与CH4结构相似,在分子组成上相差3个CH2原子团,二者互称为同系物,C正确;C4H10有正丁烷、异丁烷两种不同结构,每种物质分子中都存在两种不同位置的H原子,因此分子式是C4H10的物质进行一氯取代后生成4种沸点不同的产物,D错误;故选D。
延时符
烷烃的性质
难溶于水,随碳原子数递增,熔沸点、密度逐渐增大;
碳原子数相同,含支链越多,熔沸点越低;状态:气(C≤4)→液→固(C≥17)
①稳定性:与强酸、强碱或高锰酸钾等强氧化剂不反应;②氧化反应:可燃烧(CH4 :淡蓝色火焰);③高温分解;④取代反应:与卤素单质光照取代(多种产物)。
化学性质
物理性质
第3课时 烷烃的性质
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
