化学人教版(2019)选择性必修1 4.2.1电解原理(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.2.1电解原理(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-26 00:45:14 | ||
图片预览



文档简介
(共19张PPT)
第二节 电解池
第1课时 电解原理
第四章 化学反应与电能
[学习目标]
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
1.了解电解及电解池的概念,熟悉电解池的构成条件。
2.理解电解原理及电解的规律,会判断电解的产物,掌握电解池电极反应式的书写(重、难点)。
新课导入
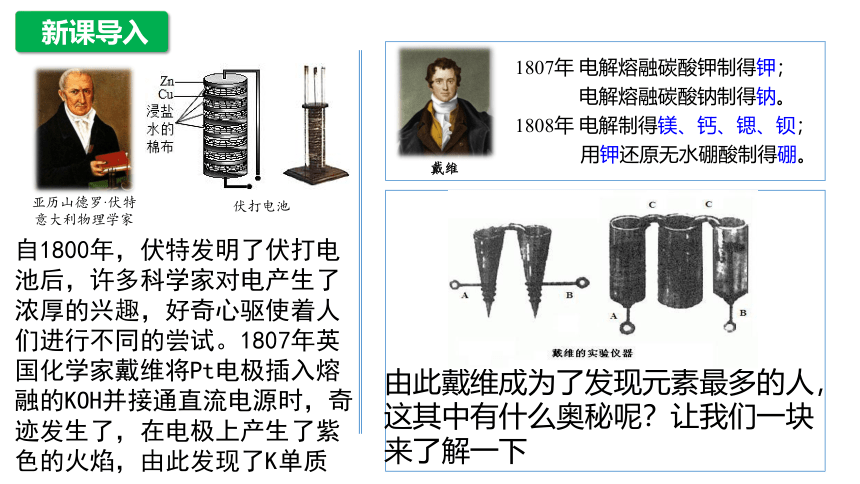
亚历山德罗·伏特
意大利物理学家
伏打电池
1807年 电解熔融碳酸钾制得钾;
电解熔融碳酸钠制得钠。
1808年 电解制得镁、钙、锶、钡;
用钾还原无水硼酸制得硼。
戴维
由此戴维成为了发现元素最多的人,这其中有什么奥秘呢?让我们一块来了解一下
自1800年,伏特发明了伏打电池后,许多科学家对电产生了浓厚的兴趣,好奇心驱使着人们进行不同的尝试。1807年英国化学家戴维将Pt电极插入熔融的KOH并接通直流电源时,奇迹发生了,在电极上产生了紫色的火焰,由此发现了K单质
1.实验探究:电解CuCl2溶液
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
【思考与讨论】
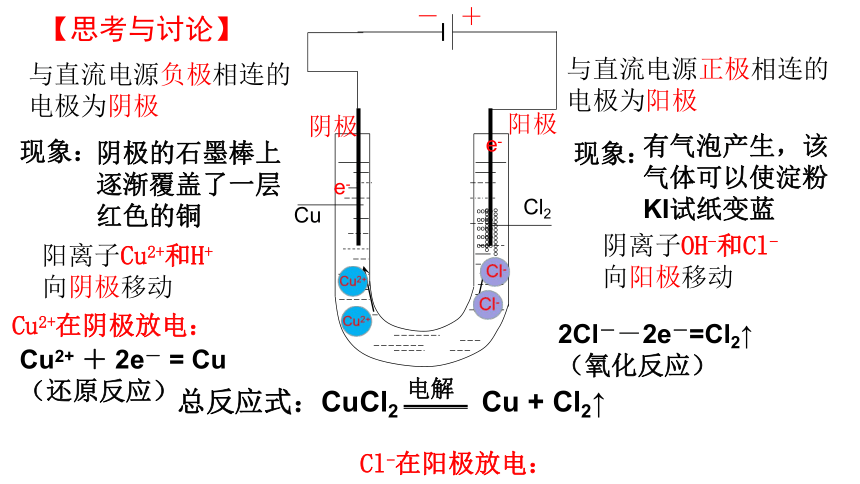
与直流电源负极相连的电极为阴极
与直流电源正极相连的电极为阳极
阳离子Cu2+和H+
向阴极移动
阴离子OH-和Cl-
向阳极移动
Cu2+在阴极放电:
Cl-在阳极放电:
2Cl--2e-=Cl2↑
(氧化反应)
Cu2+ + 2e- = Cu
(还原反应)
总反应式:CuCl2 Cu + Cl2↑
电解
现象:
现象:
阴极的石墨棒上逐渐覆盖了一层红色的铜
有气泡产生,该气体可以使淀粉KI试纸变蓝
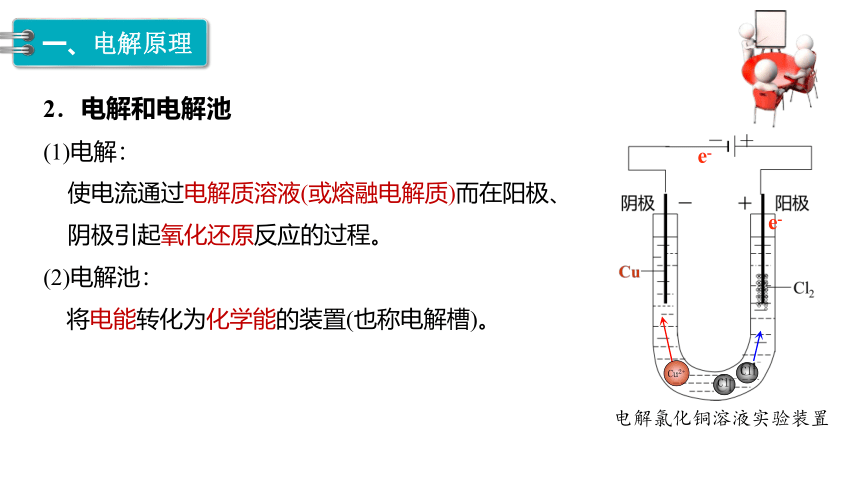
2.电解和电解池
(1)电解:
电解氯化铜溶液实验装置
e-
e-
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(2)电解池:
将电能转化为化学能的装置(也称电解槽)。
一、电解原理
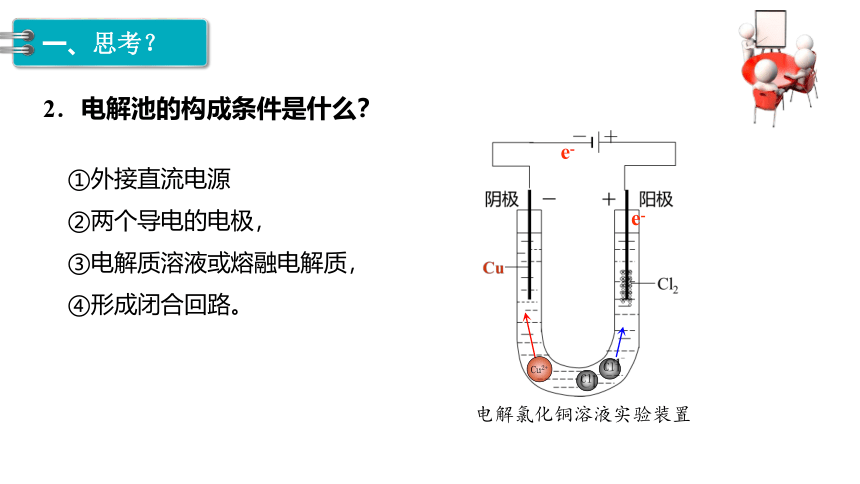
2.电解池的构成条件是什么?
电解氯化铜溶液实验装置
e-
e-
①外接直流电源
②两个导电的电极,
③电解质溶液或熔融电解质,
④形成闭合回路。
一、思考?
思考交流
2.如图所示装置中属于电解池的是_______(填序号)。
③⑥
①②⑤无外接直流电源,不能构成电解池;
④无电解质溶液或熔融电解质;
⑦中蔗糖属于非电解质,不能构成电解池;
⑧没有形成闭合回路,不能构成电解池。
一、电解原理
直流电源
阳极
阴极
阳离子
阴离子
e-
离子导体
e-
氧化反应
还原反应
失电子
得电子
一、电解原理
3.电解池分析
阳极:
与电源的正极相连,发生氧化反应
阴极:
与电源的负极相连,发生还原反应
电子流动方向:
电子从负极出发,沿导线流入阴极,再从电解池的阳极流出,流入电源的正极
电解池内部:
阳离子流向:
阴离子流向:
阴极
阳极
一、电解规律
思考:在阴极为什么是铜离子得电子而不是氢离子?
思考:在阳极为什么是氯离子失电子而不是氢氧根?
放电:离子到达电极时,就会失去或得到电子,发生氧化还原反应的过程
(1)阳极为惰性电极(如碳棒、Pt、稀土金属材料等)
①阳极:溶液中常见阴离子放电顺序
S2->I->Br->Cl->OH->含氧酸根离子>F-
②阴极:溶液中常见阳离子放电顺序
Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>……
(2)阳极为活性电极(如Fe、Cu、Ag等)
电极本身先放电,电极反应式为M-ne-===Mn+
电极不放电
电极失电子放电
二、电解规律
1.放电规律
①阴极——阳离子放电顺序:(得电子,氧化性强先得电子)
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+ > Sn2+ >Fe2+>Zn2+ >H+(水电离)> Al3+>Mg2+>Na+>Ca2+>K+
金属单质还原性越强,对应阳离子氧化性越弱,越难得电子
一、电解原理
离子放电顺序
②阳极(与电极材料有关) ——阴离子放电顺序:(失电子,还原性强先失去电子)
a、阳极为活性电极(如Fe、Cu、Ag等)电极本身先放电,电极反应式为M-ne-===Mn+
b、阳极为惰性电极(如碳棒、Pt、稀土金属材料等),电极不放电,溶液中阳离子放
电,放电顺序为
S2->I->Br->Cl->OH->含氧酸根>F-
笔记
例:写出用石墨做电极电解CuCl2溶液的电极反应式及总电解方程式
① 首先分析、比较出阴阳极的放电离子
阴极:Cu2+ > H+
阳极:Cl- > OH-
② 然后写电极反应式 :
阴极:
阳极:
Cu2+ + 2eˉ === Cu
2Cl- -2e- === Cl2↑
③ 两极反应式相加得总方程式
2Cu2+ +2Cl- === 2Cu+Cl2↑
电解
CuCl2 === Cu + Cl2↑
电解
二、电极反应式的书写
分析电解反应的一般思路:
①判断电极材料
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原分析得出产物,两极相加得到总方程式
【思考】电解氯化铜溶液时,溶液中Cu2+和Cl-放电基本完毕后,电解过程是否也就停止了呢?
溶液中Cu2+和Cl-放电完毕后,原溶液变为纯水,此时,在纯水中存在H+和OH-, H+在阴极放电,OH-在阳极放电,实际上是电解水的过程,电极反应式如下:
二、电极反应式的书写
阴极:
阳极:
总反应:
4H2O+ 4e- === 2H2 ↑ +4OH-
2H2O-4e- === 4H+ + O2 ↑
2H2O === 2H2↑ + O2 ↑
电解
注意:书写反应的总离子方程式时,若参与电极反应的H+(或OH-)是由水电离出来的,应用水的分子式表示。
电解质 H2SO4 NaOH Na2SO4
阳极反应式 _________________________ 阴极反应式 ___________________ pH变化 _____ _____ _____
复原加入物质 加入_____ 减小
增大
不变
H2O
4OH--4e-===O2↑+2H2O
4H++4e-===2H2↑
三、电解规律
1、电解 H2O 型(含氧酸、强碱、活泼金属含氧酸)
注意:电解质溶液的复原应遵循“从溶液中析出什么补什么”的原则,即从溶液中析出哪种元素的原子,则应按比例补入哪些原子。
或 2H2O-4e- === 4H+ + O2 ↑
或 4H2O+ 4e- === 2H2 ↑ +4OH-
电解质 HCl CuCl2
阳极反应式 __________________ 阴极反应式 _________________ Cu2++2e-===Cu
pH变化 _____
复原加入物质 加入_____ 加入______
2Cl--2e-===Cl2↑
2H++2e-===H2↑
增大
HCl
CuCl2
3、电解 电解质和水 型(活泼金属无氧酸盐、不活泼金属的含氧酸盐)
2、电解 电解质 型(无氧酸、不活泼金属的无氧酸盐)
电解质 NaCl CuSO4
阳极反应式 _________________ _______________________
阴极反应式 _________________________ ___________________
pH变化 _____ _____
复原加入物质 加入____ 加入____________
2Cl--2e-===Cl2↑
2H2O-4e-===O2↑+4H+
2H2O+2e-===H2↑+2OH-
2Cu2++4e-===2Cu
增大
减小
HCl
CuO或CuCO3
放氢生碱型
放氧生酸型
1.若只生成H2,则溶液的PH值增大
2.若只生成O2,则溶液的PH值减小
3.既生成H2,又生成O2,实质上电解的是水,则溶液中电解质浓度 增大
①若溶质为酸,PH减小
②若溶质为碱,PH增大
③若溶质为中性,PH不变
二、电解规律
酸碱变化规律:
1.与电源的正极相连的是阳极,负极相连的是阴极
2.电解质溶液中阳离子向阴极移动,阴离子向阳极移动
3.根据两极的的变化
阴极本身不参与反应,质量不会减少,当阴极有金属析出时,质量增加;
阳极质量不会增加,当阳极材料放电时,质量会减少
二、电解规律
电解池阴阳极的判断
本节内容结束
第二节 电解池
第1课时 电解原理
第四章 化学反应与电能
[学习目标]
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
1.了解电解及电解池的概念,熟悉电解池的构成条件。
2.理解电解原理及电解的规律,会判断电解的产物,掌握电解池电极反应式的书写(重、难点)。
新课导入
亚历山德罗·伏特
意大利物理学家
伏打电池
1807年 电解熔融碳酸钾制得钾;
电解熔融碳酸钠制得钠。
1808年 电解制得镁、钙、锶、钡;
用钾还原无水硼酸制得硼。
戴维
由此戴维成为了发现元素最多的人,这其中有什么奥秘呢?让我们一块来了解一下
自1800年,伏特发明了伏打电池后,许多科学家对电产生了浓厚的兴趣,好奇心驱使着人们进行不同的尝试。1807年英国化学家戴维将Pt电极插入熔融的KOH并接通直流电源时,奇迹发生了,在电极上产生了紫色的火焰,由此发现了K单质
1.实验探究:电解CuCl2溶液
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
【思考与讨论】
与直流电源负极相连的电极为阴极
与直流电源正极相连的电极为阳极
阳离子Cu2+和H+
向阴极移动
阴离子OH-和Cl-
向阳极移动
Cu2+在阴极放电:
Cl-在阳极放电:
2Cl--2e-=Cl2↑
(氧化反应)
Cu2+ + 2e- = Cu
(还原反应)
总反应式:CuCl2 Cu + Cl2↑
电解
现象:
现象:
阴极的石墨棒上逐渐覆盖了一层红色的铜
有气泡产生,该气体可以使淀粉KI试纸变蓝
2.电解和电解池
(1)电解:
电解氯化铜溶液实验装置
e-
e-
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(2)电解池:
将电能转化为化学能的装置(也称电解槽)。
一、电解原理
2.电解池的构成条件是什么?
电解氯化铜溶液实验装置
e-
e-
①外接直流电源
②两个导电的电极,
③电解质溶液或熔融电解质,
④形成闭合回路。
一、思考?
思考交流
2.如图所示装置中属于电解池的是_______(填序号)。
③⑥
①②⑤无外接直流电源,不能构成电解池;
④无电解质溶液或熔融电解质;
⑦中蔗糖属于非电解质,不能构成电解池;
⑧没有形成闭合回路,不能构成电解池。
一、电解原理
直流电源
阳极
阴极
阳离子
阴离子
e-
离子导体
e-
氧化反应
还原反应
失电子
得电子
一、电解原理
3.电解池分析
阳极:
与电源的正极相连,发生氧化反应
阴极:
与电源的负极相连,发生还原反应
电子流动方向:
电子从负极出发,沿导线流入阴极,再从电解池的阳极流出,流入电源的正极
电解池内部:
阳离子流向:
阴离子流向:
阴极
阳极
一、电解规律
思考:在阴极为什么是铜离子得电子而不是氢离子?
思考:在阳极为什么是氯离子失电子而不是氢氧根?
放电:离子到达电极时,就会失去或得到电子,发生氧化还原反应的过程
(1)阳极为惰性电极(如碳棒、Pt、稀土金属材料等)
①阳极:溶液中常见阴离子放电顺序
S2->I->Br->Cl->OH->含氧酸根离子>F-
②阴极:溶液中常见阳离子放电顺序
Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>……
(2)阳极为活性电极(如Fe、Cu、Ag等)
电极本身先放电,电极反应式为M-ne-===Mn+
电极不放电
电极失电子放电
二、电解规律
1.放电规律
①阴极——阳离子放电顺序:(得电子,氧化性强先得电子)
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+ > Sn2+ >Fe2+>Zn2+ >H+(水电离)> Al3+>Mg2+>Na+>Ca2+>K+
金属单质还原性越强,对应阳离子氧化性越弱,越难得电子
一、电解原理
离子放电顺序
②阳极(与电极材料有关) ——阴离子放电顺序:(失电子,还原性强先失去电子)
a、阳极为活性电极(如Fe、Cu、Ag等)电极本身先放电,电极反应式为M-ne-===Mn+
b、阳极为惰性电极(如碳棒、Pt、稀土金属材料等),电极不放电,溶液中阳离子放
电,放电顺序为
S2->I->Br->Cl->OH->含氧酸根>F-
笔记
例:写出用石墨做电极电解CuCl2溶液的电极反应式及总电解方程式
① 首先分析、比较出阴阳极的放电离子
阴极:Cu2+ > H+
阳极:Cl- > OH-
② 然后写电极反应式 :
阴极:
阳极:
Cu2+ + 2eˉ === Cu
2Cl- -2e- === Cl2↑
③ 两极反应式相加得总方程式
2Cu2+ +2Cl- === 2Cu+Cl2↑
电解
CuCl2 === Cu + Cl2↑
电解
二、电极反应式的书写
分析电解反应的一般思路:
①判断电极材料
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原分析得出产物,两极相加得到总方程式
【思考】电解氯化铜溶液时,溶液中Cu2+和Cl-放电基本完毕后,电解过程是否也就停止了呢?
溶液中Cu2+和Cl-放电完毕后,原溶液变为纯水,此时,在纯水中存在H+和OH-, H+在阴极放电,OH-在阳极放电,实际上是电解水的过程,电极反应式如下:
二、电极反应式的书写
阴极:
阳极:
总反应:
4H2O+ 4e- === 2H2 ↑ +4OH-
2H2O-4e- === 4H+ + O2 ↑
2H2O === 2H2↑ + O2 ↑
电解
注意:书写反应的总离子方程式时,若参与电极反应的H+(或OH-)是由水电离出来的,应用水的分子式表示。
电解质 H2SO4 NaOH Na2SO4
阳极反应式 _________________________ 阴极反应式 ___________________ pH变化 _____ _____ _____
复原加入物质 加入_____ 减小
增大
不变
H2O
4OH--4e-===O2↑+2H2O
4H++4e-===2H2↑
三、电解规律
1、电解 H2O 型(含氧酸、强碱、活泼金属含氧酸)
注意:电解质溶液的复原应遵循“从溶液中析出什么补什么”的原则,即从溶液中析出哪种元素的原子,则应按比例补入哪些原子。
或 2H2O-4e- === 4H+ + O2 ↑
或 4H2O+ 4e- === 2H2 ↑ +4OH-
电解质 HCl CuCl2
阳极反应式 __________________ 阴极反应式 _________________ Cu2++2e-===Cu
pH变化 _____
复原加入物质 加入_____ 加入______
2Cl--2e-===Cl2↑
2H++2e-===H2↑
增大
HCl
CuCl2
3、电解 电解质和水 型(活泼金属无氧酸盐、不活泼金属的含氧酸盐)
2、电解 电解质 型(无氧酸、不活泼金属的无氧酸盐)
电解质 NaCl CuSO4
阳极反应式 _________________ _______________________
阴极反应式 _________________________ ___________________
pH变化 _____ _____
复原加入物质 加入____ 加入____________
2Cl--2e-===Cl2↑
2H2O-4e-===O2↑+4H+
2H2O+2e-===H2↑+2OH-
2Cu2++4e-===2Cu
增大
减小
HCl
CuO或CuCO3
放氢生碱型
放氧生酸型
1.若只生成H2,则溶液的PH值增大
2.若只生成O2,则溶液的PH值减小
3.既生成H2,又生成O2,实质上电解的是水,则溶液中电解质浓度 增大
①若溶质为酸,PH减小
②若溶质为碱,PH增大
③若溶质为中性,PH不变
二、电解规律
酸碱变化规律:
1.与电源的正极相连的是阳极,负极相连的是阴极
2.电解质溶液中阳离子向阴极移动,阴离子向阳极移动
3.根据两极的的变化
阴极本身不参与反应,质量不会减少,当阴极有金属析出时,质量增加;
阳极质量不会增加,当阳极材料放电时,质量会减少
二、电解规律
电解池阴阳极的判断
本节内容结束
