11.2化学肥料同步练习(含答案)人教版化学九年级下册
文档属性
| 名称 | 11.2化学肥料同步练习(含答案)人教版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 97.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-26 15:05:10 | ||
图片预览




文档简介
11.2 化学肥料 同步练习
一、多选题
1.下列实验方案设计合理的是
A.除去铜中的少量氧化铜——加入足量氢氧化钠溶液,过滤
B.鉴别硫酸铵和尿素[CO(NH2)2]——分别加熟石灰、研磨、闻气味
C.除去CO中的少量CO2——依次通过足量NaOH溶液、浓硫酸
D.鉴别二氧化碳和氮气——将带火星的木条分别插入集气瓶中
2.下列对实验现象的解释不正确的是( )
选项 实验现象 解释
A 向硬水中滴加肥皂水会产生浮渣 硬水中含有较多的可溶性钙、镁化合物
B 向铁粉中滴加稀盐酸有气泡产生 盐酸易挥发
C 向某无色溶液中滴入溶液有白色沉淀产生 该溶液中一定含有碳酸盐
D 向某氮肥中加入碱并研磨会产生氨味 铵盐与碱反应放出氨气
A.A B.B C.C D.D
3.下列有关物质的检验或鉴别正确的是
A.用燃着的木条鉴别氮气和二氧化碳
B.用明矾鉴别蒸馏水和澄清石灰水
C.用紫色石蕊溶液证明二氧化碳与水发生了化学反应
D.用闻气味的方法区别碳酸氢铵和蔗糖固体
4.下列实验方案设计中,不能达到实验目的的是
选项 实验目的 实验方案
A 验证某化肥为铵态氮肥 将样品与熟石灰研磨,有刺激性气味气体生成
B 鉴别某溶液中是否含有 取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,则该溶液中一定有
C 分离KCl固体和MnO2固体 加水溶解、过滤、洗涤、干燥
D 除去氯化钾溶液中的碳酸钾 加入适量氯化钙溶液,充分反应后过滤
A.A B.B C.C D.D
5.鉴别、检验、除杂与分离是进行化学研究的重要方法。下列实验方案能达到实验目的的是
选项 实验目的 实验方案
A 鉴别化肥NH4Cl和KCl 取样,分别加熟石灰研磨,闻气味
B 检验敞口放置的NaOH溶液是否变质 取样,滴加酚酞溶液,观察颜色
C 除去KCl溶液中少量的K2SO4杂质 加入适量的Ba(NO3)2溶液,过滤
D 从KCl和MnO2的混合物中回收MnO2 加水充分溶解、过滤、洗涤、干燥
A.A B.B C.C D.D
二、选择题
6.下列实验方案设计与结论合理的是
A.铵态氮肥与熟石灰混合研磨后不能嗅到刺激性气味
B.用酚酞溶液区分NaOH溶液和Na2CO3溶液
C.用Fe、Ag、CuSO4溶液验证Fe、Cu、Ag三种金属的活动性
D.用氢氧化钠固体干燥SO2
7.下列实验目的能通过对应实验方法达到的是
选项 实验目的 实验方法
A 证明稀硫酸与氢氧化钠溶液反应 取样,滴加稀硫酸至PH基本不变
B 验证质量守恒定律 称量镁条燃烧前后固体质量
C 探究蜡烛的组成 点燃,在火焰上方罩个烧杯
D 鉴别化肥硫酸钾和氯化钾 取样,看颜色、闻气味、溶于水
A.A B.B C.C D.D
8.关于空气和水的说法正确的是
A.无色无味的水是纯净物
B.空气中的稀有气体可以发光
C.空气中含量最多的气体是氧气
D.过量施用化肥会造成水体污染
9.无锡正走在生态优先,绿色发展的道路上。下列选项有利于保护环境的是
A.深埋电池 B.焚烧秸秆 C.禁用农药 D.回收塑料
10.下列属于复合肥料的是
A.NH4Cl B.CO(NH2)2 C.Ca(H2PO4)2 D.KNO3
11.美丽山西建设坚持“治山、治水、治气、治城”一体化推进。下列措施不利于生态保护和修复的是
A.退耕还林、荒山荒地绿化 B.加强水土保持和水污染治理
C.加大化肥农药用量,促进农业发展 D.应用新技术治理大气污染
12.某化肥厂生产的一种化肥包装袋上的部分说明如图所示,关于该化肥的说法中错误的是( )
硝酸铵NH4NO3 净重:50Kg 含氮量≥34% ××化肥厂
A.该化肥不宜与熟石灰混用
B.该化肥中NH4NO3的质量分数为95%
C.该化肥能使植物茎叶生长茂盛,叶色浓绿
D.NH4NO3属于盐
13.下列实验方案能达到相应实验目的的是
选项 实验目的 实验方案
A 除去硫酸亚铁溶液中混有的少量硫酸铜 加过量锌粒、过滤
B 除去 CaO 中的 CaCO3 加足量的稀盐酸至不再产生气泡,过滤
C 分离 MnO2 和 KCl 的固体混合物 加水溶解,过滤,洗涤,干燥
D 鉴别硫酸铵和硝酸钾固体 分别取样与少量熟石灰混合研磨,闻气味
A.A B.B C.C D.D
14.分类法是学习和研究化学的常用方法。下列分类中不正确的是( )
A.碱:烧碱、熟石灰 B.氧化物:干冰、水
C.混合物:空气、石油 D.复合肥料:尿素、硝酸钾
15.2020年——脱贫攻坚决战决胜之年,新疆化学学会理事长张亚刚和科普队员走进乡村,为初中学生讲化学方面知识和科普专题讲座《魅力化学》,下列对化学肥料的认识错误的是
A.KNO3是一种常见的复合肥料
B.植物出现倒伏的状况应适量施用磷肥
C.硝酸铵不能与熟石灰混合使用
D.通过看颜色的方法可以区分磷矿粉和K2SO4
三、综合应用题
16.硫酸钾是一种常见的化肥,不同等级农用硫酸钾中硫酸钾的含量要求如下表:
优等品 一等品 合格品
硫酸钾(K2SO4)含量≥ (%) 92.6 83.3 61.1
化学兴趣小组同学从农用硫酸钾中取4.0g样品进行如下实验:(硫酸钾与氯化钡反应的化学方程式为K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应,滤渣无损失)
(1)农作物出现下列症状时,宜施用硫酸钾的是 。
A.叶片变黄,植株长势弱 B.植株长得矮、生长速度慢 C.秸秆变软易倒伏,分蘖少
(2)实验中,证明加入氯化钡溶液过量的方法是 (写出操作及现象)。
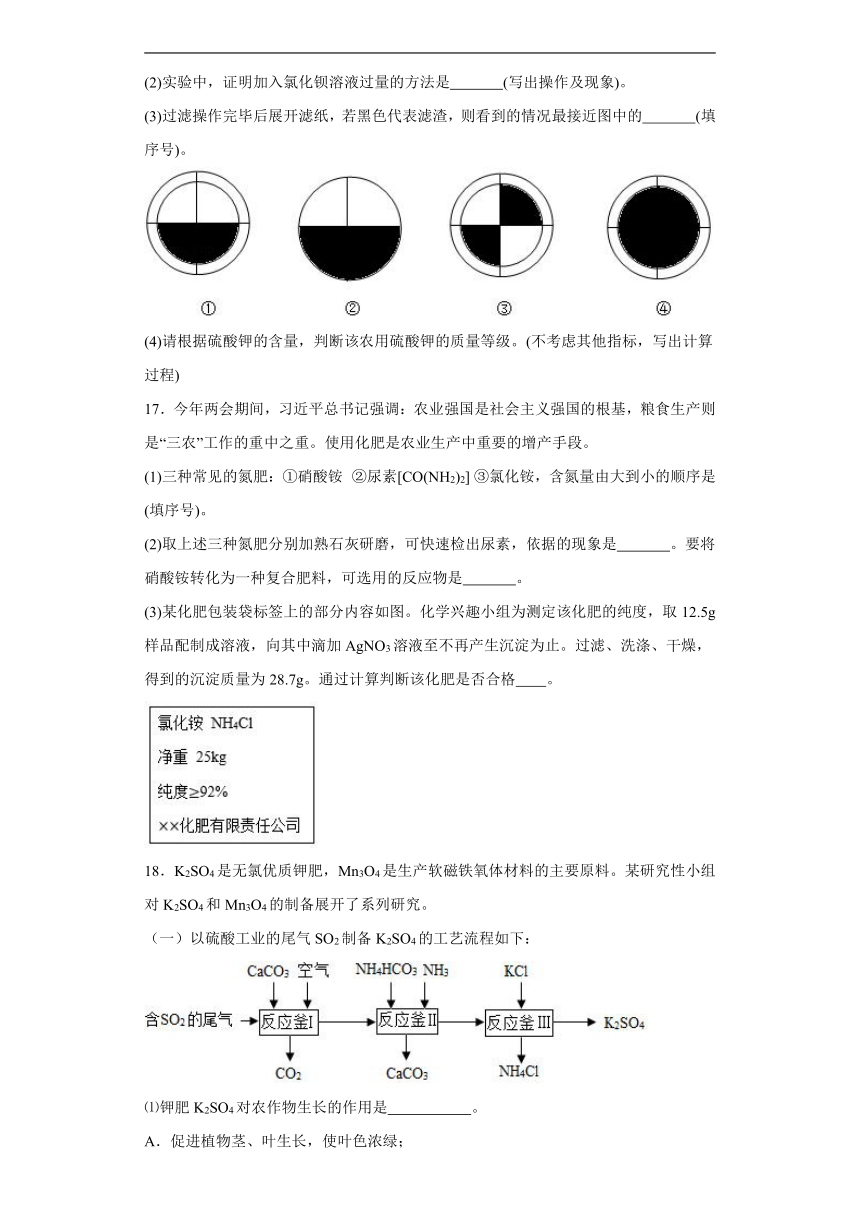
(3)过滤操作完毕后展开滤纸,若黑色代表滤渣,则看到的情况最接近图中的 (填序号)。
(4)请根据硫酸钾的含量,判断该农用硫酸钾的质量等级。(不考虑其他指标,写出计算过程)
17.今年两会期间,习近平总书记强调:农业强国是社会主义强国的根基,粮食生产则是“三农”工作的重中之重。使用化肥是农业生产中重要的增产手段。
(1)三种常见的氮肥:①硝酸铵 ②尿素[CO(NH2)2] ③氯化铵,含氮量由大到小的顺序是 (填序号)。
(2)取上述三种氮肥分别加熟石灰研磨,可快速检出尿素,依据的现象是 。要将硝酸铵转化为一种复合肥料,可选用的反应物是 。
(3)某化肥包装袋标签上的部分内容如图。化学兴趣小组为测定该化肥的纯度,取12.5g样品配制成溶液,向其中滴加AgNO3溶液至不再产生沉淀为止。过滤、洗涤、干燥,得到的沉淀质量为28.7g。通过计算判断该化肥是否合格 。
18.K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
(一)以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
⑴钾肥K2SO4对农作物生长的作用是 。
A.促进植物茎、叶生长,使叶色浓绿;
B.增强植物的抗寒、抗旱能力
C.增强植物的抗病虫害、抗倒伏能力
⑵反应釜I中发生的反应包括:①碳酸钙高温分解的化学方程式为 ;
②CaO + SO2==CaSO3③ 2CaSO3+O2==2CaSO4
⑶反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤 、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为 (填字母序号,如图为几种盐的溶解度曲线)。
A.0℃-10℃ B.20℃-30℃ C. 60℃-65℃ D.80℃-90℃
⑷上述工艺流程中循环利用的物质是 ;证明产品K2SO4中不含杂质的实验方法是 写出方法、现象)。
(二)实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
【步骤I】制备MnSO4溶液:在三颈烧瓶中(装置见图) 加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
⑸烧杯中石灰乳(有效成分为氢氧化钙)的作用为 。
⑹三颈烧瓶中生成MnSO4的反应化学方程式为 。
⑺步骤I中,先通入氮气的目的是 。为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:及时搅拌反应液、 (任写1条)。
【步骤II】制备MnSO4 H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4 H2O晶体。
【步骤III】制备Mn3O4固体:准确称取101.4mg MnSO4 H2O,将MnSO4 H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4又被氧气氧化为Mn2O3或MnO2
⑻该曲线中A段所表示物质的化学式为 。
参考答案:
1.BC
2.BC
3.CD
4.BC
5.AD
6.C
7.A
8.D
9.D
10.D
11.C
12.B
13.D
14.D
15.B
16.(1)C
(2)加入碳酸钠溶液,出现白色沉淀
(3)①
(4)设样品中硫酸钾的质量是
硫酸钾的含量是
92.6%>87>%83.3%,因此属于一等品
17.(1)②①③
(2) 无刺激性气味 KOH/氢氧化钾
(3)解:设化肥中含NH4Cl的质量为x
x=10.7g
该化肥的纯度为
故该化肥不合格。
18. C CaCO3CaO+CO2↑ D CaCO3 取少量样品,加水配成溶液,先滴加足量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,若无沉淀生成,说明K2SO4中不含杂质。 吸收二氧化硫气体,防止空气污染 MnO2+SO2===MnSO4 排尽装置内的空气,防止SO2气体被氧化为硫酸,导致转化率降低。 微热提高温度 MnSO4
一、多选题
1.下列实验方案设计合理的是
A.除去铜中的少量氧化铜——加入足量氢氧化钠溶液,过滤
B.鉴别硫酸铵和尿素[CO(NH2)2]——分别加熟石灰、研磨、闻气味
C.除去CO中的少量CO2——依次通过足量NaOH溶液、浓硫酸
D.鉴别二氧化碳和氮气——将带火星的木条分别插入集气瓶中
2.下列对实验现象的解释不正确的是( )
选项 实验现象 解释
A 向硬水中滴加肥皂水会产生浮渣 硬水中含有较多的可溶性钙、镁化合物
B 向铁粉中滴加稀盐酸有气泡产生 盐酸易挥发
C 向某无色溶液中滴入溶液有白色沉淀产生 该溶液中一定含有碳酸盐
D 向某氮肥中加入碱并研磨会产生氨味 铵盐与碱反应放出氨气
A.A B.B C.C D.D
3.下列有关物质的检验或鉴别正确的是
A.用燃着的木条鉴别氮气和二氧化碳
B.用明矾鉴别蒸馏水和澄清石灰水
C.用紫色石蕊溶液证明二氧化碳与水发生了化学反应
D.用闻气味的方法区别碳酸氢铵和蔗糖固体
4.下列实验方案设计中,不能达到实验目的的是
选项 实验目的 实验方案
A 验证某化肥为铵态氮肥 将样品与熟石灰研磨,有刺激性气味气体生成
B 鉴别某溶液中是否含有 取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,则该溶液中一定有
C 分离KCl固体和MnO2固体 加水溶解、过滤、洗涤、干燥
D 除去氯化钾溶液中的碳酸钾 加入适量氯化钙溶液,充分反应后过滤
A.A B.B C.C D.D
5.鉴别、检验、除杂与分离是进行化学研究的重要方法。下列实验方案能达到实验目的的是
选项 实验目的 实验方案
A 鉴别化肥NH4Cl和KCl 取样,分别加熟石灰研磨,闻气味
B 检验敞口放置的NaOH溶液是否变质 取样,滴加酚酞溶液,观察颜色
C 除去KCl溶液中少量的K2SO4杂质 加入适量的Ba(NO3)2溶液,过滤
D 从KCl和MnO2的混合物中回收MnO2 加水充分溶解、过滤、洗涤、干燥
A.A B.B C.C D.D
二、选择题
6.下列实验方案设计与结论合理的是
A.铵态氮肥与熟石灰混合研磨后不能嗅到刺激性气味
B.用酚酞溶液区分NaOH溶液和Na2CO3溶液
C.用Fe、Ag、CuSO4溶液验证Fe、Cu、Ag三种金属的活动性
D.用氢氧化钠固体干燥SO2
7.下列实验目的能通过对应实验方法达到的是
选项 实验目的 实验方法
A 证明稀硫酸与氢氧化钠溶液反应 取样,滴加稀硫酸至PH基本不变
B 验证质量守恒定律 称量镁条燃烧前后固体质量
C 探究蜡烛的组成 点燃,在火焰上方罩个烧杯
D 鉴别化肥硫酸钾和氯化钾 取样,看颜色、闻气味、溶于水
A.A B.B C.C D.D
8.关于空气和水的说法正确的是
A.无色无味的水是纯净物
B.空气中的稀有气体可以发光
C.空气中含量最多的气体是氧气
D.过量施用化肥会造成水体污染
9.无锡正走在生态优先,绿色发展的道路上。下列选项有利于保护环境的是
A.深埋电池 B.焚烧秸秆 C.禁用农药 D.回收塑料
10.下列属于复合肥料的是
A.NH4Cl B.CO(NH2)2 C.Ca(H2PO4)2 D.KNO3
11.美丽山西建设坚持“治山、治水、治气、治城”一体化推进。下列措施不利于生态保护和修复的是
A.退耕还林、荒山荒地绿化 B.加强水土保持和水污染治理
C.加大化肥农药用量,促进农业发展 D.应用新技术治理大气污染
12.某化肥厂生产的一种化肥包装袋上的部分说明如图所示,关于该化肥的说法中错误的是( )
硝酸铵NH4NO3 净重:50Kg 含氮量≥34% ××化肥厂
A.该化肥不宜与熟石灰混用
B.该化肥中NH4NO3的质量分数为95%
C.该化肥能使植物茎叶生长茂盛,叶色浓绿
D.NH4NO3属于盐
13.下列实验方案能达到相应实验目的的是
选项 实验目的 实验方案
A 除去硫酸亚铁溶液中混有的少量硫酸铜 加过量锌粒、过滤
B 除去 CaO 中的 CaCO3 加足量的稀盐酸至不再产生气泡,过滤
C 分离 MnO2 和 KCl 的固体混合物 加水溶解,过滤,洗涤,干燥
D 鉴别硫酸铵和硝酸钾固体 分别取样与少量熟石灰混合研磨,闻气味
A.A B.B C.C D.D
14.分类法是学习和研究化学的常用方法。下列分类中不正确的是( )
A.碱:烧碱、熟石灰 B.氧化物:干冰、水
C.混合物:空气、石油 D.复合肥料:尿素、硝酸钾
15.2020年——脱贫攻坚决战决胜之年,新疆化学学会理事长张亚刚和科普队员走进乡村,为初中学生讲化学方面知识和科普专题讲座《魅力化学》,下列对化学肥料的认识错误的是
A.KNO3是一种常见的复合肥料
B.植物出现倒伏的状况应适量施用磷肥
C.硝酸铵不能与熟石灰混合使用
D.通过看颜色的方法可以区分磷矿粉和K2SO4
三、综合应用题
16.硫酸钾是一种常见的化肥,不同等级农用硫酸钾中硫酸钾的含量要求如下表:
优等品 一等品 合格品
硫酸钾(K2SO4)含量≥ (%) 92.6 83.3 61.1
化学兴趣小组同学从农用硫酸钾中取4.0g样品进行如下实验:(硫酸钾与氯化钡反应的化学方程式为K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应,滤渣无损失)
(1)农作物出现下列症状时,宜施用硫酸钾的是 。
A.叶片变黄,植株长势弱 B.植株长得矮、生长速度慢 C.秸秆变软易倒伏,分蘖少
(2)实验中,证明加入氯化钡溶液过量的方法是 (写出操作及现象)。
(3)过滤操作完毕后展开滤纸,若黑色代表滤渣,则看到的情况最接近图中的 (填序号)。
(4)请根据硫酸钾的含量,判断该农用硫酸钾的质量等级。(不考虑其他指标,写出计算过程)
17.今年两会期间,习近平总书记强调:农业强国是社会主义强国的根基,粮食生产则是“三农”工作的重中之重。使用化肥是农业生产中重要的增产手段。
(1)三种常见的氮肥:①硝酸铵 ②尿素[CO(NH2)2] ③氯化铵,含氮量由大到小的顺序是 (填序号)。
(2)取上述三种氮肥分别加熟石灰研磨,可快速检出尿素,依据的现象是 。要将硝酸铵转化为一种复合肥料,可选用的反应物是 。
(3)某化肥包装袋标签上的部分内容如图。化学兴趣小组为测定该化肥的纯度,取12.5g样品配制成溶液,向其中滴加AgNO3溶液至不再产生沉淀为止。过滤、洗涤、干燥,得到的沉淀质量为28.7g。通过计算判断该化肥是否合格 。
18.K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
(一)以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
⑴钾肥K2SO4对农作物生长的作用是 。
A.促进植物茎、叶生长,使叶色浓绿;
B.增强植物的抗寒、抗旱能力
C.增强植物的抗病虫害、抗倒伏能力
⑵反应釜I中发生的反应包括:①碳酸钙高温分解的化学方程式为 ;
②CaO + SO2==CaSO3③ 2CaSO3+O2==2CaSO4
⑶反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤 、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为 (填字母序号,如图为几种盐的溶解度曲线)。
A.0℃-10℃ B.20℃-30℃ C. 60℃-65℃ D.80℃-90℃
⑷上述工艺流程中循环利用的物质是 ;证明产品K2SO4中不含杂质的实验方法是 写出方法、现象)。
(二)实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
【步骤I】制备MnSO4溶液:在三颈烧瓶中(装置见图) 加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
⑸烧杯中石灰乳(有效成分为氢氧化钙)的作用为 。
⑹三颈烧瓶中生成MnSO4的反应化学方程式为 。
⑺步骤I中,先通入氮气的目的是 。为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:及时搅拌反应液、 (任写1条)。
【步骤II】制备MnSO4 H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4 H2O晶体。
【步骤III】制备Mn3O4固体:准确称取101.4mg MnSO4 H2O,将MnSO4 H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4又被氧气氧化为Mn2O3或MnO2
⑻该曲线中A段所表示物质的化学式为 。
参考答案:
1.BC
2.BC
3.CD
4.BC
5.AD
6.C
7.A
8.D
9.D
10.D
11.C
12.B
13.D
14.D
15.B
16.(1)C
(2)加入碳酸钠溶液,出现白色沉淀
(3)①
(4)设样品中硫酸钾的质量是
硫酸钾的含量是
92.6%>87>%83.3%,因此属于一等品
17.(1)②①③
(2) 无刺激性气味 KOH/氢氧化钾
(3)解:设化肥中含NH4Cl的质量为x
x=10.7g
该化肥的纯度为
故该化肥不合格。
18. C CaCO3CaO+CO2↑ D CaCO3 取少量样品,加水配成溶液,先滴加足量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,若无沉淀生成,说明K2SO4中不含杂质。 吸收二氧化硫气体,防止空气污染 MnO2+SO2===MnSO4 排尽装置内的空气,防止SO2气体被氧化为硫酸,导致转化率降低。 微热提高温度 MnSO4
同课章节目录
