8.2金属的性质同步练习(含解析) 仁爱版化学九年级下册
文档属性
| 名称 | 8.2金属的性质同步练习(含解析) 仁爱版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 532.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-26 00:00:00 | ||
图片预览




文档简介
8.2金属的性质
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列说法正确的个数为
①滤渣中一定有铜
②向滤渣中加入一定量的稀盐酸,可能有气泡产生
③滤液一定呈无色
④滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2,可能有Cu(NO3)2
⑤忽略过滤操作中溶液损失及水分蒸发,滤液中溶质的质量一定等于原混合溶液溶质的质量
A.1 B.2 C.3 D.4
2.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是
选项 物质 少量杂质 所用试剂和操作方法
A 一氧化碳 二氧化碳 通过足量灼热碳层
B 氯酸钾 氯化钾 加入适量二氧化锰,加热至不再产生气体
C FeCl3溶液 CuCl2 加入过量铁粉,充分反应过滤、洗涤、干燥
D 铁粉 铜 加入足量硝酸银,过滤
A.A B.B C.C D.D
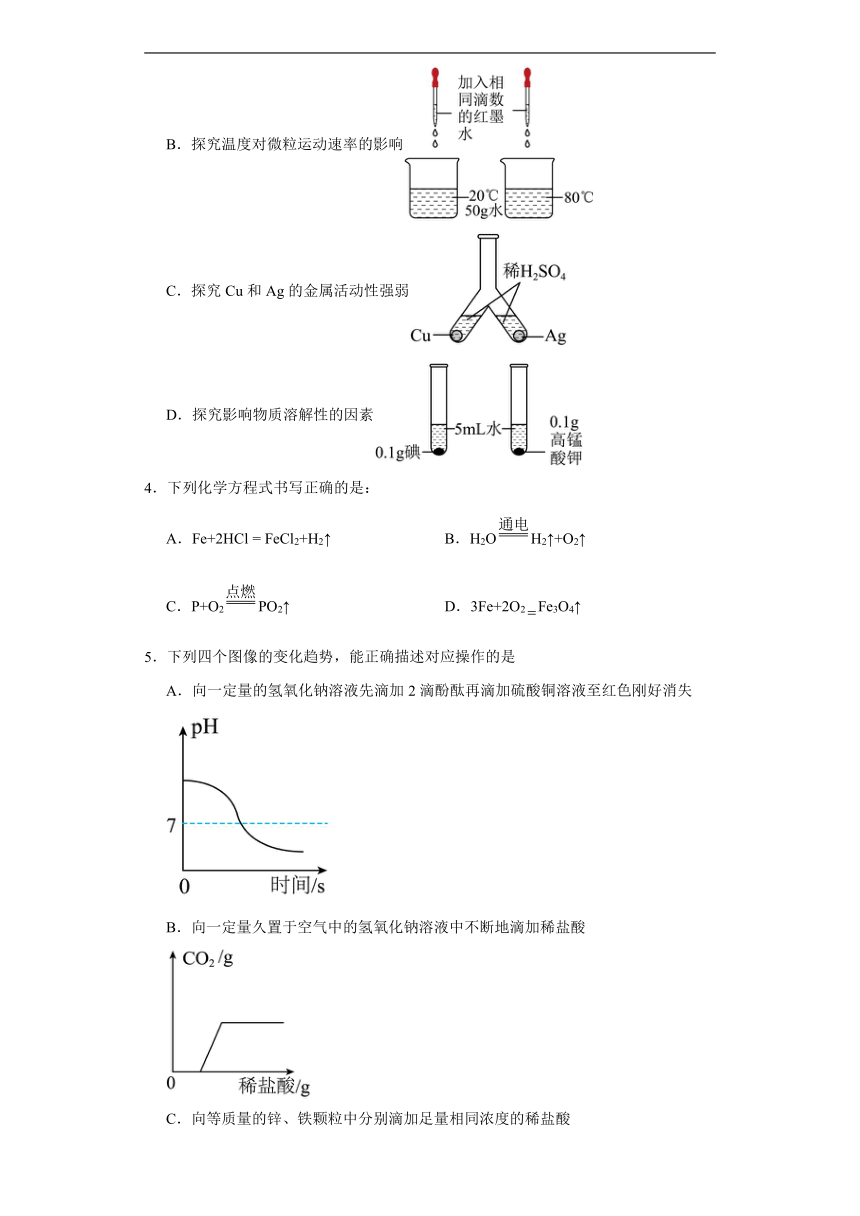
3.对比实验是实验探究的重要方法。下列对比实验设计不能达到目的的是
A.探究空气与呼出气体中二氧化碳的含量
B.探究温度对微粒运动速率的影响
C.探究Cu和Ag的金属活动性强弱
D.探究影响物质溶解性的因素
4.下列化学方程式书写正确的是:
A.Fe+2HCl = FeCl2+H2↑ B.H2OH2↑+O2↑
C.P+O2PO2↑ D.3Fe+2O2Fe3O4↑
5.下列四个图像的变化趋势,能正确描述对应操作的是
A.向一定量的氢氧化钠溶液先滴加2滴酚酞再滴加硫酸铜溶液至红色刚好消失
B.向一定量久置于空气中的氢氧化钠溶液中不断地滴加稀盐酸
C.向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D.向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
6.物质组成、结构、性质以及变化规律是化学研究的重要内容。下列有关说法正确的是
A.组成:一氧化碳和二氧化碳组成元素相同,所以化学性质相似
B.结构:金刚石和石墨中碳原子排列方式不同,所以物理性质差异大
C.性质:氧气能支持燃烧,所以可以作燃料
D.变化规律:铁能与稀盐酸反应,所以所有的金属都能与稀盐酸反应
7.下列方程式书写正确的是
A.4 Fe +3O22Fe2O3
B.H2+O2H2O2
C.4Al+3O2=2Al2O3
D.2P +5O22P2O5
8.关于金属的性质,下列推理正确的是( )
A.镁条可在空气中燃烧,故铁丝也可在空气中燃烧
B.金属Al在空气中放置会生成致密的Al2O3薄膜,所以金属Fe在空气中放置也会生成致密的氧化膜
C.武德合金的熔点低,所以熔点低的金属材料都是合金
D.生铁比纯铁硬,故黄铜比纯铜硬
9.根据金属活动性顺序Fe>Cu>Ag判断,下列说法错误的是
A.反应Cu+FeSO4═Fe+CuSO4可以发生
B.反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生
C.铜片放入硝酸银溶液中,颜色由无色变成蓝色
D.铁丝插入硫酸铜溶液中,铁丝表面有红色物质析出
10.如图所示装置气密性良好,要使注射器中的活塞向右移动,使用的液体M和固体N可能是
①稀盐酸和鸡蛋壳;②稀硫酸和锌;③水和氧化钙;④水和硝酸钾
A.①②③④ B.①②③ C.①②④ D.②③④
二、判断题
11.铁、铜分别放入硫酸锌溶液中,表面均无现象( )
12.金属的活动性顺序不能作为金属能否在溶液中发生置换反应的一种判断依据。( )
13.镁、铝等金属与盐酸反应都能产生氢气,所以金属都能与盐酸反应产生氢气( )
14.铜和盐酸可以发生反应。( )
15.Cu是金属活动顺序表中H后面的金属,所以Cu不会发生置换反应( )
三、综合应用题
16.为探究影响锌与硫酸反应速率的因素,实验小组取质量、颗粒大小相同的粗锌,设计了以下4组方案,记录数据并绘制生成氢气体积与反应时间的关系曲线如下图。已知粗锌中的杂质既不溶于水,也不与稀硫酸反应。
组别 取用的粗锌质量 硫酸的浓度/%(均取98mL) 温度/℃ 对应的曲线
1 4.0g m 20 a
2 4.0g 10 30 b
3 4.0g 5 30 c
4 4.0g 10 50 d
(1)通过第1组和第3组实验可以探究温度对锌与硫酸反应速率的影响,则m的数值为 。据此可知温度与反应速率的关系是 。
(2)能探究硫酸浓度对锌与硫酸反应速率的影响的组别是 。(填序号)
(3)根据你对本实验的理解,请在坐标图中画出第4组实验对应的大致曲线d。
(4)实验条件下890mLH2折合为0.08g,请计算出本实验所用4.0g粗锌中锌的质量分数。(用化学方程式计算,写出完整的计算过程)
17.金属材料广泛应用于生产生活中:
(1)铝块能制成铝箔是利用了铝的 性。
(2)为探究铝、铁、铜三种金属的活动性顺序。实验小组的同学设计了四个实验方案:
①铁、铜、硫酸铝溶液;②铝、铜、氯化亚铁溶液;③铜、硫酸铝溶液、硫酸亚铁溶液;④铁、硫酸铝溶液、硫酸铜溶液。
上述四个方案所选试剂正确的是 (填序号)。
(3)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如图所示,回答问题。
①写出化学式:A ;B 。
②反应Ⅱ的化学方程式为 。
③反应Ⅲ的化学方程式为 。
④反应Ⅳ的化学方程式为 。
18.两个实验小组分别进行“溶液酸碱度的检验”和“金属的回收”的探究实验。
【实验一】溶液酸碱度的检验
(1)如图是测定土壤酸碱度的操作示意图,其中正确的是 (填“A”“B”或“C下同),可能导致所测溶液pH数值发生改变的错误操作是 。
【实验二】金属回收的探究
从含少量铜粉的银、锰混合粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为A、B、C,并设计了如下流程。
(2)滤液b 中所含阳离子的符号为 。
(3)A、B、C三种金属的活动性由强到弱的顺序为 。由该实验可得出比较金属活动性强弱的方法有① ;② 。
(4)已知A的硫酸盐中A元素显+2 价,请写出步骤①的反应的化学方程式 。
参考答案:
1.D
【分析】金属活动性Mg>Zn>Fe>Cu,所以锌先和硝酸铜反应生成硝酸锌和铜,如有硝酸铜剩余则铁和硝酸铜反应生成硝酸亚铁和铜。硝酸镁不参与反应。因反应前后固体的质量均为ag,,可知,一定发生了铁和硝酸铜的反应,否则反应前后固体质量不可能相等。
【详解】①滤渣中一定有置换出的铜,该选项正确。
②如铁未完全反应会有铁剩余,铁能和稀盐酸反应,所以向滤渣中加入一定量的稀盐酸,可能有气泡产生,该选项正确。
③滤液一定有颜色,如硝酸铜有剩余溶液可能为蓝色,铁和硝酸铜一定发生反应则一定有硝酸亚铁生成,如无硝酸铜溶液为浅绿色。该选项不正确。
④滤液中一定有不反应的Mg(NO3)2和反应生成的Zn(NO3)2和Fe(NO3)2,可能有过量的Cu(NO3)2,该选项正确。
⑤反应前后物质总质量不变,反应前后固体质量相等,如忽略过滤操作中溶液损失及水分蒸发,滤液中溶质的质量一定等于原混合溶液溶质的质量,该选项正确。
①②④⑤4个正确,故选:D。
2.A
【详解】A.二氧化碳通过足量灼热碳层,二氧化碳会与碳反应生成一氧化碳,所以可以除去杂质,选项正确;
B.氯化钾加入适量二氧化锰,不会反应,相反氯酸钾加了二氧化锰加热至不再产生气体生成氯化钾,除去了原本要的物质,违背了除杂原则,选项错误;
C.氯化铁和氯化铜都会与铁粉反应,违背了除杂原则,选项错误;
D.铁和铜均会与硝酸银反应,并且铁活性强,铁会先反应,违背了除杂原则,选项错误。
故选:A。
3.C
【详解】A、检验二氧化碳使用澄清石灰水,图中实验,滴入呼出气体中的石灰水变浑浊,滴入空气的石灰水无明显现象,可比较空气与人体呼出的气体中二氧化碳的含量,该选项能达到实验目的,不符合题意;
B、探究温度对微粒运动速率的影响,是在其他条件相同条件下,比较不同温度时,红墨水扩散速率,该选项能达到实验目的,不符合题意;
C、图中实验,铜、银都不能与稀硫酸反应,只能说明铜、银排在H之后,不能确定铜、银活动性强弱,选项不能达到相应实验目的,符合题意;
D、该实验中碘不能溶于水,高锰酸钾能溶于水,说明相同条件下物质的溶解性与溶质的性质有关,该选项能达到实验目的,不符合题意。
故选C。
4.A
【详解】A、铁和稀盐酸反应生成氯化亚铁和氢气,A书写正确;
B、没有配平,B错误;
C、违背了客观事实,生成物是五氧化二磷,五氧化二磷是固态,C错误;
D、没有注明反应条件,四氧化三铁是固态。D错误。
综上所述:选择A。
5.B
【详解】A、氢氧化钠溶液显碱性,能使无色酚酞变红且溶液的pH>7,向氢氧化钠溶液中滴加酚酞后再滴加硫酸铜溶液至红色刚好消失,说明硫酸铜和氢氧化钠恰好完全反应,反应后溶液呈中性,pH的变化是从大于7变化到等于7,故不符合题意;
B、久置于空气中的氢氧化钠溶液会和空气中的二氧化碳反应生成碳酸钙沉淀,加入盐酸后,氢氧化钠和稀盐酸反应没有气体产生,当氢氧化钠反应完毕后,稀盐酸和碳酸钙反应就会生成气体,故符合题意;
C、锌比铁活泼,当金属和足量酸反应时,锌产生气体的速率比铁快,又因为铁的相对原子质量(56)小于锌的相对原子质量(65),等质量的锌、铁和足量稀盐酸反应时,铁生成的氢气多,故不符合题意;
D、向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体,由于溶液已经饱和,溶质质量不变,溶剂质量不变,所以溶质质量分数不变,故不符合题意。
【点睛】金属和酸反应的图像类题目中,主要涉及镁、铝、铁、锌四种金属,根据他们的金属活动性强弱可判断与酸反应的快慢,越活泼的金属反应越快,在横坐标为时间,纵坐标为氢气质量的图像上就表现为越靠近纵坐标。
6.B
【详解】A、一氧化碳和二氧化碳的组成元素相同,但它们分子的构成不同,它们的化学性质不同。如一氧化碳具有可燃性,二氧化碳不能燃烧。A说法不正确;
B、由于金刚石和石墨中碳原子排列方式不同,所以物理性质差异很大。B说法正确;
C、氧气能支持燃烧,但不具有可燃性,所以不能作燃料。C说法不正确;
D、能跟稀盐酸反应的金属,是在金属活动性顺序表中应位于H之前的金属,铁能与稀盐酸反应,是因为在金属活动性顺序表中铁位于H之前。不是所有的金属都能与稀盐酸反应。D说法不正确。
综上所述:选择B。
7.C
【详解】A、铁在氧气中燃烧生成四氧化三铁,该反应的化学方程式为:,生成物错误,不符合题意;
B、氢气在氧气中燃烧生成水,该反应的化学方程式为:,生成物错误,不符合题意;
C、常温下,铝能与氧气反应生成氧化铝,该反应的化学方程式为:,符合题意;
D、磷在氧气中燃烧生成五氧化二磷,该反应的化学方程式为:,未配平,不符合题意。
故选C。
8.D
【详解】A、镁条可在空气中燃烧,但铁丝不能空气中燃烧;故选项错误;
B、金属Al在空气中放置会生成致密的Al2O3薄膜,但金属Fe在空气中放置不会生成致密的氧化膜;故选项错误;
C、武德合金的熔点低,所以熔点低的金属材料不一定都是合金,例如:汞;故选项错误;
D、一般合金的硬度要大于组成它的纯金属硬度,生铁比纯铁硬,故黄铜比纯铜硬;故选项正确;
故选:D。
9.A
【详解】A、反应Cu+FeSO4═Fe+CuSO4不可以发生,因为铜的活动性小于铁的活动性,故A错误,符合题意;
B、铁的活动性与银强,所以反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生,故B正确,不符合题意;
C、铜片放入硝酸银溶液中,生成硫酸铜和银,硝酸银溶液无色,硫酸铜溶液呈蓝色,反应前后颜色由无色变成蓝色,故C正确,不符合题意;
D、铁丝插入硫酸铜溶液中,生成铜和硫酸亚铁,可以铁丝表面有红色物质析出,故D正确,不符合题意。故选A。
10.B
【详解】①稀盐酸和鸡蛋壳(主要成分碳酸钙)反应生成二氧化碳气体,使瓶内压强增大,注射器中的活塞向右移动,故符合题意;
②稀硫酸和锌反应生成硫酸锌和氢气,使瓶内压强增大,注射器中的活塞向右移动,故符合题意;
③氧化钙与水反应放热,气体受热膨胀,使瓶内压强增大,注射器中的活塞向右移动,故符合题意;
④硝酸钾溶于水吸热,溶液温度降低,使瓶内压强减小,注射器中的活塞向左移动,故不符合题意;
故选B。
11.正确
【详解】金属活动性表中,活动性,故铁、铜分别放入硫酸锌溶液中,均不反应,表面均无现象,故填:正确。
12.×
【详解】在金属活动性顺序表中,靠前的金属才能将后面的金属从它的盐溶液中置换出来,所以可以根据金属是否和另一种金属的盐溶液反应判断金属活动性顺序。故说法错误。
13.错误
【详解】在金属活动性顺序里,镁、铝等金属排在氢前,镁、铝等金属能与盐酸反应产生氢气,但是氢后金属不能与盐酸反应,如铜,错误。
14.错误
【详解】铜的金属活动性顺序在氢之后,无法与酸发生反应。
15.错误
【详解】Cu是金属活动顺序表中H后面的金属,但Cu并不是不会发生置换反应,例如铜能与硝酸银溶液发生置换反应生成硝酸铜溶液和银,故说法错误。
16.(1) 5 在其他条件相同的情况下,温度越高,反应速率越快
(2)第2组和第3组
(3)
(4)解:设本实验所用4.0g粗锌中锌的质量为x。
x=2.6g
本实验所用4.0g粗锌中锌的质量分数为
答:本实验所用4.0g粗锌中锌的质量分数为52%。
【详解】(1)第1组、第3组实验:取用粗锌的质量相同、温度不同,要探究温度对锌与稀硫酸反应速率的影响,根据控制变量的思想,需要控制硫酸的浓度相同,则m的数值为5;由据氢气体积与反应时间的关系曲线可知,温度为30℃时,反应速率快,则温度与反应速率的关系是在其他条件相同的情况下,温度越高,反应速率越快,故填:5;在其他条件相同的情况下,温度越高,反应速率越快;
(2)探究硫酸浓度对锌与硫酸反应速率的影响,需要硫酸浓度不同,控制取用粗锌的质量、温度相同,满足的组别是第2组和第3组,故填:第2组和第3组;
(3)通过实验可知,在其他条件相同的情况下,酸的浓度越大,反应速率越快;温度越高,反应速率越快, 4组实验中第四组酸的浓度最大、温度最高,所以反应速率最快,曲线d图为,故填:;
(4)见答案。
17.(1)延展
(2)②④/④②
(3) C Fe2O3 C+ CO22CO Fe + CuSO4=FeSO4 + Cu CO+ CuOCu + CO2
【详解】(1)利用金属的延展性可把金属压成片、拉成丝,故铝块能制成铝箔是利用了铝的延展性;
(2)①、铁、铜都不能与硫酸铝溶液反应,说明了铝的活泼性大于铁、铜,但不能比较铁、铜的活泼性。故①是不可行的方案;
②、铝与氯化亚铁反应,可验证铝的活动性比铁强。铜与氯化亚铁不反应,可知铜的活动性比铁弱。故②是可行的方案;
③、铜不能与硫酸铝溶液、硫酸亚铁溶液反应,说明了铝、铁的活泼性大于铜,不能比较铝、铁的活泼性。故③是不可行的方案;
④、铁与硫酸铜溶液,可验证铁的活动性比铜强。铁与硫酸铝溶液不反应,可知铁的活动性比铝弱。故④是可行的方案;
由以上分析可知,②④正确;
(3)A~G是初中化学常见的物质,A为黑色固体单质,B为红棕色粉末,F为黑色粉末,G为紫红色固体单质,所以G是铜,A是碳,B是氧化铁,碳和氧化铁在高温的条件下生成铁和二氧化碳,C会与碳反应,所以C是一氧化碳,D是铁,铁和硫酸铜反应生成硫酸亚铁和铜,一氧化碳和F反应生成铜,所以F是氧化铜,经过验证,推导正确。
①A是C,B为Fe2O3;
②反应Ⅱ是二氧化碳和碳在高温的条件下生成一氧化碳,化学方程式为:;
③反应Ⅲ是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
④反应Ⅳ是一氧化碳与氧化铜加热生成铜和二氧化碳,化学方程式为:。
18. B C Cu2+ A>B>C 利用金属和酸的反应判断金属活动性 利用金属和盐溶液的反应判断金属活动性 Mn+H2SO4═MnSO4+H2↑
【详解】(1)A、用pH试纸测定未知溶液的pH时,不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误;
B、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,图中所示操作正确;
C、不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,图中所示操作错误;
故正确的选B,可能导致所测溶液pH数值发生改变的错误操作是C;
(2)由题意可知,A、B、C三种金属中,A能与稀硫酸反应生成硫酸盐溶液和氢气,B、C不与稀硫酸反应,说明金属活动性A>H>B>C或A>H>C>B;B能与硝酸银溶液反应,C不能,说明了金属活动性B>Ag>C;则A、B、C 三种金属的活动性由强到弱的顺序为A>B>C。
铜、银的金属活动性比氢弱,不能与稀硫酸反应,则A为锰,B为铜,C为银,铜与硝酸银溶液反应生成硝酸铜和银,滤液b 中所含阳离子为铜离子,其符号为Cu2+;
(3)由(2)分析可知,A、B、C三种金属的活动性由强到弱的顺序为A>B>C;由该实验可得出比较金属活动性强弱的方法有①利用金属和酸的反应判断金属活动性、②利用金属和盐溶液的反应判断金属活动性(合理即可);
(4)已知A 的硫酸盐中A 元素显+2 价,即锰元素的化合价为+2价,锰与稀硫酸反应生成硫酸锰和氢气,反应的化学方程式为:Mn+H2SO4═MnSO4+H2↑。
【点睛】金属活动性顺序中,氢前的金属能与稀硫酸、稀盐酸反应生成氢气,氢后的金属不能与稀盐酸、稀硫酸反应生成氢气;排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列说法正确的个数为
①滤渣中一定有铜
②向滤渣中加入一定量的稀盐酸,可能有气泡产生
③滤液一定呈无色
④滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2,可能有Cu(NO3)2
⑤忽略过滤操作中溶液损失及水分蒸发,滤液中溶质的质量一定等于原混合溶液溶质的质量
A.1 B.2 C.3 D.4
2.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是
选项 物质 少量杂质 所用试剂和操作方法
A 一氧化碳 二氧化碳 通过足量灼热碳层
B 氯酸钾 氯化钾 加入适量二氧化锰,加热至不再产生气体
C FeCl3溶液 CuCl2 加入过量铁粉,充分反应过滤、洗涤、干燥
D 铁粉 铜 加入足量硝酸银,过滤
A.A B.B C.C D.D
3.对比实验是实验探究的重要方法。下列对比实验设计不能达到目的的是
A.探究空气与呼出气体中二氧化碳的含量
B.探究温度对微粒运动速率的影响
C.探究Cu和Ag的金属活动性强弱
D.探究影响物质溶解性的因素
4.下列化学方程式书写正确的是:
A.Fe+2HCl = FeCl2+H2↑ B.H2OH2↑+O2↑
C.P+O2PO2↑ D.3Fe+2O2Fe3O4↑
5.下列四个图像的变化趋势,能正确描述对应操作的是
A.向一定量的氢氧化钠溶液先滴加2滴酚酞再滴加硫酸铜溶液至红色刚好消失
B.向一定量久置于空气中的氢氧化钠溶液中不断地滴加稀盐酸
C.向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D.向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
6.物质组成、结构、性质以及变化规律是化学研究的重要内容。下列有关说法正确的是
A.组成:一氧化碳和二氧化碳组成元素相同,所以化学性质相似
B.结构:金刚石和石墨中碳原子排列方式不同,所以物理性质差异大
C.性质:氧气能支持燃烧,所以可以作燃料
D.变化规律:铁能与稀盐酸反应,所以所有的金属都能与稀盐酸反应
7.下列方程式书写正确的是
A.4 Fe +3O22Fe2O3
B.H2+O2H2O2
C.4Al+3O2=2Al2O3
D.2P +5O22P2O5
8.关于金属的性质,下列推理正确的是( )
A.镁条可在空气中燃烧,故铁丝也可在空气中燃烧
B.金属Al在空气中放置会生成致密的Al2O3薄膜,所以金属Fe在空气中放置也会生成致密的氧化膜
C.武德合金的熔点低,所以熔点低的金属材料都是合金
D.生铁比纯铁硬,故黄铜比纯铜硬
9.根据金属活动性顺序Fe>Cu>Ag判断,下列说法错误的是
A.反应Cu+FeSO4═Fe+CuSO4可以发生
B.反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生
C.铜片放入硝酸银溶液中,颜色由无色变成蓝色
D.铁丝插入硫酸铜溶液中,铁丝表面有红色物质析出
10.如图所示装置气密性良好,要使注射器中的活塞向右移动,使用的液体M和固体N可能是
①稀盐酸和鸡蛋壳;②稀硫酸和锌;③水和氧化钙;④水和硝酸钾
A.①②③④ B.①②③ C.①②④ D.②③④
二、判断题
11.铁、铜分别放入硫酸锌溶液中,表面均无现象( )
12.金属的活动性顺序不能作为金属能否在溶液中发生置换反应的一种判断依据。( )
13.镁、铝等金属与盐酸反应都能产生氢气,所以金属都能与盐酸反应产生氢气( )
14.铜和盐酸可以发生反应。( )
15.Cu是金属活动顺序表中H后面的金属,所以Cu不会发生置换反应( )
三、综合应用题
16.为探究影响锌与硫酸反应速率的因素,实验小组取质量、颗粒大小相同的粗锌,设计了以下4组方案,记录数据并绘制生成氢气体积与反应时间的关系曲线如下图。已知粗锌中的杂质既不溶于水,也不与稀硫酸反应。
组别 取用的粗锌质量 硫酸的浓度/%(均取98mL) 温度/℃ 对应的曲线
1 4.0g m 20 a
2 4.0g 10 30 b
3 4.0g 5 30 c
4 4.0g 10 50 d
(1)通过第1组和第3组实验可以探究温度对锌与硫酸反应速率的影响,则m的数值为 。据此可知温度与反应速率的关系是 。
(2)能探究硫酸浓度对锌与硫酸反应速率的影响的组别是 。(填序号)
(3)根据你对本实验的理解,请在坐标图中画出第4组实验对应的大致曲线d。
(4)实验条件下890mLH2折合为0.08g,请计算出本实验所用4.0g粗锌中锌的质量分数。(用化学方程式计算,写出完整的计算过程)
17.金属材料广泛应用于生产生活中:
(1)铝块能制成铝箔是利用了铝的 性。
(2)为探究铝、铁、铜三种金属的活动性顺序。实验小组的同学设计了四个实验方案:
①铁、铜、硫酸铝溶液;②铝、铜、氯化亚铁溶液;③铜、硫酸铝溶液、硫酸亚铁溶液;④铁、硫酸铝溶液、硫酸铜溶液。
上述四个方案所选试剂正确的是 (填序号)。
(3)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如图所示,回答问题。
①写出化学式:A ;B 。
②反应Ⅱ的化学方程式为 。
③反应Ⅲ的化学方程式为 。
④反应Ⅳ的化学方程式为 。
18.两个实验小组分别进行“溶液酸碱度的检验”和“金属的回收”的探究实验。
【实验一】溶液酸碱度的检验
(1)如图是测定土壤酸碱度的操作示意图,其中正确的是 (填“A”“B”或“C下同),可能导致所测溶液pH数值发生改变的错误操作是 。
【实验二】金属回收的探究
从含少量铜粉的银、锰混合粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为A、B、C,并设计了如下流程。
(2)滤液b 中所含阳离子的符号为 。
(3)A、B、C三种金属的活动性由强到弱的顺序为 。由该实验可得出比较金属活动性强弱的方法有① ;② 。
(4)已知A的硫酸盐中A元素显+2 价,请写出步骤①的反应的化学方程式 。
参考答案:
1.D
【分析】金属活动性Mg>Zn>Fe>Cu,所以锌先和硝酸铜反应生成硝酸锌和铜,如有硝酸铜剩余则铁和硝酸铜反应生成硝酸亚铁和铜。硝酸镁不参与反应。因反应前后固体的质量均为ag,,可知,一定发生了铁和硝酸铜的反应,否则反应前后固体质量不可能相等。
【详解】①滤渣中一定有置换出的铜,该选项正确。
②如铁未完全反应会有铁剩余,铁能和稀盐酸反应,所以向滤渣中加入一定量的稀盐酸,可能有气泡产生,该选项正确。
③滤液一定有颜色,如硝酸铜有剩余溶液可能为蓝色,铁和硝酸铜一定发生反应则一定有硝酸亚铁生成,如无硝酸铜溶液为浅绿色。该选项不正确。
④滤液中一定有不反应的Mg(NO3)2和反应生成的Zn(NO3)2和Fe(NO3)2,可能有过量的Cu(NO3)2,该选项正确。
⑤反应前后物质总质量不变,反应前后固体质量相等,如忽略过滤操作中溶液损失及水分蒸发,滤液中溶质的质量一定等于原混合溶液溶质的质量,该选项正确。
①②④⑤4个正确,故选:D。
2.A
【详解】A.二氧化碳通过足量灼热碳层,二氧化碳会与碳反应生成一氧化碳,所以可以除去杂质,选项正确;
B.氯化钾加入适量二氧化锰,不会反应,相反氯酸钾加了二氧化锰加热至不再产生气体生成氯化钾,除去了原本要的物质,违背了除杂原则,选项错误;
C.氯化铁和氯化铜都会与铁粉反应,违背了除杂原则,选项错误;
D.铁和铜均会与硝酸银反应,并且铁活性强,铁会先反应,违背了除杂原则,选项错误。
故选:A。
3.C
【详解】A、检验二氧化碳使用澄清石灰水,图中实验,滴入呼出气体中的石灰水变浑浊,滴入空气的石灰水无明显现象,可比较空气与人体呼出的气体中二氧化碳的含量,该选项能达到实验目的,不符合题意;
B、探究温度对微粒运动速率的影响,是在其他条件相同条件下,比较不同温度时,红墨水扩散速率,该选项能达到实验目的,不符合题意;
C、图中实验,铜、银都不能与稀硫酸反应,只能说明铜、银排在H之后,不能确定铜、银活动性强弱,选项不能达到相应实验目的,符合题意;
D、该实验中碘不能溶于水,高锰酸钾能溶于水,说明相同条件下物质的溶解性与溶质的性质有关,该选项能达到实验目的,不符合题意。
故选C。
4.A
【详解】A、铁和稀盐酸反应生成氯化亚铁和氢气,A书写正确;
B、没有配平,B错误;
C、违背了客观事实,生成物是五氧化二磷,五氧化二磷是固态,C错误;
D、没有注明反应条件,四氧化三铁是固态。D错误。
综上所述:选择A。
5.B
【详解】A、氢氧化钠溶液显碱性,能使无色酚酞变红且溶液的pH>7,向氢氧化钠溶液中滴加酚酞后再滴加硫酸铜溶液至红色刚好消失,说明硫酸铜和氢氧化钠恰好完全反应,反应后溶液呈中性,pH的变化是从大于7变化到等于7,故不符合题意;
B、久置于空气中的氢氧化钠溶液会和空气中的二氧化碳反应生成碳酸钙沉淀,加入盐酸后,氢氧化钠和稀盐酸反应没有气体产生,当氢氧化钠反应完毕后,稀盐酸和碳酸钙反应就会生成气体,故符合题意;
C、锌比铁活泼,当金属和足量酸反应时,锌产生气体的速率比铁快,又因为铁的相对原子质量(56)小于锌的相对原子质量(65),等质量的锌、铁和足量稀盐酸反应时,铁生成的氢气多,故不符合题意;
D、向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体,由于溶液已经饱和,溶质质量不变,溶剂质量不变,所以溶质质量分数不变,故不符合题意。
【点睛】金属和酸反应的图像类题目中,主要涉及镁、铝、铁、锌四种金属,根据他们的金属活动性强弱可判断与酸反应的快慢,越活泼的金属反应越快,在横坐标为时间,纵坐标为氢气质量的图像上就表现为越靠近纵坐标。
6.B
【详解】A、一氧化碳和二氧化碳的组成元素相同,但它们分子的构成不同,它们的化学性质不同。如一氧化碳具有可燃性,二氧化碳不能燃烧。A说法不正确;
B、由于金刚石和石墨中碳原子排列方式不同,所以物理性质差异很大。B说法正确;
C、氧气能支持燃烧,但不具有可燃性,所以不能作燃料。C说法不正确;
D、能跟稀盐酸反应的金属,是在金属活动性顺序表中应位于H之前的金属,铁能与稀盐酸反应,是因为在金属活动性顺序表中铁位于H之前。不是所有的金属都能与稀盐酸反应。D说法不正确。
综上所述:选择B。
7.C
【详解】A、铁在氧气中燃烧生成四氧化三铁,该反应的化学方程式为:,生成物错误,不符合题意;
B、氢气在氧气中燃烧生成水,该反应的化学方程式为:,生成物错误,不符合题意;
C、常温下,铝能与氧气反应生成氧化铝,该反应的化学方程式为:,符合题意;
D、磷在氧气中燃烧生成五氧化二磷,该反应的化学方程式为:,未配平,不符合题意。
故选C。
8.D
【详解】A、镁条可在空气中燃烧,但铁丝不能空气中燃烧;故选项错误;
B、金属Al在空气中放置会生成致密的Al2O3薄膜,但金属Fe在空气中放置不会生成致密的氧化膜;故选项错误;
C、武德合金的熔点低,所以熔点低的金属材料不一定都是合金,例如:汞;故选项错误;
D、一般合金的硬度要大于组成它的纯金属硬度,生铁比纯铁硬,故黄铜比纯铜硬;故选项正确;
故选:D。
9.A
【详解】A、反应Cu+FeSO4═Fe+CuSO4不可以发生,因为铜的活动性小于铁的活动性,故A错误,符合题意;
B、铁的活动性与银强,所以反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生,故B正确,不符合题意;
C、铜片放入硝酸银溶液中,生成硫酸铜和银,硝酸银溶液无色,硫酸铜溶液呈蓝色,反应前后颜色由无色变成蓝色,故C正确,不符合题意;
D、铁丝插入硫酸铜溶液中,生成铜和硫酸亚铁,可以铁丝表面有红色物质析出,故D正确,不符合题意。故选A。
10.B
【详解】①稀盐酸和鸡蛋壳(主要成分碳酸钙)反应生成二氧化碳气体,使瓶内压强增大,注射器中的活塞向右移动,故符合题意;
②稀硫酸和锌反应生成硫酸锌和氢气,使瓶内压强增大,注射器中的活塞向右移动,故符合题意;
③氧化钙与水反应放热,气体受热膨胀,使瓶内压强增大,注射器中的活塞向右移动,故符合题意;
④硝酸钾溶于水吸热,溶液温度降低,使瓶内压强减小,注射器中的活塞向左移动,故不符合题意;
故选B。
11.正确
【详解】金属活动性表中,活动性,故铁、铜分别放入硫酸锌溶液中,均不反应,表面均无现象,故填:正确。
12.×
【详解】在金属活动性顺序表中,靠前的金属才能将后面的金属从它的盐溶液中置换出来,所以可以根据金属是否和另一种金属的盐溶液反应判断金属活动性顺序。故说法错误。
13.错误
【详解】在金属活动性顺序里,镁、铝等金属排在氢前,镁、铝等金属能与盐酸反应产生氢气,但是氢后金属不能与盐酸反应,如铜,错误。
14.错误
【详解】铜的金属活动性顺序在氢之后,无法与酸发生反应。
15.错误
【详解】Cu是金属活动顺序表中H后面的金属,但Cu并不是不会发生置换反应,例如铜能与硝酸银溶液发生置换反应生成硝酸铜溶液和银,故说法错误。
16.(1) 5 在其他条件相同的情况下,温度越高,反应速率越快
(2)第2组和第3组
(3)
(4)解:设本实验所用4.0g粗锌中锌的质量为x。
x=2.6g
本实验所用4.0g粗锌中锌的质量分数为
答:本实验所用4.0g粗锌中锌的质量分数为52%。
【详解】(1)第1组、第3组实验:取用粗锌的质量相同、温度不同,要探究温度对锌与稀硫酸反应速率的影响,根据控制变量的思想,需要控制硫酸的浓度相同,则m的数值为5;由据氢气体积与反应时间的关系曲线可知,温度为30℃时,反应速率快,则温度与反应速率的关系是在其他条件相同的情况下,温度越高,反应速率越快,故填:5;在其他条件相同的情况下,温度越高,反应速率越快;
(2)探究硫酸浓度对锌与硫酸反应速率的影响,需要硫酸浓度不同,控制取用粗锌的质量、温度相同,满足的组别是第2组和第3组,故填:第2组和第3组;
(3)通过实验可知,在其他条件相同的情况下,酸的浓度越大,反应速率越快;温度越高,反应速率越快, 4组实验中第四组酸的浓度最大、温度最高,所以反应速率最快,曲线d图为,故填:;
(4)见答案。
17.(1)延展
(2)②④/④②
(3) C Fe2O3 C+ CO22CO Fe + CuSO4=FeSO4 + Cu CO+ CuOCu + CO2
【详解】(1)利用金属的延展性可把金属压成片、拉成丝,故铝块能制成铝箔是利用了铝的延展性;
(2)①、铁、铜都不能与硫酸铝溶液反应,说明了铝的活泼性大于铁、铜,但不能比较铁、铜的活泼性。故①是不可行的方案;
②、铝与氯化亚铁反应,可验证铝的活动性比铁强。铜与氯化亚铁不反应,可知铜的活动性比铁弱。故②是可行的方案;
③、铜不能与硫酸铝溶液、硫酸亚铁溶液反应,说明了铝、铁的活泼性大于铜,不能比较铝、铁的活泼性。故③是不可行的方案;
④、铁与硫酸铜溶液,可验证铁的活动性比铜强。铁与硫酸铝溶液不反应,可知铁的活动性比铝弱。故④是可行的方案;
由以上分析可知,②④正确;
(3)A~G是初中化学常见的物质,A为黑色固体单质,B为红棕色粉末,F为黑色粉末,G为紫红色固体单质,所以G是铜,A是碳,B是氧化铁,碳和氧化铁在高温的条件下生成铁和二氧化碳,C会与碳反应,所以C是一氧化碳,D是铁,铁和硫酸铜反应生成硫酸亚铁和铜,一氧化碳和F反应生成铜,所以F是氧化铜,经过验证,推导正确。
①A是C,B为Fe2O3;
②反应Ⅱ是二氧化碳和碳在高温的条件下生成一氧化碳,化学方程式为:;
③反应Ⅲ是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
④反应Ⅳ是一氧化碳与氧化铜加热生成铜和二氧化碳,化学方程式为:。
18. B C Cu2+ A>B>C 利用金属和酸的反应判断金属活动性 利用金属和盐溶液的反应判断金属活动性 Mn+H2SO4═MnSO4+H2↑
【详解】(1)A、用pH试纸测定未知溶液的pH时,不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误;
B、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,图中所示操作正确;
C、不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,图中所示操作错误;
故正确的选B,可能导致所测溶液pH数值发生改变的错误操作是C;
(2)由题意可知,A、B、C三种金属中,A能与稀硫酸反应生成硫酸盐溶液和氢气,B、C不与稀硫酸反应,说明金属活动性A>H>B>C或A>H>C>B;B能与硝酸银溶液反应,C不能,说明了金属活动性B>Ag>C;则A、B、C 三种金属的活动性由强到弱的顺序为A>B>C。
铜、银的金属活动性比氢弱,不能与稀硫酸反应,则A为锰,B为铜,C为银,铜与硝酸银溶液反应生成硝酸铜和银,滤液b 中所含阳离子为铜离子,其符号为Cu2+;
(3)由(2)分析可知,A、B、C三种金属的活动性由强到弱的顺序为A>B>C;由该实验可得出比较金属活动性强弱的方法有①利用金属和酸的反应判断金属活动性、②利用金属和盐溶液的反应判断金属活动性(合理即可);
(4)已知A 的硫酸盐中A 元素显+2 价,即锰元素的化合价为+2价,锰与稀硫酸反应生成硫酸锰和氢气,反应的化学方程式为:Mn+H2SO4═MnSO4+H2↑。
【点睛】金属活动性顺序中,氢前的金属能与稀硫酸、稀盐酸反应生成氢气,氢后的金属不能与稀盐酸、稀硫酸反应生成氢气;排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来。
