7.1酸性溶液和碱性溶液同步练习(含解析) 仁爱版化学九年级下册
文档属性
| 名称 | 7.1酸性溶液和碱性溶液同步练习(含解析) 仁爱版化学九年级下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 470.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-26 00:00:00 | ||
图片预览


文档简介
7.1酸性溶液和碱性溶液
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.在一无色溶液中滴入数滴酚酞试液,溶液仍显无色,则可以得出这样的结论:①溶液是中性的;②溶液不可能是碱性的;③溶液可能是酸性的;④如果在该溶液中滴入紫色石蕊试液,溶液一定仍显紫色,结论中正确的是
A.①②③④ B.①④ C.②③ D.以上答案都不对
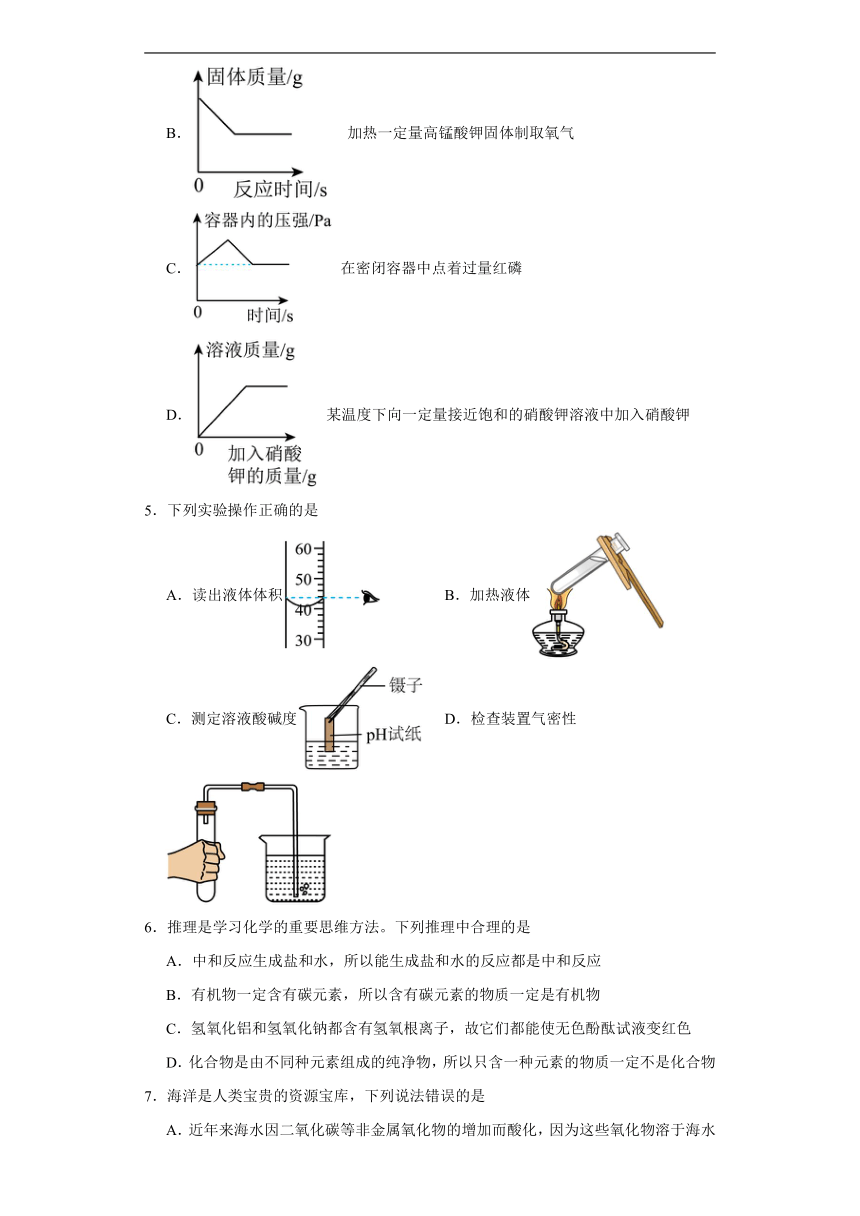
2.实验室利用数字化实验测定氢氧化钠溶液和稀盐酸反应(图一)温度和pH的变化曲线(图二)所示。下列说法错误的是
A.该反应是将稀盐酸逐滴加入氢氧化钠溶液中
B.氢氧化钠和稀盐酸恰好完全反应时,放热最大
C.在0~60s之间pH变化不大是因为氢氧化钠没反应完
D.70s时,溶液中含有的阳离子只含有有Na+
3.化学课上老师在滤纸上用酚酞试液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图像,则X可能是( )
A.稀盐酸 B.蒸馏水 C.石灰水 D.食盐水
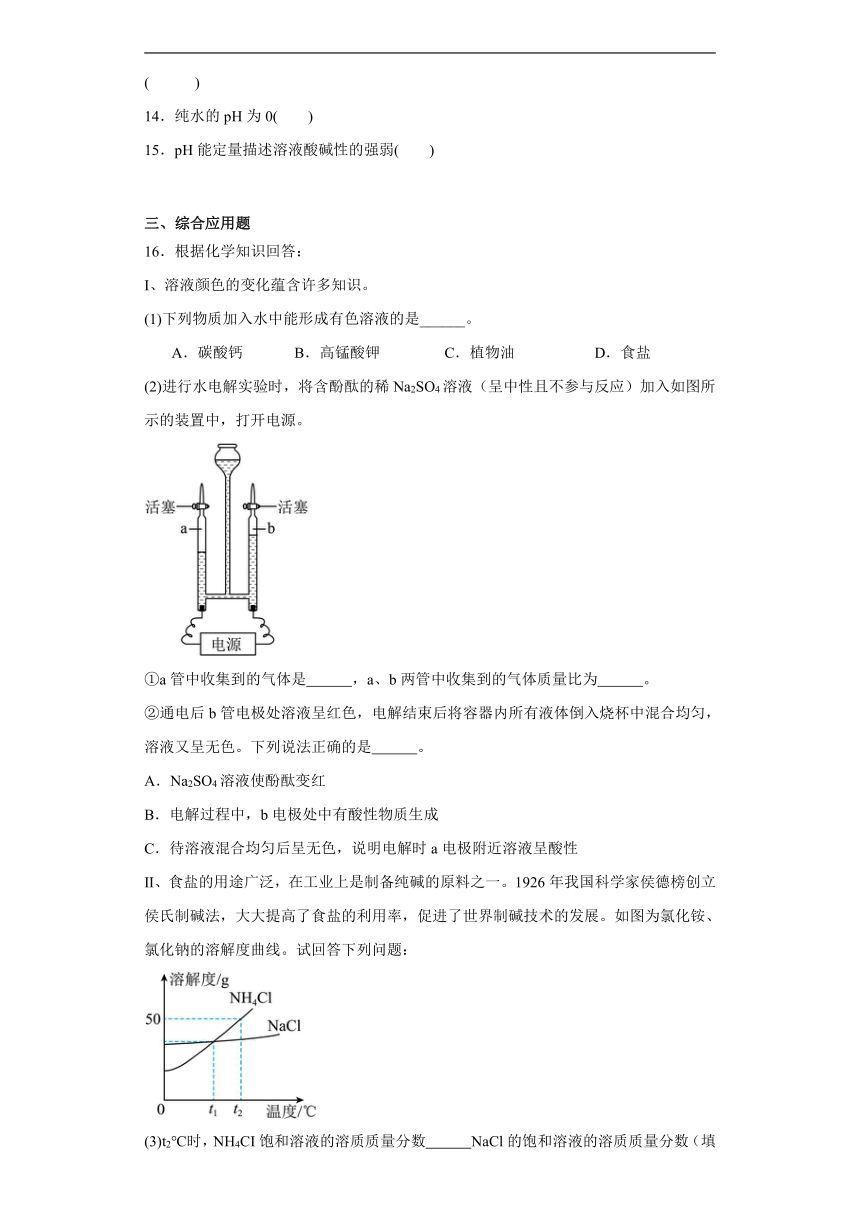
4.下列四个图像分别与选项中的操作相对应,其中合理的是
A. 向一定量稀盐酸中加水
B. 加热一定量高锰酸钾固体制取氧气
C. 在密闭容器中点着过量红磷
D. 某温度下向一定量接近饱和的硝酸钾溶液中加入硝酸钾
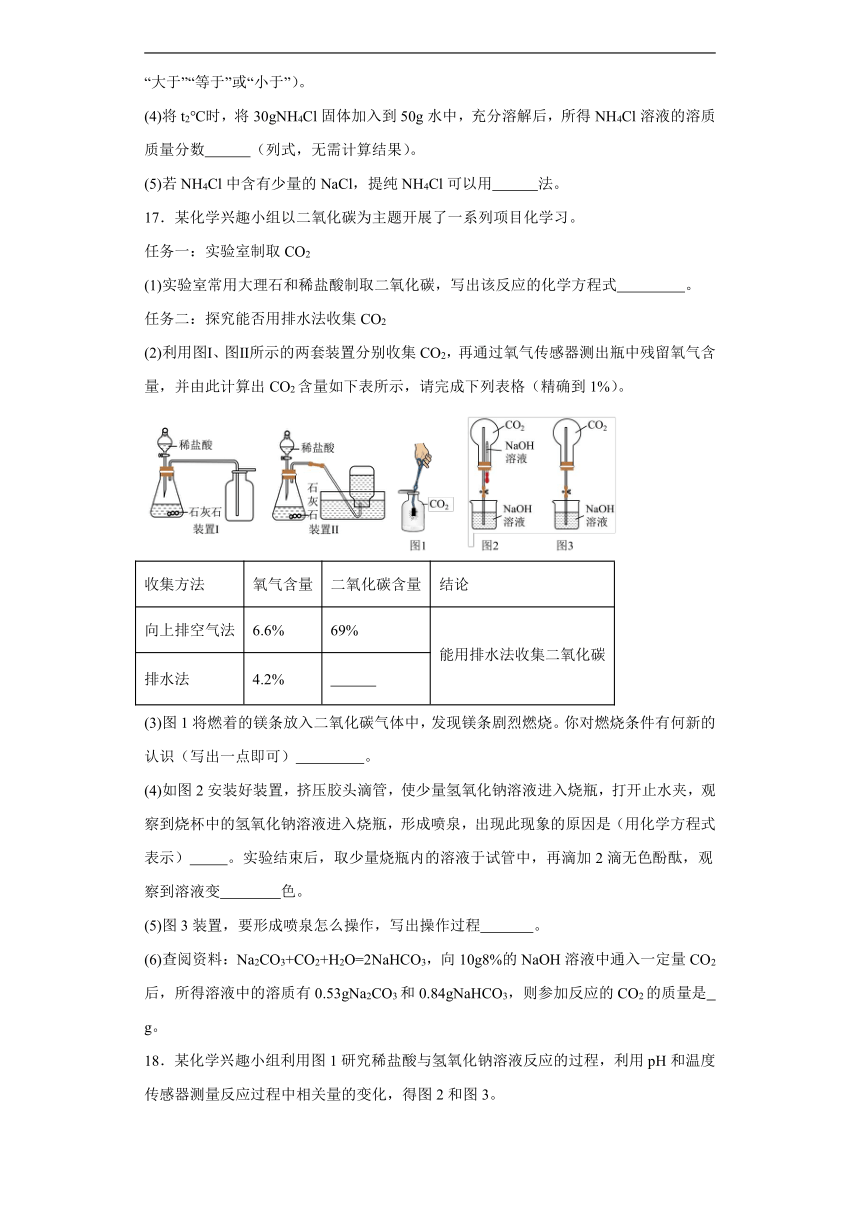
5.下列实验操作正确的是
A.读出液体体积 B.加热液体
C.测定溶液酸碱度 D.检查装置气密性
6.推理是学习化学的重要思维方法。下列推理中合理的是
A.中和反应生成盐和水,所以能生成盐和水的反应都是中和反应
B.有机物一定含有碳元素,所以含有碳元素的物质一定是有机物
C.氢氧化铝和氢氧化钠都含有氢氧根离子,故它们都能使无色酚酞试液变红色
D.化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物
7.海洋是人类宝贵的资源宝库,下列说法错误的是
A.近年来海水因二氧化碳等非金属氧化物的增加而酸化,因为这些氧化物溶于海水中会使海水 PH 值增加
B.海水制镁时,加入石灰乳的目的是将镁离子沉降聚集
C.用膜分离法淡化海水,其原理与过滤相似,都是选择合适的孔径将直径大小不同的粒子(或颗粒)分开
D.海水酸化严重将影响珊瑚和其他分泌碳酸钙的海洋生物生存,因为海水 H+ 的浓度增加,这些海洋生物的碳酸钙外壳会遭到破坏
8.一些物质的近似 pH 如下表,下列相关说法正确的是( )
物质 厕所清洁剂 苹果汁 纯鲜牛奶 肥皂水 炉具清洁剂
pH 2 3 6.5 10 13
A.肥皂水显酸性 B.蚊虫叮咬后可涂抹肥皂水减轻痛痒
C.纯鲜牛奶的酸性比苹果汁强 D.厕所清洁剂可以和炉具清洁剂混合使用
9.一些食物的近似pH如表:
食物 苹果 葡萄 牛奶 玉米粥
pH 2.9-3.3 3.5-4.5 6.3-6.6 7.2-8.0
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最适宜食用上述食物中的
A.葡萄 B.苹果 C.玉米粥 D.牛奶
10.蚊虫叮咬时释放出的液体中含有蚁酸(显酸性),为了减轻痒痛,可以在被叮咬处涂抹
物质名称 西红柿汁 苹果汁 牛奶 牙膏
pH范围 4~5 2~3 6~7 8~9
A.西红柿汁 B.苹果汁 C.牛奶 D.牙膏
二、判断题
11.酸和碱的溶液能与指示剂反应,则所有的酸和碱都能使指示剂变色( )
12.向石蕊溶液通入二氧化碳,溶液由红色变为紫色。( )
13.测定溶液的方法:取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测溶液滴到试纸上,把试纸显示的颜色与颜色卡比较,即可得出溶液的。( )
14.纯水的pH为0( )
15.pH能定量描述溶液酸碱性的强弱( )
三、综合应用题
16.根据化学知识回答:
Ⅰ、溶液颜色的变化蕴含许多知识。
(1)下列物质加入水中能形成有色溶液的是______。
A.碳酸钙 B.高锰酸钾 C.植物油 D.食盐
(2)进行水电解实验时,将含酚酞的稀Na2SO4溶液(呈中性且不参与反应)加入如图所示的装置中,打开电源。
①a管中收集到的气体是 ,a、b两管中收集到的气体质量比为 。
②通电后b管电极处溶液呈红色,电解结束后将容器内所有液体倒入烧杯中混合均匀,溶液又呈无色。下列说法正确的是 。
A.Na2SO4溶液使酚酞变红
B.电解过程中,b电极处中有酸性物质生成
C.待溶液混合均匀后呈无色,说明电解时a电极附近溶液呈酸性
Ⅱ、食盐的用途广泛,在工业上是制备纯碱的原料之一。1926年我国科学家侯德榜创立侯氏制碱法,大大提高了食盐的利用率,促进了世界制碱技术的发展。如图为氯化铵、氯化钠的溶解度曲线。试回答下列问题:
(3)t2℃时,NH4CI饱和溶液的溶质质量分数 NaCl的饱和溶液的溶质质量分数(填“大于”“等于”或“小于”)。
(4)将t2℃时,将30gNH4Cl固体加入到50g水中,充分溶解后,所得NH4Cl溶液的溶质质量分数 (列式,无需计算结果)。
(5)若NH4Cl中含有少量的NaCl,提纯NH4Cl可以用 法。
17.某化学兴趣小组以二氧化碳为主题开展了一系列项目化学习。
任务一:实验室制取CO2
(1)实验室常用大理石和稀盐酸制取二氧化碳,写出该反应的化学方程式 。
任务二:探究能否用排水法收集CO2
(2)利用图Ⅰ、图Ⅱ所示的两套装置分别收集CO2,再通过氧气传感器测出瓶中残留氧气含量,并由此计算出CO2含量如下表所示,请完成下列表格(精确到1%)。
收集方法 氧气含量 二氧化碳含量 结论
向上排空气法 6.6% 69% 能用排水法收集二氧化碳
排水法 4.2%
(3)图1将燃着的镁条放入二氧化碳气体中,发现镁条剧烈燃烧。你对燃烧条件有何新的认识(写出一点即可) 。
(4)如图2安装好装置,挤压胶头滴管,使少量氢氧化钠溶液进入烧瓶,打开止水夹,观察到烧杯中的氢氧化钠溶液进入烧瓶,形成喷泉,出现此现象的原因是(用化学方程式表示) 。实验结束后,取少量烧瓶内的溶液于试管中,再滴加2滴无色酚酞,观察到溶液变 色。
(5)图3装置,要形成喷泉怎么操作,写出操作过程 。
(6)查阅资料:Na2CO3+CO2+H2O=2NaHCO3,向10g8%的NaOH溶液中通入一定量CO2后,所得溶液中的溶质有0.53gNa2CO3和0.84gNaHCO3,则参加反应的CO2的质量是 g。
18.某化学兴趣小组利用图1研究稀盐酸与氢氧化钠溶液反应的过程,利用pH和温度传感器测量反应过程中相关量的变化,得图2和图3。
(1)图2中b点所示溶液中的溶质是 。(写化学式)
(2)取图2中d点所示溶液,滴加紫色石蕊试液,观察到的现象是 。
(3)图3中V的数值最接近 (填“5”、“10”或“12.5”),图3中溶液温度发生变化的原因是 。
(4)若向8g氢氧化钠溶液中加入溶质质量分数为7.3%的稀盐酸10g,恰好完全反应。试计算氢氧化钠溶液的溶质质量分数。
参考答案:
1.C
【详解】酸性溶液和中性溶液均不能使酚酞变色,只有碱性溶液才能使酚酞变成红色。故选C。
2.D
【详解】A、一开始时溶液的pH=14,呈碱性,说明该反应是将稀盐酸逐滴加入氢氧化钠溶液中,正确;
B、氢氧化钠和稀盐酸反应是放热反应,随着反应的进行,温度越来越高,当氢氧化钠和稀盐酸恰好完全反应时,温度达到最大值,正确;
C、在0~60 s,氢氧化钠没有反应完,所以pH变化不大,正确;
D、70 s时,溶液呈酸性,稀盐酸过量,溶液中含有的阳离子有Na+、H+,错误。
故选D。
3.C
【详解】酚酞遇碱性溶液会变红色,而遇中性物质和酸性物质都不变色。
A、稀盐酸呈酸性,所以不能使酚酞变红,故A错误;
B、蒸馏水呈中性,不能使酚酞变红,故B错误;
C、石灰水呈碱性,可以使酚酞变红,故C正确;
D、食盐水呈中性,不能使酚酞变红,故D错误。故选C。
4.B
【详解】A、向一定量的稀盐酸中加水,溶液的酸性减弱,pH增大,但不会等于7,更不会大于7,选项错误;
B、高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,固体质量减少,反应停止,固体质量不变,选项正确;
C、红磷燃烧放热,容器内压强增大,反应停止,恢复至室温后,压强减小,应反应消耗氧气,最终压强小于初始压强,选项错误;
D、某温度下向一定量接近饱和的硝酸钾溶液中加入硝酸钾,初始溶液质量不为零,部分硝酸钾溶解至溶液饱和,溶液质量先增大后不变,选项错误。
故选B。
5.D
【详解】A、用量筒量取液体体积读数时,视线要与凹液面最低处相平,故错误;
B、用试管加热液体时,试管中的液体不能超过试管容积的三分之一,故错误;
C、用pH试纸测定溶液的酸碱性时,不能将pH试纸直接插入待测液体中,故错误;
D、检查装置的气密性的方法是将玻璃导管放入水中,用手握住试管,如导管口处有气泡冒出,则气密性良好,故正确。故选D。
6.D
【详解】A、中和反应生成盐和水,能生成盐和水的反应不一定是中和反应,如碳酸氢盐与酸反应,故选项不合理;
B、有机物一定含有碳元素,含有碳元素的物质不一定是有机物,如二氧化碳,一氧化碳,故选项不合理;
C、碱性溶液能使无色酚酞变色,氢氧化铝不溶于水,不能使无色酚酞试液变红,故选项不合理;
D、化合物是由不同种元素组成的纯净物,只含一种元素的物质一定不是化合物,故选项合理。
故选D
7.A
【详解】A、海水中二氧化碳等非金属氧化物的增加,可使海水中酸性增强,从而使海水酸化,pH减小,故说法错误;
B、海水制镁时,加入石灰乳的目的是将镁离子生成氢氧化镁沉淀,使其沉降聚集,故说法正确;
C、膜法淡化海水是对膜中的海水施以压力,使海水中的溶剂渗透到膜外,而溶质却被膜阻挡在海水中,与过滤的原理相似,都是选择合适的孔径将直径大小不同的粒子(或颗粒)分开,故说法正确;
D、酸化的海水中氢离子和碳酸钙可发生反应,可使海洋生物中碳酸钙外壳溶解,故说法正确。
故选A。
8.B
【详解】A. 由表可知肥皂水的pH值为10,大于7,显碱性,故选项说法错误。
B、蚊虫叮咬后会释放蚁酸,蚁酸对皮肤的刺激产生痛痒的感觉,可以采用碱性物质肥皂水来中和减轻痛痒,故选项说法正确。
C、pH值越小,酸性越强,纯鲜牛奶的pH值比苹果汁pH值大,因此纯鲜牛奶的酸性比苹果汁弱,故选项说法错误。
D、厕所清洁剂pH值为2,炉具清洁剂pH值为13,混合后会相互反应,使得清洁剂失效,不能混合,故选项说法错误。
故选:B。
【点睛】解答本题类似题目,要掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论。
9.C
【详解】人的胃液中含有盐酸,胃酸过多,应食用碱性物质,酸碱中和,减轻病症,葡萄、苹果、牛奶的pH均小于7,均显酸性,玉米粥pH>7,显碱性。
故选C。
10.D
【分析】蚊虫叮咬时释放出的液体中含有蚁酸(显酸性),酸和碱反应生成盐和水,则需要涂抹显碱性的物质。
【详解】A、西红柿汁的pH为4~5,显酸性,不和蚁酸反应,不能涂抹,不正确;
B、苹果汁的pH为2~3,显酸性,不和蚁酸反应,不能涂抹,不正确;
C、牛奶的pH为6~7,显弱酸性,不和蚁酸反应,不能涂抹,不正确;
D、牙膏的pH为8~9,显碱性,和蚁酸反应,能涂抹,正确;
故选D。
11.错误/错/×
【详解】酸和碱的溶液能与指示剂反应,但是不是所有的酸和碱都能使指示剂变色,如酸不能使无色酚酞试液变色,故错误。
12.错误
【详解】向紫色石蕊溶液通入二氧化碳,二氧化碳与水反应生成碳酸,碳酸显酸性,溶液由紫色变为红色,故填:错误。
13.×
【详解】应把试纸显示的颜色与标准比色卡比较,即可得出溶液的。
此说法错误
14.错误
【详解】纯水为中性,pH为7,故错误。
15.正确
【详解】酸碱度是溶液酸碱性的强弱程度,pH的范围是0~14;当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性,且pH越小,酸性越强;当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,所以pH能定量描述溶液酸碱性的强弱,故原题说法正确。
16.(1)B
(2) H2/氢气 1:8 C
(3)大于
(4)
(5)降温结晶(或冷却热的饱和溶液)
【详解】(1)A、碳酸钙不溶于水,不能形成溶液,故A选项错误;
B、高锰酸钾溶于水,能形成紫红色溶液,故B选项正确;
C、植物油不溶于水,不能形成溶液,故C选项错误;
D、食盐溶于水,能形成溶液,但为无色,故D选项错误。
故选B。
(2)①水的电解实验中正极产生氧气,负极产生氢气,产生氢气和氧气的体积比为2:1,由图分析可知:a管中收集到的是氢气,b管中收集到的是氧气;a、b两管中收集到的氢分子与氧分子的个数比为2:1,则a、b两管中收集到的气体质量比为,故填:氢气(或H2);1:8;
②A、Na2SO4溶液呈中性,不能使酚酞变红,说法错误;
B、电解过程中,b管电极处溶液呈红色,说明b电极处中有碱性物质生成,说法错误;
C、b管电极处溶液呈红色,说明电解时b电极附近溶液呈碱性,待溶液混合均匀后呈无色,则说明电解时a电极附近溶液呈酸性,说法正确。
故选C。
(3)t2℃时,NH4Cl的溶解度大于NaCl,根据饱和溶液的溶质质量分数,可知t2℃时,NH4Cl饱和溶液的溶质质量分数大于NaCl的饱和溶液的溶质质量分数,故填:大于;
(4)t2℃时,NH4Cl的溶解度是50g,表示100g水中最多溶解50gNH4Cl,将30gNH4Cl固体加入到50g水中,充分溶解后,得到NH4Cl的饱和溶液,则溶质质量分数为,故填:;
(5)若NH4Cl中含有少量的NaCl,NH4Cl的溶解度受温度影响较大,要提纯NH4Cl可以用降温结晶或冷却热饱和溶液的方法,故填:降温结晶(或冷却热饱和溶液)。
17.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)80%/79%
(3)燃烧不一定需要氧气
(4) 2NaOH+CO2=Na2CO3+H2O 红
(5)打开止水夹,并用热毛巾捂住烧瓶外部
(6)0.66
解:因为二氧化碳与氢氧化钠溶液反应生成碳酸钠、水,继续通入二氧化碳,二氧化碳、水、碳酸钠发生反应生成碳酸氢钠,10g 8%的NaOH溶液中溶质的质量为:10g×8%=0.8g,设与10g 8%NaOH溶液反应的二氧化碳的质量为y。
,y=0.44g
设反应生成0.84gNaHCO3消耗二氧化碳的质量为x。
,x=0.22g
故参加反应的CO2的质量为:0.44g+0.22g=0.66g
【详解】(1)实验室常用大理石或石灰石和稀盐酸制取二氧化碳,该反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)假设气体的总体积是100mL,氧气含量为4.2%,所以氧气的体积是4.2 mL,则空气的体积是:=20 mL,(空气中氧气的体积分数按21%计算)或=21 mL(空气中氧气的体积分数按20%计算),则二氧化碳的体积分数是80%或79%,故填:80%或79%。
(3)将燃着的镁条放入二氧化碳气体中,发现镁条剧烈燃烧,说明燃烧发生时不一定需要氧气;
(4)如图2安装好装置,挤压胶头滴管,使少量氢氧化钠溶液进入烧瓶,打开止水夹,观察到烧杯中的氢氧化钠溶液进入烧瓶,形成喷泉,出现此现象的原因是二氧化碳与氢氧化钠溶液发生反应,烧瓶内气体减少,压强变小,所以溶液进入烧瓶内,形成喷泉,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。反应后生成的碳酸钠溶液显碱性,能使酚酞试液变红,所以实验结束后,取少量烧瓶内的溶液于试管中,再滴加2滴无色酚酞,观察到溶液变红色。
(5)图3装置,要形成喷泉的操作是:打开止水夹,并用热毛巾捂住烧瓶外部,会使烧瓶内的气体受热膨胀而排出,取下毛巾后,气温降低,烧瓶内气压减少,从而形成喷泉。
(6)见答案。
18. 、 紫色石蕊试液变红(或溶液变红) 10 e→f,温度逐渐上升,其原因是氢氧化钠与稀盐酸发生中和反应放出热量(答案合理即可);f→g,温度逐渐下降,其原因 是溶液的 然冷却, 是加入冷的稀盐酸起到冷却作用(答案合理即可) 10%
解:设的质量为x
x=0.8g
氢氧化钠溶液溶质的质量分数
答:氢氧化钠溶液溶质的质量分数为10%。
【分析】(1)根据b点pH>7,溶液中含有,已经加入少量盐酸,盐酸与氢氧化钠反应生成水和氯化钠,因此溶液中一定有氯化钠进行解答;
(2)根据紫色石蕊试液遇酸变红、遇碱变蓝,d点pH<7,呈酸性,因此溶液变为红色;
(3)根据酸碱中和反应放热,完全反应时放热最多,溶液温度最高,pH应为中性进行分析解答,认真分析图3中pH和温度传感器测量反应过程中相关量的变化进行解答;
(4)根据盐酸中溶质的质量去求出氢氧化钠的质量,再根据溶质的质量分数的计算公式进行解答。
【详解】(1)b点pH>7,溶液中含有,已经加入少量盐酸,盐酸与氢氧化钠反应生成水和氯化钠,化学方程式为:,因此溶液中一定有氯化钠,故溶质中、,故填:、;
(2)紫色石蕊试液遇酸变红、遇碱变蓝,d点pH<7,呈酸性,因此溶液变为红色,故填:紫色石蕊试液变红(或溶液变红);
(3)酸碱中和反应放热,完全反应时放热最多,溶液温度最高,pH应为中性,V的数值最接近10;e→f,温度逐渐上升,其原因是氢氧化钠与稀盐酸发生中和反应放出热量(答案合理即可);f→g,温度逐渐下降,其原因 是溶液的 然冷却, 是加入冷的稀盐酸起到冷却作用(答案合理即可);
(4)见答案。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.在一无色溶液中滴入数滴酚酞试液,溶液仍显无色,则可以得出这样的结论:①溶液是中性的;②溶液不可能是碱性的;③溶液可能是酸性的;④如果在该溶液中滴入紫色石蕊试液,溶液一定仍显紫色,结论中正确的是
A.①②③④ B.①④ C.②③ D.以上答案都不对
2.实验室利用数字化实验测定氢氧化钠溶液和稀盐酸反应(图一)温度和pH的变化曲线(图二)所示。下列说法错误的是
A.该反应是将稀盐酸逐滴加入氢氧化钠溶液中
B.氢氧化钠和稀盐酸恰好完全反应时,放热最大
C.在0~60s之间pH变化不大是因为氢氧化钠没反应完
D.70s时,溶液中含有的阳离子只含有有Na+
3.化学课上老师在滤纸上用酚酞试液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图像,则X可能是( )
A.稀盐酸 B.蒸馏水 C.石灰水 D.食盐水
4.下列四个图像分别与选项中的操作相对应,其中合理的是
A. 向一定量稀盐酸中加水
B. 加热一定量高锰酸钾固体制取氧气
C. 在密闭容器中点着过量红磷
D. 某温度下向一定量接近饱和的硝酸钾溶液中加入硝酸钾
5.下列实验操作正确的是
A.读出液体体积 B.加热液体
C.测定溶液酸碱度 D.检查装置气密性
6.推理是学习化学的重要思维方法。下列推理中合理的是
A.中和反应生成盐和水,所以能生成盐和水的反应都是中和反应
B.有机物一定含有碳元素,所以含有碳元素的物质一定是有机物
C.氢氧化铝和氢氧化钠都含有氢氧根离子,故它们都能使无色酚酞试液变红色
D.化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物
7.海洋是人类宝贵的资源宝库,下列说法错误的是
A.近年来海水因二氧化碳等非金属氧化物的增加而酸化,因为这些氧化物溶于海水中会使海水 PH 值增加
B.海水制镁时,加入石灰乳的目的是将镁离子沉降聚集
C.用膜分离法淡化海水,其原理与过滤相似,都是选择合适的孔径将直径大小不同的粒子(或颗粒)分开
D.海水酸化严重将影响珊瑚和其他分泌碳酸钙的海洋生物生存,因为海水 H+ 的浓度增加,这些海洋生物的碳酸钙外壳会遭到破坏
8.一些物质的近似 pH 如下表,下列相关说法正确的是( )
物质 厕所清洁剂 苹果汁 纯鲜牛奶 肥皂水 炉具清洁剂
pH 2 3 6.5 10 13
A.肥皂水显酸性 B.蚊虫叮咬后可涂抹肥皂水减轻痛痒
C.纯鲜牛奶的酸性比苹果汁强 D.厕所清洁剂可以和炉具清洁剂混合使用
9.一些食物的近似pH如表:
食物 苹果 葡萄 牛奶 玉米粥
pH 2.9-3.3 3.5-4.5 6.3-6.6 7.2-8.0
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最适宜食用上述食物中的
A.葡萄 B.苹果 C.玉米粥 D.牛奶
10.蚊虫叮咬时释放出的液体中含有蚁酸(显酸性),为了减轻痒痛,可以在被叮咬处涂抹
物质名称 西红柿汁 苹果汁 牛奶 牙膏
pH范围 4~5 2~3 6~7 8~9
A.西红柿汁 B.苹果汁 C.牛奶 D.牙膏
二、判断题
11.酸和碱的溶液能与指示剂反应,则所有的酸和碱都能使指示剂变色( )
12.向石蕊溶液通入二氧化碳,溶液由红色变为紫色。( )
13.测定溶液的方法:取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测溶液滴到试纸上,把试纸显示的颜色与颜色卡比较,即可得出溶液的。( )
14.纯水的pH为0( )
15.pH能定量描述溶液酸碱性的强弱( )
三、综合应用题
16.根据化学知识回答:
Ⅰ、溶液颜色的变化蕴含许多知识。
(1)下列物质加入水中能形成有色溶液的是______。
A.碳酸钙 B.高锰酸钾 C.植物油 D.食盐
(2)进行水电解实验时,将含酚酞的稀Na2SO4溶液(呈中性且不参与反应)加入如图所示的装置中,打开电源。
①a管中收集到的气体是 ,a、b两管中收集到的气体质量比为 。
②通电后b管电极处溶液呈红色,电解结束后将容器内所有液体倒入烧杯中混合均匀,溶液又呈无色。下列说法正确的是 。
A.Na2SO4溶液使酚酞变红
B.电解过程中,b电极处中有酸性物质生成
C.待溶液混合均匀后呈无色,说明电解时a电极附近溶液呈酸性
Ⅱ、食盐的用途广泛,在工业上是制备纯碱的原料之一。1926年我国科学家侯德榜创立侯氏制碱法,大大提高了食盐的利用率,促进了世界制碱技术的发展。如图为氯化铵、氯化钠的溶解度曲线。试回答下列问题:
(3)t2℃时,NH4CI饱和溶液的溶质质量分数 NaCl的饱和溶液的溶质质量分数(填“大于”“等于”或“小于”)。
(4)将t2℃时,将30gNH4Cl固体加入到50g水中,充分溶解后,所得NH4Cl溶液的溶质质量分数 (列式,无需计算结果)。
(5)若NH4Cl中含有少量的NaCl,提纯NH4Cl可以用 法。
17.某化学兴趣小组以二氧化碳为主题开展了一系列项目化学习。
任务一:实验室制取CO2
(1)实验室常用大理石和稀盐酸制取二氧化碳,写出该反应的化学方程式 。
任务二:探究能否用排水法收集CO2
(2)利用图Ⅰ、图Ⅱ所示的两套装置分别收集CO2,再通过氧气传感器测出瓶中残留氧气含量,并由此计算出CO2含量如下表所示,请完成下列表格(精确到1%)。
收集方法 氧气含量 二氧化碳含量 结论
向上排空气法 6.6% 69% 能用排水法收集二氧化碳
排水法 4.2%
(3)图1将燃着的镁条放入二氧化碳气体中,发现镁条剧烈燃烧。你对燃烧条件有何新的认识(写出一点即可) 。
(4)如图2安装好装置,挤压胶头滴管,使少量氢氧化钠溶液进入烧瓶,打开止水夹,观察到烧杯中的氢氧化钠溶液进入烧瓶,形成喷泉,出现此现象的原因是(用化学方程式表示) 。实验结束后,取少量烧瓶内的溶液于试管中,再滴加2滴无色酚酞,观察到溶液变 色。
(5)图3装置,要形成喷泉怎么操作,写出操作过程 。
(6)查阅资料:Na2CO3+CO2+H2O=2NaHCO3,向10g8%的NaOH溶液中通入一定量CO2后,所得溶液中的溶质有0.53gNa2CO3和0.84gNaHCO3,则参加反应的CO2的质量是 g。
18.某化学兴趣小组利用图1研究稀盐酸与氢氧化钠溶液反应的过程,利用pH和温度传感器测量反应过程中相关量的变化,得图2和图3。
(1)图2中b点所示溶液中的溶质是 。(写化学式)
(2)取图2中d点所示溶液,滴加紫色石蕊试液,观察到的现象是 。
(3)图3中V的数值最接近 (填“5”、“10”或“12.5”),图3中溶液温度发生变化的原因是 。
(4)若向8g氢氧化钠溶液中加入溶质质量分数为7.3%的稀盐酸10g,恰好完全反应。试计算氢氧化钠溶液的溶质质量分数。
参考答案:
1.C
【详解】酸性溶液和中性溶液均不能使酚酞变色,只有碱性溶液才能使酚酞变成红色。故选C。
2.D
【详解】A、一开始时溶液的pH=14,呈碱性,说明该反应是将稀盐酸逐滴加入氢氧化钠溶液中,正确;
B、氢氧化钠和稀盐酸反应是放热反应,随着反应的进行,温度越来越高,当氢氧化钠和稀盐酸恰好完全反应时,温度达到最大值,正确;
C、在0~60 s,氢氧化钠没有反应完,所以pH变化不大,正确;
D、70 s时,溶液呈酸性,稀盐酸过量,溶液中含有的阳离子有Na+、H+,错误。
故选D。
3.C
【详解】酚酞遇碱性溶液会变红色,而遇中性物质和酸性物质都不变色。
A、稀盐酸呈酸性,所以不能使酚酞变红,故A错误;
B、蒸馏水呈中性,不能使酚酞变红,故B错误;
C、石灰水呈碱性,可以使酚酞变红,故C正确;
D、食盐水呈中性,不能使酚酞变红,故D错误。故选C。
4.B
【详解】A、向一定量的稀盐酸中加水,溶液的酸性减弱,pH增大,但不会等于7,更不会大于7,选项错误;
B、高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,固体质量减少,反应停止,固体质量不变,选项正确;
C、红磷燃烧放热,容器内压强增大,反应停止,恢复至室温后,压强减小,应反应消耗氧气,最终压强小于初始压强,选项错误;
D、某温度下向一定量接近饱和的硝酸钾溶液中加入硝酸钾,初始溶液质量不为零,部分硝酸钾溶解至溶液饱和,溶液质量先增大后不变,选项错误。
故选B。
5.D
【详解】A、用量筒量取液体体积读数时,视线要与凹液面最低处相平,故错误;
B、用试管加热液体时,试管中的液体不能超过试管容积的三分之一,故错误;
C、用pH试纸测定溶液的酸碱性时,不能将pH试纸直接插入待测液体中,故错误;
D、检查装置的气密性的方法是将玻璃导管放入水中,用手握住试管,如导管口处有气泡冒出,则气密性良好,故正确。故选D。
6.D
【详解】A、中和反应生成盐和水,能生成盐和水的反应不一定是中和反应,如碳酸氢盐与酸反应,故选项不合理;
B、有机物一定含有碳元素,含有碳元素的物质不一定是有机物,如二氧化碳,一氧化碳,故选项不合理;
C、碱性溶液能使无色酚酞变色,氢氧化铝不溶于水,不能使无色酚酞试液变红,故选项不合理;
D、化合物是由不同种元素组成的纯净物,只含一种元素的物质一定不是化合物,故选项合理。
故选D
7.A
【详解】A、海水中二氧化碳等非金属氧化物的增加,可使海水中酸性增强,从而使海水酸化,pH减小,故说法错误;
B、海水制镁时,加入石灰乳的目的是将镁离子生成氢氧化镁沉淀,使其沉降聚集,故说法正确;
C、膜法淡化海水是对膜中的海水施以压力,使海水中的溶剂渗透到膜外,而溶质却被膜阻挡在海水中,与过滤的原理相似,都是选择合适的孔径将直径大小不同的粒子(或颗粒)分开,故说法正确;
D、酸化的海水中氢离子和碳酸钙可发生反应,可使海洋生物中碳酸钙外壳溶解,故说法正确。
故选A。
8.B
【详解】A. 由表可知肥皂水的pH值为10,大于7,显碱性,故选项说法错误。
B、蚊虫叮咬后会释放蚁酸,蚁酸对皮肤的刺激产生痛痒的感觉,可以采用碱性物质肥皂水来中和减轻痛痒,故选项说法正确。
C、pH值越小,酸性越强,纯鲜牛奶的pH值比苹果汁pH值大,因此纯鲜牛奶的酸性比苹果汁弱,故选项说法错误。
D、厕所清洁剂pH值为2,炉具清洁剂pH值为13,混合后会相互反应,使得清洁剂失效,不能混合,故选项说法错误。
故选:B。
【点睛】解答本题类似题目,要掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论。
9.C
【详解】人的胃液中含有盐酸,胃酸过多,应食用碱性物质,酸碱中和,减轻病症,葡萄、苹果、牛奶的pH均小于7,均显酸性,玉米粥pH>7,显碱性。
故选C。
10.D
【分析】蚊虫叮咬时释放出的液体中含有蚁酸(显酸性),酸和碱反应生成盐和水,则需要涂抹显碱性的物质。
【详解】A、西红柿汁的pH为4~5,显酸性,不和蚁酸反应,不能涂抹,不正确;
B、苹果汁的pH为2~3,显酸性,不和蚁酸反应,不能涂抹,不正确;
C、牛奶的pH为6~7,显弱酸性,不和蚁酸反应,不能涂抹,不正确;
D、牙膏的pH为8~9,显碱性,和蚁酸反应,能涂抹,正确;
故选D。
11.错误/错/×
【详解】酸和碱的溶液能与指示剂反应,但是不是所有的酸和碱都能使指示剂变色,如酸不能使无色酚酞试液变色,故错误。
12.错误
【详解】向紫色石蕊溶液通入二氧化碳,二氧化碳与水反应生成碳酸,碳酸显酸性,溶液由紫色变为红色,故填:错误。
13.×
【详解】应把试纸显示的颜色与标准比色卡比较,即可得出溶液的。
此说法错误
14.错误
【详解】纯水为中性,pH为7,故错误。
15.正确
【详解】酸碱度是溶液酸碱性的强弱程度,pH的范围是0~14;当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性,且pH越小,酸性越强;当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,所以pH能定量描述溶液酸碱性的强弱,故原题说法正确。
16.(1)B
(2) H2/氢气 1:8 C
(3)大于
(4)
(5)降温结晶(或冷却热的饱和溶液)
【详解】(1)A、碳酸钙不溶于水,不能形成溶液,故A选项错误;
B、高锰酸钾溶于水,能形成紫红色溶液,故B选项正确;
C、植物油不溶于水,不能形成溶液,故C选项错误;
D、食盐溶于水,能形成溶液,但为无色,故D选项错误。
故选B。
(2)①水的电解实验中正极产生氧气,负极产生氢气,产生氢气和氧气的体积比为2:1,由图分析可知:a管中收集到的是氢气,b管中收集到的是氧气;a、b两管中收集到的氢分子与氧分子的个数比为2:1,则a、b两管中收集到的气体质量比为,故填:氢气(或H2);1:8;
②A、Na2SO4溶液呈中性,不能使酚酞变红,说法错误;
B、电解过程中,b管电极处溶液呈红色,说明b电极处中有碱性物质生成,说法错误;
C、b管电极处溶液呈红色,说明电解时b电极附近溶液呈碱性,待溶液混合均匀后呈无色,则说明电解时a电极附近溶液呈酸性,说法正确。
故选C。
(3)t2℃时,NH4Cl的溶解度大于NaCl,根据饱和溶液的溶质质量分数,可知t2℃时,NH4Cl饱和溶液的溶质质量分数大于NaCl的饱和溶液的溶质质量分数,故填:大于;
(4)t2℃时,NH4Cl的溶解度是50g,表示100g水中最多溶解50gNH4Cl,将30gNH4Cl固体加入到50g水中,充分溶解后,得到NH4Cl的饱和溶液,则溶质质量分数为,故填:;
(5)若NH4Cl中含有少量的NaCl,NH4Cl的溶解度受温度影响较大,要提纯NH4Cl可以用降温结晶或冷却热饱和溶液的方法,故填:降温结晶(或冷却热饱和溶液)。
17.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)80%/79%
(3)燃烧不一定需要氧气
(4) 2NaOH+CO2=Na2CO3+H2O 红
(5)打开止水夹,并用热毛巾捂住烧瓶外部
(6)0.66
解:因为二氧化碳与氢氧化钠溶液反应生成碳酸钠、水,继续通入二氧化碳,二氧化碳、水、碳酸钠发生反应生成碳酸氢钠,10g 8%的NaOH溶液中溶质的质量为:10g×8%=0.8g,设与10g 8%NaOH溶液反应的二氧化碳的质量为y。
,y=0.44g
设反应生成0.84gNaHCO3消耗二氧化碳的质量为x。
,x=0.22g
故参加反应的CO2的质量为:0.44g+0.22g=0.66g
【详解】(1)实验室常用大理石或石灰石和稀盐酸制取二氧化碳,该反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)假设气体的总体积是100mL,氧气含量为4.2%,所以氧气的体积是4.2 mL,则空气的体积是:=20 mL,(空气中氧气的体积分数按21%计算)或=21 mL(空气中氧气的体积分数按20%计算),则二氧化碳的体积分数是80%或79%,故填:80%或79%。
(3)将燃着的镁条放入二氧化碳气体中,发现镁条剧烈燃烧,说明燃烧发生时不一定需要氧气;
(4)如图2安装好装置,挤压胶头滴管,使少量氢氧化钠溶液进入烧瓶,打开止水夹,观察到烧杯中的氢氧化钠溶液进入烧瓶,形成喷泉,出现此现象的原因是二氧化碳与氢氧化钠溶液发生反应,烧瓶内气体减少,压强变小,所以溶液进入烧瓶内,形成喷泉,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。反应后生成的碳酸钠溶液显碱性,能使酚酞试液变红,所以实验结束后,取少量烧瓶内的溶液于试管中,再滴加2滴无色酚酞,观察到溶液变红色。
(5)图3装置,要形成喷泉的操作是:打开止水夹,并用热毛巾捂住烧瓶外部,会使烧瓶内的气体受热膨胀而排出,取下毛巾后,气温降低,烧瓶内气压减少,从而形成喷泉。
(6)见答案。
18. 、 紫色石蕊试液变红(或溶液变红) 10 e→f,温度逐渐上升,其原因是氢氧化钠与稀盐酸发生中和反应放出热量(答案合理即可);f→g,温度逐渐下降,其原因 是溶液的 然冷却, 是加入冷的稀盐酸起到冷却作用(答案合理即可) 10%
解:设的质量为x
x=0.8g
氢氧化钠溶液溶质的质量分数
答:氢氧化钠溶液溶质的质量分数为10%。
【分析】(1)根据b点pH>7,溶液中含有,已经加入少量盐酸,盐酸与氢氧化钠反应生成水和氯化钠,因此溶液中一定有氯化钠进行解答;
(2)根据紫色石蕊试液遇酸变红、遇碱变蓝,d点pH<7,呈酸性,因此溶液变为红色;
(3)根据酸碱中和反应放热,完全反应时放热最多,溶液温度最高,pH应为中性进行分析解答,认真分析图3中pH和温度传感器测量反应过程中相关量的变化进行解答;
(4)根据盐酸中溶质的质量去求出氢氧化钠的质量,再根据溶质的质量分数的计算公式进行解答。
【详解】(1)b点pH>7,溶液中含有,已经加入少量盐酸,盐酸与氢氧化钠反应生成水和氯化钠,化学方程式为:,因此溶液中一定有氯化钠,故溶质中、,故填:、;
(2)紫色石蕊试液遇酸变红、遇碱变蓝,d点pH<7,呈酸性,因此溶液变为红色,故填:紫色石蕊试液变红(或溶液变红);
(3)酸碱中和反应放热,完全反应时放热最多,溶液温度最高,pH应为中性,V的数值最接近10;e→f,温度逐渐上升,其原因是氢氧化钠与稀盐酸发生中和反应放出热量(答案合理即可);f→g,温度逐渐下降,其原因 是溶液的 然冷却, 是加入冷的稀盐酸起到冷却作用(答案合理即可);
(4)见答案。
