9.2.1反应的合理选择(课件)(共30张PPT)高一化学(苏教版2019必修第二册)
文档属性
| 名称 | 9.2.1反应的合理选择(课件)(共30张PPT)高一化学(苏教版2019必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-27 01:50:35 | ||
图片预览








文档简介
(共30张PPT)
第二节 探究铁及其化合物的转化
课时1 反应的合理选择
专题九 金属与人类文明
授课人:
学习目标
1.掌握Fe单质的性质。
2.能依据Fe3+、Fe2+的性质提出相互转化的思路和检验方法。
3.能从多个方面对可能的物质制备反应路线进行选择。
4.能从多个方面对可能的转化路径进行优选。
如何鉴别FeCl3 和FeCl2 溶液?
物理法:
FeCl3 溶液:黄色至红棕色
FeCl2 溶液:浅绿色
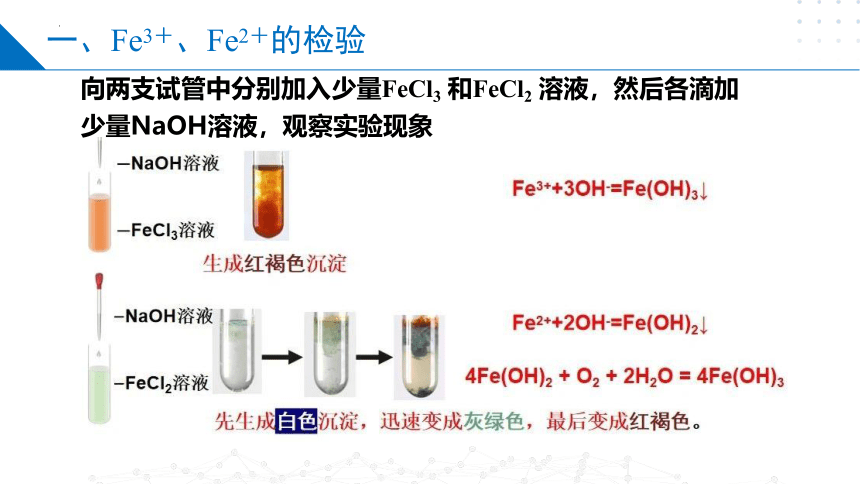
一、Fe3+、Fe2+的检验
向两支试管中分别加入少量FeCl3 和FeCl2 溶液,然后各滴加少量NaOH溶液,观察实验现象
一、Fe3+、Fe2+的检验
无明显现象
2滴NaOH溶液
稀FeCl2溶液
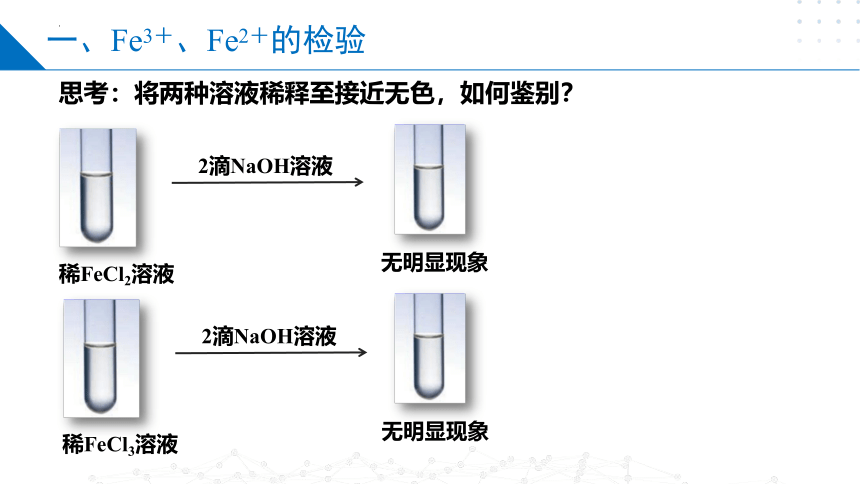
思考:将两种溶液稀释至接近无色,如何鉴别?
一、Fe3+、Fe2+的检验
2滴NaOH溶液
稀FeCl3溶液
无明显现象
一、Fe3+、Fe2+的检验
2滴KSCN溶液
稀FeCl3溶液
血红色溶液
这种方法所需试剂少,灵敏度高。因此,通常用KSCN溶液检验Fe3+ 。
Fe3++3SCN-==Fe(SCN)3
黄色
血红色
硫氰化铁,一种配合物,可溶于水
一、Fe3+、Fe2+的检验
无明显现象
滴加2滴
KSCN溶液
Fe2+与KSCN溶液不反应
FeCl2溶液
滴加几滴氯水
溶液呈红色
上述方法可用于检验溶液中Fe2+的存在,但要注意试剂的滴加顺序。
思考2:酸浸滤液中Fe2+是否完全转化成Fe3+了呢?
事实是:需要在大量Fe3+存在的情况下检验Fe2+的存在
Fe2+ 的检验
一、Fe3+、Fe2+的检验
滴加2滴
K3[Fe(CN)6]溶液
蓝色沉淀
拓展视野:铁氰化钾,即六氰合铁酸钾,化学式为K3[Fe(CN)6]。遇亚铁盐则生成蓝色沉淀。因此,常用铁氰化钾溶液检验亚铁离子。
证明有Fe2+
2mLFeCl3溶液+1滴 FeCl2溶液
Fe2+ 的检验
Fe3+与K3[Fe(CN)6]溶液不反应
典例解析
例1.鉴定某一FeCl2溶液是否被氧化,最好采用( )A.加入NaOH溶液B.加入KSCN溶液C.先通入氯气,再加入KSCN溶液D.先加足量铁粉,再加入KSCN溶液
B
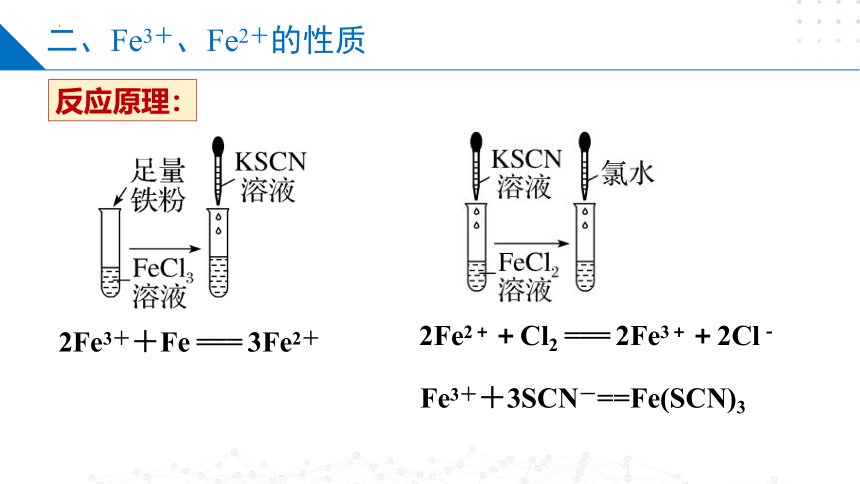
二、Fe3+、Fe2+的性质
二、Fe3+、Fe2+的性质
反应原理:
2Fe3++Fe === 3Fe2+
2Fe2++Cl2 === 2Fe3++2Cl-
Fe3++3SCN-==Fe(SCN)3
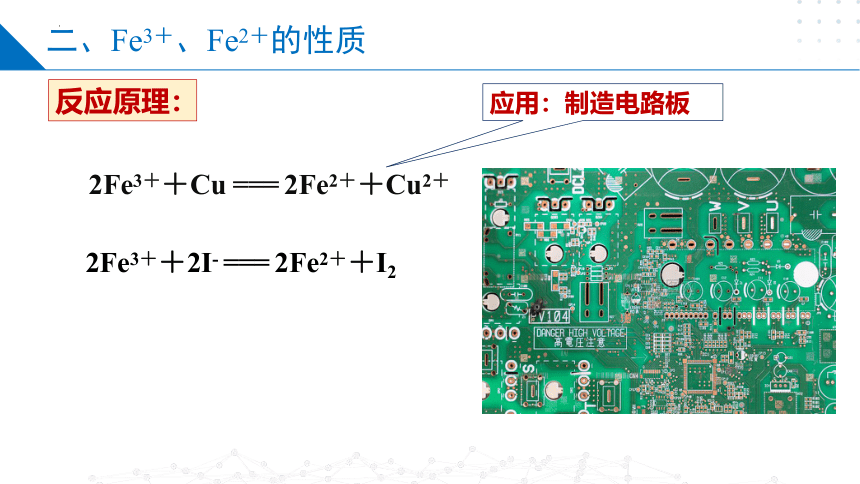
二、Fe3+、Fe2+的性质
反应原理:
应用:制造电路板
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
二、Fe3+、Fe2+的性质
反应原理:
应用:制造电路板
2Fe3++Cu === 2Fe2++Cu2+
蚀刻液
——氯化铁溶液
2Fe3++2I- === 2Fe2++I2
二、Fe3+、Fe2+的性质
具有氧化性
既有氧化性
又有还原性
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
强氧化剂:Cl2、Br2、HNO3、HClO等
双氧水:2Fe2++H2O2+2H+===2Fe3++2H2O
新制氯水或氯气:2Fe2++Cl2 === 2Fe3++2Cl-
氧化剂还可以是:O2、 HNO3等
KMnO4(H+)是否可以?
二、Fe3+、Fe2+的性质
Fe2+和Cl-均具有还原性,且还原性:Fe2+大于Cl-,
酸性KMnO4溶液会优先氧化Fe2+;
但浓度较大的Cl-也能使酸性KMnO4溶液褪色。
思考:能否用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2?
二、Fe3+、Fe2+的性质
还原剂:Cu、Fe、S2-、I-、SO2等
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
“铁三角”的转化关系
二、Fe3+、Fe2+的性质
典例解析
例2.把铁和铜加入氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余则( )
A.剩下的固体是Fe和Cu
B.溶液中有Fe3+、Fe2+
C.剩下的固体是Fe,无Cu
D.溶液中有Fe2+、Cu2+
A
三氯化铁
FeCl3 是一种很重要的铁盐,也是极其重要的化工原料,在工业上有着十分广泛的用途。
三、FeCl3的制备
主要用于铜、铝、不锈钢等金属材料的蚀刻;
在污水处理方面,FeCl3 对污水进行净化处理具有较好的效果;
在建筑工业方面, FeCl3用于制备混凝土,以增强混凝土的强度、抗腐蚀性及防水性等性能;
在无机工业方面, FeCl3用作制造其他铁盐和墨水;
在新能源开发方面, FeCl3 可以作为锂离子电池正极材料—磷酸铁锂的铁源;
在有机工业方面, FeCl3用作催化剂、氧化剂和氯化剂等。
三氯化铁的用途
资料卡
三、FeCl3的制备
三、反应的合理选择
反应的类型
反应条件
反应的装置
产物分离的要求
反应原料
目标产物
可能的反应路径
请设计以铁屑为原料制取氯化铁的转化思路
物质转化的思路
三、反应的合理选择
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)3
Fe(OH)2
FeCl2
Fe2 (SO4) 3
FeCl 3
化合价升高,发生氧化还原反应
化合价不变,发生非氧化还原反应
价类二维图
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
三、反应的合理选择
以铁屑为原料制取FeCl 3的可能反应途径
Fe
FeO
Fe2O3
Fe(OH)3
Fe(OH)2
FeCl3
FeCl2
1.Fe→FeCl3
3.Fe→Fe2O3→ FeCl3
2.Fe→ FeCl2→FeCl3
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
三、反应的合理选择
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
三、反应的合理选择
物质制备反应路线的选择
实际制备物质时,必须根据反应原料、反应条件、反应步骤、产物要求、反应装置、环境保护、生产成本等因素进行综合判断,选择合适、可控的反应路径。
反应的合理选择
三、反应的合理选择
例3.如图为铁元素的价—类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( )
A.铁与高温水蒸气的反应可实现上述转化①
B.灼烧Fe(OH)3发生转化⑥,加水溶解可实现转化③
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
D.由图可预测:高铁酸盐( )具有强氧化性,可用于消毒, 与水反应最终可生成
Fe(OH)3 胶体,从而吸附水中的悬浮物,故高铁酸盐可用作净水剂
D
课堂小结
Fe3+、Fe2+的检验
反应的合理选择
不良反应
Fe3+检验
Fe2+检验
价类二维图
制备FeCl3途径选择
Fe3+、Fe2+的性质
Fe3+性质
Fe2+性质
随堂练习
1.电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制作印刷电路板。下列说法正确的是( )
A.该反应为置换反应
B.用KSCN溶液可检验废液中的Fe2+
C.可用置换法回收废液中的铜
D.Fe3+能溶解Cu说明Cu的金属性比Fe强
C
随堂练习
2.向FeCl2溶液中滴加少量溴水,溶液变为黄色。下列说法不正确的是( )
A.由于所得溶液中存在Br2,所以溶液变为黄色
B.向所得溶液中加入硫氰化钾溶液,可判断是否生成了Fe3+
C.向所得溶液中加入氢氧化钾溶液,能判断是否生成了Fe3+
D.向所得溶液中加入淀粉-KI溶液,能判断是否生成了Fe3+
A
谢谢观看
THANKS
第二节 探究铁及其化合物的转化
课时1 反应的合理选择
专题九 金属与人类文明
授课人:
学习目标
1.掌握Fe单质的性质。
2.能依据Fe3+、Fe2+的性质提出相互转化的思路和检验方法。
3.能从多个方面对可能的物质制备反应路线进行选择。
4.能从多个方面对可能的转化路径进行优选。
如何鉴别FeCl3 和FeCl2 溶液?
物理法:
FeCl3 溶液:黄色至红棕色
FeCl2 溶液:浅绿色
一、Fe3+、Fe2+的检验
向两支试管中分别加入少量FeCl3 和FeCl2 溶液,然后各滴加少量NaOH溶液,观察实验现象
一、Fe3+、Fe2+的检验
无明显现象
2滴NaOH溶液
稀FeCl2溶液
思考:将两种溶液稀释至接近无色,如何鉴别?
一、Fe3+、Fe2+的检验
2滴NaOH溶液
稀FeCl3溶液
无明显现象
一、Fe3+、Fe2+的检验
2滴KSCN溶液
稀FeCl3溶液
血红色溶液
这种方法所需试剂少,灵敏度高。因此,通常用KSCN溶液检验Fe3+ 。
Fe3++3SCN-==Fe(SCN)3
黄色
血红色
硫氰化铁,一种配合物,可溶于水
一、Fe3+、Fe2+的检验
无明显现象
滴加2滴
KSCN溶液
Fe2+与KSCN溶液不反应
FeCl2溶液
滴加几滴氯水
溶液呈红色
上述方法可用于检验溶液中Fe2+的存在,但要注意试剂的滴加顺序。
思考2:酸浸滤液中Fe2+是否完全转化成Fe3+了呢?
事实是:需要在大量Fe3+存在的情况下检验Fe2+的存在
Fe2+ 的检验
一、Fe3+、Fe2+的检验
滴加2滴
K3[Fe(CN)6]溶液
蓝色沉淀
拓展视野:铁氰化钾,即六氰合铁酸钾,化学式为K3[Fe(CN)6]。遇亚铁盐则生成蓝色沉淀。因此,常用铁氰化钾溶液检验亚铁离子。
证明有Fe2+
2mLFeCl3溶液+1滴 FeCl2溶液
Fe2+ 的检验
Fe3+与K3[Fe(CN)6]溶液不反应
典例解析
例1.鉴定某一FeCl2溶液是否被氧化,最好采用( )A.加入NaOH溶液B.加入KSCN溶液C.先通入氯气,再加入KSCN溶液D.先加足量铁粉,再加入KSCN溶液
B
二、Fe3+、Fe2+的性质
二、Fe3+、Fe2+的性质
反应原理:
2Fe3++Fe === 3Fe2+
2Fe2++Cl2 === 2Fe3++2Cl-
Fe3++3SCN-==Fe(SCN)3
二、Fe3+、Fe2+的性质
反应原理:
应用:制造电路板
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
二、Fe3+、Fe2+的性质
反应原理:
应用:制造电路板
2Fe3++Cu === 2Fe2++Cu2+
蚀刻液
——氯化铁溶液
2Fe3++2I- === 2Fe2++I2
二、Fe3+、Fe2+的性质
具有氧化性
既有氧化性
又有还原性
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
强氧化剂:Cl2、Br2、HNO3、HClO等
双氧水:2Fe2++H2O2+2H+===2Fe3++2H2O
新制氯水或氯气:2Fe2++Cl2 === 2Fe3++2Cl-
氧化剂还可以是:O2、 HNO3等
KMnO4(H+)是否可以?
二、Fe3+、Fe2+的性质
Fe2+和Cl-均具有还原性,且还原性:Fe2+大于Cl-,
酸性KMnO4溶液会优先氧化Fe2+;
但浓度较大的Cl-也能使酸性KMnO4溶液褪色。
思考:能否用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2?
二、Fe3+、Fe2+的性质
还原剂:Cu、Fe、S2-、I-、SO2等
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
“铁三角”的转化关系
二、Fe3+、Fe2+的性质
典例解析
例2.把铁和铜加入氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余则( )
A.剩下的固体是Fe和Cu
B.溶液中有Fe3+、Fe2+
C.剩下的固体是Fe,无Cu
D.溶液中有Fe2+、Cu2+
A
三氯化铁
FeCl3 是一种很重要的铁盐,也是极其重要的化工原料,在工业上有着十分广泛的用途。
三、FeCl3的制备
主要用于铜、铝、不锈钢等金属材料的蚀刻;
在污水处理方面,FeCl3 对污水进行净化处理具有较好的效果;
在建筑工业方面, FeCl3用于制备混凝土,以增强混凝土的强度、抗腐蚀性及防水性等性能;
在无机工业方面, FeCl3用作制造其他铁盐和墨水;
在新能源开发方面, FeCl3 可以作为锂离子电池正极材料—磷酸铁锂的铁源;
在有机工业方面, FeCl3用作催化剂、氧化剂和氯化剂等。
三氯化铁的用途
资料卡
三、FeCl3的制备
三、反应的合理选择
反应的类型
反应条件
反应的装置
产物分离的要求
反应原料
目标产物
可能的反应路径
请设计以铁屑为原料制取氯化铁的转化思路
物质转化的思路
三、反应的合理选择
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)3
Fe(OH)2
FeCl2
Fe2 (SO4) 3
FeCl 3
化合价升高,发生氧化还原反应
化合价不变,发生非氧化还原反应
价类二维图
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
三、反应的合理选择
以铁屑为原料制取FeCl 3的可能反应途径
Fe
FeO
Fe2O3
Fe(OH)3
Fe(OH)2
FeCl3
FeCl2
1.Fe→FeCl3
3.Fe→Fe2O3→ FeCl3
2.Fe→ FeCl2→FeCl3
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
三、反应的合理选择
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
三、反应的合理选择
物质制备反应路线的选择
实际制备物质时,必须根据反应原料、反应条件、反应步骤、产物要求、反应装置、环境保护、生产成本等因素进行综合判断,选择合适、可控的反应路径。
反应的合理选择
三、反应的合理选择
例3.如图为铁元素的价—类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( )
A.铁与高温水蒸气的反应可实现上述转化①
B.灼烧Fe(OH)3发生转化⑥,加水溶解可实现转化③
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
D.由图可预测:高铁酸盐( )具有强氧化性,可用于消毒, 与水反应最终可生成
Fe(OH)3 胶体,从而吸附水中的悬浮物,故高铁酸盐可用作净水剂
D
课堂小结
Fe3+、Fe2+的检验
反应的合理选择
不良反应
Fe3+检验
Fe2+检验
价类二维图
制备FeCl3途径选择
Fe3+、Fe2+的性质
Fe3+性质
Fe2+性质
随堂练习
1.电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制作印刷电路板。下列说法正确的是( )
A.该反应为置换反应
B.用KSCN溶液可检验废液中的Fe2+
C.可用置换法回收废液中的铜
D.Fe3+能溶解Cu说明Cu的金属性比Fe强
C
随堂练习
2.向FeCl2溶液中滴加少量溴水,溶液变为黄色。下列说法不正确的是( )
A.由于所得溶液中存在Br2,所以溶液变为黄色
B.向所得溶液中加入硫氰化钾溶液,可判断是否生成了Fe3+
C.向所得溶液中加入氢氧化钾溶液,能判断是否生成了Fe3+
D.向所得溶液中加入淀粉-KI溶液,能判断是否生成了Fe3+
A
谢谢观看
THANKS
