8.1.1 金属矿物 海水资源的开发利用 课件(共31张PPT) 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 8.1.1 金属矿物 海水资源的开发利用 课件(共31张PPT) 高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 48.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-27 01:53:28 | ||
图片预览









文档简介
(共31张PPT)
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
1.了解金属在自然界中的存在形式,理解金属冶炼的一般原理,掌握
活泼性不同的金属冶炼的一般方法。
2.了解海水的主要组成元素,了解海水资源及开发利用的主要方式,
掌握从海水中提取NaCl、Br、Mg的化学反应原理及实验方法。
核心素养发展目标
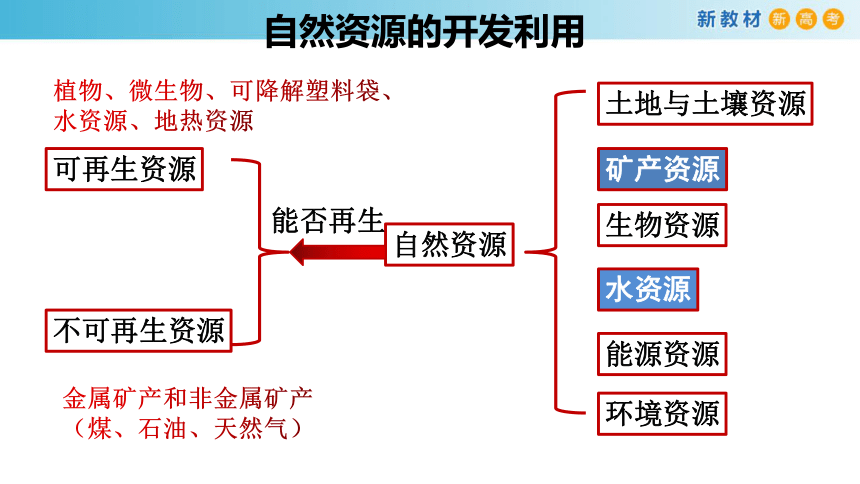
自然资源的开发利用
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
可再生资源
不可再生资源
自然资源
能否再生
植物、微生物、可降解塑料袋、水资源、地热资源
金属矿产和非金属矿产
(煤、石油、天然气)
我国古代炼铁工业长期领先于世界,我们在西汉初时已经懂得用木炭与铁矿石混合高温冶炼生铁,领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。
金属矿物是如何开发利用的呢?
1.金属元素在自然界中的存在形态
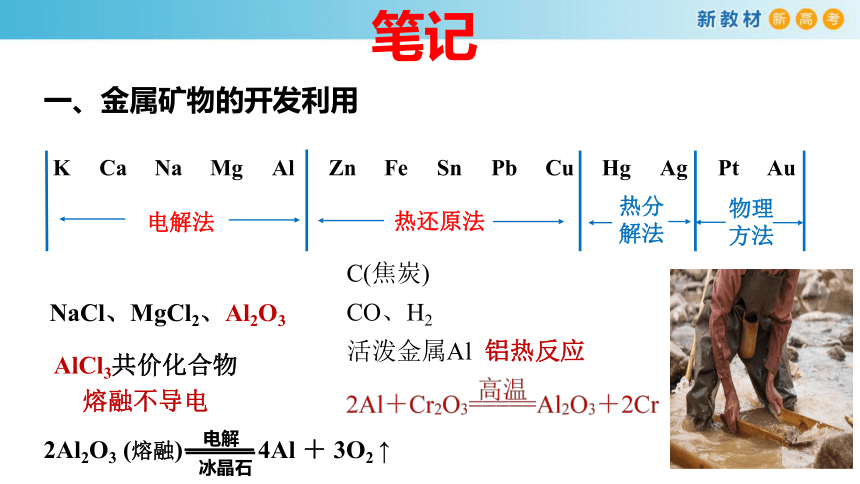
一、金属矿物的开发利用
2.金属冶炼的一般原理
利用氧化还原反应:Mn++ne-===M
游离态
金、铂
化合态
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
分析为什么呢
约200年前
约3000年前
约5000年前
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力
减弱
增强
得电子能力
K+ Ca + Na+ Mg + Al + Zn + Fe + Sn + Pb + (H+) Cu + Hg + Ag+
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
Sn
Fe
Zn
Al
Mg
Pb
Cu
Hg
Ag
Pt
Au
Ca
Na
K
电解法
热还原法
热分
解法
物理
方法
一、金属矿物的开发利用
笔记
C(焦炭)
CO、H2
活泼金属Al 铝热反应
NaCl、MgCl2、Al2O3
AlCl3共价化合物
熔融不导电
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
撒
插
点
铝热反应的应用
① 冶炼高熔点金属,如铬、锰、钨、钒等
② 金属焊接,如焊接钢轨
3MnO2 + 4Al ==== 3Mn + 2Al2O3
高温
Cr2O3 + 2Al ==== 2Cr + Al2O3
高温
其他方法 湿法炼铜 Fe+CuSO4===FeSO4+Cu
火法炼铜
视野拓展
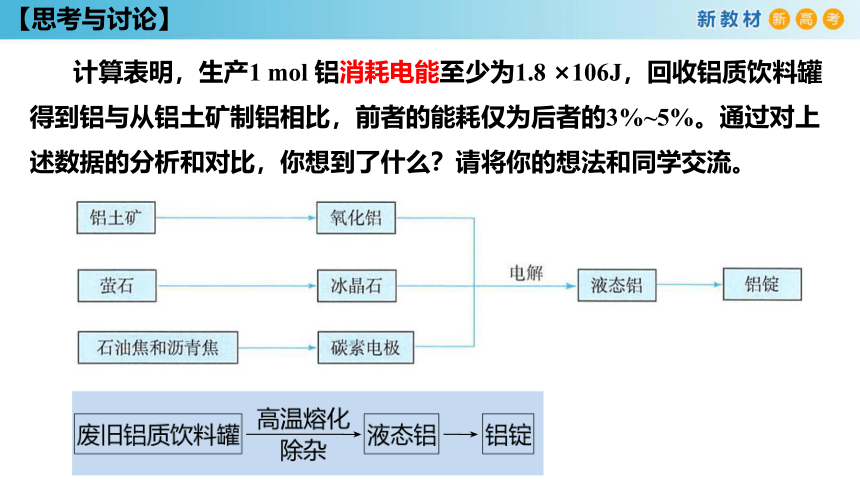
【思考与讨论】
计算表明,生产1 mol 铝消耗电能至少为1.8 ×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和对比,你想到了什么?请将你的想法和同学交流。
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性。
用铝土矿生产铝,能耗高,资源消耗量大;
在生产过程中会产生大量的废气、废液及废渣。
【思考与讨论】
途径
提高金属矿物的利用率
减少金属的使用量
加强金属资源的回收和再利用
使用其他材料代替金属材料
二、合理利用金属资源
海水中含有O、H、Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F多种常量元素,总储量很大,但许多元素的富集程度却很低。
如何对海水进行开发利用呢?
海水淡化
方法:蒸馏法、反渗透法、电渗析法。
循环冷却
二、海水中水资源的开发利用
笔记
海水循环冷却核电站
海水蒸馏:历史悠久,成本较高。
①主要仪器:A_______,B_________,C_______。
②冷却水的流向:下进上出
③B中加入碎瓷片的目的是_____________。
冷凝管
蒸馏烧瓶
锥形瓶
防止液体暴沸
三、海水中化学资源的利用
1、海水制盐 物理变化
盐田
海水
饱和食盐水
引入
日晒风吹
析出粗盐
食用盐
氯碱工业
精制
1、海水制盐
①氯碱工业:电解饱和食盐水,可生产NaOH、H2和Cl2。
化学反应方程式:____________________________________。
②制钠和氯气:__________________________。
③制盐酸: 。
④制漂白剂(84消毒液):_________________________________。
⑤制纯碱:NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3
笔记
二、海水中化学资源的利用
2、海水提溴(吹出法)
易挥发
氧化、吸收环节离子方程式:
______________________、___________________________________。
2Br-+Cl2===Br2+2Cl-
笔记
富集
×2
【思考与讨论1】海水提溴的原理是什么?请结合教材中的流程图用一句话简述。
以海水中的含溴物质为原料,通过化学和物理方法分离提纯,得到溴单质。
【思考与讨论2】该流程中是Br-如何转化成Br2?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
【思考与讨论3】为何选择氧化剂氯气来氧化Br-?
①氯气的氧化性大于溴②氯气的成本③生成物对环境无污染
【思考与讨论4】工业上常用的一种海水提溴技术叫做“吹出法”。根据资料思考:用热空气吹出的物质是什么?利用该物质的什么性质呢?
溴,有挥发性
药品 价格(万元/吨)
Cl2 0.155
KMnO4 3.4
H2O2 1.4
【思考与讨论5】请绘制出运用“吹出法”从海水中制备溴的工业流程图?
海水
富集
(浓缩)
氧化室
Cl2
吹出塔
空气
吸收塔
SO2
蒸馏塔
Cl2
冷凝器
工业原料
富集
物质转化、分离提纯
Br2
目标产品
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
制石灰乳:_________________________________________________
沉淀Mg2+:________________________________________________
酸化,制备MgCl2:Mg(OH)2+2HCl===MgCl2+2H2O
蒸发浓缩、冷却结晶、析出MgCl2·6H2O(在HCl气流中制得无水MgCl2)
电解法制备镁:_____________________________氧化还原反应
Mg2++2OH-===Mg(OH)2↓
3、海水提镁 (沉淀法+石灰乳)
(成本低)
四、海水资源的其他利用
1.从海水中提取铀和重水,用于核能开发。
2.开发潮汐能、波浪能等新型能源。
小结
反渗透法
③离子交换法
离子交换树脂可以把阴阳离子分别交换出来,使水得到纯化。
HR + Na+ = NaR + H+
ROH + Cl— = RCl +OH—
H++OH- =H2O
3、海带提碘 固体灼烧:三脚架、泥三角、坩埚
2H++2I-+H2O2===I2+2H2O
笔记
滴入H2O2的离子方程式为 。
I2
蒸馏←分液←萃取
萃取→分液→蒸馏
萃取是一种分离操作,物理变化;不能用裂化汽油、乙醇萃取Br2。
仪器:分液漏斗 上走上、下走下
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
1.了解金属在自然界中的存在形式,理解金属冶炼的一般原理,掌握
活泼性不同的金属冶炼的一般方法。
2.了解海水的主要组成元素,了解海水资源及开发利用的主要方式,
掌握从海水中提取NaCl、Br、Mg的化学反应原理及实验方法。
核心素养发展目标
自然资源的开发利用
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
可再生资源
不可再生资源
自然资源
能否再生
植物、微生物、可降解塑料袋、水资源、地热资源
金属矿产和非金属矿产
(煤、石油、天然气)
我国古代炼铁工业长期领先于世界,我们在西汉初时已经懂得用木炭与铁矿石混合高温冶炼生铁,领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。
金属矿物是如何开发利用的呢?
1.金属元素在自然界中的存在形态
一、金属矿物的开发利用
2.金属冶炼的一般原理
利用氧化还原反应:Mn++ne-===M
游离态
金、铂
化合态
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
分析为什么呢
约200年前
约3000年前
约5000年前
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力
减弱
增强
得电子能力
K+ Ca + Na+ Mg + Al + Zn + Fe + Sn + Pb + (H+) Cu + Hg + Ag+
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
Sn
Fe
Zn
Al
Mg
Pb
Cu
Hg
Ag
Pt
Au
Ca
Na
K
电解法
热还原法
热分
解法
物理
方法
一、金属矿物的开发利用
笔记
C(焦炭)
CO、H2
活泼金属Al 铝热反应
NaCl、MgCl2、Al2O3
AlCl3共价化合物
熔融不导电
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
撒
插
点
铝热反应的应用
① 冶炼高熔点金属,如铬、锰、钨、钒等
② 金属焊接,如焊接钢轨
3MnO2 + 4Al ==== 3Mn + 2Al2O3
高温
Cr2O3 + 2Al ==== 2Cr + Al2O3
高温
其他方法 湿法炼铜 Fe+CuSO4===FeSO4+Cu
火法炼铜
视野拓展
【思考与讨论】
计算表明,生产1 mol 铝消耗电能至少为1.8 ×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和对比,你想到了什么?请将你的想法和同学交流。
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性。
用铝土矿生产铝,能耗高,资源消耗量大;
在生产过程中会产生大量的废气、废液及废渣。
【思考与讨论】
途径
提高金属矿物的利用率
减少金属的使用量
加强金属资源的回收和再利用
使用其他材料代替金属材料
二、合理利用金属资源
海水中含有O、H、Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F多种常量元素,总储量很大,但许多元素的富集程度却很低。
如何对海水进行开发利用呢?
海水淡化
方法:蒸馏法、反渗透法、电渗析法。
循环冷却
二、海水中水资源的开发利用
笔记
海水循环冷却核电站
海水蒸馏:历史悠久,成本较高。
①主要仪器:A_______,B_________,C_______。
②冷却水的流向:下进上出
③B中加入碎瓷片的目的是_____________。
冷凝管
蒸馏烧瓶
锥形瓶
防止液体暴沸
三、海水中化学资源的利用
1、海水制盐 物理变化
盐田
海水
饱和食盐水
引入
日晒风吹
析出粗盐
食用盐
氯碱工业
精制
1、海水制盐
①氯碱工业:电解饱和食盐水,可生产NaOH、H2和Cl2。
化学反应方程式:____________________________________。
②制钠和氯气:__________________________。
③制盐酸: 。
④制漂白剂(84消毒液):_________________________________。
⑤制纯碱:NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3
笔记
二、海水中化学资源的利用
2、海水提溴(吹出法)
易挥发
氧化、吸收环节离子方程式:
______________________、___________________________________。
2Br-+Cl2===Br2+2Cl-
笔记
富集
×2
【思考与讨论1】海水提溴的原理是什么?请结合教材中的流程图用一句话简述。
以海水中的含溴物质为原料,通过化学和物理方法分离提纯,得到溴单质。
【思考与讨论2】该流程中是Br-如何转化成Br2?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
【思考与讨论3】为何选择氧化剂氯气来氧化Br-?
①氯气的氧化性大于溴②氯气的成本③生成物对环境无污染
【思考与讨论4】工业上常用的一种海水提溴技术叫做“吹出法”。根据资料思考:用热空气吹出的物质是什么?利用该物质的什么性质呢?
溴,有挥发性
药品 价格(万元/吨)
Cl2 0.155
KMnO4 3.4
H2O2 1.4
【思考与讨论5】请绘制出运用“吹出法”从海水中制备溴的工业流程图?
海水
富集
(浓缩)
氧化室
Cl2
吹出塔
空气
吸收塔
SO2
蒸馏塔
Cl2
冷凝器
工业原料
富集
物质转化、分离提纯
Br2
目标产品
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
制石灰乳:_________________________________________________
沉淀Mg2+:________________________________________________
酸化,制备MgCl2:Mg(OH)2+2HCl===MgCl2+2H2O
蒸发浓缩、冷却结晶、析出MgCl2·6H2O(在HCl气流中制得无水MgCl2)
电解法制备镁:_____________________________氧化还原反应
Mg2++2OH-===Mg(OH)2↓
3、海水提镁 (沉淀法+石灰乳)
(成本低)
四、海水资源的其他利用
1.从海水中提取铀和重水,用于核能开发。
2.开发潮汐能、波浪能等新型能源。
小结
反渗透法
③离子交换法
离子交换树脂可以把阴阳离子分别交换出来,使水得到纯化。
HR + Na+ = NaR + H+
ROH + Cl— = RCl +OH—
H++OH- =H2O
3、海带提碘 固体灼烧:三脚架、泥三角、坩埚
2H++2I-+H2O2===I2+2H2O
笔记
滴入H2O2的离子方程式为 。
I2
蒸馏←分液←萃取
萃取→分液→蒸馏
萃取是一种分离操作,物理变化;不能用裂化汽油、乙醇萃取Br2。
仪器:分液漏斗 上走上、下走下
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
