2.3.2化学反应的限度(共19张PPT) 化学鲁科版(2019)必修第二册
文档属性
| 名称 | 2.3.2化学反应的限度(共19张PPT) 化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 35.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-27 11:31:35 | ||
图片预览






文档简介
(共19张PPT)
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第2课时
化学反应的限度
· 化学反应的限度
导入——认识化学反应存在限度
现有反应2FeCl3+2KI=2FeCl2+I2,若向烧杯中加入FeCl3与KI的比值为1:2(即KI完全过量) ,FeCl3能否被完全反应?
检验Fe3+
反应物和生成物同时存在
反应物不可能完全转化成生成物
可逆
反应
· 化学反应的限度
学习目标
变化观念与平衡思想
了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡状态
通过探究认识化学平衡与反应限度,知道条件改变时化学平衡会发生移动,初步了解外界条件能够影响化学平衡状态
科学态度与社会责任
了解控制反应条件在生产生活中的应用,加深化学理论知识和生产生活的联系
例1:反应2H2+O2====H2O和2H2O====2H2↑+O2↑,这两个反应不是可逆反应,因为反应条件不同
点燃
通电
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
1.可逆反应
(1)定义:在相同条件下,同时向正、逆两个方向进行的反应
(2)表示方法:书写可逆反应的化学方程式时用 代替 =
(3)特征:反应物和生成物同时存在,反应物不可能完全转化成生成物
例2:N2+3H2 2NH3这个反应,在容器中充入1molN2和3molH2,最终不能完全生成2molNH3
在容器中充入2molNH3,最终也不能完全生成1molN2和3molH2
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
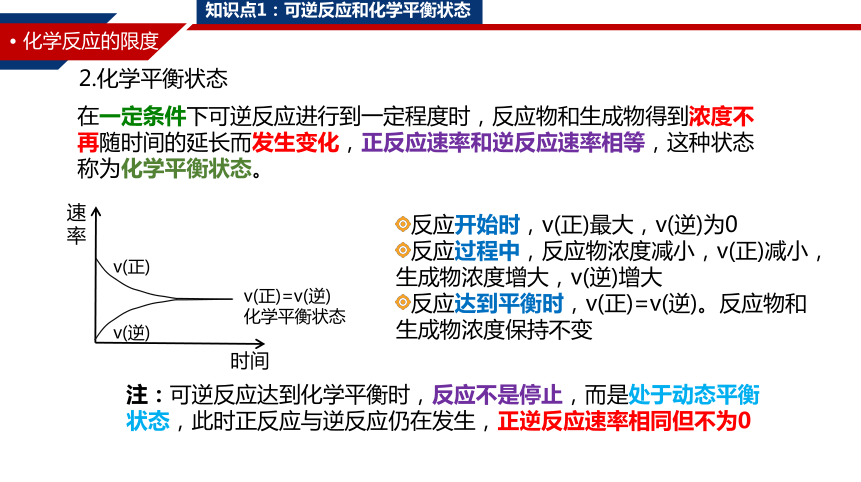
在一定条件下可逆反应进行到一定程度时,反应物和生成物得到浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等,这种状态称为化学平衡状态。
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
反应开始时,v(正)最大,v(逆)为0
反应过程中,反应物浓度减小,v(正)减小,生成物浓度增大,v(逆)增大
反应达到平衡时,v(正)=v(逆)。反应物和生成物浓度保持不变
2.化学平衡状态
注:可逆反应达到化学平衡时,反应不是停止,而是处于动态平衡状态,此时正反应与逆反应仍在发生,正逆反应速率相同但不为0
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
2.化学平衡状态
好比是一个水池,有进水口和出水口,开始往里面灌水时,设定进水速度快,出水速度慢,然后进水速度越来越慢,出水速度越老越快,最后进水速度与出水速度相同,水池里的水位不再变化,但是里面的水实际上是有进有出的,只是表面上看不出来,处于动态平衡状态
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
在一定条件下可逆反应进行到一定程度时,反应物和生成物得到浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等,这种状态称为化学平衡状态。
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
能证明可逆反应存在的实验:同位素实验
对于可逆反应2SO2+O2 2SO3,若向容器中加入2molSO2和1mol 18O2,经过足够长时间后,SO2、O2、SO3全部存在,且18O原子存在于SO2、O2、SO3中
证明相同条件下,该反应能向正、反两个方向进行且无法反应完全
催化剂
14CO2、14C、14CO
对于可逆反应14CO2 + C 2CO来说,反应达到平衡状态后,达到最大限度后,混合物中含14C的粒子有哪些?
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
2.化学平衡状态
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
化学平衡状态的特征
化学平衡研究的对象是可逆反应
逆
等
达到化学平衡状态时,正反应速率与逆反应速率相等
动
化学平衡是一种表面静止状态,反应并未停止,是一种动态平衡
定
达到化学平衡状态后,各组分浓度保持不变,不随时间变化而变化
变
外界条件发生改变时,原平衡状态将被打破,新条件下将建立新的平衡状态
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
判断:
(1)当一个可逆反应到达平衡状态时,正、逆反应速率相等且等于零
(2)平衡状态时,各物质的浓度保持相等
(3)化学平衡状态不可以通过改变条件而改变
(4)化学反应达到其限度后,反应就停止了
(5)如果参与可逆反应的气体有颜色,反应到达平衡状态时,体系的颜色不再变化
(6)可逆反应达到平衡的重要特征是正、逆反应的速率相等
练一练
×
√
√
×
×
×
不等于0
浓度不变,不是相等
可以改变,改变温度、压强等都可以改变平衡
动态平衡不是停止
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
对于可逆反应A+B C+D,正反应吸热,逆反应放热,达到化学平衡状态后,体系温度不再改变,若升高温度,正、逆反应速率如何变化?化学平衡应如何移动?
思考1:温度对平衡状态的影响
解析
升高温度,正、逆反应速率都增大,但是增大程度不同
升高温度后,体系内的反应物有恢复原来状态的倾向,于是吸热反应速率增加程度更多,放热反应速率加快但加快程度不高,最终导致化学平衡向右(正反应方向)移动
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
升温
v(逆)
v(正)
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
实验探究
2NO2 (g) N2O4(g)
红棕色
无色
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
正反应放热
逆反应吸热
预测:当放入热水中时,温度升高,正逆反应速率都增大,但容器内物质趋向于恢复原来状态即温度低时的状态,于是吸热的逆反应的速率增加的更多,使化学平衡向左移动,容器中颜色变深
放入冷水中,温度降低,正反应速率均降低,但容器内物质趋向于恢复原来状态即温度高时的状态,于是放热的正反应的速率减小的更少,吸热的逆反应的速率减少的更多,使化学平衡向右移动颜色变浅
速率
时间
v(正)
v(逆)
升温
v(正)
v(逆)
降温
v(逆)
v(正)
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
2NO2 (g) N2O4(g)
红棕色
无色
正反应放热
逆反应吸热
实验探究
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
升高温度,化学平衡向吸热反应的方向移动
降低温度,化学平衡向放热反应的方向移动
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
对于可逆反应来说,改变外界条件后,体系内物质有恢复原来状态的倾向,比如升温后平衡状态会倾向于吸热的方向移动,降温后平衡状态会倾向于放热的方向反应移动
那增大压强或者减小压强,可逆反应的平衡状态会如何移动?
思考2:压强对平衡状态的影响
若参与反应的物质均不是气体,则改变压强不会对反应的平衡状态造成影响
设可逆反应:aA+bB cC+dD,a、b、c、d为系数,A、B、C、D均为气体
若a+b=c+d,反应前后气体体积不变,增大或减小压强,对可逆反应的平衡状态无影响
若a+b≠c+d,反应前后气体体积变化,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向进行
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
可逆反应:aA+bB cC+dD,a、b、c、d为系数,A、B、C、D均为气体
若a+b≠c+d,反应前后气体体积变化,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向进行
例1:2NO2 N2O4,反应前后气体系数不同,若增大压强,则平衡向气体体积小的方向移动,即向正反应方向进行;若减小压强,则平衡向气体体积大的方向移动,即向逆反应方向进行
例2:2A+4B 3C+5D,反应前后气体系数不同,若增大压强,则平衡向气体体积小的方向移动,即向逆反应方向进行;若减小压强,则平衡向气体体积大的方向移动,即向正反应方向进行
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
对于可逆反应来说,改变外界条件后,体系内物质有恢复原来状态的倾向
若某可逆反应参与反应的物质均是气体,若往反应容器内充入某气体反应物(使其浓度增加),可逆反应的平衡状态会如何移动?充入气体生成物呢?
思考3:浓度对平衡状态的影响
某气体反应物浓度增加后,平衡移动方向为消耗该物质的方向,即向正反应方向移动;某气体生成物浓度增加后后,平衡移动方向为消耗该物质的方向,即向逆反应方向移动
例:对于可逆反应N2+3H2 2NH3来说,若向反应容器中充入N2使其浓度增加,则平衡向正反应方向即消耗N2的方向移动,若向容器中充入NH3,则平衡向逆反应方向即消耗NH3的方向移动
解析
注:是气体或离子的浓度
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
结论
化学平衡是在一定条件下建立起来的,当条件改变时,原平衡状态会被破坏,并在新的条件下建立起新的平衡状态(平衡移动方向倾向于保持原状态、以“抵消”改变)
原平衡
(v正=v逆)
条件改变
一定时间后
平衡破坏
(v正′≠v逆′)
新平衡
(v正"=v逆")
化学平衡的移动
浓度、温度、压强等因素均会影响化学平衡状态
· 化学反应的限度
知识点1
知识点2
总结
1.可逆反应
化学反应存在限度
可逆反应为在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
2.化学平衡状态
正反应速率和逆反应速率相等,v(正)=v(逆),反应混合物中各组分的浓度保持不变的状态
平衡状态特征:逆、等、动、定、变
3.化学平衡状态的改变
条件改变时,原平衡状态会被破坏,并在新的条件下建立起新的平衡状态(平衡移动方向倾向于保持原状态、以“抵消”改变)
浓度、温度、压强等因素均会影响化学平衡状态
· 化学反应的限度
知识点1
知识点2
总结
在一个密闭容器中发生反应:3Fe(s)+4H2O(g) Fe3O4(s)+2H2(g)
课堂练习
s—固体 g—气体
(1)增加Fe的量,反应速率 。(增大、减小或不变)
不变
原因:Fe为固体,增加纯固体或纯液体的量,对反应速率没有影响
(2)将容器体积缩小一半,反应速率 。
加快
原因:将容器体积缩小一半,容器内气体物质浓度增加,反应速率加快
(3)若容器体积不变、正反应放热,升高容器温度,化学平衡向 移动。
左
原因:改变外界条件后,容器内物质有维持原状的倾向,于是升温后,平衡向逆反应方向移动
本课结束
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第2课时
化学反应的限度
· 化学反应的限度
导入——认识化学反应存在限度
现有反应2FeCl3+2KI=2FeCl2+I2,若向烧杯中加入FeCl3与KI的比值为1:2(即KI完全过量) ,FeCl3能否被完全反应?
检验Fe3+
反应物和生成物同时存在
反应物不可能完全转化成生成物
可逆
反应
· 化学反应的限度
学习目标
变化观念与平衡思想
了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡状态
通过探究认识化学平衡与反应限度,知道条件改变时化学平衡会发生移动,初步了解外界条件能够影响化学平衡状态
科学态度与社会责任
了解控制反应条件在生产生活中的应用,加深化学理论知识和生产生活的联系
例1:反应2H2+O2====H2O和2H2O====2H2↑+O2↑,这两个反应不是可逆反应,因为反应条件不同
点燃
通电
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
1.可逆反应
(1)定义:在相同条件下,同时向正、逆两个方向进行的反应
(2)表示方法:书写可逆反应的化学方程式时用 代替 =
(3)特征:反应物和生成物同时存在,反应物不可能完全转化成生成物
例2:N2+3H2 2NH3这个反应,在容器中充入1molN2和3molH2,最终不能完全生成2molNH3
在容器中充入2molNH3,最终也不能完全生成1molN2和3molH2
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
在一定条件下可逆反应进行到一定程度时,反应物和生成物得到浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等,这种状态称为化学平衡状态。
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
反应开始时,v(正)最大,v(逆)为0
反应过程中,反应物浓度减小,v(正)减小,生成物浓度增大,v(逆)增大
反应达到平衡时,v(正)=v(逆)。反应物和生成物浓度保持不变
2.化学平衡状态
注:可逆反应达到化学平衡时,反应不是停止,而是处于动态平衡状态,此时正反应与逆反应仍在发生,正逆反应速率相同但不为0
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
2.化学平衡状态
好比是一个水池,有进水口和出水口,开始往里面灌水时,设定进水速度快,出水速度慢,然后进水速度越来越慢,出水速度越老越快,最后进水速度与出水速度相同,水池里的水位不再变化,但是里面的水实际上是有进有出的,只是表面上看不出来,处于动态平衡状态
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
在一定条件下可逆反应进行到一定程度时,反应物和生成物得到浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等,这种状态称为化学平衡状态。
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
能证明可逆反应存在的实验:同位素实验
对于可逆反应2SO2+O2 2SO3,若向容器中加入2molSO2和1mol 18O2,经过足够长时间后,SO2、O2、SO3全部存在,且18O原子存在于SO2、O2、SO3中
证明相同条件下,该反应能向正、反两个方向进行且无法反应完全
催化剂
14CO2、14C、14CO
对于可逆反应14CO2 + C 2CO来说,反应达到平衡状态后,达到最大限度后,混合物中含14C的粒子有哪些?
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
2.化学平衡状态
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
化学平衡状态的特征
化学平衡研究的对象是可逆反应
逆
等
达到化学平衡状态时,正反应速率与逆反应速率相等
动
化学平衡是一种表面静止状态,反应并未停止,是一种动态平衡
定
达到化学平衡状态后,各组分浓度保持不变,不随时间变化而变化
变
外界条件发生改变时,原平衡状态将被打破,新条件下将建立新的平衡状态
· 化学反应的限度
知识点1:可逆反应和化学平衡状态
判断:
(1)当一个可逆反应到达平衡状态时,正、逆反应速率相等且等于零
(2)平衡状态时,各物质的浓度保持相等
(3)化学平衡状态不可以通过改变条件而改变
(4)化学反应达到其限度后,反应就停止了
(5)如果参与可逆反应的气体有颜色,反应到达平衡状态时,体系的颜色不再变化
(6)可逆反应达到平衡的重要特征是正、逆反应的速率相等
练一练
×
√
√
×
×
×
不等于0
浓度不变,不是相等
可以改变,改变温度、压强等都可以改变平衡
动态平衡不是停止
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
对于可逆反应A+B C+D,正反应吸热,逆反应放热,达到化学平衡状态后,体系温度不再改变,若升高温度,正、逆反应速率如何变化?化学平衡应如何移动?
思考1:温度对平衡状态的影响
解析
升高温度,正、逆反应速率都增大,但是增大程度不同
升高温度后,体系内的反应物有恢复原来状态的倾向,于是吸热反应速率增加程度更多,放热反应速率加快但加快程度不高,最终导致化学平衡向右(正反应方向)移动
速率
时间
v(正)
v(逆)
v(正)=v(逆)
化学平衡状态
升温
v(逆)
v(正)
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
实验探究
2NO2 (g) N2O4(g)
红棕色
无色
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
正反应放热
逆反应吸热
预测:当放入热水中时,温度升高,正逆反应速率都增大,但容器内物质趋向于恢复原来状态即温度低时的状态,于是吸热的逆反应的速率增加的更多,使化学平衡向左移动,容器中颜色变深
放入冷水中,温度降低,正反应速率均降低,但容器内物质趋向于恢复原来状态即温度高时的状态,于是放热的正反应的速率减小的更少,吸热的逆反应的速率减少的更多,使化学平衡向右移动颜色变浅
速率
时间
v(正)
v(逆)
升温
v(正)
v(逆)
降温
v(逆)
v(正)
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
2NO2 (g) N2O4(g)
红棕色
无色
正反应放热
逆反应吸热
实验探究
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
升高温度,化学平衡向吸热反应的方向移动
降低温度,化学平衡向放热反应的方向移动
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
对于可逆反应来说,改变外界条件后,体系内物质有恢复原来状态的倾向,比如升温后平衡状态会倾向于吸热的方向移动,降温后平衡状态会倾向于放热的方向反应移动
那增大压强或者减小压强,可逆反应的平衡状态会如何移动?
思考2:压强对平衡状态的影响
若参与反应的物质均不是气体,则改变压强不会对反应的平衡状态造成影响
设可逆反应:aA+bB cC+dD,a、b、c、d为系数,A、B、C、D均为气体
若a+b=c+d,反应前后气体体积不变,增大或减小压强,对可逆反应的平衡状态无影响
若a+b≠c+d,反应前后气体体积变化,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向进行
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
可逆反应:aA+bB cC+dD,a、b、c、d为系数,A、B、C、D均为气体
若a+b≠c+d,反应前后气体体积变化,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向进行
例1:2NO2 N2O4,反应前后气体系数不同,若增大压强,则平衡向气体体积小的方向移动,即向正反应方向进行;若减小压强,则平衡向气体体积大的方向移动,即向逆反应方向进行
例2:2A+4B 3C+5D,反应前后气体系数不同,若增大压强,则平衡向气体体积小的方向移动,即向逆反应方向进行;若减小压强,则平衡向气体体积大的方向移动,即向正反应方向进行
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
对于可逆反应来说,改变外界条件后,体系内物质有恢复原来状态的倾向
若某可逆反应参与反应的物质均是气体,若往反应容器内充入某气体反应物(使其浓度增加),可逆反应的平衡状态会如何移动?充入气体生成物呢?
思考3:浓度对平衡状态的影响
某气体反应物浓度增加后,平衡移动方向为消耗该物质的方向,即向正反应方向移动;某气体生成物浓度增加后后,平衡移动方向为消耗该物质的方向,即向逆反应方向移动
例:对于可逆反应N2+3H2 2NH3来说,若向反应容器中充入N2使其浓度增加,则平衡向正反应方向即消耗N2的方向移动,若向容器中充入NH3,则平衡向逆反应方向即消耗NH3的方向移动
解析
注:是气体或离子的浓度
· 化学反应的限度
知识点1
知识点2:化学平衡状态的改变
结论
化学平衡是在一定条件下建立起来的,当条件改变时,原平衡状态会被破坏,并在新的条件下建立起新的平衡状态(平衡移动方向倾向于保持原状态、以“抵消”改变)
原平衡
(v正=v逆)
条件改变
一定时间后
平衡破坏
(v正′≠v逆′)
新平衡
(v正"=v逆")
化学平衡的移动
浓度、温度、压强等因素均会影响化学平衡状态
· 化学反应的限度
知识点1
知识点2
总结
1.可逆反应
化学反应存在限度
可逆反应为在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
2.化学平衡状态
正反应速率和逆反应速率相等,v(正)=v(逆),反应混合物中各组分的浓度保持不变的状态
平衡状态特征:逆、等、动、定、变
3.化学平衡状态的改变
条件改变时,原平衡状态会被破坏,并在新的条件下建立起新的平衡状态(平衡移动方向倾向于保持原状态、以“抵消”改变)
浓度、温度、压强等因素均会影响化学平衡状态
· 化学反应的限度
知识点1
知识点2
总结
在一个密闭容器中发生反应:3Fe(s)+4H2O(g) Fe3O4(s)+2H2(g)
课堂练习
s—固体 g—气体
(1)增加Fe的量,反应速率 。(增大、减小或不变)
不变
原因:Fe为固体,增加纯固体或纯液体的量,对反应速率没有影响
(2)将容器体积缩小一半,反应速率 。
加快
原因:将容器体积缩小一半,容器内气体物质浓度增加,反应速率加快
(3)若容器体积不变、正反应放热,升高容器温度,化学平衡向 移动。
左
原因:改变外界条件后,容器内物质有维持原状的倾向,于是升温后,平衡向逆反应方向移动
本课结束
