化学人教版(2019)必修第二册6.1.2化学反应与电能(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.2化学反应与电能(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 39.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-27 21:39:16 | ||
图片预览







文档简介
(共26张PPT)
第一课时 化学反应与电能
第六章 化学反应与能量
第一节 化学反应与能量变化
素养要求
1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
3.了解原电池工作原理的应用。
你知道我们日常使用的电能,是如何得来的吗?
我们日常使用的电能主要来自火力发电。
情境引入
1
原电池构成条件及工作原理
任务一 火力发电过程中的能量转化
1. 能源的分类
直接从自然界取得的能源
(1)一次能源
例如: 流水、风力、原煤、原(石)油、天然气、天然铀矿、核能等
2、二次能源
一次能源经加工、转换得到的能源称为二次能源。
例如:电能、蒸汽等
注:使用电器都需要电能,电能是现代社会应用最广泛,使用最方便,污染最小的一种二次能源又称电力
任务一 火力发电过程中的能量转化
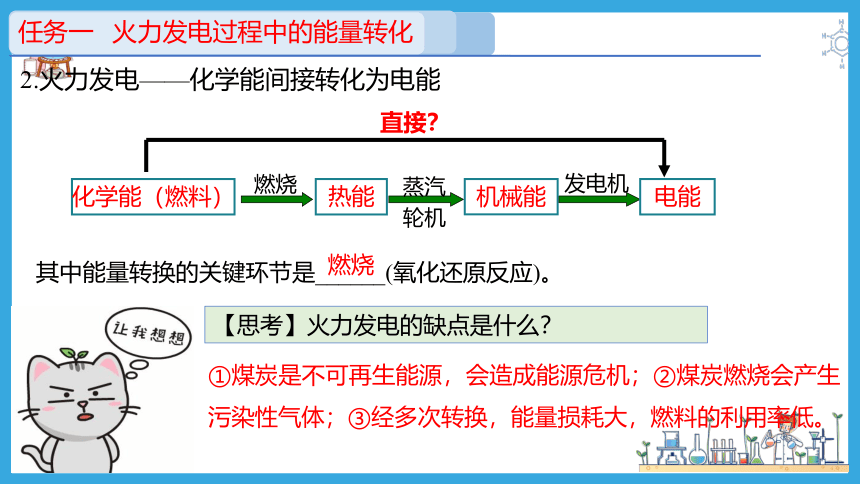
2.火力发电——化学能间接转化为电能
化学能(燃料)
燃烧
热能
蒸汽
轮机
机械能
发电机
电能
直接?
其中能量转换的关键环节是______(氧化还原反应)。
燃烧
【思考】火力发电的缺点是什么?
①煤炭是不可再生能源,会造成能源危机;②煤炭燃烧会产生污染性气体;③经多次转换,能量损耗大,燃料的利用率低。
任务一 火力发电过程中的能量转化
1799年意大利物理学家伏特发明了世界上第一个发电器,也就是电池组,伏特电堆开创了电学发展的新时代。
19世纪,英国化学家尼克尔森和卡莱尔利用伏特电池成功的电解了水,证明了水是由氢和氧两种元素组成的化合物。
英国化学家戴维,利用串联起来的伏特电池组,通过电解法发现了几种活泼的金属元素。比如金属钠和金属钾。
实验探究
实验6-3
任务二 探究原电池的形成过程
(1)将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3)如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
任务二 探究原电池的形成过程
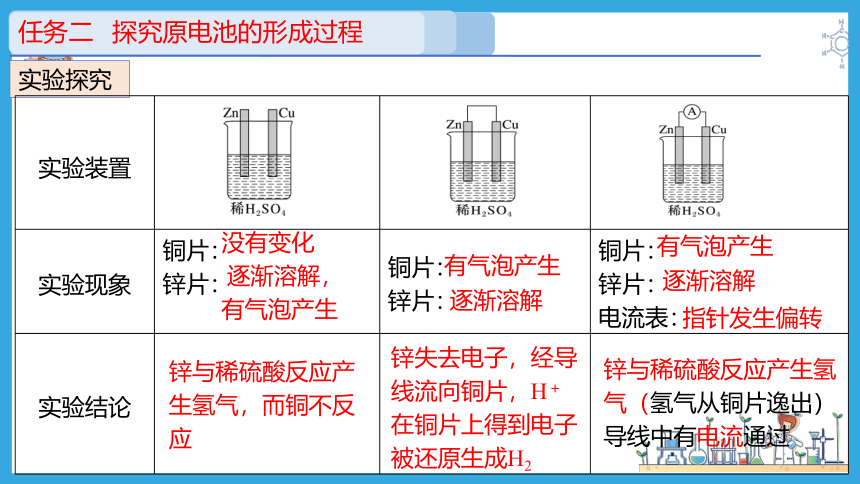
实验探究
实验装置
实验现象 铜片: 锌片: 铜片: 锌片: 铜片:
锌片:
电流表:
实验结论
没有变化
逐渐溶解,
有气泡产生
有气泡产生
逐渐溶解
有气泡产生
逐渐溶解
指针发生偏转
锌与稀硫酸反应产生氢气,而铜不反应
锌失去电子,经导线流向铜片,H+在铜片上得到电子被还原生成H2
锌与稀硫酸反应产生氢气(氢气从铜片逸出)导线中有电流通过
将 能直接转化为 能的装置。
任务二 探究原电池的形成过程
3、原电池
化学
电
电极:
负极:电子流出的一极,发生氧化反应;
正极:电子流入的一极,发生还原反应。
(1)概念:
(2)原电池的构成条件
装置条件
活动性不同的两个电极
形成闭合回路
电极插入电解质溶液
自发的氧化还原
发生 反应
本质
反应条件
【探究】结合上述实验和动画演示,分析说明该原电池的电极和导线、电解质溶液中的导电微粒分别是什么,并说明其移动方向。
电极(锌片、铜片)和导线中的导电微粒是电子,从负极流出,经导线流向正极;电解质溶液中的导电微粒是阳离子H+、阴离子 SO42-,阳离子向正极移动,阴离子向负极移动。
3、原电池工作原理
H+
Zn2+
H+
Zn2+
e-
e-
e-
e-
Cu
Zn
H+
H+
H2
H2
H+
H+
e-
任务二 探究原电池的形成过程
任务二 探究原电池的形成过程
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-= Zn2+
2H++2e-= H2↑
氧化反应
还原反应
负极
正极
阳离子
阴离子
发生溶解
产生气泡
原电池总反应:Zn+2H+ = Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路
内电路
阴离子 负极
阳离子 正极
外电路
内电路
e-
I
【总结】
知识辨析
正误判断
(1)火力发电过程中,机械能转化为电能是整个能量转化的关键( )
(2)原电池的电极材料必须是金属( )
(3)原电池工作时,正极与负极转移电子数相同( )
(4)在锌铜原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液流回锌( )
(5)原电池中阳离子向正极移动( )
×
×
√
×
√
总结归纳
电极名称的判断方法
2
原电池工作原理的应用
任务三 原电池工作原理的应用
【问题1】用Zn和稀盐酸反应制氢气时,加快该反应的方法有哪些?
锌和置换出的铜、稀盐酸构成了原电池,可以加快反应速率
思考与讨论
【问题2】为了使反应加快,常常加入少量CuSO4溶液,请问这是为什么?
2.比较金属的活动性
一般,若两种金属A、B与电解质溶液构成原电池,若金属A作负极,则金属活动性: 。
任务三 原电池工作原理的应用
1.加快氧化还原反应的进行
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应加快。
B作正极
A作负极
稀H2SO4
A>B
任务三 原电池工作原理的应用
3.设计原电池
(1)给定氧化还原反应设计原电池
一般给定氧化还原反应的还原剂作负极,氧化剂作电解质溶液,比负极活动性弱的金属或石墨等能导电的非金属作正极。
电极总反应:Cu+2AgNO3= Cu(NO3)2+2Ag
还原剂:
氧化剂:
正极材料:
正极反应方程式:
负极反应方程式:
Cu(作负极材料)
AgNO3
Cu-2e- === Cu2+
2Ag++2e- === 2Ag
石墨等金属性小于铜的固体
任务三 原电池工作原理的应用
(2)简易电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电动机等),电流表。
【实验】
(1)水果电池
(2)简易电池
水果电池
简易电池
任务三 原电池工作原理的应用
动手设计水果电池
动动手
小组小结
间接:
直接:
化学能
燃烧
热 能
蒸汽
机械能
发动机
电能
装置
原电池
化学能
与
电能
原电池
将化学能转化为电能的装置
定义
构成条件
活动性不同的两个电极
形成闭合回路
电极插入电解质溶液
电池
反应
电子
电流
氧化还原反应
由负极流向正极
由正极流向负极
离子
负负正正
当 堂 练 习
3
任务四 限时训练
选项 A B C D
M 石墨 Zn Fe Al
N Ag Ag Cu Al
P 稀硫酸 蔗糖溶液 FeCl3溶液 NaOH溶液
1.(2023·辽宁抚顺高一校联考期中)下列各组材料组成如图装置,电流表指针能发生偏转的是( )
C
任务四 限时训练
2.(2023·安徽芜湖一中高一质检)a、b、c、d四种金属片浸入稀硫酸中,用导线两两组成原电池。若a、b相连时,电流由a经导线流向b;c、d相连时,d极质量减少;a、c相连时,c极上产生大量气泡;a、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为( )
A.b>a>d>c B.b>d>a>c
C.b>a>c>d D.b>d>a>c
A
任务四 限时训练
3.(2023·广东肇庆高一质检)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,部分实验结果记录如下:
根据表中记录的实验现象,推断下
列说法不正确的是( )
A.实验2、3中Al均作电池的负极,
提供电子
B.实验2中H+在Cu极上发生还原
反应,电流表的指针偏向Cu
C.实验3中的Al电极反应式为Al-3e-+4OH-===[Al(OH)4]-
D.通过实验3可说明金属性:Mg>Al
D
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
任务四 限时训练
4.(2023·深圳高一校联考期中)海水电池为探索深海提供了能源保障。一种锂—海水电池以金属锂为负极,石墨为正极,下列关于该电池的描述正确的是( )
A.正极上发生氧化反应
B.电流由Li流向石墨
C.Li+由正极向负极迁移
D.电池的总反应为2Li+2H2O===2LiOH+H2↑
D
第一课时 化学反应与电能
第六章 化学反应与能量
第一节 化学反应与能量变化
素养要求
1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
3.了解原电池工作原理的应用。
你知道我们日常使用的电能,是如何得来的吗?
我们日常使用的电能主要来自火力发电。
情境引入
1
原电池构成条件及工作原理
任务一 火力发电过程中的能量转化
1. 能源的分类
直接从自然界取得的能源
(1)一次能源
例如: 流水、风力、原煤、原(石)油、天然气、天然铀矿、核能等
2、二次能源
一次能源经加工、转换得到的能源称为二次能源。
例如:电能、蒸汽等
注:使用电器都需要电能,电能是现代社会应用最广泛,使用最方便,污染最小的一种二次能源又称电力
任务一 火力发电过程中的能量转化
2.火力发电——化学能间接转化为电能
化学能(燃料)
燃烧
热能
蒸汽
轮机
机械能
发电机
电能
直接?
其中能量转换的关键环节是______(氧化还原反应)。
燃烧
【思考】火力发电的缺点是什么?
①煤炭是不可再生能源,会造成能源危机;②煤炭燃烧会产生污染性气体;③经多次转换,能量损耗大,燃料的利用率低。
任务一 火力发电过程中的能量转化
1799年意大利物理学家伏特发明了世界上第一个发电器,也就是电池组,伏特电堆开创了电学发展的新时代。
19世纪,英国化学家尼克尔森和卡莱尔利用伏特电池成功的电解了水,证明了水是由氢和氧两种元素组成的化合物。
英国化学家戴维,利用串联起来的伏特电池组,通过电解法发现了几种活泼的金属元素。比如金属钠和金属钾。
实验探究
实验6-3
任务二 探究原电池的形成过程
(1)将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3)如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
任务二 探究原电池的形成过程
实验探究
实验装置
实验现象 铜片: 锌片: 铜片: 锌片: 铜片:
锌片:
电流表:
实验结论
没有变化
逐渐溶解,
有气泡产生
有气泡产生
逐渐溶解
有气泡产生
逐渐溶解
指针发生偏转
锌与稀硫酸反应产生氢气,而铜不反应
锌失去电子,经导线流向铜片,H+在铜片上得到电子被还原生成H2
锌与稀硫酸反应产生氢气(氢气从铜片逸出)导线中有电流通过
将 能直接转化为 能的装置。
任务二 探究原电池的形成过程
3、原电池
化学
电
电极:
负极:电子流出的一极,发生氧化反应;
正极:电子流入的一极,发生还原反应。
(1)概念:
(2)原电池的构成条件
装置条件
活动性不同的两个电极
形成闭合回路
电极插入电解质溶液
自发的氧化还原
发生 反应
本质
反应条件
【探究】结合上述实验和动画演示,分析说明该原电池的电极和导线、电解质溶液中的导电微粒分别是什么,并说明其移动方向。
电极(锌片、铜片)和导线中的导电微粒是电子,从负极流出,经导线流向正极;电解质溶液中的导电微粒是阳离子H+、阴离子 SO42-,阳离子向正极移动,阴离子向负极移动。
3、原电池工作原理
H+
Zn2+
H+
Zn2+
e-
e-
e-
e-
Cu
Zn
H+
H+
H2
H2
H+
H+
e-
任务二 探究原电池的形成过程
任务二 探究原电池的形成过程
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-= Zn2+
2H++2e-= H2↑
氧化反应
还原反应
负极
正极
阳离子
阴离子
发生溶解
产生气泡
原电池总反应:Zn+2H+ = Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路
内电路
阴离子 负极
阳离子 正极
外电路
内电路
e-
I
【总结】
知识辨析
正误判断
(1)火力发电过程中,机械能转化为电能是整个能量转化的关键( )
(2)原电池的电极材料必须是金属( )
(3)原电池工作时,正极与负极转移电子数相同( )
(4)在锌铜原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液流回锌( )
(5)原电池中阳离子向正极移动( )
×
×
√
×
√
总结归纳
电极名称的判断方法
2
原电池工作原理的应用
任务三 原电池工作原理的应用
【问题1】用Zn和稀盐酸反应制氢气时,加快该反应的方法有哪些?
锌和置换出的铜、稀盐酸构成了原电池,可以加快反应速率
思考与讨论
【问题2】为了使反应加快,常常加入少量CuSO4溶液,请问这是为什么?
2.比较金属的活动性
一般,若两种金属A、B与电解质溶液构成原电池,若金属A作负极,则金属活动性: 。
任务三 原电池工作原理的应用
1.加快氧化还原反应的进行
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应加快。
B作正极
A作负极
稀H2SO4
A>B
任务三 原电池工作原理的应用
3.设计原电池
(1)给定氧化还原反应设计原电池
一般给定氧化还原反应的还原剂作负极,氧化剂作电解质溶液,比负极活动性弱的金属或石墨等能导电的非金属作正极。
电极总反应:Cu+2AgNO3= Cu(NO3)2+2Ag
还原剂:
氧化剂:
正极材料:
正极反应方程式:
负极反应方程式:
Cu(作负极材料)
AgNO3
Cu-2e- === Cu2+
2Ag++2e- === 2Ag
石墨等金属性小于铜的固体
任务三 原电池工作原理的应用
(2)简易电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电动机等),电流表。
【实验】
(1)水果电池
(2)简易电池
水果电池
简易电池
任务三 原电池工作原理的应用
动手设计水果电池
动动手
小组小结
间接:
直接:
化学能
燃烧
热 能
蒸汽
机械能
发动机
电能
装置
原电池
化学能
与
电能
原电池
将化学能转化为电能的装置
定义
构成条件
活动性不同的两个电极
形成闭合回路
电极插入电解质溶液
电池
反应
电子
电流
氧化还原反应
由负极流向正极
由正极流向负极
离子
负负正正
当 堂 练 习
3
任务四 限时训练
选项 A B C D
M 石墨 Zn Fe Al
N Ag Ag Cu Al
P 稀硫酸 蔗糖溶液 FeCl3溶液 NaOH溶液
1.(2023·辽宁抚顺高一校联考期中)下列各组材料组成如图装置,电流表指针能发生偏转的是( )
C
任务四 限时训练
2.(2023·安徽芜湖一中高一质检)a、b、c、d四种金属片浸入稀硫酸中,用导线两两组成原电池。若a、b相连时,电流由a经导线流向b;c、d相连时,d极质量减少;a、c相连时,c极上产生大量气泡;a、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为( )
A.b>a>d>c B.b>d>a>c
C.b>a>c>d D.b>d>a>c
A
任务四 限时训练
3.(2023·广东肇庆高一质检)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,部分实验结果记录如下:
根据表中记录的实验现象,推断下
列说法不正确的是( )
A.实验2、3中Al均作电池的负极,
提供电子
B.实验2中H+在Cu极上发生还原
反应,电流表的指针偏向Cu
C.实验3中的Al电极反应式为Al-3e-+4OH-===[Al(OH)4]-
D.通过实验3可说明金属性:Mg>Al
D
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀硫酸 偏向Al
2 Cu、Al 稀硫酸 ……
3 Mg、Al NaOH溶液 偏向Mg
任务四 限时训练
4.(2023·深圳高一校联考期中)海水电池为探索深海提供了能源保障。一种锂—海水电池以金属锂为负极,石墨为正极,下列关于该电池的描述正确的是( )
A.正极上发生氧化反应
B.电流由Li流向石墨
C.Li+由正极向负极迁移
D.电池的总反应为2Li+2H2O===2LiOH+H2↑
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
