2.2 气体的等温变化习题课课件(17张PPT)
文档属性
| 名称 | 2.2 气体的等温变化习题课课件(17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 752.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2024-03-28 08:06:41 | ||
图片预览



文档简介
(共17张PPT)
选择性必修三第二章气体、固体、液体:
第2节 气体的等温变化习题课
压强的计算
玻意耳定律的应用
变质量问题的处理
一、平衡态下液体封闭气体压强的计算
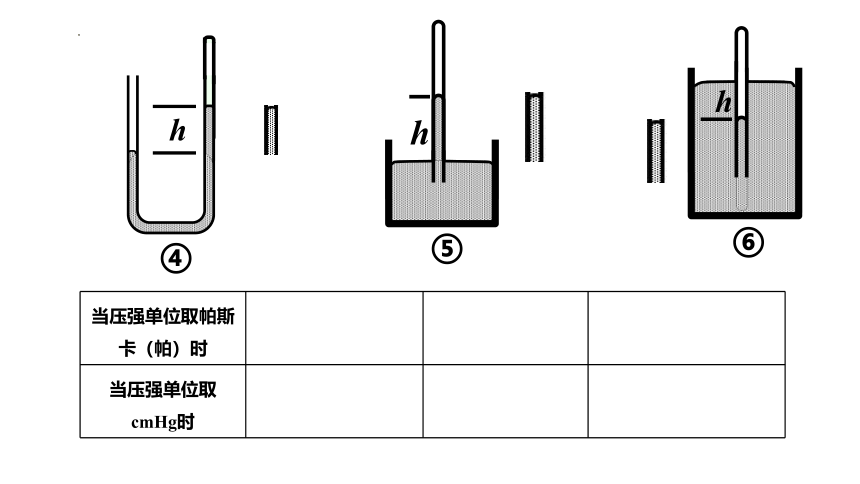
例1.下列各图装置均处于静止状态。设大气压强为p0,用水银封闭一定量的气体在玻璃管中,求封闭气体的压强p
h
①
当压强单位取帕斯卡(帕)时
当压强单位取cmHg时
③
h
p =p0
p =p0
p =p0+ρgh
p =p0-ρgh
p =p0-h
p =p0+h
h是水银柱在竖直方向的高度
h
⑥
当压强单位取帕斯卡(帕)时
当压强单位取cmHg时
④
h
h
⑤
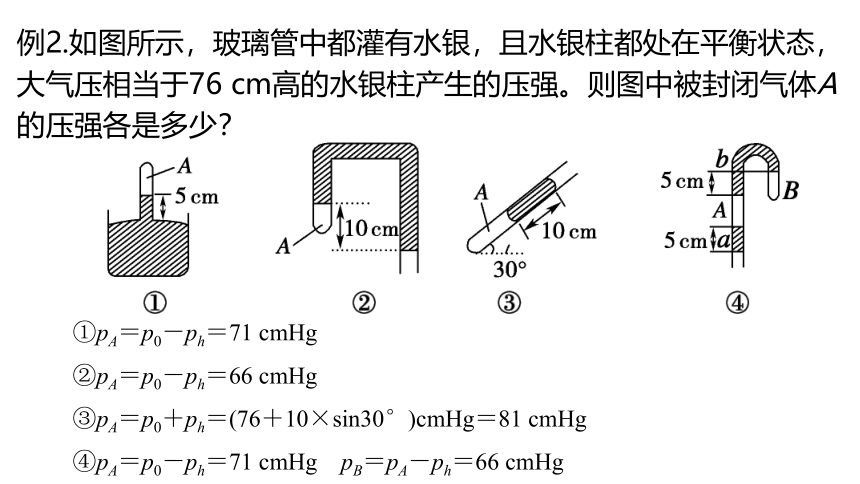
例2.如图所示,玻璃管中都灌有水银,且水银柱都处在平衡状态,大气压相当于76 cm高的水银柱产生的压强。则图中被封闭气体A的压强各是多少?
①pA=p0-ph=71 cmHg
②pA=p0-ph=66 cmHg
③pA=p0+ph=(76+10×sin30°)cmHg=81 cmHg
④pA=p0-ph=71 cmHg pB=pA-ph=66 cmHg
例1 如图所示,竖直放置的U形管,左端开口,右端封闭,管内有a、b两段水银柱,将A、B两段空气柱封闭在管内.已知水银柱a长h1为10 cm,水银柱b两个液面间的高度差h2为5 cm,大气压强为75 cmHg,求空气柱A、B的压强分别是多少?
解析 设管的截面积为S,选a的下端面为参考液面,则 (pA+ph1)S=p0S,所以pA=p0-ph1=65 cmHg,
选b的左下端面为参考液面,液柱h2的上表面处的压强等于pB则(pB+ph2)S=pAS
所以pB=pA-ph2=60 cmHg.
S
m
⑧
m
S
⑦
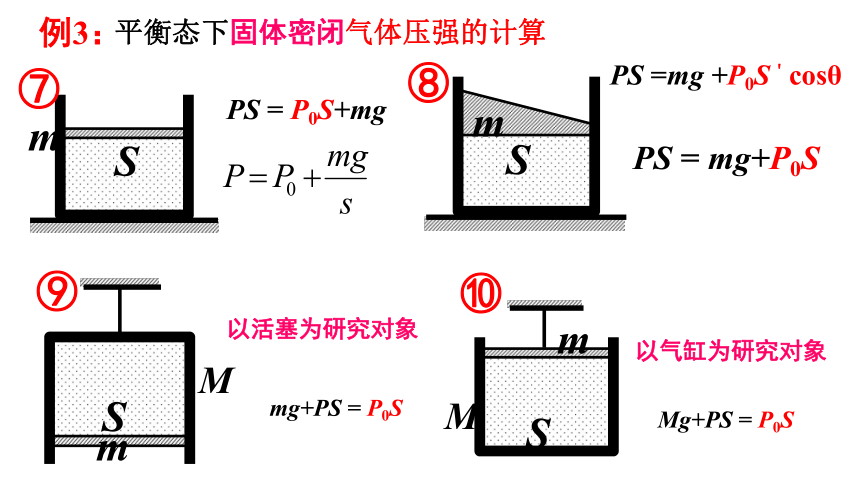
例3:
M
m
S
⑨
M
m
S
⑩
平衡态下固体密闭气体压强的计算
PS = P0S+mg
PS =mg +P0S'cosθ
PS = mg+P0S
以活塞为研究对象
mg+PS = P0S
以气缸为研究对象
Mg+PS = P0S
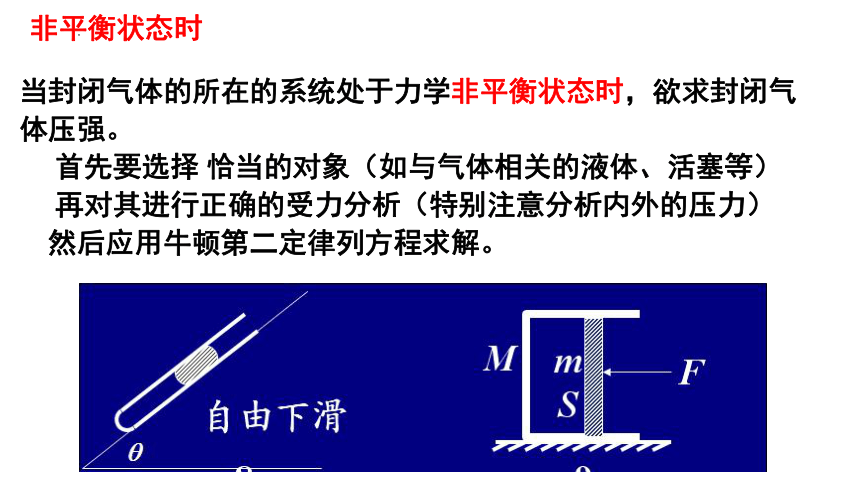
当封闭气体的所在的系统处于力学非平衡状态时,欲求封闭气体压强。
首先要选择 恰当的对象(如与气体相关的液体、活塞等)
再对其进行正确的受力分析(特别注意分析内外的压力)
然后应用牛顿第二定律列方程求解。
非平衡状态时
练3:如下图甲所示,气缸质量为m1,活塞质量为m2,不计缸内气体的质量及一切摩擦,当用一水平外力F拉活塞时,活塞和气缸最终以共同的加速度运动.求此时缸内气体的压强.(已知大气压为p0,活塞横截面积为S)
解:以气缸整体为研究对象,F=(m1+m2)a
以m2为研究对象,如图乙:F-P0S+PS=m2a
解得:P=
例3:如图所示, 长为1m,开口竖直向上的玻璃管内,封闭着长为15cm的水银柱,封闭气体的长度为20cm,已知大气压强为75cmHg,求:
(1)玻璃管水平放置时,管内气体的长度。
(2)玻璃管开口竖直向下时,管内气体的长度。(假设水银没有流出)
15cm
20cm
解:(1)以管内气体为研究对象,管口竖直向上为初态:
设管横截面积为S,则
p1=75+15=90cmHg V1=20S
水平放置为末态,p2=75cmHg
由玻意耳定律p1V1=p2V 2得:
V2=p1V1/p2=(90×20S)/75=24S
所以,管内气体长24cm
(2)以管口竖直向上为初态,管口竖直向下为末态
p2=75-15=60cmHg
由玻意耳定律得:V2= p1V1/p2=30S
所以,管内气体长30cm
因为30cm+15cm<100cm,所以水银不会流出
15cm
15cm
方法:玻意耳定律解题的基本思路
(1)明确研究对象,根据题意确定所研究的是哪部分封闭气体,注意其质量和温度应不变。
(2)明确状态参量,找准所研究气体初、末状态的p、V值。
(3)根据玻意耳定律列方程求解。
温馨提醒 利用玻意耳定律解题时,经常使用p1V1=p2V2,相同物理量的单位要求使用同一单位即可。
例4:如图所示,汽缸内封闭着一定温度的气体,气体长度为12cm。活塞质量20kg,横截面积为100cm 。已知大气压强为1×105Pa。求:汽缸开口向上时,气体的长度。
解:以缸内封闭气体为研究对象
由活塞受力平衡得:
由玻意耳定律
末态:
初态:
每充或抽一次气,容器中空气的质量都会发生变化,但如果灵活选取研究对象,可将其转变为质量不变的问题。
(1)玻意耳等温分态公式
一般地,若将某气体(p,V,M)在保持总质量、温度不变的情况下分成了若干部分(p1,V1,M1)、(p2,V2,M2)、…、(pn、Vn、Mn),则有pV=p1V1+p2V2+…+pnVn
应用等温分态公式解答温度不变情况下,气体的分与合,部分气体质量有变化、气体总质量无变化、又不直接涉及气体质量的问题时,常常十分方便。
专题:充气与抽气问题
(2)关于充气问题:如果打气时每一次打入的空气质量、体积和压强均相同,则可设想用一容积为nV0的打气筒将压强为p0的空气一次打入容器与打n次气等效代替。所以研究对象应为容器中原有的空气和n次打入的空气总和。这样充气过程可看作是气体的等温压缩过程。
(3)关于抽气问题:从容器内抽气的过程中,容器内的气体质量不断减小,这属于变质量的问题。分析时,将每次抽气过程中抽出的气体和剩余气体作为研究对象,质量不变,故抽气过程可看作是等温膨胀过程。
例5.如图为某压缩式喷雾器储液桶,其容量是5.7×10-3m3,往桶内倒入4.2×10-3 m3的药液后开始打气,假设打气过程中药液不会向外喷出.如果每次能打进2.5×10-4m3的空气,要使喷雾器内空气的压强达到4atm,应打气几次?(设标准大气压为1 atm,打气过程中不考虑温度的变化)
4.2×10-3 m3
V
5.7×10-3m3
2.5×10-4m3
2.5×10-4m3
2.5×10-4m3
2.5×10-4m3
2.5×10-4m3
………………
变质量问题
一定质量气体的等温变化
p0V + p0×N×(2.5×10-4 m3) = 4p0 V
由玻意耳定律得:
V=5.7×10-3 m3-4.2×10-3 m3=1.5×10-3 m3
N=18
◎规律总结
求解变质量问题的方法技巧
此类问题我们可认为打入喷雾器的气体都在其周围,且可以认为是一次性打入的,若初态时内外气体压强相同,则体积为内外气体体积之和,状态方程为:p1(V+nV0)=p2V。若初态时内外气体压强不同,则体积不等于内外气体体积之和,状态方程应为:p1V+np1′V0=p2V
练习:一氧气瓶的容积为0.08m3,开始时瓶中氧气的压强为20个大气压.某实验室每天消耗1个大气压的氧气0.36m3.当氧气瓶中的压强降低到2个大气压时,需重新充气.若氧气的温度保持不变,求这瓶氧气重新充气前可供该实验室使用多少天.
4
选择性必修三第二章气体、固体、液体:
第2节 气体的等温变化习题课
压强的计算
玻意耳定律的应用
变质量问题的处理
一、平衡态下液体封闭气体压强的计算
例1.下列各图装置均处于静止状态。设大气压强为p0,用水银封闭一定量的气体在玻璃管中,求封闭气体的压强p
h
①
当压强单位取帕斯卡(帕)时
当压强单位取cmHg时
③
h
p =p0
p =p0
p =p0+ρgh
p =p0-ρgh
p =p0-h
p =p0+h
h是水银柱在竖直方向的高度
h
⑥
当压强单位取帕斯卡(帕)时
当压强单位取cmHg时
④
h
h
⑤
例2.如图所示,玻璃管中都灌有水银,且水银柱都处在平衡状态,大气压相当于76 cm高的水银柱产生的压强。则图中被封闭气体A的压强各是多少?
①pA=p0-ph=71 cmHg
②pA=p0-ph=66 cmHg
③pA=p0+ph=(76+10×sin30°)cmHg=81 cmHg
④pA=p0-ph=71 cmHg pB=pA-ph=66 cmHg
例1 如图所示,竖直放置的U形管,左端开口,右端封闭,管内有a、b两段水银柱,将A、B两段空气柱封闭在管内.已知水银柱a长h1为10 cm,水银柱b两个液面间的高度差h2为5 cm,大气压强为75 cmHg,求空气柱A、B的压强分别是多少?
解析 设管的截面积为S,选a的下端面为参考液面,则 (pA+ph1)S=p0S,所以pA=p0-ph1=65 cmHg,
选b的左下端面为参考液面,液柱h2的上表面处的压强等于pB则(pB+ph2)S=pAS
所以pB=pA-ph2=60 cmHg.
S
m
⑧
m
S
⑦
例3:
M
m
S
⑨
M
m
S
⑩
平衡态下固体密闭气体压强的计算
PS = P0S+mg
PS =mg +P0S'cosθ
PS = mg+P0S
以活塞为研究对象
mg+PS = P0S
以气缸为研究对象
Mg+PS = P0S
当封闭气体的所在的系统处于力学非平衡状态时,欲求封闭气体压强。
首先要选择 恰当的对象(如与气体相关的液体、活塞等)
再对其进行正确的受力分析(特别注意分析内外的压力)
然后应用牛顿第二定律列方程求解。
非平衡状态时
练3:如下图甲所示,气缸质量为m1,活塞质量为m2,不计缸内气体的质量及一切摩擦,当用一水平外力F拉活塞时,活塞和气缸最终以共同的加速度运动.求此时缸内气体的压强.(已知大气压为p0,活塞横截面积为S)
解:以气缸整体为研究对象,F=(m1+m2)a
以m2为研究对象,如图乙:F-P0S+PS=m2a
解得:P=
例3:如图所示, 长为1m,开口竖直向上的玻璃管内,封闭着长为15cm的水银柱,封闭气体的长度为20cm,已知大气压强为75cmHg,求:
(1)玻璃管水平放置时,管内气体的长度。
(2)玻璃管开口竖直向下时,管内气体的长度。(假设水银没有流出)
15cm
20cm
解:(1)以管内气体为研究对象,管口竖直向上为初态:
设管横截面积为S,则
p1=75+15=90cmHg V1=20S
水平放置为末态,p2=75cmHg
由玻意耳定律p1V1=p2V 2得:
V2=p1V1/p2=(90×20S)/75=24S
所以,管内气体长24cm
(2)以管口竖直向上为初态,管口竖直向下为末态
p2=75-15=60cmHg
由玻意耳定律得:V2= p1V1/p2=30S
所以,管内气体长30cm
因为30cm+15cm<100cm,所以水银不会流出
15cm
15cm
方法:玻意耳定律解题的基本思路
(1)明确研究对象,根据题意确定所研究的是哪部分封闭气体,注意其质量和温度应不变。
(2)明确状态参量,找准所研究气体初、末状态的p、V值。
(3)根据玻意耳定律列方程求解。
温馨提醒 利用玻意耳定律解题时,经常使用p1V1=p2V2,相同物理量的单位要求使用同一单位即可。
例4:如图所示,汽缸内封闭着一定温度的气体,气体长度为12cm。活塞质量20kg,横截面积为100cm 。已知大气压强为1×105Pa。求:汽缸开口向上时,气体的长度。
解:以缸内封闭气体为研究对象
由活塞受力平衡得:
由玻意耳定律
末态:
初态:
每充或抽一次气,容器中空气的质量都会发生变化,但如果灵活选取研究对象,可将其转变为质量不变的问题。
(1)玻意耳等温分态公式
一般地,若将某气体(p,V,M)在保持总质量、温度不变的情况下分成了若干部分(p1,V1,M1)、(p2,V2,M2)、…、(pn、Vn、Mn),则有pV=p1V1+p2V2+…+pnVn
应用等温分态公式解答温度不变情况下,气体的分与合,部分气体质量有变化、气体总质量无变化、又不直接涉及气体质量的问题时,常常十分方便。
专题:充气与抽气问题
(2)关于充气问题:如果打气时每一次打入的空气质量、体积和压强均相同,则可设想用一容积为nV0的打气筒将压强为p0的空气一次打入容器与打n次气等效代替。所以研究对象应为容器中原有的空气和n次打入的空气总和。这样充气过程可看作是气体的等温压缩过程。
(3)关于抽气问题:从容器内抽气的过程中,容器内的气体质量不断减小,这属于变质量的问题。分析时,将每次抽气过程中抽出的气体和剩余气体作为研究对象,质量不变,故抽气过程可看作是等温膨胀过程。
例5.如图为某压缩式喷雾器储液桶,其容量是5.7×10-3m3,往桶内倒入4.2×10-3 m3的药液后开始打气,假设打气过程中药液不会向外喷出.如果每次能打进2.5×10-4m3的空气,要使喷雾器内空气的压强达到4atm,应打气几次?(设标准大气压为1 atm,打气过程中不考虑温度的变化)
4.2×10-3 m3
V
5.7×10-3m3
2.5×10-4m3
2.5×10-4m3
2.5×10-4m3
2.5×10-4m3
2.5×10-4m3
………………
变质量问题
一定质量气体的等温变化
p0V + p0×N×(2.5×10-4 m3) = 4p0 V
由玻意耳定律得:
V=5.7×10-3 m3-4.2×10-3 m3=1.5×10-3 m3
N=18
◎规律总结
求解变质量问题的方法技巧
此类问题我们可认为打入喷雾器的气体都在其周围,且可以认为是一次性打入的,若初态时内外气体压强相同,则体积为内外气体体积之和,状态方程为:p1(V+nV0)=p2V。若初态时内外气体压强不同,则体积不等于内外气体体积之和,状态方程应为:p1V+np1′V0=p2V
练习:一氧气瓶的容积为0.08m3,开始时瓶中氧气的压强为20个大气压.某实验室每天消耗1个大气压的氧气0.36m3.当氧气瓶中的压强降低到2个大气压时,需重新充气.若氧气的温度保持不变,求这瓶氧气重新充气前可供该实验室使用多少天.
4
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
