2024届高三化学二轮复习 突破能垒变化图像 课件(共25张PPT)
文档属性
| 名称 | 2024届高三化学二轮复习 突破能垒变化图像 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 01:19:52 | ||
图片预览




文档简介
(共25张PPT)
会当凌绝顶,一览众山小
---突破能垒变化图像题
二轮复习专题
教学目标与教学重难点
1.通过分析能垒变化图像,掌握数形结合突破能量-历程图像的关键能力。
2.通过分析能垒变化图像中的化学键和能量变化,掌握从宏观和微观两个角度进行问题探究的能力,培养宏观辨识与微观探析的核心素养。
3.结合历年高考中对能垒变化图像的考查,体会真实情境中能垒图像题的破解方法,构建突破化学图像题目的一般思维模型。
教学目标
目标
难点
重点
通过分析能垒变化图像题,掌握从宏观和微观两个角度进行解题的方法及技巧,构建数形结合的思维模型。
连续反应中能垒变化图像的分析与突破。
教学重点
教学难点
情境导入
教学过程
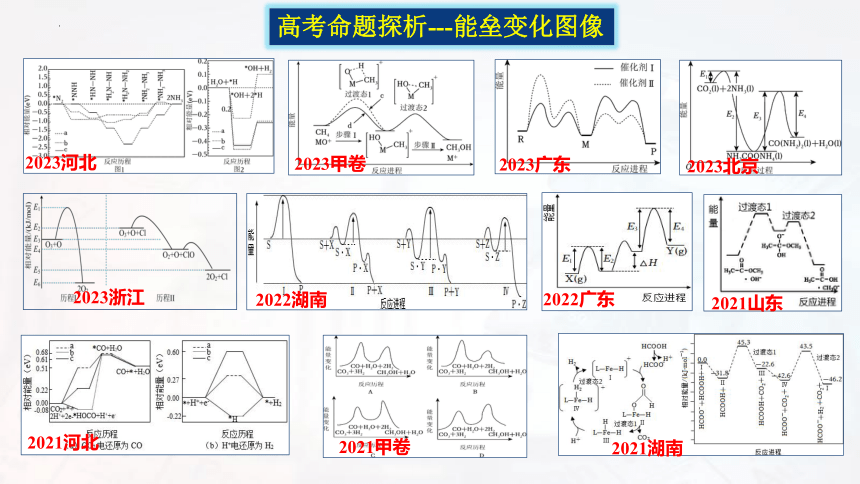
高考命题探析---能垒变化图像
2023河北
2021河北
2023广东
2022湖南
2022广东
2023甲卷
2023北京
2021山东
2021湖南
2021甲卷
2023浙江
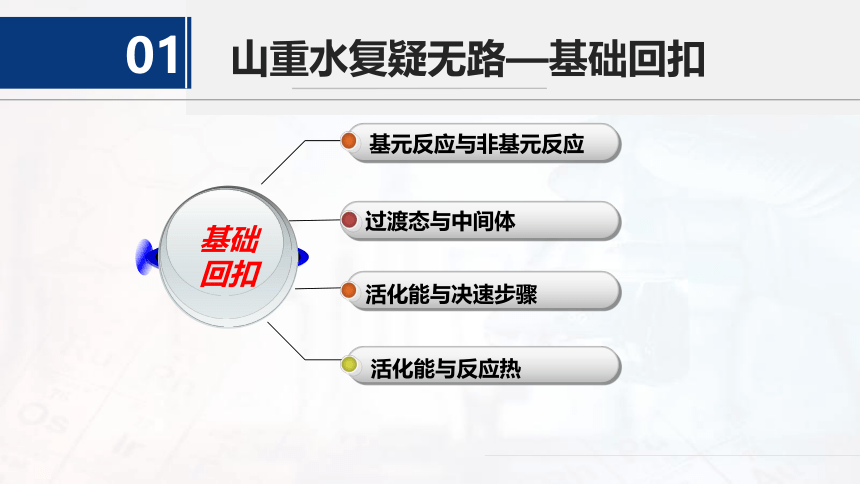
山重水复疑无路—基础回扣
01
基元反应与非基元反应
过渡态与中间体
活化能与决速步骤
活化能与反应热
基础
回扣
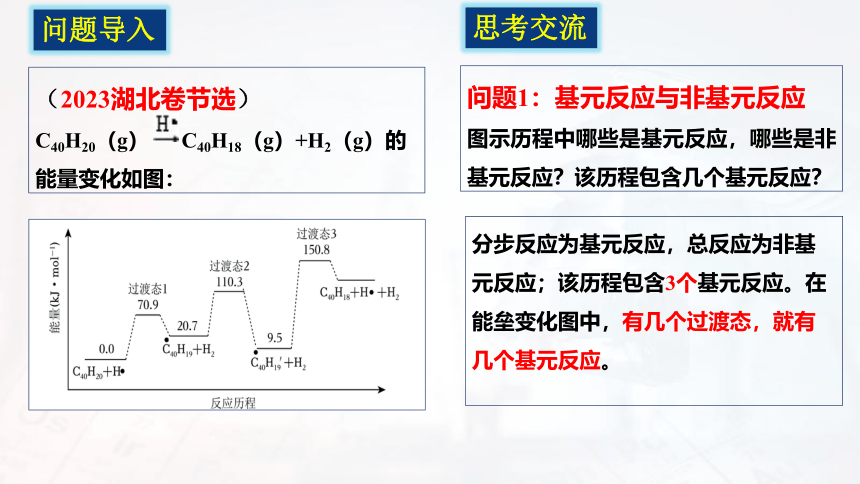
问题导入
(2023湖北卷节选)
C40H20(g) C40H18(g)+H2(g)的能量变化如图:
问题1:基元反应与非基元反应
图示历程中哪些是基元反应,哪些是非基元反应?该历程包含几个基元反应?
分步反应为基元反应,总反应为非基元反应;该历程包含3个基元反应。在能垒变化图中,有几个过渡态,就有几个基元反应。
思考交流
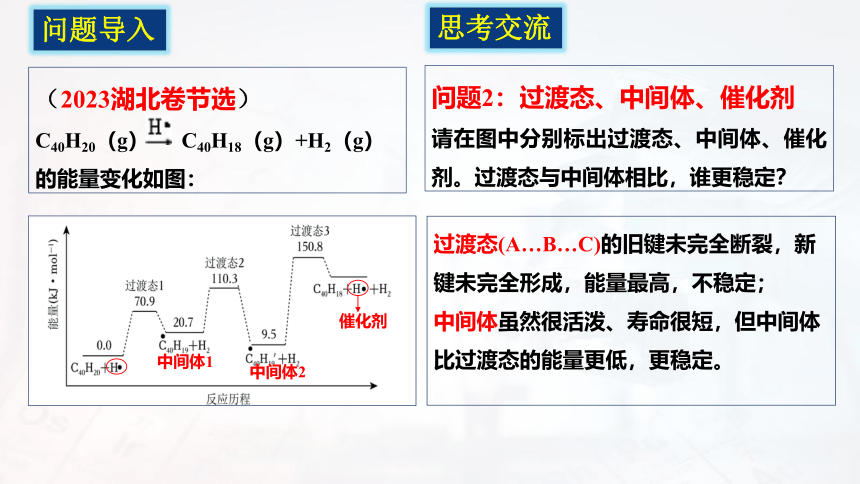
问题2:过渡态、中间体、催化剂
请在图中分别标出过渡态、中间体、催化剂。过渡态与中间体相比,谁更稳定?
过渡态(A…B…C)的旧键未完全断裂,新键未完全形成,能量最高,不稳定;
中间体虽然很活泼、寿命很短,但中间体比过渡态的能量更低,更稳定。
思考交流
中间体1
中间体2
催化剂
问题导入
(2023湖北卷节选)
C40H20(g) C40H18(g)+H2(g)的能量变化如图:
问题导入
(2023湖北卷节选)
C40H20(g) C40H18(g)+H2(g)的能量变化如图:
问题3:活化能与决速步骤
图中每步反应的活化能分别是多少?其中哪一步为决速步骤?
第3步反应的活化能最大,反应速率最慢,为决速步骤
思考交流
70.9
89.6
141.3
问题4:活化能与反应热
总反应是吸热反应还是放热反应?
总反应是吸热反应。
柳暗花明又一村—重点突破
02
能垒与单位
能垒与反应热计算
能垒与催化剂
能垒与连续反应
典例
剖析
能垒与化学键变化
【例1】在Rh催化下,甲酸分解制H2反应的过程如图所示。
其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为_______________________;甲酸分解制H2的热化学方程式可表示为________________________________________________ (阿伏加德罗常数用NA表示)。
HCOOH*===HCOO*+H*
HCOOH(g)===CO2(g)+H2(g) ΔH=-0.16NA eV·mol-1
注意:如果纵坐标相对能量的单位是电子伏特(eV),焓变应转化成每摩尔(乘以NA)
典例剖析一:能垒与单位
【例2】我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是
A.该历程中最小能垒的化学方程式为
(CH3)2NCH2OH*+H*===N (CH3)3+
OH*
B.该历程中最大能垒(活化能)为2.16 eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)===N(CH3)3(g)+H2O(g) ΔH=
-1.02 eV·mol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF的平衡转化率
√
ΔH=-1.02NA eV·mol-1
典例剖析一:能垒与单位
典例剖析二:能垒与反应热计算
【例3】(2022·广东,节选) Cr2O3催化丙烷脱氢过程中,部分反应历程如图1,X(g)→Y(g)过程的焓变为 (列式表示)。
E1﹣E2+△H+E3﹣E4
典例剖析二:能垒与反应热计算
【例4】(2023·北京,节选) 工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:
i.CO2和NH3生成NH2COONH4 ;
ii.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,
下列说法正确的是 (填序号)。
a.活化能:反应i<反应ii
b.i为放热反应,ii为吸热反应
c.CO2(1)+2NH3(1)═CO(NH2)2(1)+H2O(1)ΔH=E1﹣E4
ab
小结
总反应ΔH的计算方法
盖斯定律
ΔH=ΔH1+ΔH2+ΔH3+……
1
2
分步反应ΔH的计算方法
总反应ΔH的计算方法
ΔH=Ea正-Ea逆
【例5】(2023·广东,15)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(下图)中,M为中间产物。其他条件相同时,下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的最高浓
度更大
√
典例剖析三:能垒与催化剂
由图可知两种催化剂均出现四个波峰,所以
使用Ⅰ和Ⅱ,反应历程都分4步进行,A正确;
该反应是放热反应,升高温度平衡向左移动,
R的浓度增大,B正确;
由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C错误;
在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,D正确。
【例6】(2022·湖南,12改编)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如图所示:
下列有关四种不同反应进程的说法正确的是
A.进程Ⅰ是吸热反应 B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ D.进程Ⅳ中,Z没有催化作用
√
典例剖析三:能垒与催化剂
小结
催化剂
不能改变化学反应焓变
不能改变化学平衡常数
不能影响化学平衡移动
不能改变平衡转化率
能改变化学反应的历程
能降低反应活化能
能加快化学反应速率
能改变原料的转化率
非平衡状态
典例剖析四:能垒与连续反应
【例7】(2021河北,节选)在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+电还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为 (用a、b、c字母排序)。
c、a、b
主反应:CO2电还原为CO
副反应: H+电还原为H2
a b c
Ea 0.51 0.76 0.46
a b c
Ea 0.27 0.22 0.6
a
b
c
b
a
c
典例剖析四:能垒与连续反应
【例8】(2023河北,节选)我国科学家研究了水溶液中三种催化剂(a、b、c)上N2电还原为NH3(图1)和H2O电还原为H2(图2)反应历程中的能量变化,则三种催化剂对N2电还原为NH3的催化活性由强到弱的顺序为 (用字母a、b、c排序)。
b、a、c
主反应: N2电还原为NH3
副反应: H2O电还原为H2
a b c
Ea 0.7 0.5 0.9
a b c
Ea 0.22 0.34 0.18
c:0.9eV
a:0.7eV
b:0.5eV
b:0.34eV
a:0.22eV
c:0.18eV
总反应活化能
总反应的活化能是各步基元反应Ea经复杂数学处理之后得到,不能由各分步反应Ea直接加和求算。
1
3
连续反应活化能
连续反应(连续爬坡)中,决速步骤的活化能为总反应的活化能。
最佳催化剂选择
催化主反应时Ea最小,催化副反应时Ea最大,
为最佳催化剂
2
小结
典例剖析五:能垒与化学键变化
【例9】(2023全国甲卷,节选)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如图所示(两者历程相似,图中以CH4示例)。
(i)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ii)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线 (填“c”或“d”)。
(iii)MO+与CH2D2反应,氘代甲醇的产量CH2DOD CHD2OH(填“>”“=”或“<”)。若MO+与CHD3反应,生成的氘代甲醇有 种。
Ⅰ
c
<
2
总结
总结
03
能垒
图像
能垒与单位
能垒与催化剂
能垒与反应热计算
能垒与连续反应
能垒与化学键变化
能垒与... ...
本课结束
会当凌绝顶,一览众山小
谢谢!
会当凌绝顶,一览众山小
---突破能垒变化图像题
二轮复习专题
教学目标与教学重难点
1.通过分析能垒变化图像,掌握数形结合突破能量-历程图像的关键能力。
2.通过分析能垒变化图像中的化学键和能量变化,掌握从宏观和微观两个角度进行问题探究的能力,培养宏观辨识与微观探析的核心素养。
3.结合历年高考中对能垒变化图像的考查,体会真实情境中能垒图像题的破解方法,构建突破化学图像题目的一般思维模型。
教学目标
目标
难点
重点
通过分析能垒变化图像题,掌握从宏观和微观两个角度进行解题的方法及技巧,构建数形结合的思维模型。
连续反应中能垒变化图像的分析与突破。
教学重点
教学难点
情境导入
教学过程
高考命题探析---能垒变化图像
2023河北
2021河北
2023广东
2022湖南
2022广东
2023甲卷
2023北京
2021山东
2021湖南
2021甲卷
2023浙江
山重水复疑无路—基础回扣
01
基元反应与非基元反应
过渡态与中间体
活化能与决速步骤
活化能与反应热
基础
回扣
问题导入
(2023湖北卷节选)
C40H20(g) C40H18(g)+H2(g)的能量变化如图:
问题1:基元反应与非基元反应
图示历程中哪些是基元反应,哪些是非基元反应?该历程包含几个基元反应?
分步反应为基元反应,总反应为非基元反应;该历程包含3个基元反应。在能垒变化图中,有几个过渡态,就有几个基元反应。
思考交流
问题2:过渡态、中间体、催化剂
请在图中分别标出过渡态、中间体、催化剂。过渡态与中间体相比,谁更稳定?
过渡态(A…B…C)的旧键未完全断裂,新键未完全形成,能量最高,不稳定;
中间体虽然很活泼、寿命很短,但中间体比过渡态的能量更低,更稳定。
思考交流
中间体1
中间体2
催化剂
问题导入
(2023湖北卷节选)
C40H20(g) C40H18(g)+H2(g)的能量变化如图:
问题导入
(2023湖北卷节选)
C40H20(g) C40H18(g)+H2(g)的能量变化如图:
问题3:活化能与决速步骤
图中每步反应的活化能分别是多少?其中哪一步为决速步骤?
第3步反应的活化能最大,反应速率最慢,为决速步骤
思考交流
70.9
89.6
141.3
问题4:活化能与反应热
总反应是吸热反应还是放热反应?
总反应是吸热反应。
柳暗花明又一村—重点突破
02
能垒与单位
能垒与反应热计算
能垒与催化剂
能垒与连续反应
典例
剖析
能垒与化学键变化
【例1】在Rh催化下,甲酸分解制H2反应的过程如图所示。
其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为_______________________;甲酸分解制H2的热化学方程式可表示为________________________________________________ (阿伏加德罗常数用NA表示)。
HCOOH*===HCOO*+H*
HCOOH(g)===CO2(g)+H2(g) ΔH=-0.16NA eV·mol-1
注意:如果纵坐标相对能量的单位是电子伏特(eV),焓变应转化成每摩尔(乘以NA)
典例剖析一:能垒与单位
【例2】我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是
A.该历程中最小能垒的化学方程式为
(CH3)2NCH2OH*+H*===N (CH3)3+
OH*
B.该历程中最大能垒(活化能)为2.16 eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)===N(CH3)3(g)+H2O(g) ΔH=
-1.02 eV·mol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF的平衡转化率
√
ΔH=-1.02NA eV·mol-1
典例剖析一:能垒与单位
典例剖析二:能垒与反应热计算
【例3】(2022·广东,节选) Cr2O3催化丙烷脱氢过程中,部分反应历程如图1,X(g)→Y(g)过程的焓变为 (列式表示)。
E1﹣E2+△H+E3﹣E4
典例剖析二:能垒与反应热计算
【例4】(2023·北京,节选) 工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:
i.CO2和NH3生成NH2COONH4 ;
ii.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,
下列说法正确的是 (填序号)。
a.活化能:反应i<反应ii
b.i为放热反应,ii为吸热反应
c.CO2(1)+2NH3(1)═CO(NH2)2(1)+H2O(1)ΔH=E1﹣E4
ab
小结
总反应ΔH的计算方法
盖斯定律
ΔH=ΔH1+ΔH2+ΔH3+……
1
2
分步反应ΔH的计算方法
总反应ΔH的计算方法
ΔH=Ea正-Ea逆
【例5】(2023·广东,15)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(下图)中,M为中间产物。其他条件相同时,下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的最高浓
度更大
√
典例剖析三:能垒与催化剂
由图可知两种催化剂均出现四个波峰,所以
使用Ⅰ和Ⅱ,反应历程都分4步进行,A正确;
该反应是放热反应,升高温度平衡向左移动,
R的浓度增大,B正确;
由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C错误;
在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,D正确。
【例6】(2022·湖南,12改编)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如图所示:
下列有关四种不同反应进程的说法正确的是
A.进程Ⅰ是吸热反应 B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ D.进程Ⅳ中,Z没有催化作用
√
典例剖析三:能垒与催化剂
小结
催化剂
不能改变化学反应焓变
不能改变化学平衡常数
不能影响化学平衡移动
不能改变平衡转化率
能改变化学反应的历程
能降低反应活化能
能加快化学反应速率
能改变原料的转化率
非平衡状态
典例剖析四:能垒与连续反应
【例7】(2021河北,节选)在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+电还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为 (用a、b、c字母排序)。
c、a、b
主反应:CO2电还原为CO
副反应: H+电还原为H2
a b c
Ea 0.51 0.76 0.46
a b c
Ea 0.27 0.22 0.6
a
b
c
b
a
c
典例剖析四:能垒与连续反应
【例8】(2023河北,节选)我国科学家研究了水溶液中三种催化剂(a、b、c)上N2电还原为NH3(图1)和H2O电还原为H2(图2)反应历程中的能量变化,则三种催化剂对N2电还原为NH3的催化活性由强到弱的顺序为 (用字母a、b、c排序)。
b、a、c
主反应: N2电还原为NH3
副反应: H2O电还原为H2
a b c
Ea 0.7 0.5 0.9
a b c
Ea 0.22 0.34 0.18
c:0.9eV
a:0.7eV
b:0.5eV
b:0.34eV
a:0.22eV
c:0.18eV
总反应活化能
总反应的活化能是各步基元反应Ea经复杂数学处理之后得到,不能由各分步反应Ea直接加和求算。
1
3
连续反应活化能
连续反应(连续爬坡)中,决速步骤的活化能为总反应的活化能。
最佳催化剂选择
催化主反应时Ea最小,催化副反应时Ea最大,
为最佳催化剂
2
小结
典例剖析五:能垒与化学键变化
【例9】(2023全国甲卷,节选)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如图所示(两者历程相似,图中以CH4示例)。
(i)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ii)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线 (填“c”或“d”)。
(iii)MO+与CH2D2反应,氘代甲醇的产量CH2DOD CHD2OH(填“>”“=”或“<”)。若MO+与CHD3反应,生成的氘代甲醇有 种。
Ⅰ
c
<
2
总结
总结
03
能垒
图像
能垒与单位
能垒与催化剂
能垒与反应热计算
能垒与连续反应
能垒与化学键变化
能垒与... ...
本课结束
会当凌绝顶,一览众山小
谢谢!
同课章节目录
