化学人教版(2019)选择性必修2 2.3.1共价键的极性(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.1共价键的极性(共17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 08:34:56 | ||
图片预览




文档简介
(共17张PPT)
第三章 晶体结构与性质
第3节 分子的结构与物质的性质
高中化学人教版选择性必修二
第 1 课时 共价键的极性
学习目标
键的极性与分子极性
键的极性对化学性质的影响
本节重点
本节难点
新课导入
【预习导入】
1、写出下列物质的空间结构:BF3、CH2O、H2O、CO2、NH3。
2、下列物质只含有极性共价键的是 ;只含非极性共价键的是 ;既含极性键又含非极性键的是 。
①H2 ②HCl ③H2S ④P4 ⑤C2H4 ⑥NH3 ⑦CCl4
3、判断共价键的极性强弱:HF HCl
任务一 键的极性与分子极性
一、键的极性与分子极性
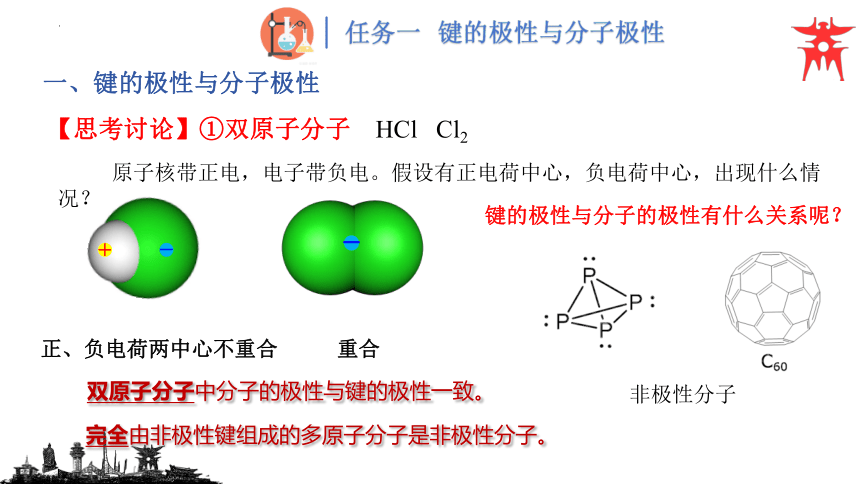
【思考讨论】①双原子分子 HCl Cl2
双原子分子中分子的极性与键的极性一致。
原子核带正电,电子带负电。假设有正电荷中心,负电荷中心,出现什么情况?
-
正、负电荷两中心不重合
+
-
重合
键的极性与分子的极性有什么关系呢?
完全由非极性键组成的多原子分子是非极性分子。
非极性分子
任务一 键的极性与分子极性
一、键的极性与分子极性
【思考讨论】
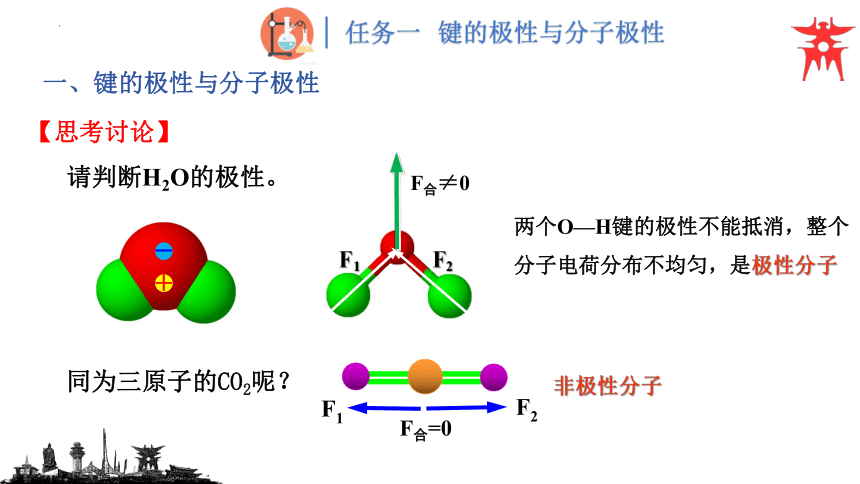
请判断H2O的极性。
+
-
F1
F2
两个O—H键的极性不能抵消,整个分子电荷分布不均匀,是极性分子
同为三原子的CO2呢?
非极性分子
任务一 键的极性与分子极性
一、键的极性与分子极性
在酸式滴定管分别注入30ml环己烷、水溶液后置于滴定管夹上,在滴定管下放置烧杯,打开活塞,让溶液缓慢流下如现线状,将带电棒接近水流,观察水流方向的变化。
【实验】
思考讨论:水流发生偏转,而环己烷流无明显变化,思考原因?
水分子中存在正极与负极,是极性分子;
而环己烷中无正极和负极之分,为非极性分子
电场
磁场
方向
任务一 键的极性与分子极性
一、键的极性与分子极性
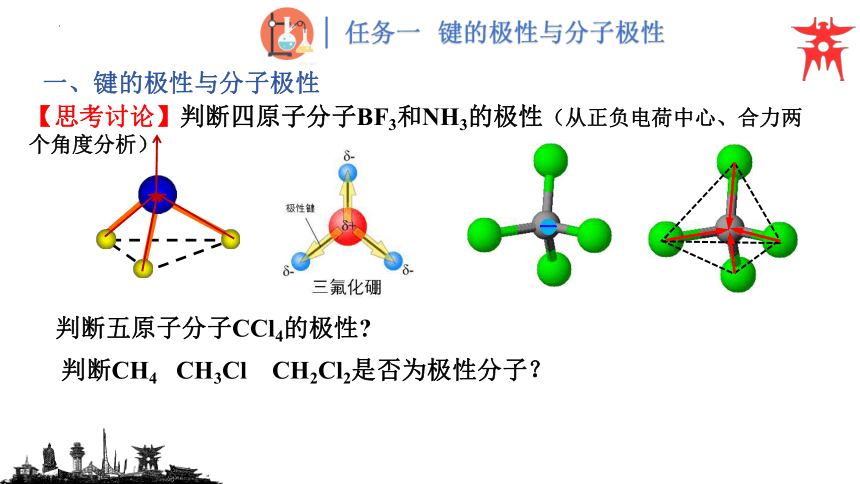
【思考讨论】判断四原子分子BF3和NH3的极性(从正负电荷中心、合力两个角度分析)
判断五原子分子CCl4的极性
-
判断CH4 CH3Cl CH2Cl2是否为极性分子?
任务一 键的极性与分子极性
一、键的极性与分子极性
1.在下列物质中属于极性分子的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.③④⑤ C.③⑤ D.①②
2.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥C2H2,其中含极性键的非极性分子是( )
A. ①③⑥ B. ②③⑥ C. ①④⑥ D. ①③④⑤
【典型例题】
任务一 键的极性与分子极性
一、键的极性与分子极性
共价键
极性键
非极性键
非极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、SO2、O3
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特殊:H2O2
单质分子:Cl2、P4、O2
直线型分子:CO2、CS2、C2H2
正三角形:SO3、BF3
正四面体:CH4、CCl4
平面形:苯、乙稀
空间结构不对称
空间结构对称
空间结构不对称
空间结构对称
极性分子
任务一 键的极性与分子极性
一、键的极性与分子极性
表面活性剂的去污原理
表面活性剂:有机分子,一端有极性(亲水基团),另一端非极性(疏水基团)
在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团,尾基是非极性基 。
科学·技术·社会
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
思考讨论:分析下列物质的酸性强弱?
CH3COO—H
CH3COO-+H+
Ka=
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa= -lgKa
pKa越小,酸性越强
羧基中的羟基极性越大→羧基易电离出氢离子→羧酸酸性越强。
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
分析表格中pKa数据的变化规律并回答相关问题
思考:酸性甲酸>乙酸>丙酸的原因
烃基是推电子基团烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
酸
性
增
强
甲基是
推电子基
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
羧酸 pKa
乙酸(CH3COOH) 4.76
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
酸
性
增
强
思考:酸性三氯乙酸>二氯乙酸>氯乙酸
的原因
由于氯的电负性较大,极性:Cl3C- > Cl2CH- > ClCH2-,导致三氯乙酸中的
羧基的极性最大,更易电离出氢离子。
分析表格中pKa数据的变化规律并回答相关问题
Cl3C—是
吸电子基
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
思考:预测三氟乙酸和三氯乙酸的酸性相对强弱
羧酸 pKa
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH)
酸
性
增
强
由于氟的电负性大于氯的电负性,极性:F3C- > Cl3C- ,导致三氟乙酸中的羧基的极性更大,更易电离出氢离子。
分析表格中pKa数据的变化规律并回答相关问题
0.23
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH ④CH2ClCOOH
⑤CH3COOH ⑥CH3CH2COOH
【典型例题】
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
科学·技术·社会
分子结构修饰与分子的性质
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化。
图2-21 蔗糖和三氯蔗糖结构式
三氯蔗糖
甜度高,热量值低,安全性好,可供糖尿病患者食用。
结构决定性质
课堂小结
通过本节课的学习,我掌握了以下知识点:
内容 获得
键的极性
分子的极性
键的极性对化学性质的影响
第三章 晶体结构与性质
第3节 分子的结构与物质的性质
高中化学人教版选择性必修二
第 1 课时 共价键的极性
学习目标
键的极性与分子极性
键的极性对化学性质的影响
本节重点
本节难点
新课导入
【预习导入】
1、写出下列物质的空间结构:BF3、CH2O、H2O、CO2、NH3。
2、下列物质只含有极性共价键的是 ;只含非极性共价键的是 ;既含极性键又含非极性键的是 。
①H2 ②HCl ③H2S ④P4 ⑤C2H4 ⑥NH3 ⑦CCl4
3、判断共价键的极性强弱:HF HCl
任务一 键的极性与分子极性
一、键的极性与分子极性
【思考讨论】①双原子分子 HCl Cl2
双原子分子中分子的极性与键的极性一致。
原子核带正电,电子带负电。假设有正电荷中心,负电荷中心,出现什么情况?
-
正、负电荷两中心不重合
+
-
重合
键的极性与分子的极性有什么关系呢?
完全由非极性键组成的多原子分子是非极性分子。
非极性分子
任务一 键的极性与分子极性
一、键的极性与分子极性
【思考讨论】
请判断H2O的极性。
+
-
F1
F2
两个O—H键的极性不能抵消,整个分子电荷分布不均匀,是极性分子
同为三原子的CO2呢?
非极性分子
任务一 键的极性与分子极性
一、键的极性与分子极性
在酸式滴定管分别注入30ml环己烷、水溶液后置于滴定管夹上,在滴定管下放置烧杯,打开活塞,让溶液缓慢流下如现线状,将带电棒接近水流,观察水流方向的变化。
【实验】
思考讨论:水流发生偏转,而环己烷流无明显变化,思考原因?
水分子中存在正极与负极,是极性分子;
而环己烷中无正极和负极之分,为非极性分子
电场
磁场
方向
任务一 键的极性与分子极性
一、键的极性与分子极性
【思考讨论】判断四原子分子BF3和NH3的极性(从正负电荷中心、合力两个角度分析)
判断五原子分子CCl4的极性
-
判断CH4 CH3Cl CH2Cl2是否为极性分子?
任务一 键的极性与分子极性
一、键的极性与分子极性
1.在下列物质中属于极性分子的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.③④⑤ C.③⑤ D.①②
2.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥C2H2,其中含极性键的非极性分子是( )
A. ①③⑥ B. ②③⑥ C. ①④⑥ D. ①③④⑤
【典型例题】
任务一 键的极性与分子极性
一、键的极性与分子极性
共价键
极性键
非极性键
非极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、SO2、O3
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特殊:H2O2
单质分子:Cl2、P4、O2
直线型分子:CO2、CS2、C2H2
正三角形:SO3、BF3
正四面体:CH4、CCl4
平面形:苯、乙稀
空间结构不对称
空间结构对称
空间结构不对称
空间结构对称
极性分子
任务一 键的极性与分子极性
一、键的极性与分子极性
表面活性剂的去污原理
表面活性剂:有机分子,一端有极性(亲水基团),另一端非极性(疏水基团)
在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团,尾基是非极性基 。
科学·技术·社会
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
思考讨论:分析下列物质的酸性强弱?
CH3COO—H
CH3COO-+H+
Ka=
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa= -lgKa
pKa越小,酸性越强
羧基中的羟基极性越大→羧基易电离出氢离子→羧酸酸性越强。
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
分析表格中pKa数据的变化规律并回答相关问题
思考:酸性甲酸>乙酸>丙酸的原因
烃基是推电子基团烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
酸
性
增
强
甲基是
推电子基
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
羧酸 pKa
乙酸(CH3COOH) 4.76
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
酸
性
增
强
思考:酸性三氯乙酸>二氯乙酸>氯乙酸
的原因
由于氯的电负性较大,极性:Cl3C- > Cl2CH- > ClCH2-,导致三氯乙酸中的
羧基的极性最大,更易电离出氢离子。
分析表格中pKa数据的变化规律并回答相关问题
Cl3C—是
吸电子基
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
思考:预测三氟乙酸和三氯乙酸的酸性相对强弱
羧酸 pKa
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH)
酸
性
增
强
由于氟的电负性大于氯的电负性,极性:F3C- > Cl3C- ,导致三氟乙酸中的羧基的极性更大,更易电离出氢离子。
分析表格中pKa数据的变化规律并回答相关问题
0.23
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH ④CH2ClCOOH
⑤CH3COOH ⑥CH3CH2COOH
【典型例题】
任务二 键的极性对化学性质的影响
二、键的极性对化学性质的影响
科学·技术·社会
分子结构修饰与分子的性质
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化。
图2-21 蔗糖和三氯蔗糖结构式
三氯蔗糖
甜度高,热量值低,安全性好,可供糖尿病患者食用。
结构决定性质
课堂小结
通过本节课的学习,我掌握了以下知识点:
内容 获得
键的极性
分子的极性
键的极性对化学性质的影响
