2024年高中化学实验探究题特训:水溶液中离子反应与平衡(含答案)
文档属性
| 名称 | 2024年高中化学实验探究题特训:水溶液中离子反应与平衡(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 653.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 16:08:39 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024年高中化学实验探究题特训:水溶液中离子反应与平衡
1.为探究锌和FeCl3溶液的反应,室温下某小组同学进行了如下实验。
(1)配置1000mL 1mol/L的FeCl3溶液,pH约为0.70,即c(H+)=0.2mol·L 1。
①从反应条件考虑,影响FeCl3水解平衡的因素有 (答两点)。
②取10mL 1mol/L的FeCl3溶液加水稀释,盐的水解程度 (填“增大”、“减小”或“不变”)。
(2)小组同学利用上述FeCl3溶液探究其与锌粉的反应。
向500mL FeCl3溶液中加入65g锌粉,实现现象记录如下:
i.实验前期,溶液的pH逐渐增大,锌粉表面未发现气泡;
ⅱ.随着反应的进行,观察到瓶底产生红褐色沉淀,同时出现少量气泡;
ⅲ.15分钟后溶液中产生大量气泡;
ⅳ.……
①经实验确认“实验前期”溶液中有Fe2+生成,确认有Fe2+的实验操作和现象是 ,结合平衡移动原理解释:实验前期溶液pH增大的原因 。
②查阅资料发现:Fe(OH)3常温下的溶度积常数为2.810-39,请写出Fe(OH)3的沉淀溶解平衡表达式 ,试从Ksp-Q关系角度结合具体数值分析反应开始c(H+)=0.2mol·L 1时,没有出现红褐色沉淀的原因 。
③结合离子方程式解释反应过程中气泡变化的原因 。
(3)锌和FeCl3溶液反应后溶液中Cl-浓度的测定。
用c mol·L-1AgNO3标准溶液滴定反应后溶液中的Cl-,采用K2CrO4为指示剂,利用Ag+与CrO生成砖红色沉淀指示滴定终点,实现操作如下:
i.以醋酸纤维滤膜过滤掉水样中的悬浮物,调节水样pH在6.5~10.5;
ⅱ.取10.00mL水样,加入K2CrO4溶液作指示剂,用AgNO3标准溶液滴定至终点,消耗AgNO3溶液VmL。
①滴定时,AgNO3标准溶液应加到 (填玻璃仪器名称)中。
②锌和FeCl3溶液反应后溶液中Cl-浓度为 (用含c的代数式表示)mol·L-1
③已知:Cr2O(黄色)+H2O2H++2CrO(橙色),解释滴定时调节水样pH在6.5~10.5的原因 。
2.葡萄酒的主要成分有水、乙醇、有机酸等,是葡萄酒中常见的一种添加剂。实验小组对某葡萄酒开展探究,回答下列问题:
(1)元素在周期表中的位置是 .
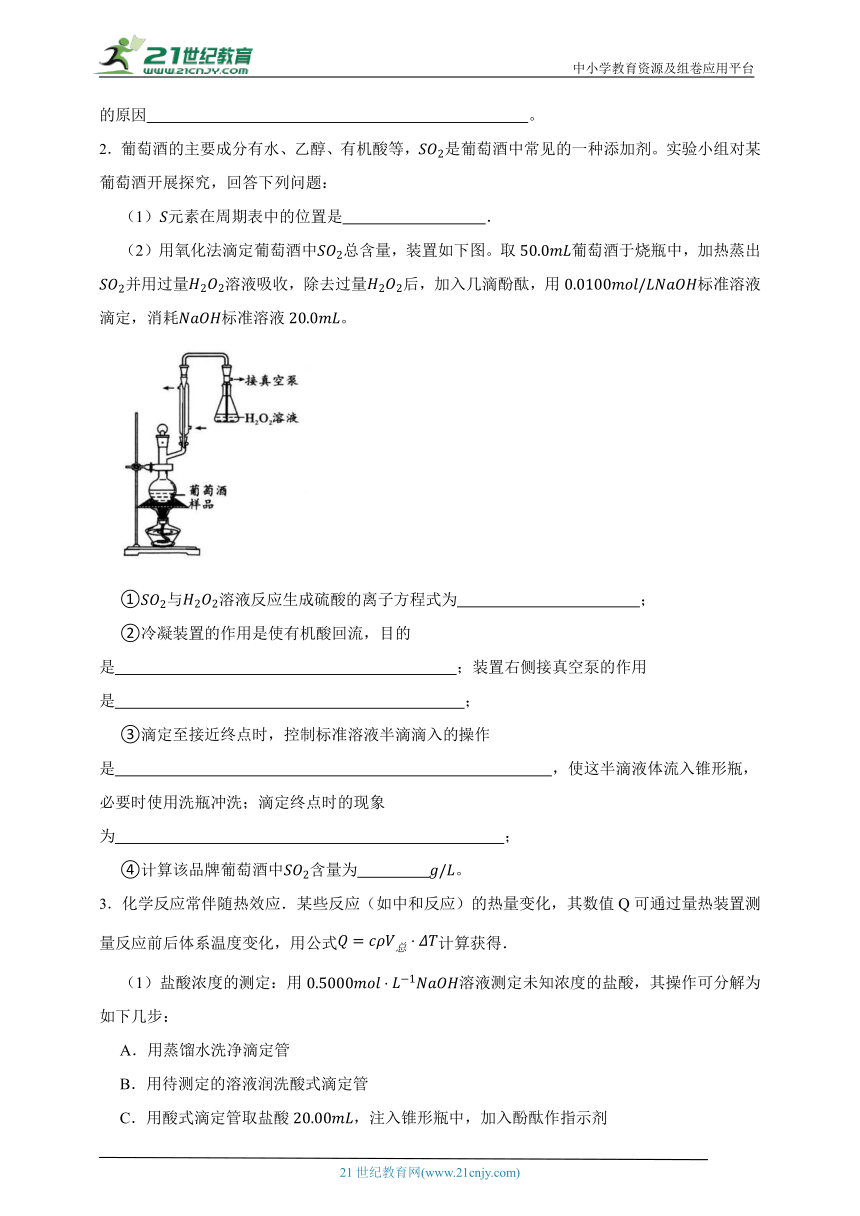
(2)用氧化法滴定葡萄酒中总含量,装置如下图。取葡萄酒于烧瓶中,加热蒸出并用过量溶液吸收,除去过量后,加入几滴酚酞,用标准溶液滴定,消耗标准溶液。
①与溶液反应生成硫酸的离子方程式为 ;
②冷凝装置的作用是使有机酸回流,目的是 ;装置右侧接真空泵的作用是 ;
③滴定至接近终点时,控制标准溶液半滴滴入的操作是 ,使这半滴液体流入锥形瓶,必要时使用洗瓶冲洗;滴定终点时的现象为 ;
④计算该品牌葡萄酒中含量为 。
3.化学反应常伴随热效应.某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式计算获得.
(1)盐酸浓度的测定:用溶液测定未知浓度的盐酸,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取盐酸,注入锥形瓶中,加入酚酞作指示剂
D.另取锥形瓶,再重复操作次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,调节液面至“0”刻度或“0”刻度以下,再把碱式滴定管固定好
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定时正确的操作顺序是(填序号)E→ →F→ →C→ →D.
②上述滴定操作用到的仪器有 (填序号).
③滴定时边滴边摇动锥形瓶,眼睛应注意观察 .滴定终点溶液颜色的变化是 .
④滴定结果如下表所示:
滴定次数 待测液体积/ 标准溶液的体积/
滴定前读数 滴定后读数
1 20.00 1.03 23.03
2 20.00 0.60 22.60
3 20.00 0.20 20.19
则该盐酸浓度为 .
⑤若碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准溶液,则测定结果将 (填“偏高”“偏低”或“不变”).
(2)热量的测定:取上述溶液和盐酸各进行反应,测得反应前后体系的温度值(℃)分别为,则该过程放出的热量为 J(c和ρ分别取和,忽略水以外各物质吸收的热量).
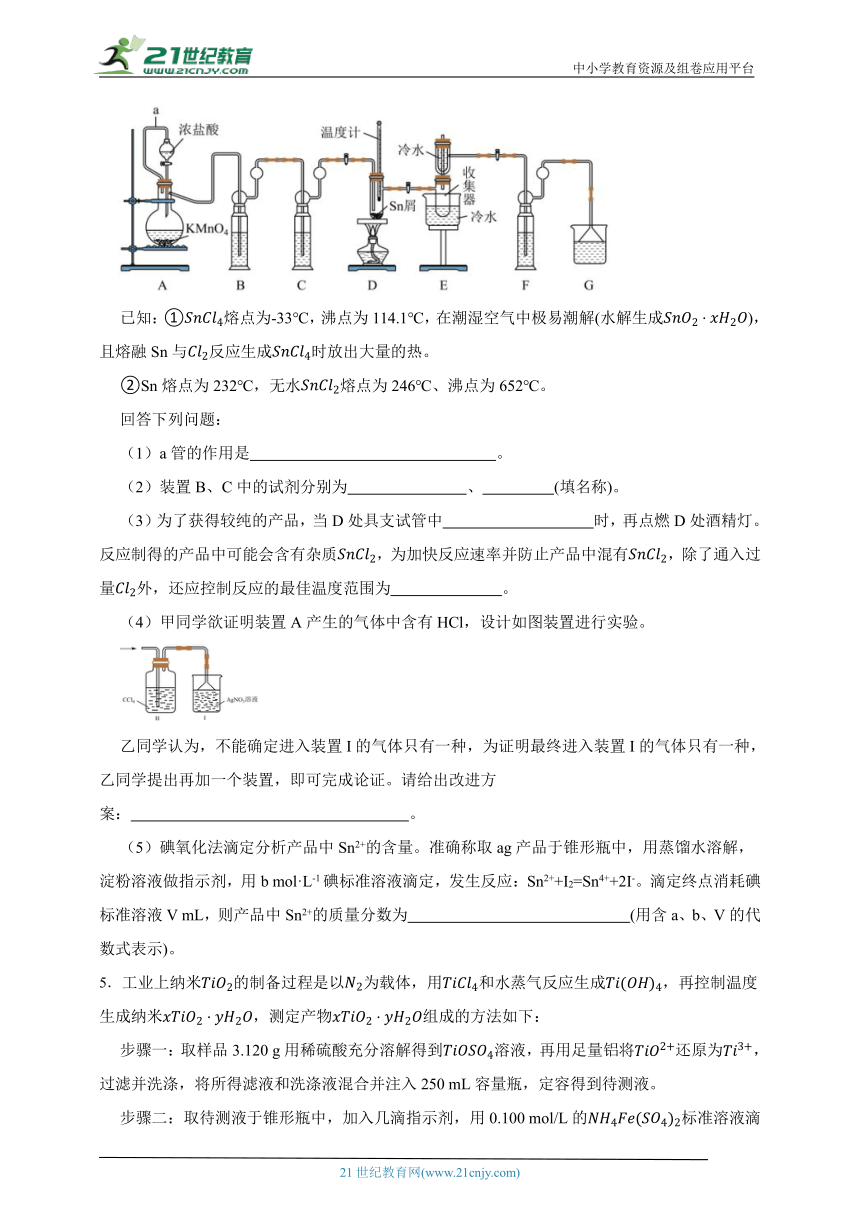
4.无水四氯化锡()常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备并测定产品中含量。
已知:①熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成),且熔融Sn与反应生成时放出大量的热。
②Sn熔点为232℃,无水熔点为246℃、沸点为652℃。
回答下列问题:
(1)a管的作用是 。
(2)装置B、C中的试剂分别为 、 (填名称)。
(3)为了获得较纯的产品,当D处具支试管中 时,再点燃D处酒精灯。反应制得的产品中可能会含有杂质,为加快反应速率并防止产品中混有,除了通入过量外,还应控制反应的最佳温度范围为 。
(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。
乙同学认为,不能确定进入装置I的气体只有一种,为证明最终进入装置I的气体只有一种,乙同学提出再加一个装置,即可完成论证。请给出改进方案: 。
(5)碘氧化法滴定分析产品中Sn2+的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b mol·L-1碘标准溶液滴定,发生反应:Sn2++I2=Sn4++2I-。滴定终点消耗碘标准溶液V mL,则产品中Sn2+的质量分数为 (用含a、b、V的代数式表示)。
5.工业上纳米的制备过程是以为载体,用和水蒸气反应生成,再控制温度生成纳米,测定产物组成的方法如下:
步骤一:取样品3.120 g用稀硫酸充分溶解得到溶液,再用足量铝将还原为,过滤并洗涤,将所得滤液和洗涤液混合并注入250 mL容量瓶,定容得到待测液。
步骤二:取待测液于锥形瓶中,加入几滴指示剂,用0.100 mol/L的标准溶液滴定,将氧化为,三次滴定测得数据记录如下:
实验编号 待测溶液的体积/mL 滴定前标准液的体积读数/mL 滴定后标准液的体积读数/mL
1 25.00 0.20 30.22
2 25.00 1.21 32.21
3 25.00 1.50 31.48
回答下列问题:
(1)若对步骤一所得的溶液加水稀释,溶液中会产生少量偏钛酸()沉淀,写出该反应的离子方程式 。
(2)已知溶液显酸性,滴定时,将标准溶液注入 (填“酸”或“碱”)式滴定管中。选出其正确操作并按顺序写出字母:检查滴定管是否漏水→蒸馏水洗涤→ → → → → →滴定管准备完成。
a.从滴定管上口加入高于“0”刻度2-3 mL所要盛装的溶液
b.将洗涤液从滴定管下部放入预置的烧杯中
c.从滴定管上口加入3 mL所要盛装的溶液,倾斜着转动滴定管
d.将洗涤液从滴定管上口倒入预置的烧杯中
e.调整液面至“0”刻度或“0“刻度以下,记录数据
f.轻轻转动活塞使滴定管的尖嘴部分充满溶液,无气泡
g.轻轻挤压玻璃球使滴定管的尖嘴部分充满溶液,无气泡
(3)上述滴定实验中,可选择 为指示剂,判断到达滴定终点的方法是 。
(4)下列关于滴定分析的操作,错误的是____。
A.用量筒量取25.00 mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速率
C.滴定时应一直观察滴定管中溶液体积的变化
D.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
E.在接近终点时,滴加药品应慢慢控制滴定管,使滴定管尖嘴悬挂半滴液体,用锥形瓶内壁将其靠下,并用蒸馏水将其冲入锥形瓶内
(5)通过分析、计算,该样品的组成为 ;若滴定前平视读数,滴定后俯视读数,则测得比实际值 (填“偏大”、“偏小”或“无影响”)。
6.中医药典记载木耳具有“和血养营”功效。某实验小组称取一定量黑木耳以检验黑木耳中含有铁元素、并测定铁元素含量。实验过程如下:
(1)Ⅰ.定性检验
“灼烧”中用于盛装黑木耳的仪器是 。
(2)甲同学往“酸浸”所得溶液中加入高锰酸钾,发现溶液的紫红色褪去,因此得出“此酸浸溶液中含”的结论。乙同学不赞同甲同学的观点,乙同学的理由是 。
(3)Ⅱ.定量分析1——高锰酸钾滴定法
取一定量待测液,利用盐酸羟胺(在溶液中可完全电离出与)将溶液中还原为,同时产生一种无污染的气体,该反应的离子方程式为 ;再利用酸性高锰酸钾溶液氧化,根据消耗的高锰酸钾溶液的体积以计算铁元素含量。
(4)配制一定物质的量浓度的高锰酸钾溶液时,下列操作会使铁元素含量测量值偏高的是____。
A.没有进行洗涤操作
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
(5)Ⅲ.定量分析2——吸光度法
取10mL待测液,利用吸光度法测得其吸光度为0.600(吸光度与的浓度关系如下图所示)。
该黑木耳中铁元素的含量(溶液密度为)= (mg/100g)。
7.实验室利用和亚硫酰氯制备无水的装置如图所示(加热及夹持装置略).已知沸点为,遇水极易反应生成两种酸性气体.回答下列问题:
(1)装置c的名称是 ,装置b内发生反应的化学方程式为 .
(2)下列说法正确的是____.
A.实验开始先通一段时间后,应先加热装置a,再加热装置b
B.两处洗气瓶e中均可装入浓硫酸
C.装置c、d.共同起到的作用冷凝回流
D.装置既可吸收尾气,又可防止倒吸,烧杯中可加入水
(3)能由上述装置将下列结晶水合物制备得到相应的无水盐的是____(填字母).
A. B. C.
(4)现有含少量杂质的,为测定n值进行如下实验:
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为不反应).
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为.
①上述滴定滴定过程中,下列操作正确的是 (填字母).
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.滴定时,常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.滴定时,眼睛应注视滴定管内液面高度变化
②下列情况会导致n测量值偏小的是 (填字母).
A.若样品中含少量杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
C.样品与反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
③若样品中所含的少量杂质不参与反应,则 (用含、c、V的表达式表示)
8.某化学兴趣小组拟按如下步骤合成铁系催化剂的中间体[Fe(CO)2Cl2]:
其中步骤①实验装置如图所示:
已知:
(I)多聚甲醛为(CH2O)n(n=6~100),当n<12的多聚甲醛可溶于水,当n≥12则不溶于水;加酸或160~200℃加热时会解聚。
(Ⅰ)[Fe(CO)2Cl2]遇氧气、水都会反应,其中Fe的化合价为+2价。
(Ⅱ)SnCl2有强还原性,可被弱氧化剂HgCl2氧化:2HgCl2+SnCl2=Hg2Cl2↓+SnCl4
请回答:
(1)步骤③产物干燥后仍需放置在干燥器中,以下称为干燥器的是____。
A. B. C. D.
(2)操作步骤②时仍需在氩气氛围下完成,理由是 。
(3)写出生成[Fe(CO)2Cl2]的化学反应方程式 。
(4)仪器a中盛放的试剂为 ,装置b的作用是 。
(5)测定产品纯度时,先称取一定量[Fe(CO)2Cl2],经多步处理并转化为Fe2+后,再用KMnO4标准溶液(用Na2C2O4标准溶液标定)滴定其含量。从下列选项中选出合理的操作并排序: 。
c→ →a→ → →f
a.将准确称量的[Fe(CO)2Cl2]溶解于水
b.准确称量Na2C2O4并配制一定物质的量浓度的溶液,进行滴定
c.将制备的KMnO4溶液加热煮沸,冷却后滤去MnO2
d.用HgCl2除过量的SnCl2,滤去沉淀
e.加入足量SnCl2进行还原
f.用Na2C2O4标准溶液标定后的KMnO4溶液进行滴定
下列情况会导致测量结果偏大的是 。
A.[Fe(CO)2Cl2]产品含少量多聚甲醛杂质
B.过量的SnCl2未被除尽
C.[Fe(CO)2Cl2]产品部分氧化或潮解
D.配好的KMnO4标准溶液久置后使用
答案解析部分
1.【答案】(1)温度和浓度;增大
(2)“实验前期”取少量溶液,滴加铁氰化钾溶液,出现蓝色沉淀或滴加酸性高锰酸钾溶液紫色褪去;Fe3++3H2OFe(OH)3+3H+,铁离子浓度减小平衡逆移,酸性减弱;Fe(OH)3(s)Fe3+(aq)+3OH-(aq);当pH=0.7,即c(H+)=0.2mol·L 1时,c(OH-)=5×10-14mol/L,生成沉淀Fe3+的最小浓度为c(Fe3+)===22.4mol/L,溶液中的c(Fe3+)=1mol/L,不会生成沉淀;或pH=0.7时,c(Fe3+)=1mol/L,Qc=c(Fe3+)×c3(OH-)=1×(5×10-14)3(3)酸式滴定管;0.1Cv;酸性太强,CrO容易形成Cr2O从而造成滴定终点滞后;碱性太强,银离子会和OH-反应,造成滴定终点的滞后
2.【答案】(1)第三周期VIA族
(2);防止有机酸进入锥形瓶,干扰测定 ;;使更易进入锥形瓶中与溶液反应;当滴定管尖嘴有液滴悬挂时,用锥形瓶瓶口内壁轻靠液体;锥形瓶中溶液由无色变为浅红色,且半分钟不褪色;0.128
3.【答案】(1)A;B;G;AD;锥形瓶内溶液颜色的变化;由无色变为粉红色且半分钟内不褪色;0.5500;偏高
(2)
4.【答案】(1)平衡压强,使浓盐酸顺利流下
(2)饱和食盐水;浓硫酸
(3)充满黄绿色气体;232~652℃
(4)在装置H、I之间连接一个放有湿润淀粉-KI试纸或湿润红色布条的试管
(5)×100%
5.【答案】(1)
(2)酸;c;b;a;f;e
(3)KSCN溶液;滴加最后半滴标准溶液,溶液变为红色且半分钟内不褪色
(4)A;C
(5);偏小
6.【答案】(1)坩埚
(2)溶液中的氯离子会与酸性高锰酸钾溶液反应,使紫红色褪去。
(3)
(4)A;C
(5)0.336
7.【答案】(1)球形冷凝管;
(2)A;B;C
(3)A
(4)C;AC;
8.【答案】(1)C
(2)[Fe(CO)2Cl2]遇氧气会反应,通入氩气隔绝氧气,起到保护作用
(3)
(4)浓氢氧化钠溶液;防倒吸
(5)b;d;e;BD
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高中化学实验探究题特训:水溶液中离子反应与平衡
1.为探究锌和FeCl3溶液的反应,室温下某小组同学进行了如下实验。
(1)配置1000mL 1mol/L的FeCl3溶液,pH约为0.70,即c(H+)=0.2mol·L 1。
①从反应条件考虑,影响FeCl3水解平衡的因素有 (答两点)。
②取10mL 1mol/L的FeCl3溶液加水稀释,盐的水解程度 (填“增大”、“减小”或“不变”)。
(2)小组同学利用上述FeCl3溶液探究其与锌粉的反应。
向500mL FeCl3溶液中加入65g锌粉,实现现象记录如下:
i.实验前期,溶液的pH逐渐增大,锌粉表面未发现气泡;
ⅱ.随着反应的进行,观察到瓶底产生红褐色沉淀,同时出现少量气泡;
ⅲ.15分钟后溶液中产生大量气泡;
ⅳ.……
①经实验确认“实验前期”溶液中有Fe2+生成,确认有Fe2+的实验操作和现象是 ,结合平衡移动原理解释:实验前期溶液pH增大的原因 。
②查阅资料发现:Fe(OH)3常温下的溶度积常数为2.810-39,请写出Fe(OH)3的沉淀溶解平衡表达式 ,试从Ksp-Q关系角度结合具体数值分析反应开始c(H+)=0.2mol·L 1时,没有出现红褐色沉淀的原因 。
③结合离子方程式解释反应过程中气泡变化的原因 。
(3)锌和FeCl3溶液反应后溶液中Cl-浓度的测定。
用c mol·L-1AgNO3标准溶液滴定反应后溶液中的Cl-,采用K2CrO4为指示剂,利用Ag+与CrO生成砖红色沉淀指示滴定终点,实现操作如下:
i.以醋酸纤维滤膜过滤掉水样中的悬浮物,调节水样pH在6.5~10.5;
ⅱ.取10.00mL水样,加入K2CrO4溶液作指示剂,用AgNO3标准溶液滴定至终点,消耗AgNO3溶液VmL。
①滴定时,AgNO3标准溶液应加到 (填玻璃仪器名称)中。
②锌和FeCl3溶液反应后溶液中Cl-浓度为 (用含c的代数式表示)mol·L-1
③已知:Cr2O(黄色)+H2O2H++2CrO(橙色),解释滴定时调节水样pH在6.5~10.5的原因 。
2.葡萄酒的主要成分有水、乙醇、有机酸等,是葡萄酒中常见的一种添加剂。实验小组对某葡萄酒开展探究,回答下列问题:
(1)元素在周期表中的位置是 .
(2)用氧化法滴定葡萄酒中总含量,装置如下图。取葡萄酒于烧瓶中,加热蒸出并用过量溶液吸收,除去过量后,加入几滴酚酞,用标准溶液滴定,消耗标准溶液。
①与溶液反应生成硫酸的离子方程式为 ;
②冷凝装置的作用是使有机酸回流,目的是 ;装置右侧接真空泵的作用是 ;
③滴定至接近终点时,控制标准溶液半滴滴入的操作是 ,使这半滴液体流入锥形瓶,必要时使用洗瓶冲洗;滴定终点时的现象为 ;
④计算该品牌葡萄酒中含量为 。
3.化学反应常伴随热效应.某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式计算获得.
(1)盐酸浓度的测定:用溶液测定未知浓度的盐酸,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取盐酸,注入锥形瓶中,加入酚酞作指示剂
D.另取锥形瓶,再重复操作次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,调节液面至“0”刻度或“0”刻度以下,再把碱式滴定管固定好
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定时正确的操作顺序是(填序号)E→ →F→ →C→ →D.
②上述滴定操作用到的仪器有 (填序号).
③滴定时边滴边摇动锥形瓶,眼睛应注意观察 .滴定终点溶液颜色的变化是 .
④滴定结果如下表所示:
滴定次数 待测液体积/ 标准溶液的体积/
滴定前读数 滴定后读数
1 20.00 1.03 23.03
2 20.00 0.60 22.60
3 20.00 0.20 20.19
则该盐酸浓度为 .
⑤若碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准溶液,则测定结果将 (填“偏高”“偏低”或“不变”).
(2)热量的测定:取上述溶液和盐酸各进行反应,测得反应前后体系的温度值(℃)分别为,则该过程放出的热量为 J(c和ρ分别取和,忽略水以外各物质吸收的热量).
4.无水四氯化锡()常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备并测定产品中含量。
已知:①熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成),且熔融Sn与反应生成时放出大量的热。
②Sn熔点为232℃,无水熔点为246℃、沸点为652℃。
回答下列问题:
(1)a管的作用是 。
(2)装置B、C中的试剂分别为 、 (填名称)。
(3)为了获得较纯的产品,当D处具支试管中 时,再点燃D处酒精灯。反应制得的产品中可能会含有杂质,为加快反应速率并防止产品中混有,除了通入过量外,还应控制反应的最佳温度范围为 。
(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。
乙同学认为,不能确定进入装置I的气体只有一种,为证明最终进入装置I的气体只有一种,乙同学提出再加一个装置,即可完成论证。请给出改进方案: 。
(5)碘氧化法滴定分析产品中Sn2+的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b mol·L-1碘标准溶液滴定,发生反应:Sn2++I2=Sn4++2I-。滴定终点消耗碘标准溶液V mL,则产品中Sn2+的质量分数为 (用含a、b、V的代数式表示)。
5.工业上纳米的制备过程是以为载体,用和水蒸气反应生成,再控制温度生成纳米,测定产物组成的方法如下:
步骤一:取样品3.120 g用稀硫酸充分溶解得到溶液,再用足量铝将还原为,过滤并洗涤,将所得滤液和洗涤液混合并注入250 mL容量瓶,定容得到待测液。
步骤二:取待测液于锥形瓶中,加入几滴指示剂,用0.100 mol/L的标准溶液滴定,将氧化为,三次滴定测得数据记录如下:
实验编号 待测溶液的体积/mL 滴定前标准液的体积读数/mL 滴定后标准液的体积读数/mL
1 25.00 0.20 30.22
2 25.00 1.21 32.21
3 25.00 1.50 31.48
回答下列问题:
(1)若对步骤一所得的溶液加水稀释,溶液中会产生少量偏钛酸()沉淀,写出该反应的离子方程式 。
(2)已知溶液显酸性,滴定时,将标准溶液注入 (填“酸”或“碱”)式滴定管中。选出其正确操作并按顺序写出字母:检查滴定管是否漏水→蒸馏水洗涤→ → → → → →滴定管准备完成。
a.从滴定管上口加入高于“0”刻度2-3 mL所要盛装的溶液
b.将洗涤液从滴定管下部放入预置的烧杯中
c.从滴定管上口加入3 mL所要盛装的溶液,倾斜着转动滴定管
d.将洗涤液从滴定管上口倒入预置的烧杯中
e.调整液面至“0”刻度或“0“刻度以下,记录数据
f.轻轻转动活塞使滴定管的尖嘴部分充满溶液,无气泡
g.轻轻挤压玻璃球使滴定管的尖嘴部分充满溶液,无气泡
(3)上述滴定实验中,可选择 为指示剂,判断到达滴定终点的方法是 。
(4)下列关于滴定分析的操作,错误的是____。
A.用量筒量取25.00 mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速率
C.滴定时应一直观察滴定管中溶液体积的变化
D.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
E.在接近终点时,滴加药品应慢慢控制滴定管,使滴定管尖嘴悬挂半滴液体,用锥形瓶内壁将其靠下,并用蒸馏水将其冲入锥形瓶内
(5)通过分析、计算,该样品的组成为 ;若滴定前平视读数,滴定后俯视读数,则测得比实际值 (填“偏大”、“偏小”或“无影响”)。
6.中医药典记载木耳具有“和血养营”功效。某实验小组称取一定量黑木耳以检验黑木耳中含有铁元素、并测定铁元素含量。实验过程如下:
(1)Ⅰ.定性检验
“灼烧”中用于盛装黑木耳的仪器是 。
(2)甲同学往“酸浸”所得溶液中加入高锰酸钾,发现溶液的紫红色褪去,因此得出“此酸浸溶液中含”的结论。乙同学不赞同甲同学的观点,乙同学的理由是 。
(3)Ⅱ.定量分析1——高锰酸钾滴定法
取一定量待测液,利用盐酸羟胺(在溶液中可完全电离出与)将溶液中还原为,同时产生一种无污染的气体,该反应的离子方程式为 ;再利用酸性高锰酸钾溶液氧化,根据消耗的高锰酸钾溶液的体积以计算铁元素含量。
(4)配制一定物质的量浓度的高锰酸钾溶液时,下列操作会使铁元素含量测量值偏高的是____。
A.没有进行洗涤操作
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
(5)Ⅲ.定量分析2——吸光度法
取10mL待测液,利用吸光度法测得其吸光度为0.600(吸光度与的浓度关系如下图所示)。
该黑木耳中铁元素的含量(溶液密度为)= (mg/100g)。
7.实验室利用和亚硫酰氯制备无水的装置如图所示(加热及夹持装置略).已知沸点为,遇水极易反应生成两种酸性气体.回答下列问题:
(1)装置c的名称是 ,装置b内发生反应的化学方程式为 .
(2)下列说法正确的是____.
A.实验开始先通一段时间后,应先加热装置a,再加热装置b
B.两处洗气瓶e中均可装入浓硫酸
C.装置c、d.共同起到的作用冷凝回流
D.装置既可吸收尾气,又可防止倒吸,烧杯中可加入水
(3)能由上述装置将下列结晶水合物制备得到相应的无水盐的是____(填字母).
A. B. C.
(4)现有含少量杂质的,为测定n值进行如下实验:
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为不反应).
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为.
①上述滴定滴定过程中,下列操作正确的是 (填字母).
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.滴定时,常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.滴定时,眼睛应注视滴定管内液面高度变化
②下列情况会导致n测量值偏小的是 (填字母).
A.若样品中含少量杂质 B.滴定达终点时发现滴定管尖嘴内有气泡生成
C.样品与反应时失水不充分 D.实验Ⅰ中,称重后样品发生了潮解
③若样品中所含的少量杂质不参与反应,则 (用含、c、V的表达式表示)
8.某化学兴趣小组拟按如下步骤合成铁系催化剂的中间体[Fe(CO)2Cl2]:
其中步骤①实验装置如图所示:
已知:
(I)多聚甲醛为(CH2O)n(n=6~100),当n<12的多聚甲醛可溶于水,当n≥12则不溶于水;加酸或160~200℃加热时会解聚。
(Ⅰ)[Fe(CO)2Cl2]遇氧气、水都会反应,其中Fe的化合价为+2价。
(Ⅱ)SnCl2有强还原性,可被弱氧化剂HgCl2氧化:2HgCl2+SnCl2=Hg2Cl2↓+SnCl4
请回答:
(1)步骤③产物干燥后仍需放置在干燥器中,以下称为干燥器的是____。
A. B. C. D.
(2)操作步骤②时仍需在氩气氛围下完成,理由是 。
(3)写出生成[Fe(CO)2Cl2]的化学反应方程式 。
(4)仪器a中盛放的试剂为 ,装置b的作用是 。
(5)测定产品纯度时,先称取一定量[Fe(CO)2Cl2],经多步处理并转化为Fe2+后,再用KMnO4标准溶液(用Na2C2O4标准溶液标定)滴定其含量。从下列选项中选出合理的操作并排序: 。
c→ →a→ → →f
a.将准确称量的[Fe(CO)2Cl2]溶解于水
b.准确称量Na2C2O4并配制一定物质的量浓度的溶液,进行滴定
c.将制备的KMnO4溶液加热煮沸,冷却后滤去MnO2
d.用HgCl2除过量的SnCl2,滤去沉淀
e.加入足量SnCl2进行还原
f.用Na2C2O4标准溶液标定后的KMnO4溶液进行滴定
下列情况会导致测量结果偏大的是 。
A.[Fe(CO)2Cl2]产品含少量多聚甲醛杂质
B.过量的SnCl2未被除尽
C.[Fe(CO)2Cl2]产品部分氧化或潮解
D.配好的KMnO4标准溶液久置后使用
答案解析部分
1.【答案】(1)温度和浓度;增大
(2)“实验前期”取少量溶液,滴加铁氰化钾溶液,出现蓝色沉淀或滴加酸性高锰酸钾溶液紫色褪去;Fe3++3H2OFe(OH)3+3H+,铁离子浓度减小平衡逆移,酸性减弱;Fe(OH)3(s)Fe3+(aq)+3OH-(aq);当pH=0.7,即c(H+)=0.2mol·L 1时,c(OH-)=5×10-14mol/L,生成沉淀Fe3+的最小浓度为c(Fe3+)===22.4mol/L,溶液中的c(Fe3+)=1mol/L,不会生成沉淀;或pH=0.7时,c(Fe3+)=1mol/L,Qc=c(Fe3+)×c3(OH-)=1×(5×10-14)3
2.【答案】(1)第三周期VIA族
(2);防止有机酸进入锥形瓶,干扰测定 ;;使更易进入锥形瓶中与溶液反应;当滴定管尖嘴有液滴悬挂时,用锥形瓶瓶口内壁轻靠液体;锥形瓶中溶液由无色变为浅红色,且半分钟不褪色;0.128
3.【答案】(1)A;B;G;AD;锥形瓶内溶液颜色的变化;由无色变为粉红色且半分钟内不褪色;0.5500;偏高
(2)
4.【答案】(1)平衡压强,使浓盐酸顺利流下
(2)饱和食盐水;浓硫酸
(3)充满黄绿色气体;232~652℃
(4)在装置H、I之间连接一个放有湿润淀粉-KI试纸或湿润红色布条的试管
(5)×100%
5.【答案】(1)
(2)酸;c;b;a;f;e
(3)KSCN溶液;滴加最后半滴标准溶液,溶液变为红色且半分钟内不褪色
(4)A;C
(5);偏小
6.【答案】(1)坩埚
(2)溶液中的氯离子会与酸性高锰酸钾溶液反应,使紫红色褪去。
(3)
(4)A;C
(5)0.336
7.【答案】(1)球形冷凝管;
(2)A;B;C
(3)A
(4)C;AC;
8.【答案】(1)C
(2)[Fe(CO)2Cl2]遇氧气会反应,通入氩气隔绝氧气,起到保护作用
(3)
(4)浓氢氧化钠溶液;防倒吸
(5)b;d;e;BD
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
