2024年高中化学实验探究题特训:常见无机物及其应用(含答案)
文档属性
| 名称 | 2024年高中化学实验探究题特训:常见无机物及其应用(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 960.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 16:10:28 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024年高中化学实验探究题特训:常见无机物及其应用
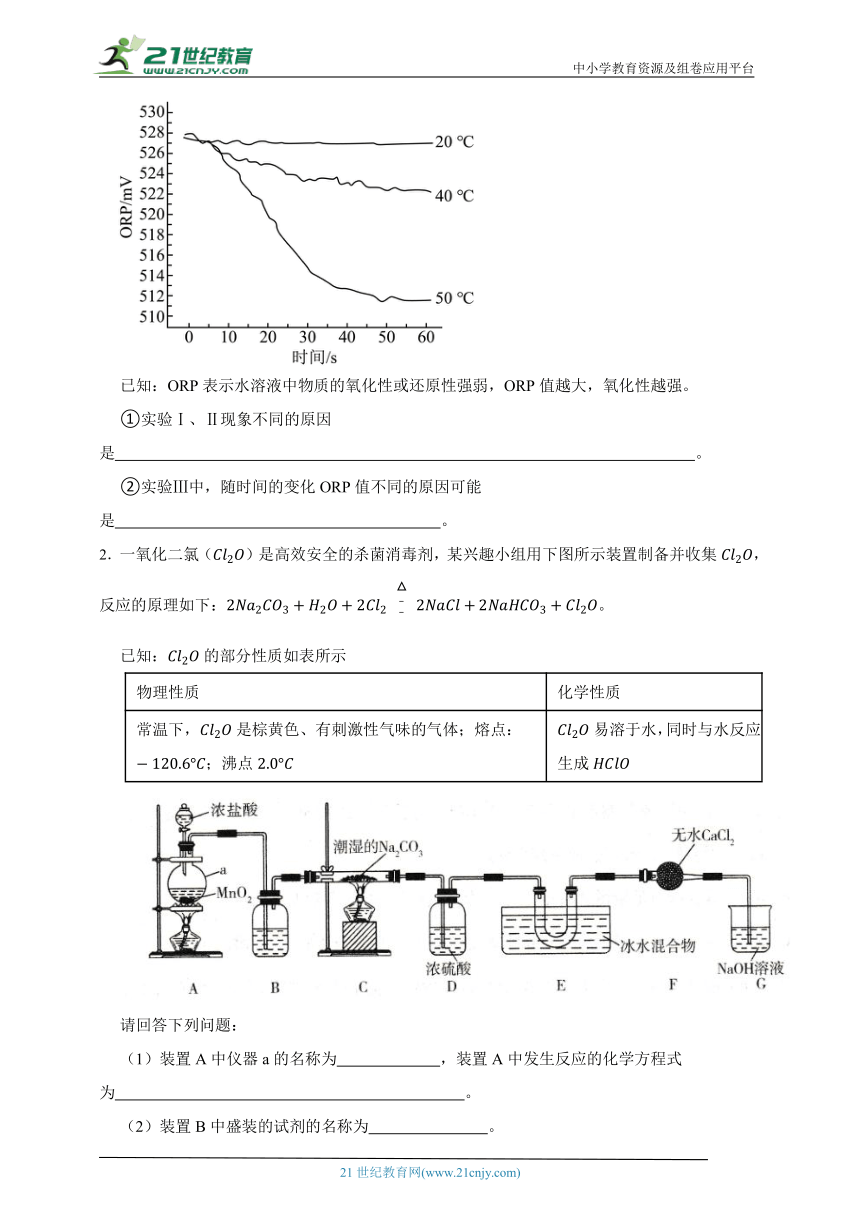
1.如图是实验室制备氯气并进行相关性质检验的装置,实验装置如图:
回答下列问题:
(1)①装置A中是用和浓盐酸反应制备,其化学方程式为 。
②B中加入饱和食盐水的目的 。
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出C发生堵塞时B中的现象 。
(3)设置装置C的实验目的是验证氯气是否具有漂白性,为此C中的Ⅰ、Ⅱ、Ⅲ依次应放入 (从下表a、b、c、d中选择)。
选项 a b c d
Ⅰ 干燥的有色布条 干燥的有色布条 湿润的有色布条 湿润的有色布条
Ⅱ 碱石灰 无水氯化钙 碱石灰 无水氯化钙
Ⅲ 湿润的有色布条 湿润的有色布条 干燥的有色布条 干燥的有色布条
(4)装置E的作用是 ,发生的离子方程式是 。
(5)某同学设计实验探究“84”消毒液(主要成分NaClO)的漂白性。
Ⅰ.在2mL“84”消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL“84”消毒液中加入2mL醋酸后,放入红色纸片,观察到纸片迅速褪色。
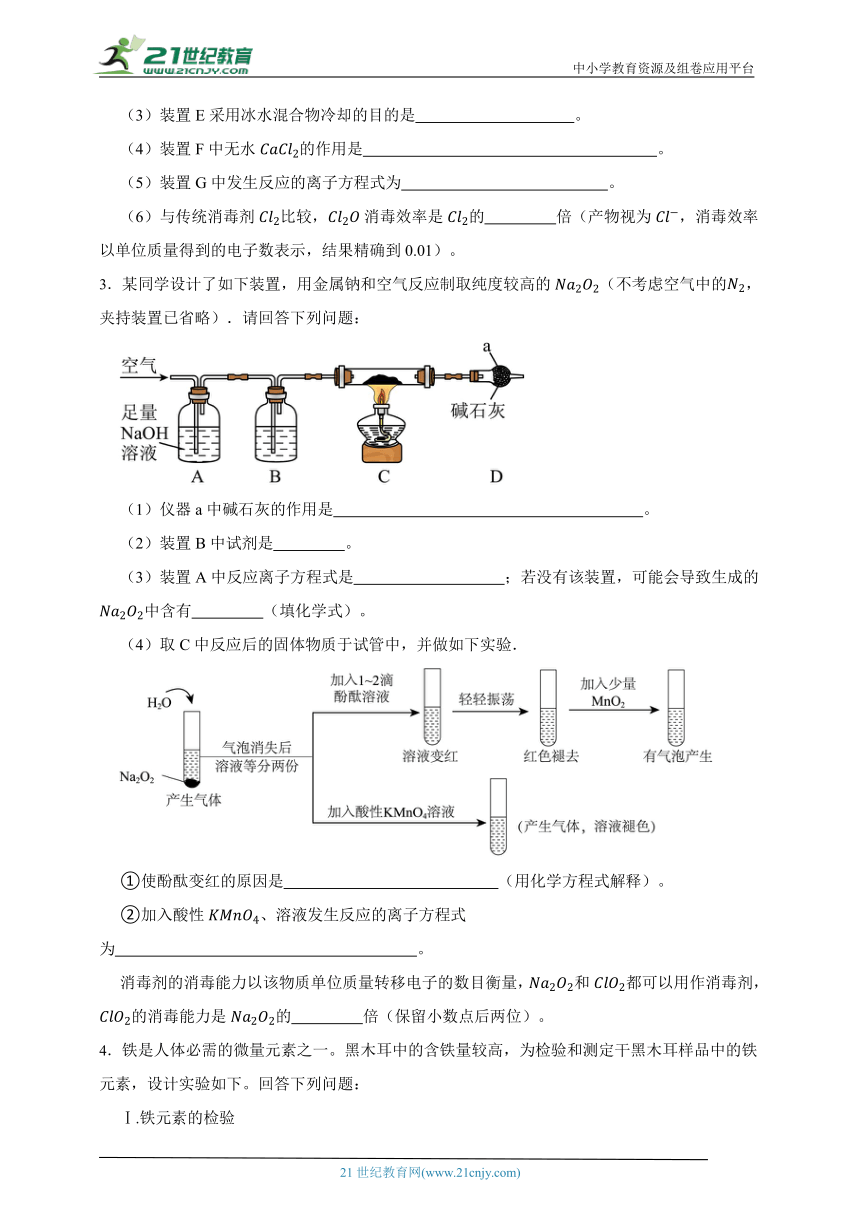
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化曲线如图所示。
已知:ORP表示水溶液中物质的氧化性或还原性强弱,ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是 。
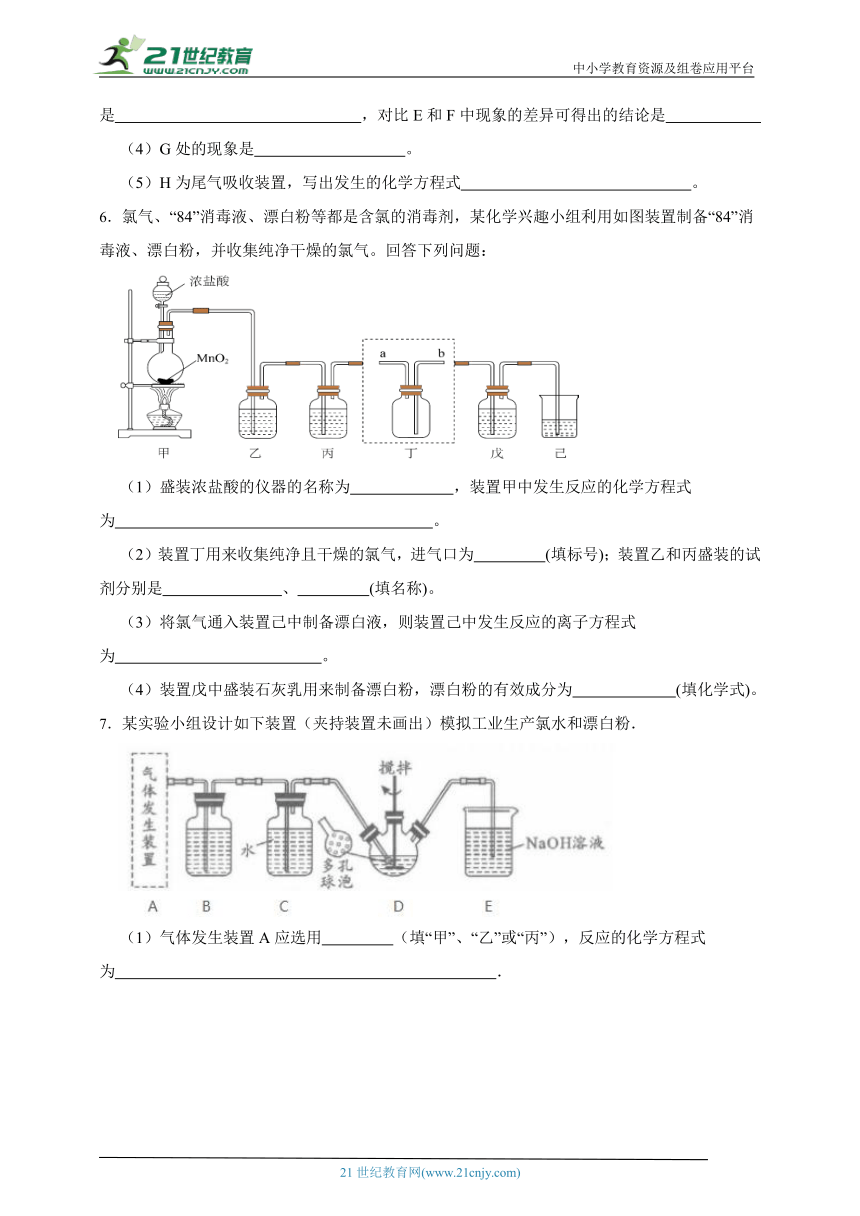
2.一氧化二氯()是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集,反应的原理如下:。
已知:的部分性质如表所示
物理性质 化学性质
常温下,是棕黄色、有刺激性气味的气体;熔点:;沸点 易溶于水,同时与水反应生成
请回答下列问题:
(1)装置A中仪器a的名称为 ,装置A中发生反应的化学方程式为 。
(2)装置B中盛装的试剂的名称为 。
(3)装置E采用冰水混合物冷却的目的是 。
(4)装置F中无水的作用是 。
(5)装置G中发生反应的离子方程式为 。
(6)与传统消毒剂比较,消毒效率是的 倍(产物视为,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
3.某同学设计了如下装置,用金属钠和空气反应制取纯度较高的(不考虑空气中的,夹持装置已省略).请回答下列问题:
(1)仪器a中碱石灰的作用是 。
(2)装置B中试剂是 。
(3)装置A中反应离子方程式是 ;若没有该装置,可能会导致生成的中含有 (填化学式)。
(4)取C中反应后的固体物质于试管中,并做如下实验.
①使酚酞变红的原因是 (用化学方程式解释)。
②加入酸性、溶液发生反应的离子方程式为 。
消毒剂的消毒能力以该物质单位质量转移电子的数目衡量,和都可以用作消毒剂,的消毒能力是的 倍(保留小数点后两位)。
4.铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
Ⅰ.铁元素的检验
(1)“操作”是指 。上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的 (填写仪器名称)。
(2)取待测液少许,滴加K3[Fe(CN)6]溶液,观察到有蓝色沉淀生成;另取待测液少许,滴加 (填化学式)溶液,观察到溶液变为红色,由此可得出结论 (填字母序号)。
a.黑木耳中一定含Fe2+和Fe3+
b.待测液中一定含Fe2+和Fe3+
(3)Ⅱ.铁元素含量的测定
利用KMnO4标准溶液测定干黑木耳样品中铁元素的含量
步骤Ⅰ:取10.00mL待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀H2SO4溶液,用0.0020mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4溶液2.20mL。
①用KMnO4标准溶液滴定至终点的标志是 。
②黑木耳中铁的含量为 mg/100g(即每100g黑木耳中含铁元素的质量)。
5.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
(1)仪器A的名称是 ,B中发生反应的离子方程式 。
(2)D装置的作用是 。
(3)E中为干燥的红色布条,F中为湿润的红色布条,可观察到的现象是 ,对比E和F中现象的差异可得出的结论是
(4)G处的现象是 。
(5)H为尾气吸收装置,写出发生的化学方程式 。
6.氯气、“84”消毒液、漂白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备“84”消毒液、漂白粉,并收集纯净干燥的氯气。回答下列问题:
(1)盛装浓盐酸的仪器的名称为 ,装置甲中发生反应的化学方程式为 。
(2)装置丁用来收集纯净且干燥的氯气,进气口为 (填标号);装置乙和丙盛装的试剂分别是 、 (填名称)。
(3)将氯气通入装置己中制备漂白液,则装置己中发生反应的离子方程式为 。
(4)装置戊中盛装石灰乳用来制备漂白粉,漂白粉的有效成分为 (填化学式)。
7.某实验小组设计如下装置(夹持装置未画出)模拟工业生产氯水和漂白粉.
(1)气体发生装置A应选用 (填“甲”、“乙”或“丙”),反应的化学方程式为 .
(2)装置B中试剂为 .
(3)制备氯水的装置是 (填字母序号).
(4)装置D用以制备漂白粉,三颈烧瓶中盛装冷的 (写试剂名称);采用多孔球泡而非常规导管导气的原因是 .
(5)探究新制氯水的性质:用胶头滴管将氯水滴加到含有酚酞的稀溶液中,当滴到一定量时,红色突然褪去.
①[提出猜想]红色褪去的原因可能有两种:
猜想Ⅰ:氯水具有漂白性;
猜想Ⅱ: .
②[验证猜想]向褪色后的溶液中滴加 ,若溶液变红,则证明猜想Ⅱ正确;反之则猜想Ⅰ正确.
8.亚氯酸钠()是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①的溶解度随温度升高而增大,适当条件下可结晶析出;
②纯易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)NaClO3起到了 剂的作用,空气的作用可能是 。
(2)吸收塔内发生反应的化学方程式为 ;吸收塔内的温度不能超过20℃,其目的是 ;
(3)溶液的物质的量浓度为 。
(4)从滤液中得到粗晶体的实验操作依次是____(选填序号)。
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤
E.冷却结晶
答案解析部分
1.【答案】(1);除去挥发的氯化氢气体
(2)B中液面降低,长颈漏斗中液面上升,形成水柱
(3)d
(4)吸收尾气,防止氯气污染空气;
(5)醋酸和次氯酸钠反应生成HClO,相同浓度时,HClO的氧化性强于次氯酸根离子;次氯酸在较高温度下分解变为盐酸和氧气
2.【答案】(1)圆底烧瓶;
(2)饱和食盐水
(3)冷凝,收集
(4)防止G中水蒸气进入E中与反应
(5)
(6)1.63
3.【答案】(1)防止空气中的水和进入装置中
(2)浓硫酸
(3);
(4);;2.89
4.【答案】(1)过滤;坩埚、100mL容量瓶
(2)KSCN;b
(3)当最后半滴酸性高锰酸钾溶液滴入锥形瓶时恰好出现浅红色,且半分钟内不褪色,说明达到终点;12.32
5.【答案】(1)分液漏斗;MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)干燥氯气(或除去氯气中的水蒸气)
(3)E中布条不褪色,F中布条褪色;氯气没有漂白性,次氯酸有漂白性
(4)棉花团变为蓝色
(5)Cl2+2NaOH=NaCl+NaClO+H2O
6.【答案】(1)分液漏斗;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)b;饱和食盐水;浓硫酸
(3)Cl2+2OH =ClO +Cl +H2O
(4)Ca(ClO)2
7.【答案】(1)乙;(浓)
(2)饱和食盐水
(3)装置C
(4)石灰乳;增大氯气与石灰乳的接触面积,提高氯气的吸收速率和利用率
(5)氯水显酸性,消耗;溶液
8.【答案】(1)氧化;稀释,以防爆炸
(2);防止分解
(3)4
(4)B;D;E
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高中化学实验探究题特训:常见无机物及其应用
1.如图是实验室制备氯气并进行相关性质检验的装置,实验装置如图:
回答下列问题:
(1)①装置A中是用和浓盐酸反应制备,其化学方程式为 。
②B中加入饱和食盐水的目的 。
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出C发生堵塞时B中的现象 。
(3)设置装置C的实验目的是验证氯气是否具有漂白性,为此C中的Ⅰ、Ⅱ、Ⅲ依次应放入 (从下表a、b、c、d中选择)。
选项 a b c d
Ⅰ 干燥的有色布条 干燥的有色布条 湿润的有色布条 湿润的有色布条
Ⅱ 碱石灰 无水氯化钙 碱石灰 无水氯化钙
Ⅲ 湿润的有色布条 湿润的有色布条 干燥的有色布条 干燥的有色布条
(4)装置E的作用是 ,发生的离子方程式是 。
(5)某同学设计实验探究“84”消毒液(主要成分NaClO)的漂白性。
Ⅰ.在2mL“84”消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL“84”消毒液中加入2mL醋酸后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化曲线如图所示。
已知:ORP表示水溶液中物质的氧化性或还原性强弱,ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是 。
2.一氧化二氯()是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集,反应的原理如下:。
已知:的部分性质如表所示
物理性质 化学性质
常温下,是棕黄色、有刺激性气味的气体;熔点:;沸点 易溶于水,同时与水反应生成
请回答下列问题:
(1)装置A中仪器a的名称为 ,装置A中发生反应的化学方程式为 。
(2)装置B中盛装的试剂的名称为 。
(3)装置E采用冰水混合物冷却的目的是 。
(4)装置F中无水的作用是 。
(5)装置G中发生反应的离子方程式为 。
(6)与传统消毒剂比较,消毒效率是的 倍(产物视为,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
3.某同学设计了如下装置,用金属钠和空气反应制取纯度较高的(不考虑空气中的,夹持装置已省略).请回答下列问题:
(1)仪器a中碱石灰的作用是 。
(2)装置B中试剂是 。
(3)装置A中反应离子方程式是 ;若没有该装置,可能会导致生成的中含有 (填化学式)。
(4)取C中反应后的固体物质于试管中,并做如下实验.
①使酚酞变红的原因是 (用化学方程式解释)。
②加入酸性、溶液发生反应的离子方程式为 。
消毒剂的消毒能力以该物质单位质量转移电子的数目衡量,和都可以用作消毒剂,的消毒能力是的 倍(保留小数点后两位)。
4.铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
Ⅰ.铁元素的检验
(1)“操作”是指 。上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的 (填写仪器名称)。
(2)取待测液少许,滴加K3[Fe(CN)6]溶液,观察到有蓝色沉淀生成;另取待测液少许,滴加 (填化学式)溶液,观察到溶液变为红色,由此可得出结论 (填字母序号)。
a.黑木耳中一定含Fe2+和Fe3+
b.待测液中一定含Fe2+和Fe3+
(3)Ⅱ.铁元素含量的测定
利用KMnO4标准溶液测定干黑木耳样品中铁元素的含量
步骤Ⅰ:取10.00mL待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀H2SO4溶液,用0.0020mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4溶液2.20mL。
①用KMnO4标准溶液滴定至终点的标志是 。
②黑木耳中铁的含量为 mg/100g(即每100g黑木耳中含铁元素的质量)。
5.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
(1)仪器A的名称是 ,B中发生反应的离子方程式 。
(2)D装置的作用是 。
(3)E中为干燥的红色布条,F中为湿润的红色布条,可观察到的现象是 ,对比E和F中现象的差异可得出的结论是
(4)G处的现象是 。
(5)H为尾气吸收装置,写出发生的化学方程式 。
6.氯气、“84”消毒液、漂白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备“84”消毒液、漂白粉,并收集纯净干燥的氯气。回答下列问题:
(1)盛装浓盐酸的仪器的名称为 ,装置甲中发生反应的化学方程式为 。
(2)装置丁用来收集纯净且干燥的氯气,进气口为 (填标号);装置乙和丙盛装的试剂分别是 、 (填名称)。
(3)将氯气通入装置己中制备漂白液,则装置己中发生反应的离子方程式为 。
(4)装置戊中盛装石灰乳用来制备漂白粉,漂白粉的有效成分为 (填化学式)。
7.某实验小组设计如下装置(夹持装置未画出)模拟工业生产氯水和漂白粉.
(1)气体发生装置A应选用 (填“甲”、“乙”或“丙”),反应的化学方程式为 .
(2)装置B中试剂为 .
(3)制备氯水的装置是 (填字母序号).
(4)装置D用以制备漂白粉,三颈烧瓶中盛装冷的 (写试剂名称);采用多孔球泡而非常规导管导气的原因是 .
(5)探究新制氯水的性质:用胶头滴管将氯水滴加到含有酚酞的稀溶液中,当滴到一定量时,红色突然褪去.
①[提出猜想]红色褪去的原因可能有两种:
猜想Ⅰ:氯水具有漂白性;
猜想Ⅱ: .
②[验证猜想]向褪色后的溶液中滴加 ,若溶液变红,则证明猜想Ⅱ正确;反之则猜想Ⅰ正确.
8.亚氯酸钠()是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①的溶解度随温度升高而增大,适当条件下可结晶析出;
②纯易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)NaClO3起到了 剂的作用,空气的作用可能是 。
(2)吸收塔内发生反应的化学方程式为 ;吸收塔内的温度不能超过20℃,其目的是 ;
(3)溶液的物质的量浓度为 。
(4)从滤液中得到粗晶体的实验操作依次是____(选填序号)。
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤
E.冷却结晶
答案解析部分
1.【答案】(1);除去挥发的氯化氢气体
(2)B中液面降低,长颈漏斗中液面上升,形成水柱
(3)d
(4)吸收尾气,防止氯气污染空气;
(5)醋酸和次氯酸钠反应生成HClO,相同浓度时,HClO的氧化性强于次氯酸根离子;次氯酸在较高温度下分解变为盐酸和氧气
2.【答案】(1)圆底烧瓶;
(2)饱和食盐水
(3)冷凝,收集
(4)防止G中水蒸气进入E中与反应
(5)
(6)1.63
3.【答案】(1)防止空气中的水和进入装置中
(2)浓硫酸
(3);
(4);;2.89
4.【答案】(1)过滤;坩埚、100mL容量瓶
(2)KSCN;b
(3)当最后半滴酸性高锰酸钾溶液滴入锥形瓶时恰好出现浅红色,且半分钟内不褪色,说明达到终点;12.32
5.【答案】(1)分液漏斗;MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)干燥氯气(或除去氯气中的水蒸气)
(3)E中布条不褪色,F中布条褪色;氯气没有漂白性,次氯酸有漂白性
(4)棉花团变为蓝色
(5)Cl2+2NaOH=NaCl+NaClO+H2O
6.【答案】(1)分液漏斗;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)b;饱和食盐水;浓硫酸
(3)Cl2+2OH =ClO +Cl +H2O
(4)Ca(ClO)2
7.【答案】(1)乙;(浓)
(2)饱和食盐水
(3)装置C
(4)石灰乳;增大氯气与石灰乳的接触面积,提高氯气的吸收速率和利用率
(5)氯水显酸性,消耗;溶液
8.【答案】(1)氧化;稀释,以防爆炸
(2);防止分解
(3)4
(4)B;D;E
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
