2024年高中化学实验探究题特训:有机化合物(含答案)
文档属性
| 名称 | 2024年高中化学实验探究题特训:有机化合物(含答案) | 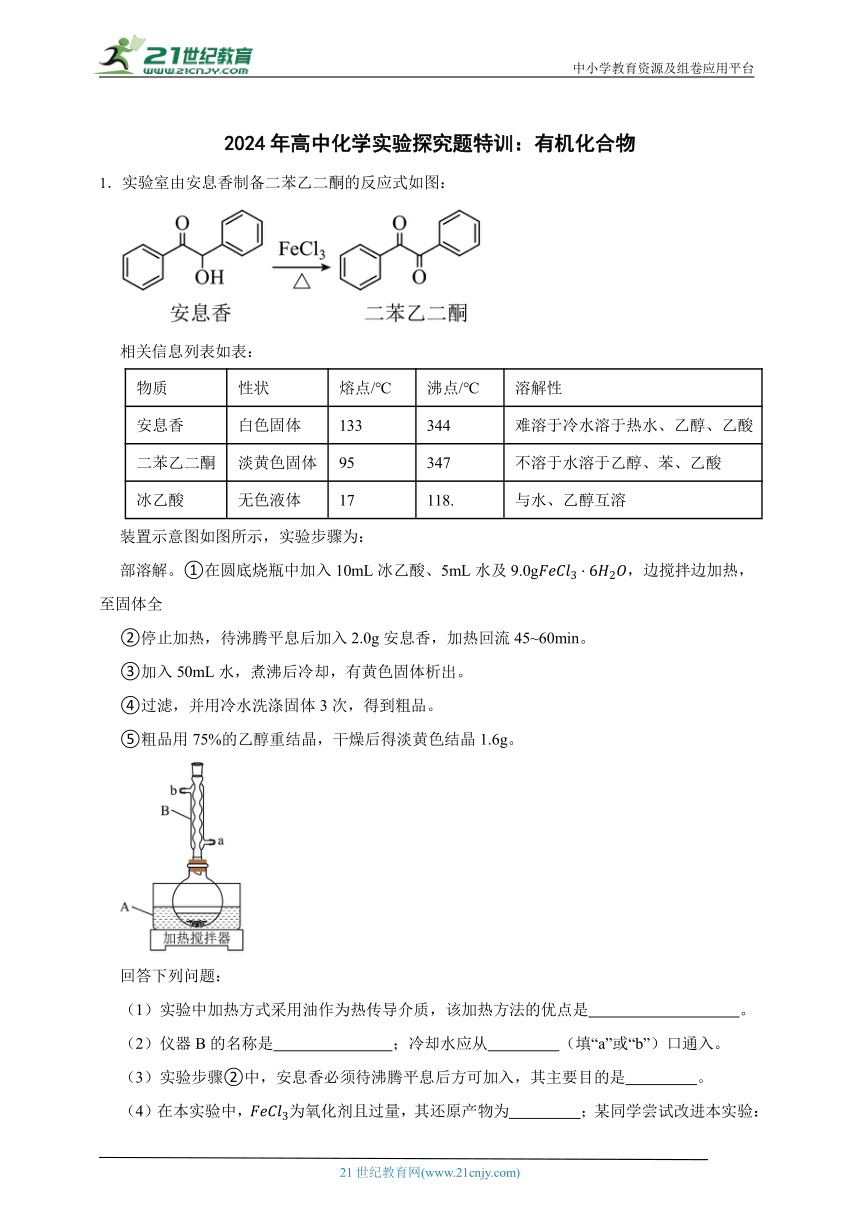 | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 16:11:08 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024年高中化学实验探究题特训:有机化合物
1.实验室由安息香制备二苯乙二酮的反应式如图:
相关信息列表如表:
物质 性状 熔点/℃ 沸点/℃ 溶解性
安息香 白色固体 133 344 难溶于冷水溶于热水、乙醇、乙酸
二苯乙二酮 淡黄色固体 95 347 不溶于水溶于乙醇、苯、乙酸
冰乙酸 无色液体 17 118. 与水、乙醇互溶
装置示意图如图所示,实验步骤为:
部溶解。①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g,边搅拌边加热,至固体全
②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。
回答下列问题:
(1)实验中加热方式采用油作为热传导介质,该加热方法的优点是 。
(2)仪器B的名称是 ;冷却水应从 (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是 。
(4)在本实验中,为氧化剂且过量,其还原产物为 ;某同学尝试改进本实验:采用催化量的并通入空气制备二苯乙二酮。该方案是否可行 (填“是”或“否”),简述判断理由 。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是 。
(6)若粗品中混有少量未氧化的安息香,可用少量 洗涤的方法除去 (填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水
b.乙酸
c.冷水
d.乙醇
(7)本实验的产率最接近于 (填标号)。
a.85%
b.80%
c.75%
d.70%
2.某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃、回答下列问题:
(1)仪器M的名称为 ,仪器A、B中的溶液均为 。
(2)甲、乙两套装置中效果比较好的装置是 ,原因是 。
(3)乙装置中冷凝水应该从 (填“a”或“b”)口进入。
(4)按甲图安装好仪器后,在反应管中加入配制的体积比为3∶2的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是 。
(5)乙醇需要过量一些的原因是 。
(6)某同学选用了CH3CH218OH、CH2=CH-COOH两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式: 。
(7)下列有关有机知识表述正确的是____(填字母)。
A.乙烯可以通过加成反应制得CH3CHCl2
B.等物质的量的甲烷和乙酸完全燃烧时所需O2的质量相同
C.乙酸乙酯中含有乙酸杂质,可加入一定量的乙醇和浓硫酸通过酯化反应除去
D.葡萄糖、麦芽糖均能与银氨溶液发生银镜反应
3.丁酸甲酯常用作香料,主要用于配制牛奶、干酪、苹果等型香精。实验室以丁酸和甲醇为原料制备丁酸甲酯的装置如图所示。
实验步骤:
Ⅰ.将丁酸和甲醇加入到三颈烧瓶中,再加入浓硫酸,混合均匀。
Ⅱ.加热三颈烧瓶,控制温度为,搅拌3—8h,充分反应。
Ⅲ.冷却,向混合液中加入溶液洗至中性。
Ⅳ.分液,取上层油状液体,加入无水固体,过滤后蒸馏,收集102~105℃馏分。
已知:几种物质的性质见下表
沸点 溶解性 性质
丁酸 163.5 与水互溶,易溶于有机溶剂 低毒
甲醇 64.7 与水互溶,易溶于有机溶剂 易挥发,有毒
丁酸甲酯 103 微溶于水,易溶于有机溶剂 易挥发
回答下列问题:
(1)制备丁酸甲酯发生反应的化学方程式为 ;丁酸甲酯的同分异构体中属于酯类的还有 种。
(2)仪器的作用是 ,仪器B的名称是
(3)步骤Ⅰ中加入浓硫酸的操作是 ;步骤Ⅱ中采用的加热方法是 。
(4)步骤Ⅲ中混合液用溶液洗涤的目的是 。
(5)步骤Ⅳ中加入无水固体的作用是 ;蒸馏用到的玻璃仪器主要有蒸馏烧瓶、酒棈灯、牛角管、锥形瓶、 、 。
4.呋喃甲醇和呋喃甲酸是重要的化工产品,实验室用呋喃甲醛在碱中发生歧化反应制备这两种物质的原理如下:
2+NaOH+
+HCl+NaCl
已知:呋喃甲醇、呋喃甲酸的沸点分别为171℃、232℃,乙醚的沸点为34.5℃。
实验步骤及装置如图所示(夹持、加热装置略)。
步骤1:向图1装置的三颈烧瓶中加适量40%的溶液,在搅拌下慢慢滴加呋喃甲醛,8~12℃保温半小时,得到淡黄色浆状物。
步骤2:在搅拌下,向三颈烧瓶中加入适量水至浆状物恰好完全溶解,此时溶液呈暗红色。
步骤3:用乙醚多次萃取,得到水溶液A和乙醚层。合并乙醚层得到液体B。
步骤4:水蒸气蒸馏液体B,分离乙醚和呋喃甲醇。
步骤5:向水溶液A中加入盐酸,调为2,充分冷却后析出晶体,抽滤得到呋喃甲酸粗品。
回答下列问题:
(1)仪器M的名称是 。
(2)步骤3通过萃取得到水溶液A和乙醚层使用的玻璃仪器是 (填名称)。
(3)用图2装置完成步骤4。导管1的主要作用是 。开始蒸馏出来的有机物是 (填名称),剩余液体采用蒸馏操作分离出呋喃甲醇、收集该馏分的温度控制在 ℃。
(4)探究呋喃甲醇的性质。设计简单实验检验呋喃甲醇中含有羟基: (简要写出实验步骤、现象和结论)。
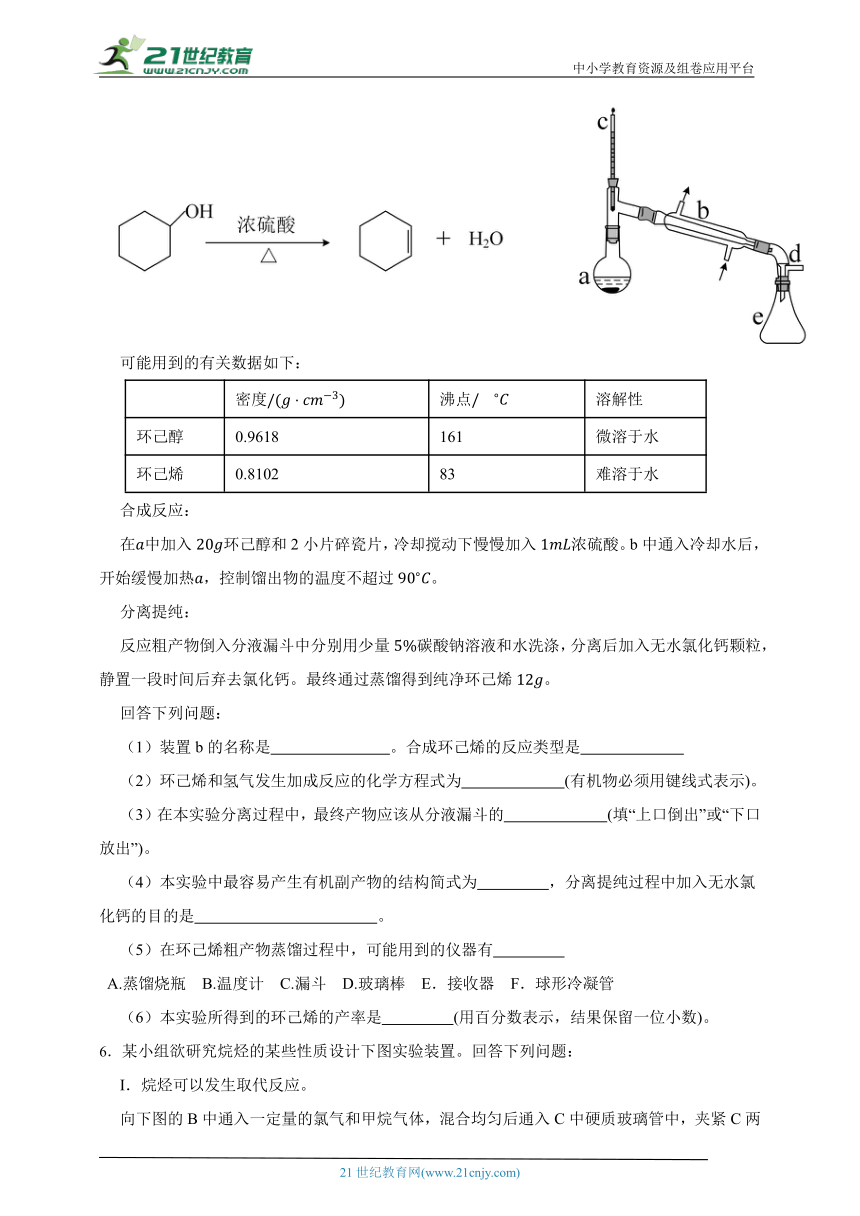
5.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
密度 沸点 溶解性
环己醇 0.9618 161 微溶于水
环己烯 0.8102 83 难溶于水
合成反应:
在中加入环己醇和2小片碎瓷片,冷却搅动下慢慢加入浓硫酸。b中通入冷却水后,开始缓慢加热,控制馏出物的温度不超过。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯。
回答下列问题:
(1)装置b的名称是 。合成环己烯的反应类型是
(2)环己烯和氢气发生加成反应的化学方程式为 (有机物必须用键线式表示)。
(3)在本实验分离过程中,最终产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(4)本实验中最容易产生有机副产物的结构简式为 ,分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有
A.蒸馏烧瓶 B.温度计 C.漏斗 D.玻璃棒 E.接收器 F.球形冷凝管
(6)本实验所得到的环己烯的产率是 (用百分数表示,结果保留一位小数)。
6.某小组欲研究烷烃的某些性质设计下图实验装置。回答下列问题:
Ⅰ.烷烃可以发生取代反应。
向下图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧C两端弹簧夹,用强光照射硬质玻璃管。
(1)将实验室制得的先通过饱和食盐水的目的是 。
(2)写出装置C中与反应生成氯仿的化学方程式 。
(3)一段时间后,C中玻璃管内的实验现象 、 。
(4)若2 mol 与发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是 mol。
(5)某丁烷与氯气发生反应的产物之一为,则分子式为的同分异构体有 种。
Ⅱ.烷烃可以发生氧化反应。
将一定量的某烷烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
实验前 实验后
实验前实验后(干燥剂+U形管)的质量 101.1g 102.9g
(石灰水+广口瓶)的质量 312.0g 315.3g
(6)试写出该烷烃分子式为 。
7.在炽热条件下,将石蜡油分解产生的乙烯通入下列各试管里,装置如图所示。
请回答下列问题:
(1)写出乙烯的电子式 ,C装置中溶液由紫色变为无色,C装置中发生反应的类型为 。
(2)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。预测:A装置中的现象是 ,B装置中的现象是 。
(3)写出A装置中发生反应的化学方程式 ,D装置的作用是 ,当观察到 时能验证D装置功能。
(4)做乙烯燃烧实验之前必须进行的操作是 ,最后燃烧可能观察到的现象是 。
(5)丙烯(CH2=CHCH3)与乙烯具有相似的化学性质。
①写出丙烯发生加聚反应的化学方程式 。
②在一定条件下丙烯与H2O(g)的加成产物可能为 (写结构简式)。
8.为验证甲烷的某些化学性质,实验室可用无水乙酸钠和碱石灰混合共热制甲烷,方程式如下:。已知甲烷可被CuO氧化,方程式如下:。实验所需装置如图甲所示(部分夹持仪器已略去),B中试剂为酸性高锰酸钾溶液。
(1)装置A应选择图乙中的 (填编号),仪器a的名称是 。
(2)B中的现象是 ,装置C中的试剂为 。
(3)装置E、F中的现象分别是 , 。
(4)装置K中发生反应的离子方程式为 。
(5)收集气体后对装置M中的混合气体进行光照,装置M中可观察到的现象为黄绿色变浅、 、有白雾产生、装置H中的导管内液面上升。生成一氯甲烷的化学方程式为 。
答案解析部分
1.【答案】(1)可以提供更高的加热温度,受热均匀,易于控制温度
(2)球形冷凝管;a
(3)防暴沸
(4);可行;空气可以将还原产物又氧化为,可循环参与反应
(5)抑制氯化铁水解
(6)a
(7)b
2.【答案】(1)蒸馏烧瓶;饱和碳酸钠溶液
(2)乙;乙的冷凝效果好,可减少丙烯酸乙酯的损失
(3)b
(4)漏加浓硫酸
(5)乙醇的沸点比丙烯酸低,易挥发而损耗
(6)CH2=CHCOOH+CH3CH218OHCH2=CHCO18OCH2CH3+H2O
(7)B;D
3.【答案】(1);8
(2)冷凝回流丁酸和甲;恒压滴液漏斗
(3)将浓硫酸沿烧杯内壁缓缓倒入三颈烧瓶中,并不断搅拌;水浴加热
(4)除去过量的酸、溶解未反应的醇、降低丁酸甲酯的溶解度
(5)除去有机层中的水;温度计;冷凝管
4.【答案】(1)球形冷凝管
(2)分液漏斗、烧杯
(3)安全管;乙醚;171
(4)①向烧杯中倒入少量呋喃甲醇,取较少的金属钠放于烧杯中,观察实验现象;②若能观察到钠的体积在减小,且有无色气体生成,则证明呋喃甲醇中含有羟基。
5.【答案】(1)直形冷凝管;消去反应
(2)+H2
(3)上口倒出
(4);干燥(或除水、除醇)
(5)ABEF
(6)73.2%
6.【答案】(1)降低氯气的溶解度,除去其中的氯化氢气体
(2)
(3)内壁上出现油状液滴;黄绿色气体变浅
(4)5
(5)4
(6)
7.【答案】(1);氧化反应
(2)红棕色褪去,液体不分层;橙黄色褪去,液体分层
(3)CH2=CH2+Br2→BrCH2CH2Br;检验乙烯的氧化产物为CO2;澄清石灰水变浑浊
(4)检验乙烯的纯度;产生明亮的火焰并伴有黑烟
(5)nCH3CH=CH2;CH3CH(OH)CH3、HOCH2CH2CH3
8.【答案】(1)①;圆底烧瓶
(2)溶液未褪色;浓硫酸
(3)无水硫酸铜变蓝色;澄清石灰水变浑浊
(4)MnO2+4H++2Cl—Mn2++Cl2↑+2H2O
(5)有油状液滴生成;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高中化学实验探究题特训:有机化合物
1.实验室由安息香制备二苯乙二酮的反应式如图:
相关信息列表如表:
物质 性状 熔点/℃ 沸点/℃ 溶解性
安息香 白色固体 133 344 难溶于冷水溶于热水、乙醇、乙酸
二苯乙二酮 淡黄色固体 95 347 不溶于水溶于乙醇、苯、乙酸
冰乙酸 无色液体 17 118. 与水、乙醇互溶
装置示意图如图所示,实验步骤为:
部溶解。①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g,边搅拌边加热,至固体全
②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。
回答下列问题:
(1)实验中加热方式采用油作为热传导介质,该加热方法的优点是 。
(2)仪器B的名称是 ;冷却水应从 (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是 。
(4)在本实验中,为氧化剂且过量,其还原产物为 ;某同学尝试改进本实验:采用催化量的并通入空气制备二苯乙二酮。该方案是否可行 (填“是”或“否”),简述判断理由 。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是 。
(6)若粗品中混有少量未氧化的安息香,可用少量 洗涤的方法除去 (填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水
b.乙酸
c.冷水
d.乙醇
(7)本实验的产率最接近于 (填标号)。
a.85%
b.80%
c.75%
d.70%
2.某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃、回答下列问题:
(1)仪器M的名称为 ,仪器A、B中的溶液均为 。
(2)甲、乙两套装置中效果比较好的装置是 ,原因是 。
(3)乙装置中冷凝水应该从 (填“a”或“b”)口进入。
(4)按甲图安装好仪器后,在反应管中加入配制的体积比为3∶2的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是 。
(5)乙醇需要过量一些的原因是 。
(6)某同学选用了CH3CH218OH、CH2=CH-COOH两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式: 。
(7)下列有关有机知识表述正确的是____(填字母)。
A.乙烯可以通过加成反应制得CH3CHCl2
B.等物质的量的甲烷和乙酸完全燃烧时所需O2的质量相同
C.乙酸乙酯中含有乙酸杂质,可加入一定量的乙醇和浓硫酸通过酯化反应除去
D.葡萄糖、麦芽糖均能与银氨溶液发生银镜反应
3.丁酸甲酯常用作香料,主要用于配制牛奶、干酪、苹果等型香精。实验室以丁酸和甲醇为原料制备丁酸甲酯的装置如图所示。
实验步骤:
Ⅰ.将丁酸和甲醇加入到三颈烧瓶中,再加入浓硫酸,混合均匀。
Ⅱ.加热三颈烧瓶,控制温度为,搅拌3—8h,充分反应。
Ⅲ.冷却,向混合液中加入溶液洗至中性。
Ⅳ.分液,取上层油状液体,加入无水固体,过滤后蒸馏,收集102~105℃馏分。
已知:几种物质的性质见下表
沸点 溶解性 性质
丁酸 163.5 与水互溶,易溶于有机溶剂 低毒
甲醇 64.7 与水互溶,易溶于有机溶剂 易挥发,有毒
丁酸甲酯 103 微溶于水,易溶于有机溶剂 易挥发
回答下列问题:
(1)制备丁酸甲酯发生反应的化学方程式为 ;丁酸甲酯的同分异构体中属于酯类的还有 种。
(2)仪器的作用是 ,仪器B的名称是
(3)步骤Ⅰ中加入浓硫酸的操作是 ;步骤Ⅱ中采用的加热方法是 。
(4)步骤Ⅲ中混合液用溶液洗涤的目的是 。
(5)步骤Ⅳ中加入无水固体的作用是 ;蒸馏用到的玻璃仪器主要有蒸馏烧瓶、酒棈灯、牛角管、锥形瓶、 、 。
4.呋喃甲醇和呋喃甲酸是重要的化工产品,实验室用呋喃甲醛在碱中发生歧化反应制备这两种物质的原理如下:
2+NaOH+
+HCl+NaCl
已知:呋喃甲醇、呋喃甲酸的沸点分别为171℃、232℃,乙醚的沸点为34.5℃。
实验步骤及装置如图所示(夹持、加热装置略)。
步骤1:向图1装置的三颈烧瓶中加适量40%的溶液,在搅拌下慢慢滴加呋喃甲醛,8~12℃保温半小时,得到淡黄色浆状物。
步骤2:在搅拌下,向三颈烧瓶中加入适量水至浆状物恰好完全溶解,此时溶液呈暗红色。
步骤3:用乙醚多次萃取,得到水溶液A和乙醚层。合并乙醚层得到液体B。
步骤4:水蒸气蒸馏液体B,分离乙醚和呋喃甲醇。
步骤5:向水溶液A中加入盐酸,调为2,充分冷却后析出晶体,抽滤得到呋喃甲酸粗品。
回答下列问题:
(1)仪器M的名称是 。
(2)步骤3通过萃取得到水溶液A和乙醚层使用的玻璃仪器是 (填名称)。
(3)用图2装置完成步骤4。导管1的主要作用是 。开始蒸馏出来的有机物是 (填名称),剩余液体采用蒸馏操作分离出呋喃甲醇、收集该馏分的温度控制在 ℃。
(4)探究呋喃甲醇的性质。设计简单实验检验呋喃甲醇中含有羟基: (简要写出实验步骤、现象和结论)。
5.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
密度 沸点 溶解性
环己醇 0.9618 161 微溶于水
环己烯 0.8102 83 难溶于水
合成反应:
在中加入环己醇和2小片碎瓷片,冷却搅动下慢慢加入浓硫酸。b中通入冷却水后,开始缓慢加热,控制馏出物的温度不超过。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯。
回答下列问题:
(1)装置b的名称是 。合成环己烯的反应类型是
(2)环己烯和氢气发生加成反应的化学方程式为 (有机物必须用键线式表示)。
(3)在本实验分离过程中,最终产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(4)本实验中最容易产生有机副产物的结构简式为 ,分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有
A.蒸馏烧瓶 B.温度计 C.漏斗 D.玻璃棒 E.接收器 F.球形冷凝管
(6)本实验所得到的环己烯的产率是 (用百分数表示,结果保留一位小数)。
6.某小组欲研究烷烃的某些性质设计下图实验装置。回答下列问题:
Ⅰ.烷烃可以发生取代反应。
向下图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧C两端弹簧夹,用强光照射硬质玻璃管。
(1)将实验室制得的先通过饱和食盐水的目的是 。
(2)写出装置C中与反应生成氯仿的化学方程式 。
(3)一段时间后,C中玻璃管内的实验现象 、 。
(4)若2 mol 与发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是 mol。
(5)某丁烷与氯气发生反应的产物之一为,则分子式为的同分异构体有 种。
Ⅱ.烷烃可以发生氧化反应。
将一定量的某烷烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
实验前 实验后
实验前实验后(干燥剂+U形管)的质量 101.1g 102.9g
(石灰水+广口瓶)的质量 312.0g 315.3g
(6)试写出该烷烃分子式为 。
7.在炽热条件下,将石蜡油分解产生的乙烯通入下列各试管里,装置如图所示。
请回答下列问题:
(1)写出乙烯的电子式 ,C装置中溶液由紫色变为无色,C装置中发生反应的类型为 。
(2)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。预测:A装置中的现象是 ,B装置中的现象是 。
(3)写出A装置中发生反应的化学方程式 ,D装置的作用是 ,当观察到 时能验证D装置功能。
(4)做乙烯燃烧实验之前必须进行的操作是 ,最后燃烧可能观察到的现象是 。
(5)丙烯(CH2=CHCH3)与乙烯具有相似的化学性质。
①写出丙烯发生加聚反应的化学方程式 。
②在一定条件下丙烯与H2O(g)的加成产物可能为 (写结构简式)。
8.为验证甲烷的某些化学性质,实验室可用无水乙酸钠和碱石灰混合共热制甲烷,方程式如下:。已知甲烷可被CuO氧化,方程式如下:。实验所需装置如图甲所示(部分夹持仪器已略去),B中试剂为酸性高锰酸钾溶液。
(1)装置A应选择图乙中的 (填编号),仪器a的名称是 。
(2)B中的现象是 ,装置C中的试剂为 。
(3)装置E、F中的现象分别是 , 。
(4)装置K中发生反应的离子方程式为 。
(5)收集气体后对装置M中的混合气体进行光照,装置M中可观察到的现象为黄绿色变浅、 、有白雾产生、装置H中的导管内液面上升。生成一氯甲烷的化学方程式为 。
答案解析部分
1.【答案】(1)可以提供更高的加热温度,受热均匀,易于控制温度
(2)球形冷凝管;a
(3)防暴沸
(4);可行;空气可以将还原产物又氧化为,可循环参与反应
(5)抑制氯化铁水解
(6)a
(7)b
2.【答案】(1)蒸馏烧瓶;饱和碳酸钠溶液
(2)乙;乙的冷凝效果好,可减少丙烯酸乙酯的损失
(3)b
(4)漏加浓硫酸
(5)乙醇的沸点比丙烯酸低,易挥发而损耗
(6)CH2=CHCOOH+CH3CH218OHCH2=CHCO18OCH2CH3+H2O
(7)B;D
3.【答案】(1);8
(2)冷凝回流丁酸和甲;恒压滴液漏斗
(3)将浓硫酸沿烧杯内壁缓缓倒入三颈烧瓶中,并不断搅拌;水浴加热
(4)除去过量的酸、溶解未反应的醇、降低丁酸甲酯的溶解度
(5)除去有机层中的水;温度计;冷凝管
4.【答案】(1)球形冷凝管
(2)分液漏斗、烧杯
(3)安全管;乙醚;171
(4)①向烧杯中倒入少量呋喃甲醇,取较少的金属钠放于烧杯中,观察实验现象;②若能观察到钠的体积在减小,且有无色气体生成,则证明呋喃甲醇中含有羟基。
5.【答案】(1)直形冷凝管;消去反应
(2)+H2
(3)上口倒出
(4);干燥(或除水、除醇)
(5)ABEF
(6)73.2%
6.【答案】(1)降低氯气的溶解度,除去其中的氯化氢气体
(2)
(3)内壁上出现油状液滴;黄绿色气体变浅
(4)5
(5)4
(6)
7.【答案】(1);氧化反应
(2)红棕色褪去,液体不分层;橙黄色褪去,液体分层
(3)CH2=CH2+Br2→BrCH2CH2Br;检验乙烯的氧化产物为CO2;澄清石灰水变浑浊
(4)检验乙烯的纯度;产生明亮的火焰并伴有黑烟
(5)nCH3CH=CH2;CH3CH(OH)CH3、HOCH2CH2CH3
8.【答案】(1)①;圆底烧瓶
(2)溶液未褪色;浓硫酸
(3)无水硫酸铜变蓝色;澄清石灰水变浑浊
(4)MnO2+4H++2Cl—Mn2++Cl2↑+2H2O
(5)有油状液滴生成;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
