2024年高中化学实验探究题特训:化学反应速率与化学平衡(含答案)
文档属性
| 名称 | 2024年高中化学实验探究题特训:化学反应速率与化学平衡(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 458.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 16:11:26 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024年高中化学实验探究题特训:化学反应速率与化学平衡
1.某实验小组探究Cu与Fe(NO3)3溶液的反应。取3 g 铜粉加入到100 mL 0.6 mol/L Fe(NO3)3溶液(用HNO3调pH=1)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
(1)预测NO3-和Fe3+分别与Cu发生了反应,补充反应Ⅱ的离子方程式。
反应 Ⅰ 3Cu + 2NO + 8H+= 3Cu2+ + 2NO↑ + 4H2O
反应 Ⅱ 。
(2)探究反应Ⅰ是否发生
①设计实验:取3 g 铜粉加入到100 mL 溶液中,振荡、静置30分钟。
②若反应 Ⅰ能够发生,预计观察到的现象有 。
实际现象不明显,借助传感器证明反应Ⅰ能够发生。
(3)探究反应Ⅱ是否发生
步骤1:取3 g 铜粉加入到100 mL 0.3 mol/L Fe2(SO4)3溶液(用H2SO4调pH=1)中,溶液迅速变为蓝绿色。
步骤2:取步骤1中上层清液,滴加少量KSCN溶液,出现白色浑浊,溶液变红,振荡后红色褪去。
①KSCN溶液的作用是 。
②已知,CuSCN是难溶于水的白色固体。结合平衡移动原理,解释步骤2中“溶液变红,振荡后红色褪去”的原因 。
(4)查阅资料可知,反应 Ⅰ和反应Ⅱ 的平衡常数分别为KⅠ=6.3×1062 和KⅡ=5×1014。请从化学反应速率和限度的角度简述对Cu与Fe(NO3)3溶液反应的认识 。
2.某化学兴趣小组想要研究氯化铜溶液的相关性质,但实验室无氯化铜样品,大家想出两种制备方案并完成有关性质实验:
【方案一】
用固体CuO(含少量Fe2O3)和盐酸反应:将固体CuO缓慢加入到盛有稀盐酸的烧杯中,边加边搅拌,直至固体完全溶解,得溶液A。
【方案二】
用铜和石墨作电极,电解稀盐酸:将两个电极和直流电源相连,插入到盛有稀盐酸的烧杯中,电解一段时间后,得溶液B。
已知:①氧化性:Fe3+>Cu2+;
②CuCl是一种白色不溶于水的固体;
③在该实验环境下,有关参数如下表:
物质 Fe(OH)3 Cu(OH)2
Ksp 2.8×10 39 2.2×10 20
阳离子完全沉淀时的pH ≥2.8 ≥6.5
回答下列问题:
(1)方案一中,为了制备不含铁元素的CuCl2溶液,有同学提议在溶液A中加入过量的铜,充分反应后过滤,该方法 (填“能”或“不能”)达到目的,理由是 (结合方程式解释)。也有同学提议用调整溶液pH的方法来除去Fe3+,假设Cu2+起始浓度为2.2mol·L 1,则在不损失铜元素的情况下,调整溶液pH的范围为 。
(2)方案二中,Cu电极应该与电源的 (填“正”或“负”)极相连,其电解的总反应方程式为 。实验过程中,有同学观察到阳极周围有气泡出现,则出现气泡最可能的原因是 。
(3)若将方案二中的稀盐酸换作饱和食盐水,发现电解过程中未有蓝绿色溶液出现,但在其中一个电极附近出现了白色固体,则生成该固体的电极反应式为 。
(4)取少量方案二中B的稀溶液于试管,在酒精灯上加热,发现溶液由蓝色变为蓝绿色,其原因是 (用平衡移动原理解释)。
(5)取纯化的A的稀溶液20mL于烧杯中,加入2gKCl固体,用玻璃棒搅拌,发现溶液由蓝色变为蓝绿色, (填“能”或“不能”)用勒夏特列原理解释该现象。
3.2021年我国制氢量位居世界第一,煤气化制氢途径的原理如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)
(2)一定温度下,向体积固定的密闭容器中加入足量的和,起始压强为,发生煤气化制氢反应.
①反应Ⅰ的平衡常数表达式 .
②平衡时向容器中充入情性气体,平衡 移动(填“正向”“逆向”或“不”,下同),加入固体,平衡 移动.
③下列能说明反应Ⅰ到达平衡状态的是 .
A.混合气体的密度保持不变 B.容器内的压强保持不变
C.的体积保持不变 D.断裂的同时,生成键
(3)常温下,保持压强为不变,向密闭容器中加入足量的和,反应达平衡时,物质的量为的物质的量为;反应Ⅱ的平衡常数 (以分压表示,分压=总压×物质的量分数)
(4)时,潮湿的石膏雕像表面会发生反应:,其平衡常数 .[已知]
4.弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则pH=13的MOH溶液的浓度 0.1mol/L(填“<”、“>”或“=”)。
(3)25℃时,三种酸的电离平衡常数如下:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka =1.8×10-5 3.0×10-8
回答下列问题:
①25℃时,等浓度的三种溶液,酸性最强的是 (填化学式),一般情况下,当温度升高时, (填“增大”、“减小”或“不变”);
②用蒸馏水稀释的醋酸,下列各式表示的数值随水量的增加而增大的是 (填序号)。
A. B. C. D.
③室温下,某溶液中存在着 CH3COOH(aq)+ (aq)CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K= 。(用Ka、K1或K2表示)
5.某实验小组探究外界条件对化学反应速率的影响,进行了以下实验。
(1)Ⅰ.探究温度、浓度对硫代硫酸钠与稀硫酸反应速率的影响
写出Na2S2O3与H2SO4反应的离子方程式
(2)该小组同学设计了如下表所示系列实验:
实验序号 反应温度/℃ Na2S2O3溶液 H2SO4稀溶液 H2O
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
① 20 10.0 0.10 10.0 0.50 0
② t1 V1 0.10 V2 0.50 V3
③ t2 V4 0.10 V5 0.50 V6
实验①和②探究温度对该反应速率的影响,则实验②中,t1= (填“20℃”或“60℃”)、V2= mL。
若V5=6.0,实验①和③的实验目的是
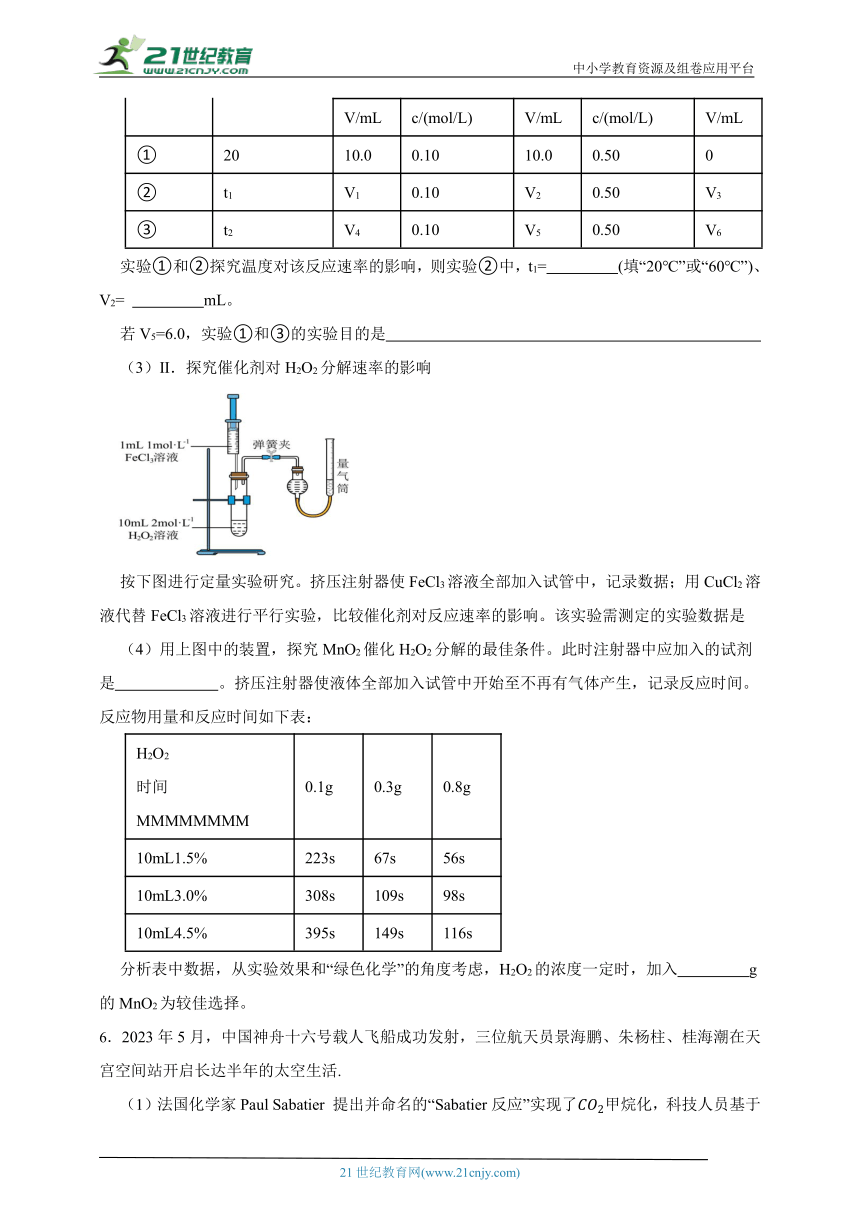
(3)Ⅱ.探究催化剂对H2O2分解速率的影响
按下图进行定量实验研究。挤压注射器使FeCl3溶液全部加入试管中,记录数据;用CuCl2溶液代替FeCl3溶液进行平行实验,比较催化剂对反应速率的影响。该实验需测定的实验数据是
(4)用上图中的装置,探究MnO2催化H2O2分解的最佳条件。此时注射器中应加入的试剂是 。挤压注射器使液体全部加入试管中开始至不再有气体产生,记录反应时间。反应物用量和反应时间如下表:
H2O2 时间 MMMMMMMM 0.1g 0.3g 0.8g
10mL1.5% 223s 67s 56s
10mL3.0% 308s 109s 98s
10mL4.5% 395s 149s 116s
分析表中数据,从实验效果和“绿色化学”的角度考虑,H2O2的浓度一定时,加入 g的MnO2为较佳选择。
6.2023年5月,中国神舟十六号载人飞船成功发射,三位航天员景海鹏、朱杨柱、桂海潮在天宫空间站开启长达半年的太空生活.
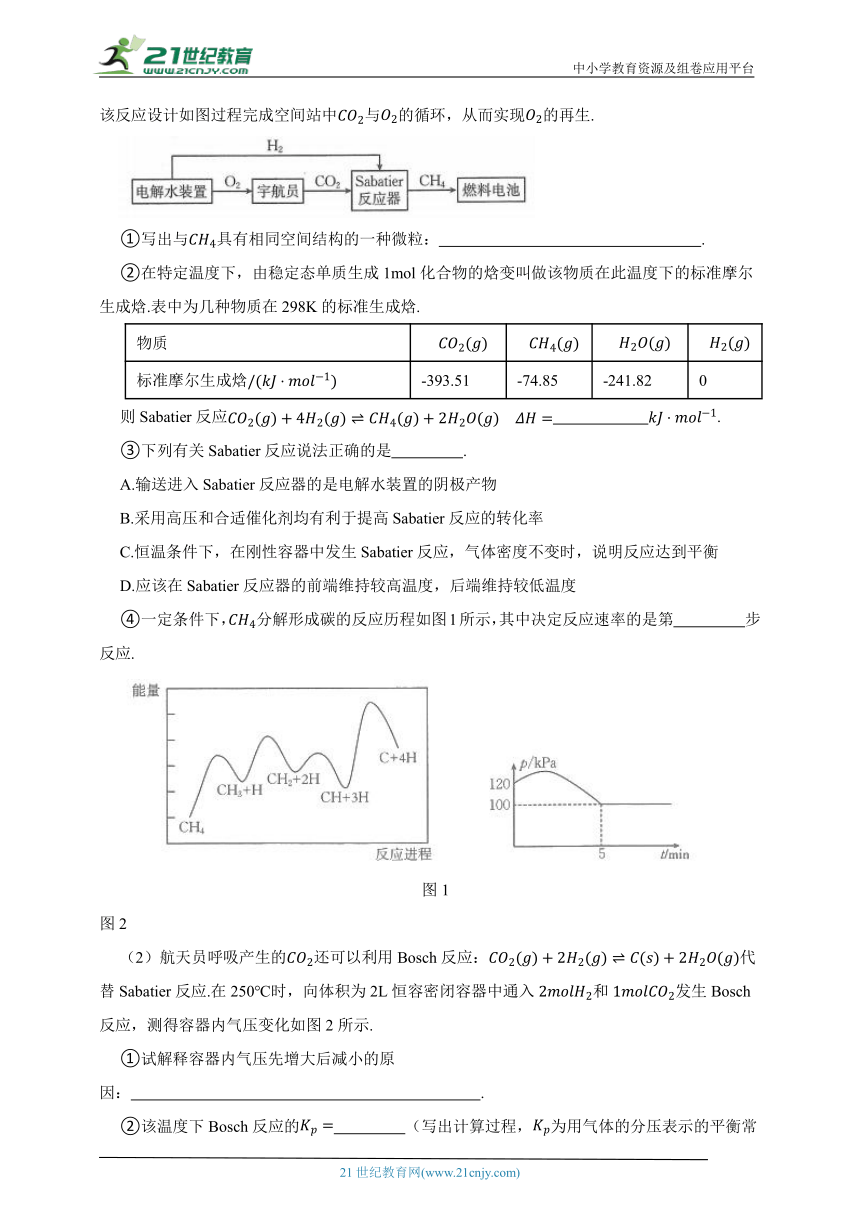
(1)法国化学家Paul Sabatier 提出并命名的“Sabatier反应”实现了甲烷化,科技人员基于该反应设计如图过程完成空间站中与的循环,从而实现的再生.
①写出与具有相同空间结构的一种微粒: .
②在特定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓.表中为几种物质在298K的标准生成焓.
物质
标准摩尔生成焓 -393.51 -74.85 -241.82 0
则Sabatier反应 .
③下列有关Sabatier反应说法正确的是 .
A.输送进入Sabatier反应器的是电解水装置的阴极产物
B.采用高压和合适催化剂均有利于提高Sabatier反应的转化率
C.恒温条件下,在刚性容器中发生Sabatier反应,气体密度不变时,说明反应达到平衡
D.应该在Sabatier反应器的前端维持较高温度,后端维持较低温度
④一定条件下,分解形成碳的反应历程如图1所示,其中决定反应速率的是第 步反应.
图1 图2
(2)航天员呼吸产生的还可以利用Bosch反应:代替Sabatier反应.在250℃时,向体积为2L恒容密闭容器中通入和发生Bosch反应,测得容器内气压变化如图2所示.
①试解释容器内气压先增大后减小的原因: .
②该温度下Bosch反应的 (写出计算过程,为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压).
③在图2基础上画出其他条件相同,向体系加入催化剂时其压强随时间的变化曲线 .
7.已知碘的四氯化碳溶液能与K2C2O4溶液发生反应:I2+K2C2O4=2KI+2CO2↑,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成CO2气体的体积来比较化学反应速率的大小,实验装置如图1所示。
实验Ⅰ.在光亮处将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
实验Ⅱ.用黑纸袋包住锥形瓶后再将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
两次实验所用M溶液与N溶液相同。
①检查图1装置气密性的方法为 。
②盛装M溶液的仪器名称为 ,a的作用是 。
③该实验探究的是 对化学反应速率的影响。
④在反应停止前,相同时间内注射器中所得CO2的体积较多的是 (填“实验Ⅰ”或“实验Ⅱ”)。
(2)乙组:通过测定溶液褪色所用时间来比较化学反应速率的大小,实验装置如图2所示。
实验时将M溶液和N溶液同时加入三颈烧瓶中,并不断搅拌,M、N的成分以及水浴温度如下表:
序号 M溶液 N溶液 水浴温度
A 含0.01mol碘的四氯化碳溶液20mL 20mL0.4 mol·L-1的K2C2O4溶液 40℃
B 含0.01mol碘的四氯化碳溶液20mL 20mL0.8 mol·L-1K2C2O4溶液 40℃
C 含0.01mol碘的四氯化碳溶液20mL 20mL0.8 mol·L-1的K2C2O4溶液 50℃
①该实验探究的是 对化学反应速率的影响。
②该组同学始终没有观察到实验A的溶液褪色,其原因是 。
8.草酸是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性溶液发生反应:.
(1)探究外界条件对反应速率的影响.
实验编号 所加试剂及用量/mL 条件 溶液颜色褪至无色所需时间/min
溶液 溶液 稀 水 温度℃
1 12.0 2.0 3.0 3.0 20
2 6.0 2.0 3.0 20
3 2.0 3.0 9.0 30
①完成此实验设计,其中: , .
②对比实验1、2可探究 对反应速率的影响.
(2)某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度.
根据消耗酸性标准溶液的体积即可测定硬水样品中的浓度.
①实验过程提及的下列仪器,在使用之前一定要润洗的是 (填字母).
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中 (填“需要”或“不需要”)另加指示剂,如何判断滴定终点 .
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的标准溶液为 .该硬水样品中的浓度为 .
④下列不当操作会使测得的硬水样品的浓度偏高的是 (填字母)
A.滴定管未用标准溶液润洗 B.草酸钙沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
答案解析部分
1.【答案】(1)Cu + 2Fe3+ = Cu2+ + 2Fe2+
(2)1.8 mol/L NaNO3溶液(用HNO3调pH=1);铜粉逐渐溶解,溶液变为蓝色,有无色气体生成,在液面上方变为红棕色
(3)检验Fe3+;加入SCN 后,Fe3+与SCN-反应,生成Fe(SCN)3溶液显红色。震荡过程中Cu+与SCN 反应生成CuSCN沉淀,使SCN 浓度减小,Fe3++3SCN- Fe(SCN)3逆向移动,溶液红色褪去。
(4)Cu与Fe3+和NO3-(H+)均能发生反应,其中Cu与NO3-(H+)反应限度更大,Cu与Fe3+反应速率更快。
2.【答案】(1)不能;2Fe3++Cu=2Fe2++Cu2+,铁的金属性比铜强,Fe2+不再与Cu反应;2.8≤pH<4(或2.8≤pH≤4)
(2)正;Cu+2HClCuCl2+H2↑;溶液中的氯离子在阳极上放电,生成了氯气
(3)Cu-e +Cl =CuCl
(4)反应[Cu(H2O)4]2++4Cl [CuCl4]2 +4H2O正向吸热,升温,平衡正向移动
(5)能
3.【答案】(1)
(2);不;不;ABC
(3)2
(4)
4.【答案】(1)Al3++3H2O Al(OH)3(胶体)+3H+
(2)>
(3)CH3COOH;增大;B;
5.【答案】(1)
(2)60℃;10.0;其它条件不变时, 探究H2SO4浓度对该反应速率的影响
(3)一定时间内产生气体的体积(或生成相同体积的气体所需要的时间)
(4)H2O2溶液;0.3
6.【答案】(1)、等答案合理即可;-164.98;AD;4或四
(2)该反应是放热反应,反应开始时容器内温度上升,压强增大,随着反应进行,反应气体分子体减少,压强减小;0.5;
7.【答案】(1)关闭分液漏斗活塞,向外拉注射器活塞,松开后,若活塞能回到原位置,则装置气密性良好;分液漏斗;平衡气压,减少误差;光照;实验Ⅰ
(2)反应温度和反应物浓度;碘单质过量了
8.【答案】(1)9.0;6.0;浓度
(2)D;不需要;当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫色,半分钟不变为原来颜色;9.60;;AB
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高中化学实验探究题特训:化学反应速率与化学平衡
1.某实验小组探究Cu与Fe(NO3)3溶液的反应。取3 g 铜粉加入到100 mL 0.6 mol/L Fe(NO3)3溶液(用HNO3调pH=1)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
(1)预测NO3-和Fe3+分别与Cu发生了反应,补充反应Ⅱ的离子方程式。
反应 Ⅰ 3Cu + 2NO + 8H+= 3Cu2+ + 2NO↑ + 4H2O
反应 Ⅱ 。
(2)探究反应Ⅰ是否发生
①设计实验:取3 g 铜粉加入到100 mL 溶液中,振荡、静置30分钟。
②若反应 Ⅰ能够发生,预计观察到的现象有 。
实际现象不明显,借助传感器证明反应Ⅰ能够发生。
(3)探究反应Ⅱ是否发生
步骤1:取3 g 铜粉加入到100 mL 0.3 mol/L Fe2(SO4)3溶液(用H2SO4调pH=1)中,溶液迅速变为蓝绿色。
步骤2:取步骤1中上层清液,滴加少量KSCN溶液,出现白色浑浊,溶液变红,振荡后红色褪去。
①KSCN溶液的作用是 。
②已知,CuSCN是难溶于水的白色固体。结合平衡移动原理,解释步骤2中“溶液变红,振荡后红色褪去”的原因 。
(4)查阅资料可知,反应 Ⅰ和反应Ⅱ 的平衡常数分别为KⅠ=6.3×1062 和KⅡ=5×1014。请从化学反应速率和限度的角度简述对Cu与Fe(NO3)3溶液反应的认识 。
2.某化学兴趣小组想要研究氯化铜溶液的相关性质,但实验室无氯化铜样品,大家想出两种制备方案并完成有关性质实验:
【方案一】
用固体CuO(含少量Fe2O3)和盐酸反应:将固体CuO缓慢加入到盛有稀盐酸的烧杯中,边加边搅拌,直至固体完全溶解,得溶液A。
【方案二】
用铜和石墨作电极,电解稀盐酸:将两个电极和直流电源相连,插入到盛有稀盐酸的烧杯中,电解一段时间后,得溶液B。
已知:①氧化性:Fe3+>Cu2+;
②CuCl是一种白色不溶于水的固体;
③在该实验环境下,有关参数如下表:
物质 Fe(OH)3 Cu(OH)2
Ksp 2.8×10 39 2.2×10 20
阳离子完全沉淀时的pH ≥2.8 ≥6.5
回答下列问题:
(1)方案一中,为了制备不含铁元素的CuCl2溶液,有同学提议在溶液A中加入过量的铜,充分反应后过滤,该方法 (填“能”或“不能”)达到目的,理由是 (结合方程式解释)。也有同学提议用调整溶液pH的方法来除去Fe3+,假设Cu2+起始浓度为2.2mol·L 1,则在不损失铜元素的情况下,调整溶液pH的范围为 。
(2)方案二中,Cu电极应该与电源的 (填“正”或“负”)极相连,其电解的总反应方程式为 。实验过程中,有同学观察到阳极周围有气泡出现,则出现气泡最可能的原因是 。
(3)若将方案二中的稀盐酸换作饱和食盐水,发现电解过程中未有蓝绿色溶液出现,但在其中一个电极附近出现了白色固体,则生成该固体的电极反应式为 。
(4)取少量方案二中B的稀溶液于试管,在酒精灯上加热,发现溶液由蓝色变为蓝绿色,其原因是 (用平衡移动原理解释)。
(5)取纯化的A的稀溶液20mL于烧杯中,加入2gKCl固体,用玻璃棒搅拌,发现溶液由蓝色变为蓝绿色, (填“能”或“不能”)用勒夏特列原理解释该现象。
3.2021年我国制氢量位居世界第一,煤气化制氢途径的原理如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)
(2)一定温度下,向体积固定的密闭容器中加入足量的和,起始压强为,发生煤气化制氢反应.
①反应Ⅰ的平衡常数表达式 .
②平衡时向容器中充入情性气体,平衡 移动(填“正向”“逆向”或“不”,下同),加入固体,平衡 移动.
③下列能说明反应Ⅰ到达平衡状态的是 .
A.混合气体的密度保持不变 B.容器内的压强保持不变
C.的体积保持不变 D.断裂的同时,生成键
(3)常温下,保持压强为不变,向密闭容器中加入足量的和,反应达平衡时,物质的量为的物质的量为;反应Ⅱ的平衡常数 (以分压表示,分压=总压×物质的量分数)
(4)时,潮湿的石膏雕像表面会发生反应:,其平衡常数 .[已知]
4.弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则pH=13的MOH溶液的浓度 0.1mol/L(填“<”、“>”或“=”)。
(3)25℃时,三种酸的电离平衡常数如下:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka =1.8×10-5 3.0×10-8
回答下列问题:
①25℃时,等浓度的三种溶液,酸性最强的是 (填化学式),一般情况下,当温度升高时, (填“增大”、“减小”或“不变”);
②用蒸馏水稀释的醋酸,下列各式表示的数值随水量的增加而增大的是 (填序号)。
A. B. C. D.
③室温下,某溶液中存在着 CH3COOH(aq)+ (aq)CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K= 。(用Ka、K1或K2表示)
5.某实验小组探究外界条件对化学反应速率的影响,进行了以下实验。
(1)Ⅰ.探究温度、浓度对硫代硫酸钠与稀硫酸反应速率的影响
写出Na2S2O3与H2SO4反应的离子方程式
(2)该小组同学设计了如下表所示系列实验:
实验序号 反应温度/℃ Na2S2O3溶液 H2SO4稀溶液 H2O
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
① 20 10.0 0.10 10.0 0.50 0
② t1 V1 0.10 V2 0.50 V3
③ t2 V4 0.10 V5 0.50 V6
实验①和②探究温度对该反应速率的影响,则实验②中,t1= (填“20℃”或“60℃”)、V2= mL。
若V5=6.0,实验①和③的实验目的是
(3)Ⅱ.探究催化剂对H2O2分解速率的影响
按下图进行定量实验研究。挤压注射器使FeCl3溶液全部加入试管中,记录数据;用CuCl2溶液代替FeCl3溶液进行平行实验,比较催化剂对反应速率的影响。该实验需测定的实验数据是
(4)用上图中的装置,探究MnO2催化H2O2分解的最佳条件。此时注射器中应加入的试剂是 。挤压注射器使液体全部加入试管中开始至不再有气体产生,记录反应时间。反应物用量和反应时间如下表:
H2O2 时间 MMMMMMMM 0.1g 0.3g 0.8g
10mL1.5% 223s 67s 56s
10mL3.0% 308s 109s 98s
10mL4.5% 395s 149s 116s
分析表中数据,从实验效果和“绿色化学”的角度考虑,H2O2的浓度一定时,加入 g的MnO2为较佳选择。
6.2023年5月,中国神舟十六号载人飞船成功发射,三位航天员景海鹏、朱杨柱、桂海潮在天宫空间站开启长达半年的太空生活.
(1)法国化学家Paul Sabatier 提出并命名的“Sabatier反应”实现了甲烷化,科技人员基于该反应设计如图过程完成空间站中与的循环,从而实现的再生.
①写出与具有相同空间结构的一种微粒: .
②在特定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓.表中为几种物质在298K的标准生成焓.
物质
标准摩尔生成焓 -393.51 -74.85 -241.82 0
则Sabatier反应 .
③下列有关Sabatier反应说法正确的是 .
A.输送进入Sabatier反应器的是电解水装置的阴极产物
B.采用高压和合适催化剂均有利于提高Sabatier反应的转化率
C.恒温条件下,在刚性容器中发生Sabatier反应,气体密度不变时,说明反应达到平衡
D.应该在Sabatier反应器的前端维持较高温度,后端维持较低温度
④一定条件下,分解形成碳的反应历程如图1所示,其中决定反应速率的是第 步反应.
图1 图2
(2)航天员呼吸产生的还可以利用Bosch反应:代替Sabatier反应.在250℃时,向体积为2L恒容密闭容器中通入和发生Bosch反应,测得容器内气压变化如图2所示.
①试解释容器内气压先增大后减小的原因: .
②该温度下Bosch反应的 (写出计算过程,为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压).
③在图2基础上画出其他条件相同,向体系加入催化剂时其压强随时间的变化曲线 .
7.已知碘的四氯化碳溶液能与K2C2O4溶液发生反应:I2+K2C2O4=2KI+2CO2↑,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成CO2气体的体积来比较化学反应速率的大小,实验装置如图1所示。
实验Ⅰ.在光亮处将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
实验Ⅱ.用黑纸袋包住锥形瓶后再将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
两次实验所用M溶液与N溶液相同。
①检查图1装置气密性的方法为 。
②盛装M溶液的仪器名称为 ,a的作用是 。
③该实验探究的是 对化学反应速率的影响。
④在反应停止前,相同时间内注射器中所得CO2的体积较多的是 (填“实验Ⅰ”或“实验Ⅱ”)。
(2)乙组:通过测定溶液褪色所用时间来比较化学反应速率的大小,实验装置如图2所示。
实验时将M溶液和N溶液同时加入三颈烧瓶中,并不断搅拌,M、N的成分以及水浴温度如下表:
序号 M溶液 N溶液 水浴温度
A 含0.01mol碘的四氯化碳溶液20mL 20mL0.4 mol·L-1的K2C2O4溶液 40℃
B 含0.01mol碘的四氯化碳溶液20mL 20mL0.8 mol·L-1K2C2O4溶液 40℃
C 含0.01mol碘的四氯化碳溶液20mL 20mL0.8 mol·L-1的K2C2O4溶液 50℃
①该实验探究的是 对化学反应速率的影响。
②该组同学始终没有观察到实验A的溶液褪色,其原因是 。
8.草酸是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性溶液发生反应:.
(1)探究外界条件对反应速率的影响.
实验编号 所加试剂及用量/mL 条件 溶液颜色褪至无色所需时间/min
溶液 溶液 稀 水 温度℃
1 12.0 2.0 3.0 3.0 20
2 6.0 2.0 3.0 20
3 2.0 3.0 9.0 30
①完成此实验设计,其中: , .
②对比实验1、2可探究 对反应速率的影响.
(2)某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度.
根据消耗酸性标准溶液的体积即可测定硬水样品中的浓度.
①实验过程提及的下列仪器,在使用之前一定要润洗的是 (填字母).
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中 (填“需要”或“不需要”)另加指示剂,如何判断滴定终点 .
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的标准溶液为 .该硬水样品中的浓度为 .
④下列不当操作会使测得的硬水样品的浓度偏高的是 (填字母)
A.滴定管未用标准溶液润洗 B.草酸钙沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
答案解析部分
1.【答案】(1)Cu + 2Fe3+ = Cu2+ + 2Fe2+
(2)1.8 mol/L NaNO3溶液(用HNO3调pH=1);铜粉逐渐溶解,溶液变为蓝色,有无色气体生成,在液面上方变为红棕色
(3)检验Fe3+;加入SCN 后,Fe3+与SCN-反应,生成Fe(SCN)3溶液显红色。震荡过程中Cu+与SCN 反应生成CuSCN沉淀,使SCN 浓度减小,Fe3++3SCN- Fe(SCN)3逆向移动,溶液红色褪去。
(4)Cu与Fe3+和NO3-(H+)均能发生反应,其中Cu与NO3-(H+)反应限度更大,Cu与Fe3+反应速率更快。
2.【答案】(1)不能;2Fe3++Cu=2Fe2++Cu2+,铁的金属性比铜强,Fe2+不再与Cu反应;2.8≤pH<4(或2.8≤pH≤4)
(2)正;Cu+2HClCuCl2+H2↑;溶液中的氯离子在阳极上放电,生成了氯气
(3)Cu-e +Cl =CuCl
(4)反应[Cu(H2O)4]2++4Cl [CuCl4]2 +4H2O正向吸热,升温,平衡正向移动
(5)能
3.【答案】(1)
(2);不;不;ABC
(3)2
(4)
4.【答案】(1)Al3++3H2O Al(OH)3(胶体)+3H+
(2)>
(3)CH3COOH;增大;B;
5.【答案】(1)
(2)60℃;10.0;其它条件不变时, 探究H2SO4浓度对该反应速率的影响
(3)一定时间内产生气体的体积(或生成相同体积的气体所需要的时间)
(4)H2O2溶液;0.3
6.【答案】(1)、等答案合理即可;-164.98;AD;4或四
(2)该反应是放热反应,反应开始时容器内温度上升,压强增大,随着反应进行,反应气体分子体减少,压强减小;0.5;
7.【答案】(1)关闭分液漏斗活塞,向外拉注射器活塞,松开后,若活塞能回到原位置,则装置气密性良好;分液漏斗;平衡气压,减少误差;光照;实验Ⅰ
(2)反应温度和反应物浓度;碘单质过量了
8.【答案】(1)9.0;6.0;浓度
(2)D;不需要;当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫色,半分钟不变为原来颜色;9.60;;AB
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
