2024年高中化学实验探究题特训:化工生产中的重要非金属元素(含答案)
文档属性
| 名称 | 2024年高中化学实验探究题特训:化工生产中的重要非金属元素(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 16:13:10 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024年高中化学实验探究题特训:化工生产中的重要非金属元素
1.某实验室利用和反应合成硫酰氯(),并对和HClO的酸性强弱进行探究。已知的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl白雾,100℃以上分解生成和。实验室合成的原理:,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
(1)写出碱石灰起作用的化学方程式: 。(写一个即可)
(2)装置戊上方分液漏斗中最好选用 (填字母)。
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.盐酸
(3)装置乙和丁盛放的试剂均是 。
(4)装置丙放置在冰水浴中的原因是 。
(5)和水反应的化学方程式为 。
(6)选用下面的装置探究酸性:,溶液均足量,其连接顺序为A→ 。能证明的酸性强于HClO的实验现象为 。信息:可以使品红褪色,通常用来检验;难溶于饱和的;酸性大于
2.为保障人民健康,我国制定了十分严格的使用标准,《食品安全国家标准食品添加剂使用标准》(GB2760-2014)规定含硫类食品添加剂的最大使用量范围为0.01~0.4(以残留量计算)。某化学兴趣小组按照如下步骤测定去核大枣中的残留量。
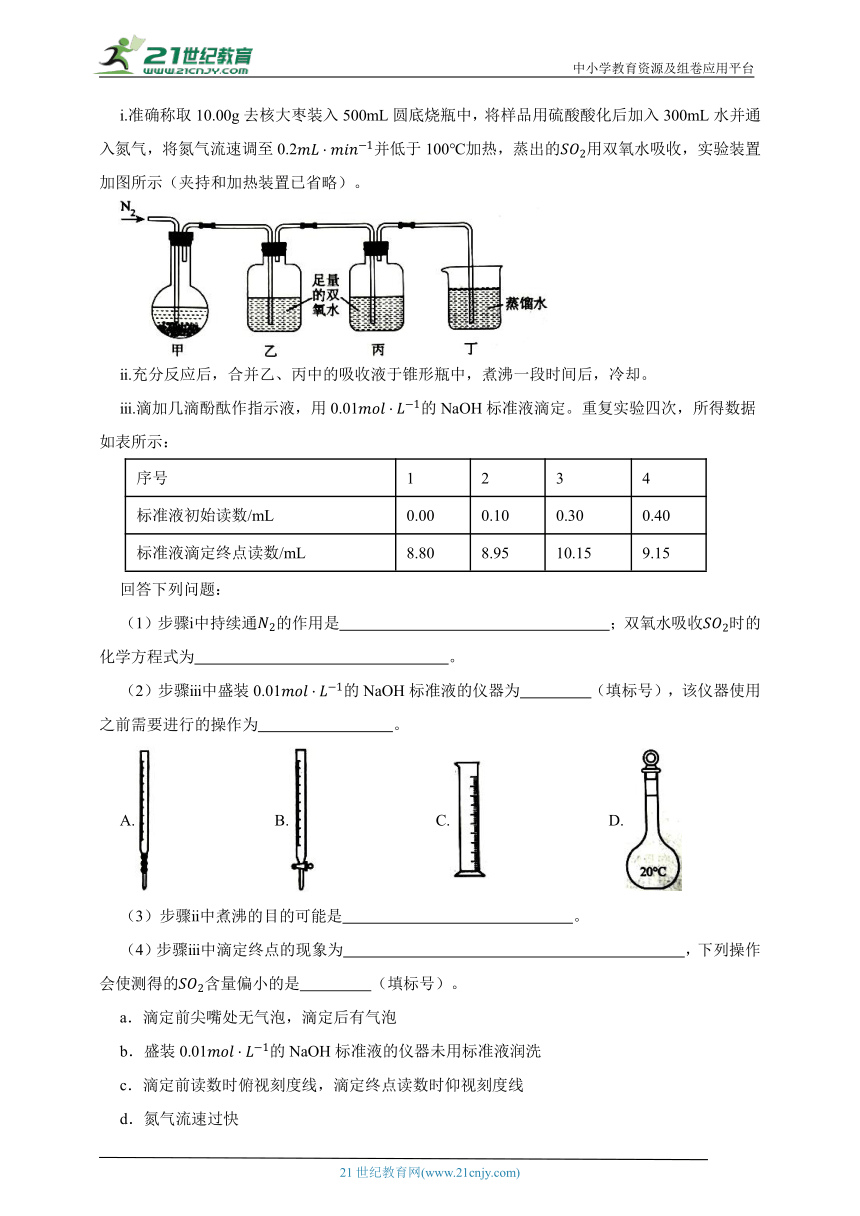
ⅰ.准确称取10.00g去核大枣装入500mL圆底烧瓶中,将样品用硫酸酸化后加入300mL水并通入氮气,将氮气流速调至0.2并低于100℃加热,蒸出的用双氧水吸收,实验装置加图所示(夹持和加热装置已省略)。
ⅱ.充分反应后,合并乙、丙中的吸收液于锥形瓶中,煮沸一段时间后,冷却。
ⅲ.滴加几滴酚酞作指示液,用0.01的NaOH标准液滴定。重复实验四次,所得数据如表所示:
序号 1 2 3 4
标准液初始读数/mL 0.00 0.10 0.30 0.40
标准液滴定终点读数/mL 8.80 8.95 10.15 9.15
回答下列问题:
(1)步骤ⅰ中持续通的作用是 ;双氧水吸收时的化学方程式为 。
(2)步骤ⅲ中盛装0.01的NaOH标准液的仪器为 (填标号),该仪器使用之前需要进行的操作为 。
A. B. C. D.
(3)步骤ⅱ中煮沸的目的可能是 。
(4)步骤ⅲ中滴定终点的现象为 ,下列操作会使测得的含量偏小的是 (填标号)。
a.滴定前尖嘴处无气泡,滴定后有气泡
b.盛装0.01的NaOH标准液的仪器未用标准液润洗
c.滴定前读数时俯视刻度线,滴定终点读数时仰视刻度线
d.氮气流速过快
(5)该大枣中的残留量为 (保留小数点后两位), (填“符合”或“不符合”)国家标准。
3.氧化铋俗称铋黄,是制作防火纸的材料之一。以白色难溶物氯氧化铋()为原料转型脱氯制备氧化铋的方法如下:
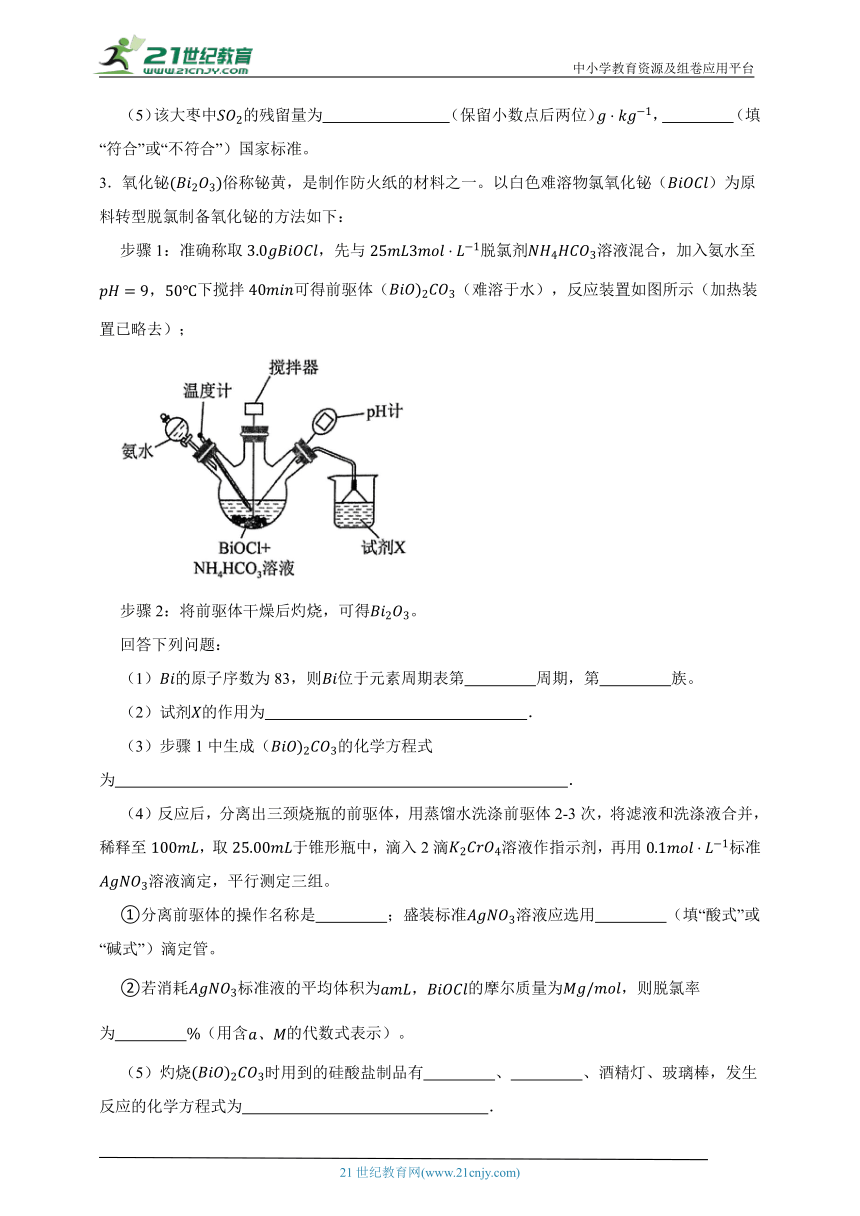
步骤1:准确称取,先与脱氯剂溶液混合,加入氨水至下搅拌可得前驱体((难溶于水),反应装置如图所示(加热装置已略去);
步骤2:将前驱体干燥后灼烧,可得。
回答下列问题:
(1)的原子序数为83,则位于元素周期表第 周期,第 族。
(2)试剂的作用为 .
(3)步骤1中生成(的化学方程式为 .
(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2-3次,将滤液和洗涤液合并,稀释至,取于锥形瓶中,滴入2滴溶液作指示剂,再用标准溶液滴定,平行测定三组。
①分离前驱体的操作名称是 ;盛装标准溶液应选用 (填“酸式”或“碱式”)滴定管。
②若消耗标准液的平均体积为的摩尔质量为,则脱氯率为 (用含的代数式表示)。
(5)灼烧时用到的硅酸盐制品有 、 、酒精灯、玻璃棒,发生反应的化学方程式为 .
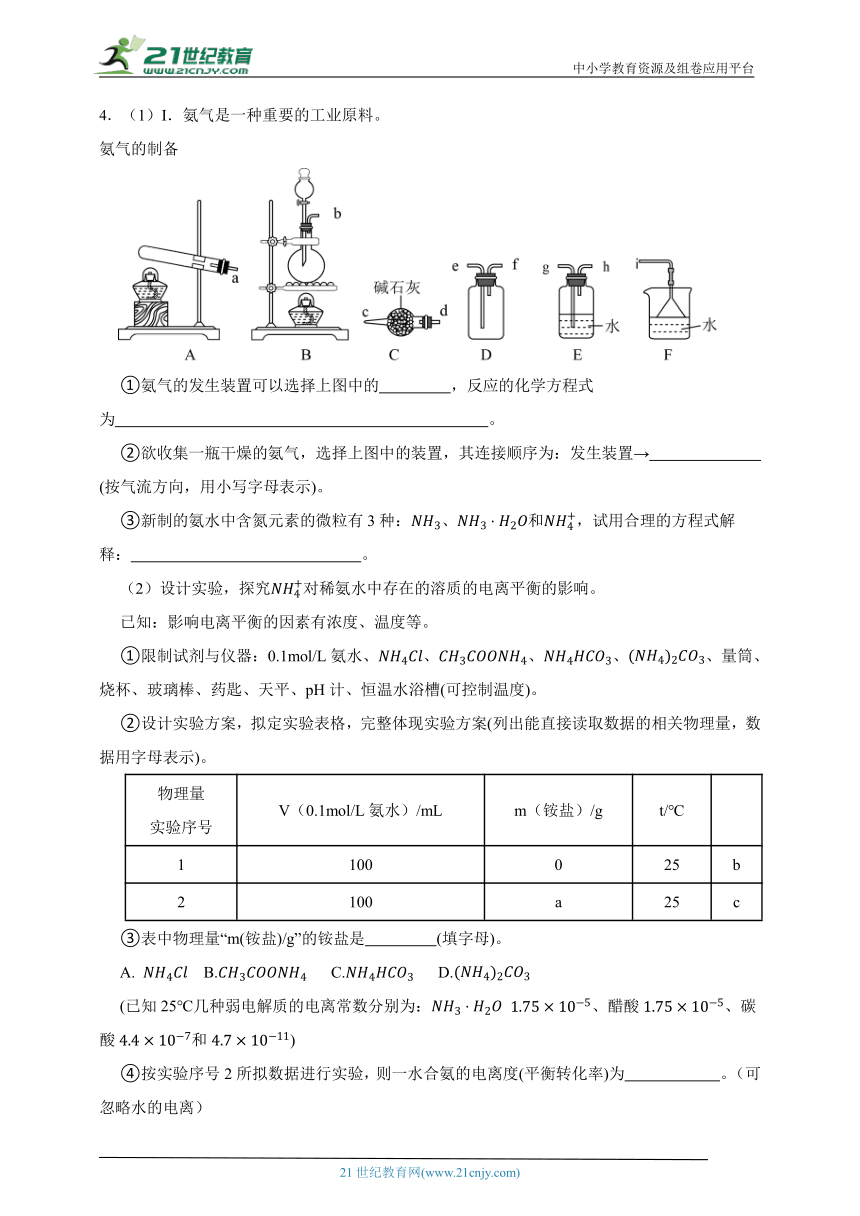
4.(1)Ⅰ.氨气是一种重要的工业原料。
氨气的制备
①氨气的发生装置可以选择上图中的 ,反应的化学方程式为 。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)。
③新制的氨水中含氮元素的微粒有3种:、和,试用合理的方程式解释: 。
(2)设计实验,探究对稀氨水中存在的溶质的电离平衡的影响。
已知:影响电离平衡的因素有浓度、温度等。
①限制试剂与仪器:0.1mol/L氨水、、、、、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量,数据用字母表示)。
物理量
实验序号 V(0.1mol/L氨水)/mL m(铵盐)/g t/℃
1 100 0 25 b
2 100 a 25 c
③表中物理量“m(铵盐)/g”的铵盐是 (填字母)。
A. B. C. D.
(已知25℃几种弱电解质的电离常数分别为: 、醋酸、碳酸和)
④按实验序号2所拟数据进行实验,则一水合氨的电离度(平衡转化率)为 。(可忽略水的电离)
5.经检测,某化工厂排出的废水,其中含有大量的H+、 Na+、Cu2+、SO42-、Cl-、NO3-。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是____(填字母)。
A.Ag+ B.Mg2+ C.OH- D.HCO3-
(2)取100 mL该废水于烧杯中,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是Na+、 (用离子符号表示)。
(3)某化学社团小组成员欲除去废水样品中的Cu2+和SO42-,最终得到中性溶液,设计的方案流程如图:
①试剂a为 溶液,蓝色沉淀1为 (均填化学式)。
②试剂b、c依次为BaCl2溶液和Na2CO3溶液,则白色沉淀2的化学式为 ,
写出白色沉淀2溶于稀盐酸的离子方程式 。
3 “分离操作”的名称是 ,需用到的玻璃仪器有 。
6.研究人员对Na2SO3和Fe粉去除废水中的硝态氮进行研究。
已知:i.某工厂排放的含氮废水中总氮=10mg·L-1,含有硝态氮、氨氮。
ii.本实验中Na2SO3在时,脱除硝态氮(转化为N2)效果较强。
iii.Na2SO3和Fe粉均可以脱除硝态氮,本实验中二者均为过量。
(1)Na2SO3和Fe粉在去除废水中硝态氮的过程中表现 性(填“氧化”或“还原”)。
(2)研究Na2SO3在pH=1的含氮废水中发生反应的情况,实验结果如图1。
①根据图1,写出“实验组一”中发生反应的离子方程式 。
②进行“实验组二”实验时发现,降低溶液pH更有利于的去除,可能的原因是 。
(3)脱除pH=1的含氮废水中硝态氮,单独加入Na2SO3或同时加入Na2SO3与Fe粉的实验结果如图2和图3。
①根据图2,前15min内Na2SO3,脱除NO;主要反应的离子方程式为 。
②根据图2和图3,20~60min内体系中生成主要反应的离子方程式为 。
③检验处理后的废水中存在取一定量废水蒸发浓缩, (补充操作和现象)。
7.某化学小组利用如图装置制备SO2并探究其性质(夹持装置已略去)。
(1)装置A中盛放Na2SO3固体的仪器名称为 ;在其中发生的化学反应方程式为 。
(2)实验时,装置B中无沉淀生成;实验结束后取B中溶液,向其中通入一种常见气体,可观察到白色沉淀;取白色沉淀加入稀盐酸,有刺激性气味气体产生,推测通入气体的化学式为 。若将装置B中溶液改为溶液,生成的沉淀的化学式为 。
(3)实验时,装置C中发生的离子方程式为 。
(4)实验时,装置D中的现象为 。
(5)为测定尾气中SO2的含量,某课外小组将尾气样品经过管道通入密闭容器中的200mL0.100mol/L酸性KMnO4溶液。若管道中尾气流量为aL/min,经过bmin溶液恰好褪色,假定样品中的SO2可被溶液充分吸收,则该尾气样品中SO2的含量为 g/L。
8.过硫酸钾()可用作破胶剂、聚合促进剂、氧化剂、分析试剂等,时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:
(1)可用于检验酸性溶液中的,在催化剂的作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
①完成化学方程式: 。
②当生成高锰酸钾时,共有 电子发生转移。
(2)小组同学预测过硫酸钾的分解产物有、、和,并用下图所示装置验证分解产物中含有和(部分夹持及加热仪器已省略)。
①装置D、E中盛放的试剂依次为 、 (填字母)。装置D、E中均有气泡冒出,还观察到的现象分别为 、 。
a.品红溶液 b.NaOH溶液 c.溶液 d.溶液 e.浓
②实验时,通入He排尽装置中的空气后,应先加热装置 (填“A”或“B”),其中装置A适合的加热方式为 。
③装置B中石棉绒的作用为 。
答案解析部分
1.【答案】(1)Cl2+2NaOH=NaCl+NaClO+H2O、SO2+2NaOH=Na2SO3+H2O
(2)b
(3)浓硫酸
(4)反应放热,且SO2Cl2沸点低,冰水浴有利于生成和收集SO2Cl2
(5)SO2Cl2+2H2O=H2SO4+2HCl
(6)C→B→E→D→F;装置D中品红不褪色,装置F中产生白色沉淀
2.【答案】(1)使生成的完全被双氧水吸收;
(2)A;检查是否漏液
(3)除去未和反应的
(4)溶液由无色变为浅红色,且半分钟内不褪色;ad
(5)0.28;符合
3.【答案】(1)六;ⅤA
(2)吸收挥发的氨气,防止污染空气
(3)
(4)过滤;酸式;
(5)坩埚;泥三角;
4.【答案】(1)A(或B);2NH4CI + Ca(OH)2=CaCl2 + 2H2O + 2NH3↑(或);d→c→f→e→i(cd、ef位置可颠倒);
(2)A;
5.【答案】(1)B
(2)H+、Cu2+
(3)NaOH;Cu(OH)2 ;BaCO3;BaCO3+2H+=Ba2++CO2↑+H2O;过滤;漏斗、烧杯、玻璃棒
6.【答案】(1)还原
(2);c(H+)较大时,的氧化性较强;或增大c(H+)有利于提高和反应速率
(3);;加入浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体
7.【答案】(1)三颈烧瓶;
(2)NH3;BaSO4
(3)
(4)紫色石蕊溶液变红
(5)
8.【答案】(1)2,5,,2,4,8;5
(2)c;a;生成白色沉淀;品红溶液褪色;B;沸水浴;增大铁粉与的接触面积,使铁粉与充分反应,同时防止固体粉末堵塞导管
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高中化学实验探究题特训:化工生产中的重要非金属元素
1.某实验室利用和反应合成硫酰氯(),并对和HClO的酸性强弱进行探究。已知的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl白雾,100℃以上分解生成和。实验室合成的原理:,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
(1)写出碱石灰起作用的化学方程式: 。(写一个即可)
(2)装置戊上方分液漏斗中最好选用 (填字母)。
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.盐酸
(3)装置乙和丁盛放的试剂均是 。
(4)装置丙放置在冰水浴中的原因是 。
(5)和水反应的化学方程式为 。
(6)选用下面的装置探究酸性:,溶液均足量,其连接顺序为A→ 。能证明的酸性强于HClO的实验现象为 。信息:可以使品红褪色,通常用来检验;难溶于饱和的;酸性大于
2.为保障人民健康,我国制定了十分严格的使用标准,《食品安全国家标准食品添加剂使用标准》(GB2760-2014)规定含硫类食品添加剂的最大使用量范围为0.01~0.4(以残留量计算)。某化学兴趣小组按照如下步骤测定去核大枣中的残留量。
ⅰ.准确称取10.00g去核大枣装入500mL圆底烧瓶中,将样品用硫酸酸化后加入300mL水并通入氮气,将氮气流速调至0.2并低于100℃加热,蒸出的用双氧水吸收,实验装置加图所示(夹持和加热装置已省略)。
ⅱ.充分反应后,合并乙、丙中的吸收液于锥形瓶中,煮沸一段时间后,冷却。
ⅲ.滴加几滴酚酞作指示液,用0.01的NaOH标准液滴定。重复实验四次,所得数据如表所示:
序号 1 2 3 4
标准液初始读数/mL 0.00 0.10 0.30 0.40
标准液滴定终点读数/mL 8.80 8.95 10.15 9.15
回答下列问题:
(1)步骤ⅰ中持续通的作用是 ;双氧水吸收时的化学方程式为 。
(2)步骤ⅲ中盛装0.01的NaOH标准液的仪器为 (填标号),该仪器使用之前需要进行的操作为 。
A. B. C. D.
(3)步骤ⅱ中煮沸的目的可能是 。
(4)步骤ⅲ中滴定终点的现象为 ,下列操作会使测得的含量偏小的是 (填标号)。
a.滴定前尖嘴处无气泡,滴定后有气泡
b.盛装0.01的NaOH标准液的仪器未用标准液润洗
c.滴定前读数时俯视刻度线,滴定终点读数时仰视刻度线
d.氮气流速过快
(5)该大枣中的残留量为 (保留小数点后两位), (填“符合”或“不符合”)国家标准。
3.氧化铋俗称铋黄,是制作防火纸的材料之一。以白色难溶物氯氧化铋()为原料转型脱氯制备氧化铋的方法如下:
步骤1:准确称取,先与脱氯剂溶液混合,加入氨水至下搅拌可得前驱体((难溶于水),反应装置如图所示(加热装置已略去);
步骤2:将前驱体干燥后灼烧,可得。
回答下列问题:
(1)的原子序数为83,则位于元素周期表第 周期,第 族。
(2)试剂的作用为 .
(3)步骤1中生成(的化学方程式为 .
(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2-3次,将滤液和洗涤液合并,稀释至,取于锥形瓶中,滴入2滴溶液作指示剂,再用标准溶液滴定,平行测定三组。
①分离前驱体的操作名称是 ;盛装标准溶液应选用 (填“酸式”或“碱式”)滴定管。
②若消耗标准液的平均体积为的摩尔质量为,则脱氯率为 (用含的代数式表示)。
(5)灼烧时用到的硅酸盐制品有 、 、酒精灯、玻璃棒,发生反应的化学方程式为 .
4.(1)Ⅰ.氨气是一种重要的工业原料。
氨气的制备
①氨气的发生装置可以选择上图中的 ,反应的化学方程式为 。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)。
③新制的氨水中含氮元素的微粒有3种:、和,试用合理的方程式解释: 。
(2)设计实验,探究对稀氨水中存在的溶质的电离平衡的影响。
已知:影响电离平衡的因素有浓度、温度等。
①限制试剂与仪器:0.1mol/L氨水、、、、、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量,数据用字母表示)。
物理量
实验序号 V(0.1mol/L氨水)/mL m(铵盐)/g t/℃
1 100 0 25 b
2 100 a 25 c
③表中物理量“m(铵盐)/g”的铵盐是 (填字母)。
A. B. C. D.
(已知25℃几种弱电解质的电离常数分别为: 、醋酸、碳酸和)
④按实验序号2所拟数据进行实验,则一水合氨的电离度(平衡转化率)为 。(可忽略水的电离)
5.经检测,某化工厂排出的废水,其中含有大量的H+、 Na+、Cu2+、SO42-、Cl-、NO3-。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是____(填字母)。
A.Ag+ B.Mg2+ C.OH- D.HCO3-
(2)取100 mL该废水于烧杯中,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是Na+、 (用离子符号表示)。
(3)某化学社团小组成员欲除去废水样品中的Cu2+和SO42-,最终得到中性溶液,设计的方案流程如图:
①试剂a为 溶液,蓝色沉淀1为 (均填化学式)。
②试剂b、c依次为BaCl2溶液和Na2CO3溶液,则白色沉淀2的化学式为 ,
写出白色沉淀2溶于稀盐酸的离子方程式 。
3 “分离操作”的名称是 ,需用到的玻璃仪器有 。
6.研究人员对Na2SO3和Fe粉去除废水中的硝态氮进行研究。
已知:i.某工厂排放的含氮废水中总氮=10mg·L-1,含有硝态氮、氨氮。
ii.本实验中Na2SO3在时,脱除硝态氮(转化为N2)效果较强。
iii.Na2SO3和Fe粉均可以脱除硝态氮,本实验中二者均为过量。
(1)Na2SO3和Fe粉在去除废水中硝态氮的过程中表现 性(填“氧化”或“还原”)。
(2)研究Na2SO3在pH=1的含氮废水中发生反应的情况,实验结果如图1。
①根据图1,写出“实验组一”中发生反应的离子方程式 。
②进行“实验组二”实验时发现,降低溶液pH更有利于的去除,可能的原因是 。
(3)脱除pH=1的含氮废水中硝态氮,单独加入Na2SO3或同时加入Na2SO3与Fe粉的实验结果如图2和图3。
①根据图2,前15min内Na2SO3,脱除NO;主要反应的离子方程式为 。
②根据图2和图3,20~60min内体系中生成主要反应的离子方程式为 。
③检验处理后的废水中存在取一定量废水蒸发浓缩, (补充操作和现象)。
7.某化学小组利用如图装置制备SO2并探究其性质(夹持装置已略去)。
(1)装置A中盛放Na2SO3固体的仪器名称为 ;在其中发生的化学反应方程式为 。
(2)实验时,装置B中无沉淀生成;实验结束后取B中溶液,向其中通入一种常见气体,可观察到白色沉淀;取白色沉淀加入稀盐酸,有刺激性气味气体产生,推测通入气体的化学式为 。若将装置B中溶液改为溶液,生成的沉淀的化学式为 。
(3)实验时,装置C中发生的离子方程式为 。
(4)实验时,装置D中的现象为 。
(5)为测定尾气中SO2的含量,某课外小组将尾气样品经过管道通入密闭容器中的200mL0.100mol/L酸性KMnO4溶液。若管道中尾气流量为aL/min,经过bmin溶液恰好褪色,假定样品中的SO2可被溶液充分吸收,则该尾气样品中SO2的含量为 g/L。
8.过硫酸钾()可用作破胶剂、聚合促进剂、氧化剂、分析试剂等,时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:
(1)可用于检验酸性溶液中的,在催化剂的作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
①完成化学方程式: 。
②当生成高锰酸钾时,共有 电子发生转移。
(2)小组同学预测过硫酸钾的分解产物有、、和,并用下图所示装置验证分解产物中含有和(部分夹持及加热仪器已省略)。
①装置D、E中盛放的试剂依次为 、 (填字母)。装置D、E中均有气泡冒出,还观察到的现象分别为 、 。
a.品红溶液 b.NaOH溶液 c.溶液 d.溶液 e.浓
②实验时,通入He排尽装置中的空气后,应先加热装置 (填“A”或“B”),其中装置A适合的加热方式为 。
③装置B中石棉绒的作用为 。
答案解析部分
1.【答案】(1)Cl2+2NaOH=NaCl+NaClO+H2O、SO2+2NaOH=Na2SO3+H2O
(2)b
(3)浓硫酸
(4)反应放热,且SO2Cl2沸点低,冰水浴有利于生成和收集SO2Cl2
(5)SO2Cl2+2H2O=H2SO4+2HCl
(6)C→B→E→D→F;装置D中品红不褪色,装置F中产生白色沉淀
2.【答案】(1)使生成的完全被双氧水吸收;
(2)A;检查是否漏液
(3)除去未和反应的
(4)溶液由无色变为浅红色,且半分钟内不褪色;ad
(5)0.28;符合
3.【答案】(1)六;ⅤA
(2)吸收挥发的氨气,防止污染空气
(3)
(4)过滤;酸式;
(5)坩埚;泥三角;
4.【答案】(1)A(或B);2NH4CI + Ca(OH)2=CaCl2 + 2H2O + 2NH3↑(或);d→c→f→e→i(cd、ef位置可颠倒);
(2)A;
5.【答案】(1)B
(2)H+、Cu2+
(3)NaOH;Cu(OH)2 ;BaCO3;BaCO3+2H+=Ba2++CO2↑+H2O;过滤;漏斗、烧杯、玻璃棒
6.【答案】(1)还原
(2);c(H+)较大时,的氧化性较强;或增大c(H+)有利于提高和反应速率
(3);;加入浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体
7.【答案】(1)三颈烧瓶;
(2)NH3;BaSO4
(3)
(4)紫色石蕊溶液变红
(5)
8.【答案】(1)2,5,,2,4,8;5
(2)c;a;生成白色沉淀;品红溶液褪色;B;沸水浴;增大铁粉与的接触面积,使铁粉与充分反应,同时防止固体粉末堵塞导管
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
