人教版九年级化学下册第九单元溶液单元复习题(含解析)
文档属性
| 名称 | 人教版九年级化学下册第九单元溶液单元复习题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 136.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 00:00:00 | ||
图片预览




文档简介
人教版九年级化学下册第九单元溶液单元复习题
一、单选题
1.下列物质的溶解度,随温度升高而减少的是( )
A.食盐 B.熟石灰 C.硝酸钠 D.硫酸铜
2.下列有关物质的性质与用途具有对应关系的是( )
A.活性炭具有吸附性,可做电极
B.熟石灰具有碱性,可用作发酵粉
C.氩气的化学性质稳定,可用作电光源
D.洗洁精具有乳化作用,可用于去除油污
3.向20%NaCl溶液中,再加入1.5 gNaCl和6 g水,所得溶液溶质质量分数( )
A.等于20% B.大于20% C.小于20% D.无法判断
4.在“配制50g溶质质量分数为15%的氯化钠溶液”实验中,下列操作正确的是( )
A.甲图表示称取7.5g氯化钠 B.乙图表示量取42.5mL水
C.丙图表示溶解氯化钠 D.丁图表示向试剂瓶中转移溶液
5.下列物质加入水中,不能形成溶液的是( )
A.食盐 B.白糖 C.植物油 D.白醋
6.下列推理正确的是( )
A.溶液是均一、稳定的,所以均一稳定的液体都是溶液
B.含有氧元素的化合物不一定是氧化物,但是氧化物中一定含有氧元素
C.燃烧伴随发光、放热现象,所以有发光,放热的变化都是燃烧
D.化合物由不同种元素组成,所以不同种元素组成的物质都是化合物
7.分析如图溶解度曲线,下列说法错误的是( )
A.t1℃时,甲和乙的溶解度相等
B.t2℃时,在100g水里加入100g甲固体,得到200g甲溶液
C.t2℃时,等质量的两种物质的饱和溶液同时降温至t1℃,盛有甲溶液的烧杯中析出较多晶体
D.将t1℃时两种物质的饱和溶液升温至t2℃,溶质质量分数:甲>乙
8.下列叙述错误的是( )
A.日常生活中可用肥皂水鉴别硬水和软水
B.铝比铁具有更好的抗腐蚀性能,是因为铁比铝更活泼
C.建造游泳中心“水立方”用到的聚乙烯是有机合成材料
D.用汽油和加了洗涤剂的水分别除去衣服上的油污,两者去污原理不同
9.物质在水中溶解是复杂的物理和化学变化过程,往往伴随着热量变化,因此,不同物质溶于水所得溶液的温度有所不同.下列物质溶于水,溶液温度明显降低的是
A.NH4NO3固体 B.NaOH 固体 C.NaCl 固体 D.浓H2SO4
10.“天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:( )
①硝酸钾、氯化铵和水的混合溶液
②溶质质量分数为24 %的樟脑的酒精溶液
下列说法中,错误的是
A.溶液中的溶质可以为多种
B.樟脑的酒精溶液中酒精是溶剂
C.溶质质量分数为24 %的含义是指每100 g的溶剂中,溶质是24 g
D.“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化
11.甲、乙、丙三种固体物质溶解度曲线如图所示,下列说法不正确的是( )
A.M点表示在t1℃时,乙和丙的溶解度相等
B.N点表示t1℃时,丙物质的不饱和溶液,其可以通过降温或加溶质的方式变为饱和溶液
C.t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为80g
D.甲的浓溶液中含有少量的丙,可以通过降温结晶的方式提纯甲
12.农业生成中常用溶质质量分数为16%的氯化钠溶液来选种,对该溶液理解正确的是( )
A.溶液中含氯化钠16g B.溶液质量为100g
C.每100g溶液中含氯化钠16g D.每100g水中含氯化钠16g
二、非选择题
13.阅读下列短文,回答问题。
氢氧化钙是一种白色粉末状固体,俗称熟石灰或消石灰,加入水后,分上下两层,上层水溶液俗称澄清石灰水,可用于CO2气体的检验。下层悬浊液称作石灰乳或石灰浆,是一种建筑材料。氢氧化钙是一种强碱,具有杀菌与防腐能力,对皮肤、织物有腐蚀作用。氢氧化钙用途广泛,除了用于建筑外,还可与硫酸铜溶液混合配制农药波尔多液,用加了硫粉的石灰乳涂抹于树上可以防冻和防止害虫产卵等。
(1)石灰水具有碱的化学性质是因为石灰水含有的阴离子是 。(填符号)
(2)如图是氢氧化钙的溶解度曲线。
①氢氧化钙的溶解性属于 。(填“可溶”“微溶”或“难溶”)
②试分析加热饱和石灰水变浑浊的原因: 。该变化是 (填“物理”或“化学”)变化。
(3)除上述内容外,请再举一例Ca(OH)2的用途: 。
14. 右图是常见固体物质的溶解度曲线,根据图示回答:
(1)曲线上M点表示 ,t3℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(2)t1℃时,将10g A物质放入100g水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液。欲使t2℃时C物质的饱和溶液变为不饱和溶液,可采取的方法是 (任填一种方法)。
(3)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:
①水的质量 ②溶液中KNO3的质量 ③KNO3的质量分数 ④30℃时KNO3的溶解度 ⑤溶液的质量
Ⅰ.在该不饱和溶液中加硝酸钾至饱和,不变的量有 (填序号,下同)。
Ⅱ.将该不饱和溶液恒温蒸发至饱和,不变的量有 。
15.据下图配制100g溶质质量分数为5%的氯化钠溶液。请回答下列问题:
(1)配制上述氯化钠溶液,需要水的质量为 g。
(2)该实验正确的操作顺序是_______
A.④⑤①②③ B.①②③④⑤
C.②①④③⑤ D.③④①②⑤
(3)如图⑤称量过程中若发现指针偏向左边,你应采取的操作是__________
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母
(4)用量筒量取水时,若仰视读数,则配制结果将偏 (填“大”或“小”)(假设氯化钠质量的计算和称量均正确,且实验过程中氯化钠无损失).
(5)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 。
16.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是 。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水 g。
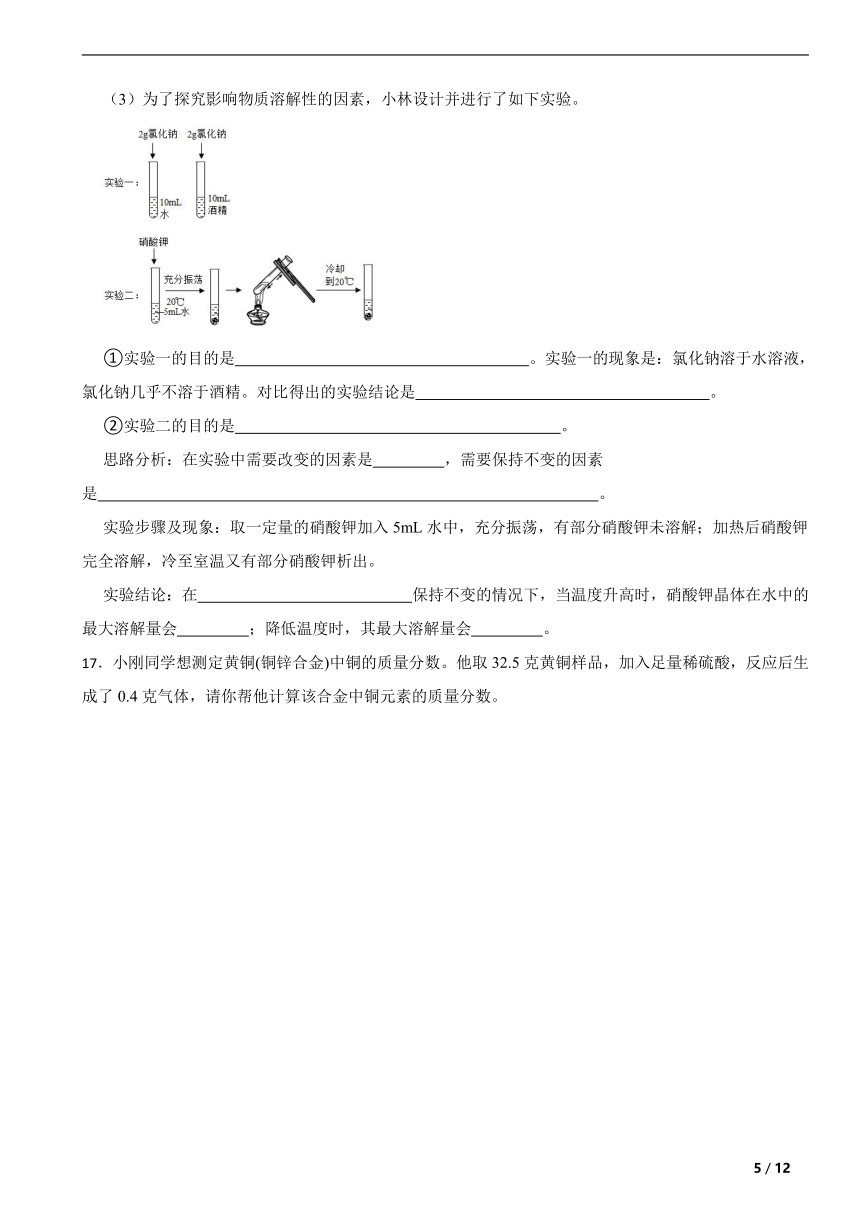
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是 。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是 。
②实验二的目的是 。
思路分析:在实验中需要改变的因素是 ,需要保持不变的因素是 。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在 保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会 ;降低温度时,其最大溶解量会 。
17.小刚同学想测定黄铜(铜锌合金)中铜的质量分数。他取32.5克黄铜样品,加入足量稀硫酸,反应后生成了0.4克气体,请你帮他计算该合金中铜元素的质量分数。
答案解析部分
1.【答案】B
【解析】【解答】物质的溶解度随着温度的变化而变化的情况的一般规律是:大部分固体随温度升高溶解度增大,如硝酸钾;只有少数固体溶解度受温度影响不大,如食盐(氯化钠);极少数物质溶解度随温度升高反而减小,如熟石灰,B符合题意。
故答案为:B。【分析】本题主要考查常见物质的溶解度,需要掌握常见物质的溶解度与温度之间的关系。
2.【答案】D
【解析】【解答】A、活性炭具有吸附性,可做滤毒罐、脱色剂等,故不符合题意;
B、熟石灰具有腐蚀性,虽然是碱性物质但不能做发酵粉,故不符合题意;
C、氩气的化学性质稳定,可作保护气,可用作电光源是利用稀有气体在通电时能发出不同颜色的光,故不符合题意;
D、洗洁精具有乳化作用,可用于去除油污,故符合题意。
故答案为:D
【分析】物质的性质决定用途,可以根据物质的性质方面进行分析、判断,从而得出正确的结论。
3.【答案】A
【解析】【解答】结合题意,可以把此过程看作向20%NaCl溶液中,加入另一份溶质质量分数一定的溶液,据此分析判断即可。1.5gNaCl溶于6g水,溶液中溶质的质量分数为:
×100%=20%;即向20%NaCl溶液中,再加入相同溶质质量分数的溶液,所得溶液溶质质量分数仍为20%,A符合题意。
故答案为:A。【分析】本题主要考查溶液中溶质质量分数的计算,溶质质量分数等于溶质质量与溶液质量之比。
4.【答案】C
【解析】【解答】A、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,A选项图中所示操作错误;
B、量取42.5mL水,应使用50mL的量筒,不能使用烧杯,B选项图中所示操作错误;
C、溶解时,用玻璃棒不断搅拌,以加快溶解速率,C选项图中所示操作正确;
D、向试剂瓶中转移溶液,瓶塞要倒放,烧杯口要紧挨着试剂瓶口,D选项图中所示操作错误;
故选:C。
【分析】A、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断;
B、根据量取液体的方法,进行分析判断;
C、根据溶解操作的方法,进行分析判断;
D、根据转移溶液的方法,进行分析判断。
5.【答案】C
【解析】【解答】A、食盐能溶于水,形成均一、稳定的混合物,可以形成溶液,不符合题意;
B、白糖能溶于水,形成均一、稳定的混合物,可以形成溶液,不符合题意;
C、植物油不溶于水,只能以小液滴的形式悬浮于液体里形成乳浊液,符合题意;
D、白醋能溶于水,形成均一、稳定的混合物,可以形成溶液,不符合题意。
故答案为:C。
【分析】根据溶液的特征进行分析:均一的、稳定的混合物
6.【答案】B
【解析】【解答】A. 溶液是均一、稳定的,但均一、稳定的液体不一定都是溶液,如水是均一、稳定的液体,但不是溶液,故不符合题意。
B. 氧化物是由氧元素和另一种元素组成的化合物,因此氧化物一定含有氧元素,但含有氧元素的化合物不一定是氧化物,如:KMnO4,故符合题意。
C. 燃烧伴有发光、放热现象,但有发光、放热现象不一定是燃烧,如灯泡发光、放热,故不符合题意。
D. 化合物由不同种元素组成,不同种元素组成的纯净物是化合物,故不符合题意。
故答案为:B。
【分析】A、溶液是混合物,具有均一性、稳定性。
B、根据氧化物的概念,进行分析。
C、根据燃烧的特点,进行分析。
D、根据化合物的概念,进行分析。
7.【答案】D
【解析】【解答】A. 由溶解度曲线可知,t1℃时,甲和乙的溶解度相等,故正确,不符合题意;
B. t2℃时,甲物质的溶解度为110g,因此在100g水里加入100g甲固体能够完全溶解,得到200g甲溶液,故正确,不符合题意;
C. 因为甲物质的溶解度受温度的影响较大,因此t2℃时,等质量的两种物质的饱和溶液同时降温至t1℃,盛有甲溶液的烧杯中析出较多晶体,故正确,不符合题意;
D. t1℃时,甲和乙的溶解度相等,两种物质的饱和溶液溶质质量分数相等,将t1℃时两种物质的饱和溶液升温至t2℃,都无晶体析出,两种物质的溶质质量分数仍相等,故错误,符合题意;
故答案为:D
【分析】根据固体的溶解度曲线,可以比较不同物质在同一温度下的溶解度大小;可以判断物质的溶解度随温度变化的变化情况,从而判断降温后析出晶体的多少;可以查出某物质在一定温度下的溶解度,从而计算形成饱和溶液的质量。
8.【答案】B
【解析】【解答】解:A、肥皂水可以鉴别硬水和软水,泡沫多的是软水,泡沫少的是硬水,故正确;
B、铝在空气中易被氧气氧化,表面形成致密的氧化铝保护膜,故耐腐蚀,铝的金属活动性比铁活泼,故不正确;
C、聚乙烯是塑料,属于有机合成材料,故正确;
D、汽油除去衣服上的油污是溶解,洗涤剂除去衣服上的油污是溶解乳化,二者原理不同,故正确.
答案:B
【分析】A、根据用肥皂水可以鉴别硬水和软水解答;
B、根据铝、铁与氧气反应生成的氧化物的特点分析判断;
C、根据聚乙烯是塑料,属于有机合成材料分析;
D、根据汽油除去衣服上的油污是溶解,洗涤剂除去衣服上的油污是溶解乳化分析.
9.【答案】A
【解析】【解答】物质在溶解时经常伴随有吸热或放热现象,如氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低.
A. NH4NO3固体溶于水吸热,溶液温度明显降低.
B.NaOH固体溶于水放热,溶液温度明显升高.
C.氯化钠固体溶于水,既不吸热、也不放热,溶液温度基本保持不变.
D.浓硫酸溶于水放热,溶液温度明显升高.
故选:A.
【分析】根据常见物质溶于水的吸热与放热现象、溶液温度的变化情况进行分析解答即可.
10.【答案】C
【解析】【解答】A、溶液中的溶质可以为多种,如“天气瓶”内的液体主要成分是硝酸钾、氯化铵和水的混合溶液,其中硝酸钾、氯化铵是溶质,故A说法不符合题意;
B、固体溶于液体时,固体是溶质、液体是溶剂,故樟脑的酒精溶液中酒精是溶剂,故B说法不符合题意;
C、溶质质量分数为24%的含义是指每100g的溶液中,溶质是24g,故C说法符合题意;
D、物质的溶解度受温度影响,“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化,故D说法不符合题意;
故答案为:C。
【分析】A、根据溶液的概念分析
B、根据溶液中有水时溶剂一定是水分析
C、根据根据溶质质量分数的含义分析
D、根据溶解度的影响因素分析
11.【答案】B
【解析】【解答】A、在t1℃时,乙和丙的溶解度曲线交于M点,说明乙和丙的溶解度相等,故不符合题意;
B、丙物质的溶解度随着温度的升高而减小,N点表示在t1℃时丙物质的不饱和溶液,可以通过升温的办法或增加溶质的方式变为饱和溶液,而不是降温,故符合题意;
C、t3℃时,甲的溶解度为60g,因此用50g的水只能溶解30g的甲物质,充分溶解后所得的溶液的质量为50g+30g=80g,故不符合题意;
D、甲的溶解度随温度的降低而减小,丙的溶解度随温度的降低而增大,若甲的浓溶液中含有少量的丙,可以通过降温结晶的方式析出甲,从而提纯甲,故不符合题意。
故答案为:B。
【分析】由溶解度曲线图可以看出丙物质的溶解度随温度的升高而降低,图中N点代表t1℃时丙物质的不饱和溶液,要将此时的溶液变为饱和溶液可以通过加溶质或者蒸发溶剂的方法。
12.【答案】C
【解析】解答:由溶液中溶质质量分数= 可知,氯化钠溶液的溶质质量分数为16%是指100g食盐溶液中含有16g氯化钠.这要与溶解度的概念要区别清楚。
所以选:C.
分析:此题主要考查溶质的质量分数的含义,属基础性题.
13.【答案】(1)
(2)微溶;饱和石灰水的溶质是氢氧化钙,氢氧化钙的溶解度随温度升高而减小,即温度升高有氢氧化钙固体析出,所以加热饱和石灰水变浑浊;物理
(3)改良酸性土壤
【解析】【解答】(1)石灰水即氢氧化钙溶液,氢氧化钙溶液由钙离子、氢氧根离子、水分子构成,所以石灰水含有的阴离子是是氢氧根离子,符号为。
(2)根据氢氧化钙的溶解度曲线图,可知室温即20℃时氢氧化钙的溶解度约为0.17g,在0.01g~1g之间,所以,氢氧化钙的溶解性属于微溶。
饱和石灰水的溶质是氢氧化钙,氢氧化钙的溶解度随温度升高而减小,加热饱和石灰水即温度升高有氢氧化钙固体析出,所以加热饱和石灰水变浑浊。
氢氧化钙析出,没有生成新物质,是物理变化。
(3)Ca(OH)2的用途非常广泛。除了用于建筑外,还可与硫酸铜溶液混合配制农药波尔多液,用加了硫粉的石灰乳涂抹于树上可以防冻和防止害虫产卵,农业上还可用来改良酸性土壤等。
【分析】(1)根据碱的概念解答;
(2)根据氢氧化钙的溶解度曲线图分析;物理变化:无新物质生成;
(3)根据氢氧化钙的性质推断其用途。
14.【答案】t2℃时,A与C的溶解度相等;A>B>C;不饱和;加水或降温;①④;②④
【解析】【解答】(1)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等;因为曲线上M点为t2℃时,A与C两物质的溶解度曲线的交点,因此,M点表示t2℃时A与C两物质的溶解度相等。根据溶解度曲线可以比较相同温度时(或一定温度范围内)不同物质溶解度的大小;t3℃时,A、B、C三种物质的溶解度曲线的位置关系为:物质A的溶解度曲线位于最上方,而物质C的溶解度曲线位于最下方,故可判断此时A、B、C三种物质的溶解度由大到小的顺序为A>B>C。
(2)由A物质的溶解曲线可知,t1℃时物质A的溶解度为40g,即此时100g水最多可溶解A物质40g,因此,此时将10gA物质放入100g水中充分溶解后所得溶液为不饱和溶液;由C物质的溶解度曲线可知,物质C的溶解度随温度升高而减小,因此,采取加水或降温的方法都可以使t2℃时C物质的饱和溶液变为不饱和溶液。
(3)I.在30℃时不饱和KNO3溶液中加硝酸钾,硝酸钾继续溶解至饱和,此时所得饱和溶液中溶质质量增加,导致溶液的质量及溶液的溶质质量分数都变大,而溶液中溶剂水的质量不变,温度不变硝酸钾的溶解度也不改变;故选①④。
II.将30℃时不饱和KNO3溶液恒温蒸发至饱和,温度不变硝酸钾的溶解度也不变,蒸发溶剂水至饱和,溶液中溶质硝酸钾的质量不变,由于溶剂减少,溶液的质量减小、溶液的溶质质量分数变大吗,故选②④。
【分析】根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小。
15.【答案】(1)95g
(2)A
(3)B
(4)小
(5)加速氯化钠溶解
【解析】【解答】(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g=95g;(2)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量,正确顺序是④⑤①②③;(3)用托盘天平称量所需氯化钠时,步骤是:调节天平平衡,在右盘上加砝码和拨动游码,然后向左边托盘添加药品直至天平平衡;称量过程中发现天平的指针偏向左边,说明食盐的质量大于砝码质量,应减少食盐;(4)用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小;(5)溶解过程中用玻璃棒搅拌,其目的是加速氯化钠溶解。
故答案为:(1)95g(2)A(3)B(4)小(5)加速氯化钠溶解
【分析】(1)根据溶质质量分数的计算公式解答
(2)根据配置溶液的步骤解答
(3)根据天平指针偏向那边那边质量大解答
(4)仰视读数,量取的水多,配置的溶液中溶质的质量分数偏小
(5)根据配置溶液所用的仪器和玻璃棒的作用解答
16.【答案】(1)酒精
(2)50
(3)比较氯化钠在水和酒精中的溶解情况;同种溶质在不同的溶剂中溶解性不同;比较温度对硝酸钾在水中的溶解性的影响;温度;一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);溶质和溶剂的种类和质量;增加;减少
【解析】【解答】(1)消毒酒精是医疗上常用的一种溶液,其溶质是酒精,溶剂是水;
(2)若使溶液的溶质质量分数增大一倍,设应蒸发掉水的质量为x,则有100g×10%=(100g-x)×20%,x=50g;
(3)
①根据图示可知实验一的目的是比较氯化钠在水和酒精中的溶解情况;
氯化钠溶于水,几乎不溶于酒精,对比得出的实验结论是同种溶质在不同的溶剂中溶解性不同。
②根据图示可知,硝酸钾和水定量条件下,温度从20℃硝酸钾固体未完全溶解到加热完全溶解再到降温20℃硝酸钾固体未完全溶解,可知实验二的目的是比较温度对硝酸钾在水中的溶解性的影响;
由上分析可知在实验中需要改变的因素是温度,需要保持不变的因素是一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);
根据实验现象可知在溶质和溶剂的种类和质量保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会增加,降低温度时,其最大溶解量会减少。
【分析】(1)根据酒精溶液中溶质为酒精分析;
(2)根据溶质质量分数=溶质质量/溶液质量分析;
(3)根据所做实验中溶剂不同影响溶解性不同,溶质、溶剂种类和质量对物质溶解的量的影响分析。
17.【答案】60%
【解析】【解答】铜不与酸发生反应,产生氢气为锌与酸反应,设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
65:2=x:0.4g
x=13g
则铜的质量分数为。
【分析】根据锌与酸反应,铜不与酸反应,由锌与酸反应产生氢气质量代入方程式计算出锌的质量,从而计算铜的质量分数分析。
1 / 1
一、单选题
1.下列物质的溶解度,随温度升高而减少的是( )
A.食盐 B.熟石灰 C.硝酸钠 D.硫酸铜
2.下列有关物质的性质与用途具有对应关系的是( )
A.活性炭具有吸附性,可做电极
B.熟石灰具有碱性,可用作发酵粉
C.氩气的化学性质稳定,可用作电光源
D.洗洁精具有乳化作用,可用于去除油污
3.向20%NaCl溶液中,再加入1.5 gNaCl和6 g水,所得溶液溶质质量分数( )
A.等于20% B.大于20% C.小于20% D.无法判断
4.在“配制50g溶质质量分数为15%的氯化钠溶液”实验中,下列操作正确的是( )
A.甲图表示称取7.5g氯化钠 B.乙图表示量取42.5mL水
C.丙图表示溶解氯化钠 D.丁图表示向试剂瓶中转移溶液
5.下列物质加入水中,不能形成溶液的是( )
A.食盐 B.白糖 C.植物油 D.白醋
6.下列推理正确的是( )
A.溶液是均一、稳定的,所以均一稳定的液体都是溶液
B.含有氧元素的化合物不一定是氧化物,但是氧化物中一定含有氧元素
C.燃烧伴随发光、放热现象,所以有发光,放热的变化都是燃烧
D.化合物由不同种元素组成,所以不同种元素组成的物质都是化合物
7.分析如图溶解度曲线,下列说法错误的是( )
A.t1℃时,甲和乙的溶解度相等
B.t2℃时,在100g水里加入100g甲固体,得到200g甲溶液
C.t2℃时,等质量的两种物质的饱和溶液同时降温至t1℃,盛有甲溶液的烧杯中析出较多晶体
D.将t1℃时两种物质的饱和溶液升温至t2℃,溶质质量分数:甲>乙
8.下列叙述错误的是( )
A.日常生活中可用肥皂水鉴别硬水和软水
B.铝比铁具有更好的抗腐蚀性能,是因为铁比铝更活泼
C.建造游泳中心“水立方”用到的聚乙烯是有机合成材料
D.用汽油和加了洗涤剂的水分别除去衣服上的油污,两者去污原理不同
9.物质在水中溶解是复杂的物理和化学变化过程,往往伴随着热量变化,因此,不同物质溶于水所得溶液的温度有所不同.下列物质溶于水,溶液温度明显降低的是
A.NH4NO3固体 B.NaOH 固体 C.NaCl 固体 D.浓H2SO4
10.“天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:( )
①硝酸钾、氯化铵和水的混合溶液
②溶质质量分数为24 %的樟脑的酒精溶液
下列说法中,错误的是
A.溶液中的溶质可以为多种
B.樟脑的酒精溶液中酒精是溶剂
C.溶质质量分数为24 %的含义是指每100 g的溶剂中,溶质是24 g
D.“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化
11.甲、乙、丙三种固体物质溶解度曲线如图所示,下列说法不正确的是( )
A.M点表示在t1℃时,乙和丙的溶解度相等
B.N点表示t1℃时,丙物质的不饱和溶液,其可以通过降温或加溶质的方式变为饱和溶液
C.t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为80g
D.甲的浓溶液中含有少量的丙,可以通过降温结晶的方式提纯甲
12.农业生成中常用溶质质量分数为16%的氯化钠溶液来选种,对该溶液理解正确的是( )
A.溶液中含氯化钠16g B.溶液质量为100g
C.每100g溶液中含氯化钠16g D.每100g水中含氯化钠16g
二、非选择题
13.阅读下列短文,回答问题。
氢氧化钙是一种白色粉末状固体,俗称熟石灰或消石灰,加入水后,分上下两层,上层水溶液俗称澄清石灰水,可用于CO2气体的检验。下层悬浊液称作石灰乳或石灰浆,是一种建筑材料。氢氧化钙是一种强碱,具有杀菌与防腐能力,对皮肤、织物有腐蚀作用。氢氧化钙用途广泛,除了用于建筑外,还可与硫酸铜溶液混合配制农药波尔多液,用加了硫粉的石灰乳涂抹于树上可以防冻和防止害虫产卵等。
(1)石灰水具有碱的化学性质是因为石灰水含有的阴离子是 。(填符号)
(2)如图是氢氧化钙的溶解度曲线。
①氢氧化钙的溶解性属于 。(填“可溶”“微溶”或“难溶”)
②试分析加热饱和石灰水变浑浊的原因: 。该变化是 (填“物理”或“化学”)变化。
(3)除上述内容外,请再举一例Ca(OH)2的用途: 。
14. 右图是常见固体物质的溶解度曲线,根据图示回答:
(1)曲线上M点表示 ,t3℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(2)t1℃时,将10g A物质放入100g水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液。欲使t2℃时C物质的饱和溶液变为不饱和溶液,可采取的方法是 (任填一种方法)。
(3)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:
①水的质量 ②溶液中KNO3的质量 ③KNO3的质量分数 ④30℃时KNO3的溶解度 ⑤溶液的质量
Ⅰ.在该不饱和溶液中加硝酸钾至饱和,不变的量有 (填序号,下同)。
Ⅱ.将该不饱和溶液恒温蒸发至饱和,不变的量有 。
15.据下图配制100g溶质质量分数为5%的氯化钠溶液。请回答下列问题:
(1)配制上述氯化钠溶液,需要水的质量为 g。
(2)该实验正确的操作顺序是_______
A.④⑤①②③ B.①②③④⑤
C.②①④③⑤ D.③④①②⑤
(3)如图⑤称量过程中若发现指针偏向左边,你应采取的操作是__________
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母
(4)用量筒量取水时,若仰视读数,则配制结果将偏 (填“大”或“小”)(假设氯化钠质量的计算和称量均正确,且实验过程中氯化钠无损失).
(5)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 。
16.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是 。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水 g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是 。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是 。
②实验二的目的是 。
思路分析:在实验中需要改变的因素是 ,需要保持不变的因素是 。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在 保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会 ;降低温度时,其最大溶解量会 。
17.小刚同学想测定黄铜(铜锌合金)中铜的质量分数。他取32.5克黄铜样品,加入足量稀硫酸,反应后生成了0.4克气体,请你帮他计算该合金中铜元素的质量分数。
答案解析部分
1.【答案】B
【解析】【解答】物质的溶解度随着温度的变化而变化的情况的一般规律是:大部分固体随温度升高溶解度增大,如硝酸钾;只有少数固体溶解度受温度影响不大,如食盐(氯化钠);极少数物质溶解度随温度升高反而减小,如熟石灰,B符合题意。
故答案为:B。【分析】本题主要考查常见物质的溶解度,需要掌握常见物质的溶解度与温度之间的关系。
2.【答案】D
【解析】【解答】A、活性炭具有吸附性,可做滤毒罐、脱色剂等,故不符合题意;
B、熟石灰具有腐蚀性,虽然是碱性物质但不能做发酵粉,故不符合题意;
C、氩气的化学性质稳定,可作保护气,可用作电光源是利用稀有气体在通电时能发出不同颜色的光,故不符合题意;
D、洗洁精具有乳化作用,可用于去除油污,故符合题意。
故答案为:D
【分析】物质的性质决定用途,可以根据物质的性质方面进行分析、判断,从而得出正确的结论。
3.【答案】A
【解析】【解答】结合题意,可以把此过程看作向20%NaCl溶液中,加入另一份溶质质量分数一定的溶液,据此分析判断即可。1.5gNaCl溶于6g水,溶液中溶质的质量分数为:
×100%=20%;即向20%NaCl溶液中,再加入相同溶质质量分数的溶液,所得溶液溶质质量分数仍为20%,A符合题意。
故答案为:A。【分析】本题主要考查溶液中溶质质量分数的计算,溶质质量分数等于溶质质量与溶液质量之比。
4.【答案】C
【解析】【解答】A、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,A选项图中所示操作错误;
B、量取42.5mL水,应使用50mL的量筒,不能使用烧杯,B选项图中所示操作错误;
C、溶解时,用玻璃棒不断搅拌,以加快溶解速率,C选项图中所示操作正确;
D、向试剂瓶中转移溶液,瓶塞要倒放,烧杯口要紧挨着试剂瓶口,D选项图中所示操作错误;
故选:C。
【分析】A、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断;
B、根据量取液体的方法,进行分析判断;
C、根据溶解操作的方法,进行分析判断;
D、根据转移溶液的方法,进行分析判断。
5.【答案】C
【解析】【解答】A、食盐能溶于水,形成均一、稳定的混合物,可以形成溶液,不符合题意;
B、白糖能溶于水,形成均一、稳定的混合物,可以形成溶液,不符合题意;
C、植物油不溶于水,只能以小液滴的形式悬浮于液体里形成乳浊液,符合题意;
D、白醋能溶于水,形成均一、稳定的混合物,可以形成溶液,不符合题意。
故答案为:C。
【分析】根据溶液的特征进行分析:均一的、稳定的混合物
6.【答案】B
【解析】【解答】A. 溶液是均一、稳定的,但均一、稳定的液体不一定都是溶液,如水是均一、稳定的液体,但不是溶液,故不符合题意。
B. 氧化物是由氧元素和另一种元素组成的化合物,因此氧化物一定含有氧元素,但含有氧元素的化合物不一定是氧化物,如:KMnO4,故符合题意。
C. 燃烧伴有发光、放热现象,但有发光、放热现象不一定是燃烧,如灯泡发光、放热,故不符合题意。
D. 化合物由不同种元素组成,不同种元素组成的纯净物是化合物,故不符合题意。
故答案为:B。
【分析】A、溶液是混合物,具有均一性、稳定性。
B、根据氧化物的概念,进行分析。
C、根据燃烧的特点,进行分析。
D、根据化合物的概念,进行分析。
7.【答案】D
【解析】【解答】A. 由溶解度曲线可知,t1℃时,甲和乙的溶解度相等,故正确,不符合题意;
B. t2℃时,甲物质的溶解度为110g,因此在100g水里加入100g甲固体能够完全溶解,得到200g甲溶液,故正确,不符合题意;
C. 因为甲物质的溶解度受温度的影响较大,因此t2℃时,等质量的两种物质的饱和溶液同时降温至t1℃,盛有甲溶液的烧杯中析出较多晶体,故正确,不符合题意;
D. t1℃时,甲和乙的溶解度相等,两种物质的饱和溶液溶质质量分数相等,将t1℃时两种物质的饱和溶液升温至t2℃,都无晶体析出,两种物质的溶质质量分数仍相等,故错误,符合题意;
故答案为:D
【分析】根据固体的溶解度曲线,可以比较不同物质在同一温度下的溶解度大小;可以判断物质的溶解度随温度变化的变化情况,从而判断降温后析出晶体的多少;可以查出某物质在一定温度下的溶解度,从而计算形成饱和溶液的质量。
8.【答案】B
【解析】【解答】解:A、肥皂水可以鉴别硬水和软水,泡沫多的是软水,泡沫少的是硬水,故正确;
B、铝在空气中易被氧气氧化,表面形成致密的氧化铝保护膜,故耐腐蚀,铝的金属活动性比铁活泼,故不正确;
C、聚乙烯是塑料,属于有机合成材料,故正确;
D、汽油除去衣服上的油污是溶解,洗涤剂除去衣服上的油污是溶解乳化,二者原理不同,故正确.
答案:B
【分析】A、根据用肥皂水可以鉴别硬水和软水解答;
B、根据铝、铁与氧气反应生成的氧化物的特点分析判断;
C、根据聚乙烯是塑料,属于有机合成材料分析;
D、根据汽油除去衣服上的油污是溶解,洗涤剂除去衣服上的油污是溶解乳化分析.
9.【答案】A
【解析】【解答】物质在溶解时经常伴随有吸热或放热现象,如氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低.
A. NH4NO3固体溶于水吸热,溶液温度明显降低.
B.NaOH固体溶于水放热,溶液温度明显升高.
C.氯化钠固体溶于水,既不吸热、也不放热,溶液温度基本保持不变.
D.浓硫酸溶于水放热,溶液温度明显升高.
故选:A.
【分析】根据常见物质溶于水的吸热与放热现象、溶液温度的变化情况进行分析解答即可.
10.【答案】C
【解析】【解答】A、溶液中的溶质可以为多种,如“天气瓶”内的液体主要成分是硝酸钾、氯化铵和水的混合溶液,其中硝酸钾、氯化铵是溶质,故A说法不符合题意;
B、固体溶于液体时,固体是溶质、液体是溶剂,故樟脑的酒精溶液中酒精是溶剂,故B说法不符合题意;
C、溶质质量分数为24%的含义是指每100g的溶液中,溶质是24g,故C说法符合题意;
D、物质的溶解度受温度影响,“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化,故D说法不符合题意;
故答案为:C。
【分析】A、根据溶液的概念分析
B、根据溶液中有水时溶剂一定是水分析
C、根据根据溶质质量分数的含义分析
D、根据溶解度的影响因素分析
11.【答案】B
【解析】【解答】A、在t1℃时,乙和丙的溶解度曲线交于M点,说明乙和丙的溶解度相等,故不符合题意;
B、丙物质的溶解度随着温度的升高而减小,N点表示在t1℃时丙物质的不饱和溶液,可以通过升温的办法或增加溶质的方式变为饱和溶液,而不是降温,故符合题意;
C、t3℃时,甲的溶解度为60g,因此用50g的水只能溶解30g的甲物质,充分溶解后所得的溶液的质量为50g+30g=80g,故不符合题意;
D、甲的溶解度随温度的降低而减小,丙的溶解度随温度的降低而增大,若甲的浓溶液中含有少量的丙,可以通过降温结晶的方式析出甲,从而提纯甲,故不符合题意。
故答案为:B。
【分析】由溶解度曲线图可以看出丙物质的溶解度随温度的升高而降低,图中N点代表t1℃时丙物质的不饱和溶液,要将此时的溶液变为饱和溶液可以通过加溶质或者蒸发溶剂的方法。
12.【答案】C
【解析】解答:由溶液中溶质质量分数= 可知,氯化钠溶液的溶质质量分数为16%是指100g食盐溶液中含有16g氯化钠.这要与溶解度的概念要区别清楚。
所以选:C.
分析:此题主要考查溶质的质量分数的含义,属基础性题.
13.【答案】(1)
(2)微溶;饱和石灰水的溶质是氢氧化钙,氢氧化钙的溶解度随温度升高而减小,即温度升高有氢氧化钙固体析出,所以加热饱和石灰水变浑浊;物理
(3)改良酸性土壤
【解析】【解答】(1)石灰水即氢氧化钙溶液,氢氧化钙溶液由钙离子、氢氧根离子、水分子构成,所以石灰水含有的阴离子是是氢氧根离子,符号为。
(2)根据氢氧化钙的溶解度曲线图,可知室温即20℃时氢氧化钙的溶解度约为0.17g,在0.01g~1g之间,所以,氢氧化钙的溶解性属于微溶。
饱和石灰水的溶质是氢氧化钙,氢氧化钙的溶解度随温度升高而减小,加热饱和石灰水即温度升高有氢氧化钙固体析出,所以加热饱和石灰水变浑浊。
氢氧化钙析出,没有生成新物质,是物理变化。
(3)Ca(OH)2的用途非常广泛。除了用于建筑外,还可与硫酸铜溶液混合配制农药波尔多液,用加了硫粉的石灰乳涂抹于树上可以防冻和防止害虫产卵,农业上还可用来改良酸性土壤等。
【分析】(1)根据碱的概念解答;
(2)根据氢氧化钙的溶解度曲线图分析;物理变化:无新物质生成;
(3)根据氢氧化钙的性质推断其用途。
14.【答案】t2℃时,A与C的溶解度相等;A>B>C;不饱和;加水或降温;①④;②④
【解析】【解答】(1)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等;因为曲线上M点为t2℃时,A与C两物质的溶解度曲线的交点,因此,M点表示t2℃时A与C两物质的溶解度相等。根据溶解度曲线可以比较相同温度时(或一定温度范围内)不同物质溶解度的大小;t3℃时,A、B、C三种物质的溶解度曲线的位置关系为:物质A的溶解度曲线位于最上方,而物质C的溶解度曲线位于最下方,故可判断此时A、B、C三种物质的溶解度由大到小的顺序为A>B>C。
(2)由A物质的溶解曲线可知,t1℃时物质A的溶解度为40g,即此时100g水最多可溶解A物质40g,因此,此时将10gA物质放入100g水中充分溶解后所得溶液为不饱和溶液;由C物质的溶解度曲线可知,物质C的溶解度随温度升高而减小,因此,采取加水或降温的方法都可以使t2℃时C物质的饱和溶液变为不饱和溶液。
(3)I.在30℃时不饱和KNO3溶液中加硝酸钾,硝酸钾继续溶解至饱和,此时所得饱和溶液中溶质质量增加,导致溶液的质量及溶液的溶质质量分数都变大,而溶液中溶剂水的质量不变,温度不变硝酸钾的溶解度也不改变;故选①④。
II.将30℃时不饱和KNO3溶液恒温蒸发至饱和,温度不变硝酸钾的溶解度也不变,蒸发溶剂水至饱和,溶液中溶质硝酸钾的质量不变,由于溶剂减少,溶液的质量减小、溶液的溶质质量分数变大吗,故选②④。
【分析】根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小。
15.【答案】(1)95g
(2)A
(3)B
(4)小
(5)加速氯化钠溶解
【解析】【解答】(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g=95g;(2)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量,正确顺序是④⑤①②③;(3)用托盘天平称量所需氯化钠时,步骤是:调节天平平衡,在右盘上加砝码和拨动游码,然后向左边托盘添加药品直至天平平衡;称量过程中发现天平的指针偏向左边,说明食盐的质量大于砝码质量,应减少食盐;(4)用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小;(5)溶解过程中用玻璃棒搅拌,其目的是加速氯化钠溶解。
故答案为:(1)95g(2)A(3)B(4)小(5)加速氯化钠溶解
【分析】(1)根据溶质质量分数的计算公式解答
(2)根据配置溶液的步骤解答
(3)根据天平指针偏向那边那边质量大解答
(4)仰视读数,量取的水多,配置的溶液中溶质的质量分数偏小
(5)根据配置溶液所用的仪器和玻璃棒的作用解答
16.【答案】(1)酒精
(2)50
(3)比较氯化钠在水和酒精中的溶解情况;同种溶质在不同的溶剂中溶解性不同;比较温度对硝酸钾在水中的溶解性的影响;温度;一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);溶质和溶剂的种类和质量;增加;减少
【解析】【解答】(1)消毒酒精是医疗上常用的一种溶液,其溶质是酒精,溶剂是水;
(2)若使溶液的溶质质量分数增大一倍,设应蒸发掉水的质量为x,则有100g×10%=(100g-x)×20%,x=50g;
(3)
①根据图示可知实验一的目的是比较氯化钠在水和酒精中的溶解情况;
氯化钠溶于水,几乎不溶于酒精,对比得出的实验结论是同种溶质在不同的溶剂中溶解性不同。
②根据图示可知,硝酸钾和水定量条件下,温度从20℃硝酸钾固体未完全溶解到加热完全溶解再到降温20℃硝酸钾固体未完全溶解,可知实验二的目的是比较温度对硝酸钾在水中的溶解性的影响;
由上分析可知在实验中需要改变的因素是温度,需要保持不变的因素是一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);
根据实验现象可知在溶质和溶剂的种类和质量保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会增加,降低温度时,其最大溶解量会减少。
【分析】(1)根据酒精溶液中溶质为酒精分析;
(2)根据溶质质量分数=溶质质量/溶液质量分析;
(3)根据所做实验中溶剂不同影响溶解性不同,溶质、溶剂种类和质量对物质溶解的量的影响分析。
17.【答案】60%
【解析】【解答】铜不与酸发生反应,产生氢气为锌与酸反应,设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
65:2=x:0.4g
x=13g
则铜的质量分数为。
【分析】根据锌与酸反应,铜不与酸反应,由锌与酸反应产生氢气质量代入方程式计算出锌的质量,从而计算铜的质量分数分析。
1 / 1
同课章节目录
