第1章 原子结构 元素周期律 复习练习 (含答案)2023-2024学年高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章 原子结构 元素周期律 复习练习 (含答案)2023-2024学年高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 476.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 22:07:29 | ||
图片预览



文档简介
第1章 原子结构 元素周期律 复习练习2023-2024学年高一下学期化学鲁科版(2019)必修第二册(附答案)
一、选择题。(18题)
1、已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子数相同,则下列关系式正确的是( )
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
2、下列叙述中一定能说明金属A比金属B的活泼性强的是( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1 mol A从酸中置换H+生成H2比1 mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢气,而B不能
3、元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
A.X有三种同位素
B.其中一种同位素的质量数为80
C.X2的平均相对分子质量为159
D.质量数为79的同位素的原子百分数为50%
4、如图是部分1~18号元素原子半径与原子序数的关系图,下列说法不正确的是( )
A.离子半径:N>Z B.原子序数:M<N
C.失电子能力:Y>Z D.单质的氧化性:N<X
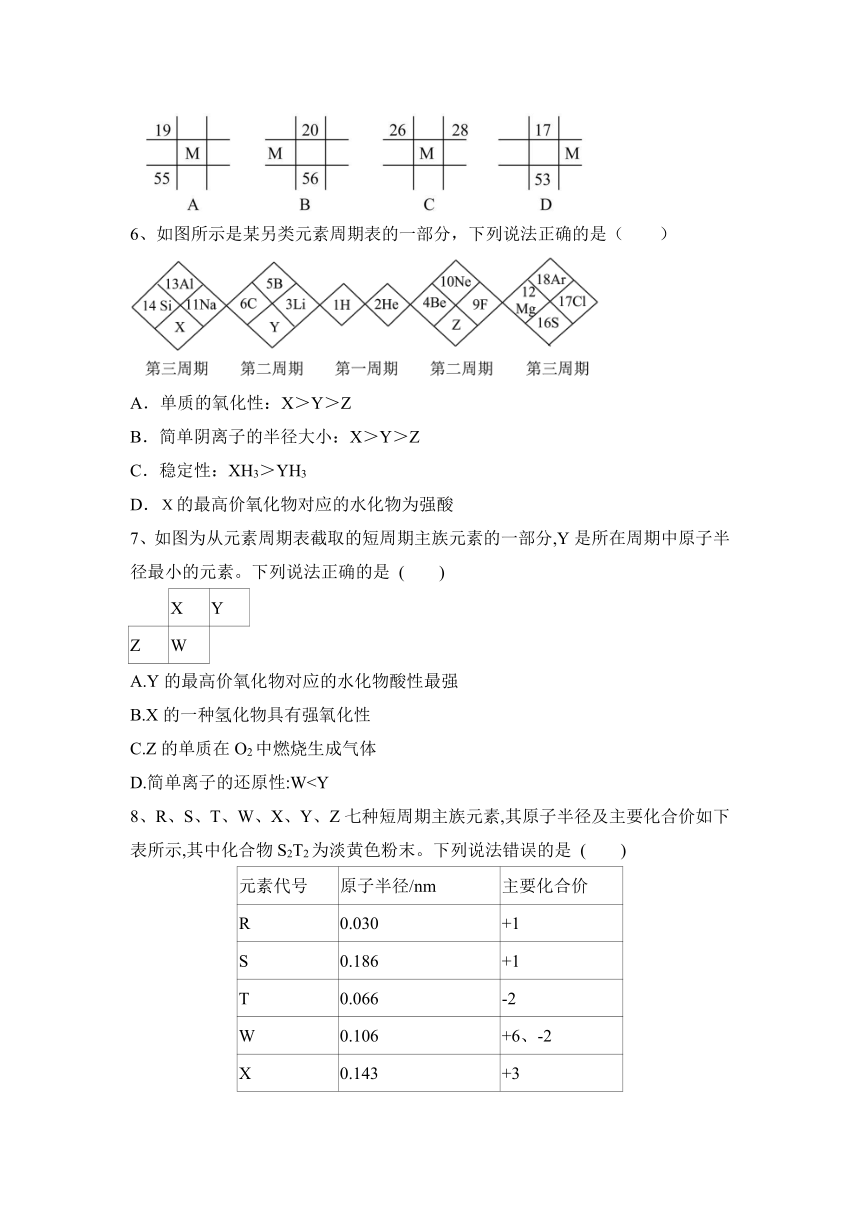
5、下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为36的是 ( )
6、如图所示是某另类元素周期表的一部分,下列说法正确的是( )
A.单质的氧化性:X>Y>Z
B.简单阴离子的半径大小:X>Y>Z
C.稳定性:XH3>YH3
D.的最高价氧化物对应的水化物为强酸
7、如图为从元素周期表截取的短周期主族元素的一部分,Y是所在周期中原子半径最小的元素。下列说法正确的是 ( )
X Y
Z W
A.Y的最高价氧化物对应的水化物酸性最强
B.X的一种氢化物具有强氧化性
C.Z的单质在O2中燃烧生成气体
D.简单离子的还原性:W8、R、S、T、W、X、Y、Z七种短周期主族元素,其原子半径及主要化合价如下表所示,其中化合物S2T2为淡黄色粉末。下列说法错误的是 ( )
元素代号 原子半径/nm 主要化合价
R 0.030 +1
S 0.186 +1
T 0.066 -2
W 0.106 +6、-2
X 0.143 +3
Y 0.160 +2
Z 0.099 -1
A.X(TR)3、STR、R2WT4三种化合物在一定条件下能够相互反应
B.简单氢化物的稳定性:WC.化合物S2T2与化合物R2T反应,S2T2既是氧化剂又是还原剂
D.Z元素位于第2周期ⅦA族
9、短周期主族元素R、X、Y、Z的原子序数依次增大,R元素最高正价和最低负价的代数和为2,在短周期主族元素中X原子半径最大,Y的单质可与某些金属氧化物反应用于焊接钢轨,Z元素形成的单质可使湿润的有色布条褪色。下列说法错误的是( )
A.最高价氧化物对应水化物的碱性:X>Y
B.R元素的氢化物可用作制冷剂
C.Z元素分别与X、Y元素形成的化合物一定是离子化合物
D.工业上常用电解法冶炼X和Y的单质
10、同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:WB.原子最外层电子数:WC.单质的氧化能力:WD.元素的最高化合价:W11、有下列结论:①微粒半径:S2->Cl>S>F;②氢化物的稳定性:HF>HCl>H2S>H2Se;③离子的还原性:S2->Cl->Br->I-;④氧化性:Cl2>S>Se>Te;⑤酸性:H2SO4>HClO4>H2SeO4;⑥非金属性:F>Cl>S>Se。其中正确的是( )
A.②④⑥ B.①③④ C.只有① D.只有⑥
12、下列物质属于硅酸盐材料的是( )
A.碳纤维 B.石灰石 C.普通水泥 D.石英玻璃
13、下列有关钯原子(Pd)的说法错误的是( )
A.原子序数为46 B.质子数为46
C.电子数为46 D.中子数为46
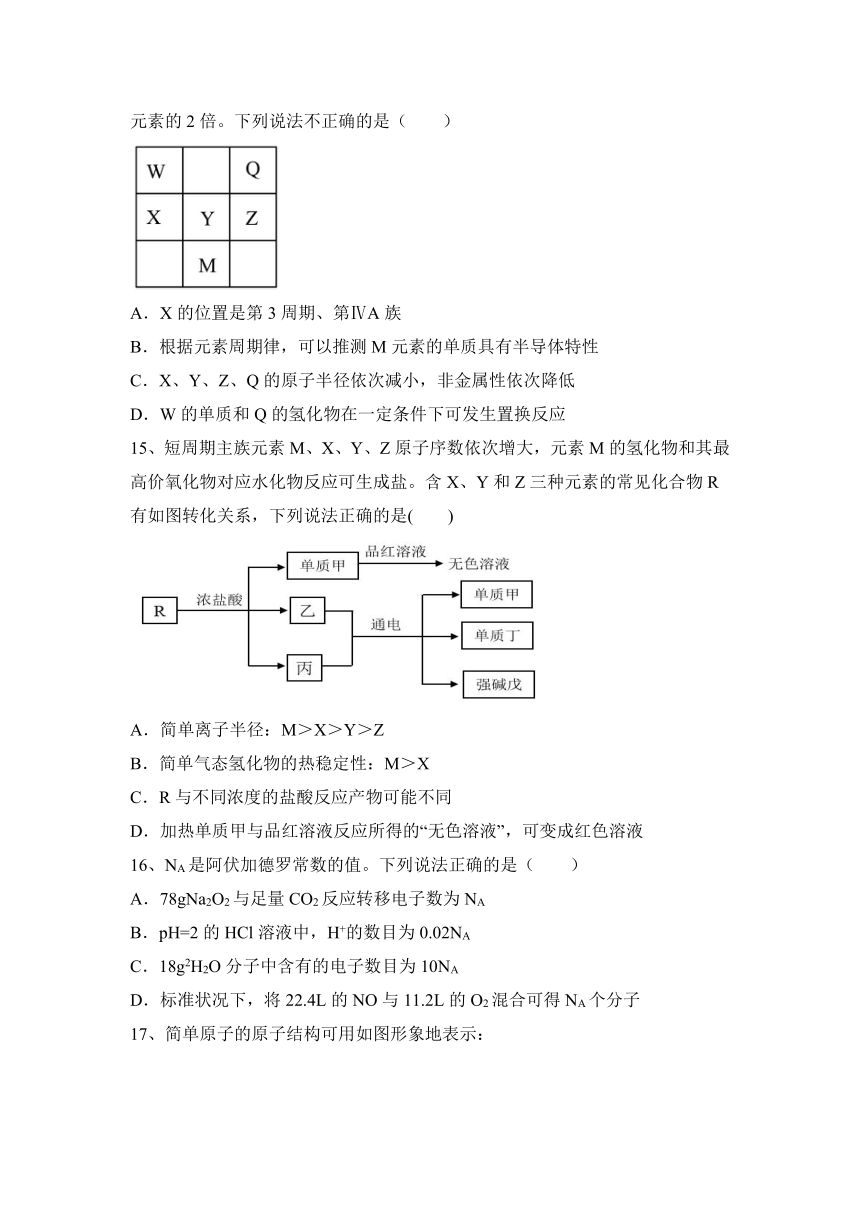
14、如图所示为元素周期表的一部分,都为短周期元素,Z元素的核电荷数为Q元素的2倍。下列说法不正确的是( )
A.X的位置是第3周期、第ⅣA族
B.根据元素周期律,可以推测M元素的单质具有半导体特性
C.X、Y、Z、Q的原子半径依次减小,非金属性依次降低
D.W的单质和Q的氢化物在一定条件下可发生置换反应
15、短周期主族元素M、X、Y、Z原子序数依次增大,元素M的氢化物和其最高价氧化物对应水化物反应可生成盐。含X、Y和Z三种元素的常见化合物R有如图转化关系,下列说法正确的是( )
A.简单离子半径:M>X>Y>Z
B.简单气态氢化物的热稳定性:M>X
C.R与不同浓度的盐酸反应产物可能不同
D.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
16、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.78gNa2O2与足量CO2反应转移电子数为NA
B.pH=2的HCl溶液中,H+的数目为0.02NA
C.18g2H2O分子中含有的电子数目为10NA
D.标准状况下,将22.4L的NO与11.2L的O2混合可得NA个分子
17、简单原子的原子结构可用如图形象地表示:
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
a.①②③互为同位素
b.①②③表示三种化学性质不同的粒子
c.①②③具有相同的质量数
d.①②③具有相同的质量
e.①②③是三种不同的原子
A.a、e B.b、e C.d、e D.a、c
18、水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2+O2+4OH-=Fe3O4+ +2H2O(已知Fe3O4可表示成FeO·Fe2O3),下列说法正确的是( )
A.铁位于周期表第四周期第ⅢB族
B.上述反应过程中仅Fe3+被氧化
C.Fe3O4纳米颗粒能够产生丁达尔效应
D.若有3mol Fe2+反应,则被Fe2+还原的O2,标准状况下为11.2L
二、填空题。(4题)
19、请按要求填空:
(1)简单原子的原子结构可用下图形象地表示:
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是__
A.①②③是三种不同的核素
B.①②③具有相同的质量数
C.①②③互为同位素
D.①②③是三种化学性质不同的粒子
(2)科学家已发现一种新型氢分子(H3),在相同条件下,等质量的H3和H2相同的是__ 。
A 分子数 B 原子数 C 体积 D 电子数
(3)微粒AXn+ 核外有a个电子,则它的核内中子数为______
(4)与10克D2O含有相同电子数的NH3在标准状况下的体积是_____
20、(1)硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。是玻璃的成分之一,与氢氧化钠溶液反应的离子方程式为:
,工艺师常用 (填物质名称)来雕刻玻璃。
(2)为实现燃煤脱硫,向煤中加入浆状,使燃烧产生的转化为稳定的化合物,写出该反应的化学方程式: 。
(3)工业上制取氯酸钾的主要步骤为:
Ⅰ、将通入石灰浆,在75℃左右充分反应,然后过滤;
Ⅱ、向滤液中加入稍过量的固体,进行适当操作可析出固体。
下图是有关物质的溶解度曲线。
①步骤Ⅱ中,若溶液中的含量为,则的物质的量浓度为 。
②步骤Ⅱ中的溶液经 、 、过滤、洗涤、干燥,即可得到较纯净的固体(填操作名称)。
③检验固体洗涤干净的操作方法是
。
21、六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是:_______________。
(2)A、C形成的四原子核化合物甲的电子式为_______,该化合物呈弱酸性,试写出这种化合物的电离方程式:_______________。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:__________________________________________________。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式:_______________________________________________________。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式:____________。
(6)A、E形成的四原子核化合物丙容易液化,其原因是:___________。
22、如图所示是部分元素在元素周期表中的位置,根据下列要求回答问题:
(1)下列关于 Ca、Bk(锫)、Ts和 Ts的说法中不正确的是________(填字母)。
A.117号元素的相对原子质量为293.5
B.Ts和 Ts互为同位素
C.Ca、Bk表示两种原子、两种元素
D.上述元素都位于长周期中
(2)根据元素周期表结构推知,117号元素在周期表中的位置是________(填字母)。
A.第7周期ⅣA族 B.第7周期ⅦA族
C.第6周期ⅣA族 D.第6周期ⅦA族
(3)117号元素Ts的气态氢化物稳定性比砹的气态氢化物稳定性________(填“强”或“弱”);它的最高价氧化物的化学式为________。
(4)下列关于上述元素及其化合物的判断中,正确的是________(填字母)。
A.I、Cs和 Cs放射性元素变成其他元素,发生了化学变化
B.氢化物稳定性:e>d
C.j元素与d元素组成的化合物颜色相同
D.加碘食盐中“碘”不是 I
三、实验题。
23、某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________
__________________ 。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________ 。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________ 。
第1章 原子结构 元素周期律 复习练习2023-2024学年高一下学期化学鲁科版(2019)必修第二册(附答案)
一、选择题。(18题)
1、已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子数相同,则下列关系式正确的是( )
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
【答案】A
2、下列叙述中一定能说明金属A比金属B的活泼性强的是( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1 mol A从酸中置换H+生成H2比1 mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢气,而B不能
【答案】D
3、元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
A.X有三种同位素
B.其中一种同位素的质量数为80
C.X2的平均相对分子质量为159
D.质量数为79的同位素的原子百分数为50%
【答案】C
4、如图是部分1~18号元素原子半径与原子序数的关系图,下列说法不正确的是( )
A.离子半径:N>Z B.原子序数:M<N
C.失电子能力:Y>Z D.单质的氧化性:N<X
【答案】C
5、下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为36的是 ( )
【答案】D。
6、如图所示是某另类元素周期表的一部分,下列说法正确的是( )
A.单质的氧化性:X>Y>Z
B.简单阴离子的半径大小:X>Y>Z
C.稳定性:XH3>YH3
D.的最高价氧化物对应的水化物为强酸
【答案】B
7、如图为从元素周期表截取的短周期主族元素的一部分,Y是所在周期中原子半径最小的元素。下列说法正确的是 ( )
X Y
Z W
A.Y的最高价氧化物对应的水化物酸性最强
B.X的一种氢化物具有强氧化性
C.Z的单质在O2中燃烧生成气体
D.简单离子的还原性:W【答案】B
8、R、S、T、W、X、Y、Z七种短周期主族元素,其原子半径及主要化合价如下表所示,其中化合物S2T2为淡黄色粉末。下列说法错误的是 ( )
元素代号 原子半径/nm 主要化合价
R 0.030 +1
S 0.186 +1
T 0.066 -2
W 0.106 +6、-2
X 0.143 +3
Y 0.160 +2
Z 0.099 -1
A.X(TR)3、STR、R2WT4三种化合物在一定条件下能够相互反应
B.简单氢化物的稳定性:WC.化合物S2T2与化合物R2T反应,S2T2既是氧化剂又是还原剂
D.Z元素位于第2周期ⅦA族
【答案】D
9、短周期主族元素R、X、Y、Z的原子序数依次增大,R元素最高正价和最低负价的代数和为2,在短周期主族元素中X原子半径最大,Y的单质可与某些金属氧化物反应用于焊接钢轨,Z元素形成的单质可使湿润的有色布条褪色。下列说法错误的是( )
A.最高价氧化物对应水化物的碱性:X>Y
B.R元素的氢化物可用作制冷剂
C.Z元素分别与X、Y元素形成的化合物一定是离子化合物
D.工业上常用电解法冶炼X和Y的单质
【答案】C
10、同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:WB.原子最外层电子数:WC.单质的氧化能力:WD.元素的最高化合价:W【答案】B
11、有下列结论:①微粒半径:S2->Cl>S>F;②氢化物的稳定性:HF>HCl>H2S>H2Se;③离子的还原性:S2->Cl->Br->I-;④氧化性:Cl2>S>Se>Te;⑤酸性:H2SO4>HClO4>H2SeO4;⑥非金属性:F>Cl>S>Se。其中正确的是( )
A.②④⑥ B.①③④ C.只有① D.只有⑥
【答案】A
12、下列物质属于硅酸盐材料的是( )
A.碳纤维 B.石灰石 C.普通水泥 D.石英玻璃
【答案】C
13、下列有关钯原子(Pd)的说法错误的是( )
A.原子序数为46 B.质子数为46
C.电子数为46 D.中子数为46
【答案】D
14、如图所示为元素周期表的一部分,都为短周期元素,Z元素的核电荷数为Q元素的2倍。下列说法不正确的是( )
A.X的位置是第3周期、第ⅣA族
B.根据元素周期律,可以推测M元素的单质具有半导体特性
C.X、Y、Z、Q的原子半径依次减小,非金属性依次降低
D.W的单质和Q的氢化物在一定条件下可发生置换反应
【答案】C
15、短周期主族元素M、X、Y、Z原子序数依次增大,元素M的氢化物和其最高价氧化物对应水化物反应可生成盐。含X、Y和Z三种元素的常见化合物R有如图转化关系,下列说法正确的是( )
A.简单离子半径:M>X>Y>Z
B.简单气态氢化物的热稳定性:M>X
C.R与不同浓度的盐酸反应产物可能不同
D.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
【答案】C
16、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.78gNa2O2与足量CO2反应转移电子数为NA
B.pH=2的HCl溶液中,H+的数目为0.02NA
C.18g2H2O分子中含有的电子数目为10NA
D.标准状况下,将22.4L的NO与11.2L的O2混合可得NA个分子
【答案】A
17、简单原子的原子结构可用如图形象地表示:
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
a.①②③互为同位素
b.①②③表示三种化学性质不同的粒子
c.①②③具有相同的质量数
d.①②③具有相同的质量
e.①②③是三种不同的原子
A.a、e B.b、e C.d、e D.a、c
【答案】A
18、水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2+O2+4OH-=Fe3O4+ +2H2O(已知Fe3O4可表示成FeO·Fe2O3),下列说法正确的是( )
A.铁位于周期表第四周期第ⅢB族
B.上述反应过程中仅Fe3+被氧化
C.Fe3O4纳米颗粒能够产生丁达尔效应
D.若有3mol Fe2+反应,则被Fe2+还原的O2,标准状况下为11.2L
【答案】D
二、填空题。(4题)
19、请按要求填空:
(1)简单原子的原子结构可用下图形象地表示:
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是__
A.①②③是三种不同的核素
B.①②③具有相同的质量数
C.①②③互为同位素
D.①②③是三种化学性质不同的粒子
(2)科学家已发现一种新型氢分子(H3),在相同条件下,等质量的H3和H2相同的是__
A 分子数 B 原子数 C 体积 D 电子数
(3)微粒AXn+ 核外有a个电子,则它的核内中子数为______
(4)与10克D2O含有相同电子数的NH3在标准状况下的体积是_____
【答案】 AC BD 11.2L
20、(1)硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。是玻璃的成分之一,与氢氧化钠溶液反应的离子方程式为:
,工艺师常用 (填物质名称)来雕刻玻璃。
(2)为实现燃煤脱硫,向煤中加入浆状,使燃烧产生的转化为稳定的化合物,写出该反应的化学方程式: 。
(3)工业上制取氯酸钾的主要步骤为:
Ⅰ、将通入石灰浆,在75℃左右充分反应,然后过滤;
Ⅱ、向滤液中加入稍过量的固体,进行适当操作可析出固体。
下图是有关物质的溶解度曲线。
①步骤Ⅱ中,若溶液中的含量为,则的物质的量浓度为 。
②步骤Ⅱ中的溶液经 、 、过滤、洗涤、干燥,即可得到较纯净的固体(填操作名称)。
③检验固体洗涤干净的操作方法是
。
【答案】(1) 氢氟酸
(2)
(3) 蒸发浓缩 冷却结晶
取少量最后一次洗涤液于试管中,滴加溶液,若无白色沉淀产生,则说明已洗涤干净(或其它合理答案)
21、六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是:_______________。
(2)A、C形成的四原子核化合物甲的电子式为_______,该化合物呈弱酸性,试写出这种化合物的电离方程式:_______________。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:__________________________________________________。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式:_______________________________________________________。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式:____________。
(6)A、E形成的四原子核化合物丙容易液化,其原因是:___________。
【答案】SO32-+H2OHSO3-+OH-(HSO3-+H2OH2SO3+OH-) H2O2HO2-+H+ H++HSO3-=SO2↑+H2O H2O2+H2SO3=H2SO4+H2O Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓ 分子间形成氢键,增加了分子之间的作用力,使之易液化
22、如图所示是部分元素在元素周期表中的位置,根据下列要求回答问题:
(1)下列关于 Ca、Bk(锫)、Ts和 Ts的说法中不正确的是________(填字母)。
A.117号元素的相对原子质量为293.5
B.Ts和 Ts互为同位素
C.Ca、Bk表示两种原子、两种元素
D.上述元素都位于长周期中
(2)根据元素周期表结构推知,117号元素在周期表中的位置是________(填字母)。
A.第7周期ⅣA族 B.第7周期ⅦA族
C.第6周期ⅣA族 D.第6周期ⅦA族
(3)117号元素Ts的气态氢化物稳定性比砹的气态氢化物稳定性________(填“强”或“弱”);它的最高价氧化物的化学式为________。
(4)下列关于上述元素及其化合物的判断中,正确的是________(填字母)。
A.I、Cs和 Cs放射性元素变成其他元素,发生了化学变化
B.氢化物稳定性:e>d
C.j元素与d元素组成的化合物颜色相同
D.加碘食盐中“碘”不是 I
【答案】(1)A (2)B (3)弱 Ts2O7 (4)BD
三、实验题。
23、某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________
__________________ 。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________ 。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________ 。
【答案】(1)坩埚 500 mL容量瓶
(2)向分液漏斗中加入少量水,检查旋塞处是否漏水;
将漏斗倒转过来,检查玻璃塞是否漏水 液
体分上下两层,下层呈紫红色 AB 过滤
主要由于碘易升华,会导致碘的损失
一、选择题。(18题)
1、已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子数相同,则下列关系式正确的是( )
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
2、下列叙述中一定能说明金属A比金属B的活泼性强的是( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1 mol A从酸中置换H+生成H2比1 mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢气,而B不能
3、元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
A.X有三种同位素
B.其中一种同位素的质量数为80
C.X2的平均相对分子质量为159
D.质量数为79的同位素的原子百分数为50%
4、如图是部分1~18号元素原子半径与原子序数的关系图,下列说法不正确的是( )
A.离子半径:N>Z B.原子序数:M<N
C.失电子能力:Y>Z D.单质的氧化性:N<X
5、下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为36的是 ( )
6、如图所示是某另类元素周期表的一部分,下列说法正确的是( )
A.单质的氧化性:X>Y>Z
B.简单阴离子的半径大小:X>Y>Z
C.稳定性:XH3>YH3
D.的最高价氧化物对应的水化物为强酸
7、如图为从元素周期表截取的短周期主族元素的一部分,Y是所在周期中原子半径最小的元素。下列说法正确的是 ( )
X Y
Z W
A.Y的最高价氧化物对应的水化物酸性最强
B.X的一种氢化物具有强氧化性
C.Z的单质在O2中燃烧生成气体
D.简单离子的还原性:W
元素代号 原子半径/nm 主要化合价
R 0.030 +1
S 0.186 +1
T 0.066 -2
W 0.106 +6、-2
X 0.143 +3
Y 0.160 +2
Z 0.099 -1
A.X(TR)3、STR、R2WT4三种化合物在一定条件下能够相互反应
B.简单氢化物的稳定性:W
D.Z元素位于第2周期ⅦA族
9、短周期主族元素R、X、Y、Z的原子序数依次增大,R元素最高正价和最低负价的代数和为2,在短周期主族元素中X原子半径最大,Y的单质可与某些金属氧化物反应用于焊接钢轨,Z元素形成的单质可使湿润的有色布条褪色。下列说法错误的是( )
A.最高价氧化物对应水化物的碱性:X>Y
B.R元素的氢化物可用作制冷剂
C.Z元素分别与X、Y元素形成的化合物一定是离子化合物
D.工业上常用电解法冶炼X和Y的单质
10、同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:W
A.②④⑥ B.①③④ C.只有① D.只有⑥
12、下列物质属于硅酸盐材料的是( )
A.碳纤维 B.石灰石 C.普通水泥 D.石英玻璃
13、下列有关钯原子(Pd)的说法错误的是( )
A.原子序数为46 B.质子数为46
C.电子数为46 D.中子数为46
14、如图所示为元素周期表的一部分,都为短周期元素,Z元素的核电荷数为Q元素的2倍。下列说法不正确的是( )
A.X的位置是第3周期、第ⅣA族
B.根据元素周期律,可以推测M元素的单质具有半导体特性
C.X、Y、Z、Q的原子半径依次减小,非金属性依次降低
D.W的单质和Q的氢化物在一定条件下可发生置换反应
15、短周期主族元素M、X、Y、Z原子序数依次增大,元素M的氢化物和其最高价氧化物对应水化物反应可生成盐。含X、Y和Z三种元素的常见化合物R有如图转化关系,下列说法正确的是( )
A.简单离子半径:M>X>Y>Z
B.简单气态氢化物的热稳定性:M>X
C.R与不同浓度的盐酸反应产物可能不同
D.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
16、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.78gNa2O2与足量CO2反应转移电子数为NA
B.pH=2的HCl溶液中,H+的数目为0.02NA
C.18g2H2O分子中含有的电子数目为10NA
D.标准状况下,将22.4L的NO与11.2L的O2混合可得NA个分子
17、简单原子的原子结构可用如图形象地表示:
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
a.①②③互为同位素
b.①②③表示三种化学性质不同的粒子
c.①②③具有相同的质量数
d.①②③具有相同的质量
e.①②③是三种不同的原子
A.a、e B.b、e C.d、e D.a、c
18、水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2+O2+4OH-=Fe3O4+ +2H2O(已知Fe3O4可表示成FeO·Fe2O3),下列说法正确的是( )
A.铁位于周期表第四周期第ⅢB族
B.上述反应过程中仅Fe3+被氧化
C.Fe3O4纳米颗粒能够产生丁达尔效应
D.若有3mol Fe2+反应,则被Fe2+还原的O2,标准状况下为11.2L
二、填空题。(4题)
19、请按要求填空:
(1)简单原子的原子结构可用下图形象地表示:
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是__
A.①②③是三种不同的核素
B.①②③具有相同的质量数
C.①②③互为同位素
D.①②③是三种化学性质不同的粒子
(2)科学家已发现一种新型氢分子(H3),在相同条件下,等质量的H3和H2相同的是__ 。
A 分子数 B 原子数 C 体积 D 电子数
(3)微粒AXn+ 核外有a个电子,则它的核内中子数为______
(4)与10克D2O含有相同电子数的NH3在标准状况下的体积是_____
20、(1)硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。是玻璃的成分之一,与氢氧化钠溶液反应的离子方程式为:
,工艺师常用 (填物质名称)来雕刻玻璃。
(2)为实现燃煤脱硫,向煤中加入浆状,使燃烧产生的转化为稳定的化合物,写出该反应的化学方程式: 。
(3)工业上制取氯酸钾的主要步骤为:
Ⅰ、将通入石灰浆,在75℃左右充分反应,然后过滤;
Ⅱ、向滤液中加入稍过量的固体,进行适当操作可析出固体。
下图是有关物质的溶解度曲线。
①步骤Ⅱ中,若溶液中的含量为,则的物质的量浓度为 。
②步骤Ⅱ中的溶液经 、 、过滤、洗涤、干燥,即可得到较纯净的固体(填操作名称)。
③检验固体洗涤干净的操作方法是
。
21、六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是:_______________。
(2)A、C形成的四原子核化合物甲的电子式为_______,该化合物呈弱酸性,试写出这种化合物的电离方程式:_______________。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:__________________________________________________。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式:_______________________________________________________。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式:____________。
(6)A、E形成的四原子核化合物丙容易液化,其原因是:___________。
22、如图所示是部分元素在元素周期表中的位置,根据下列要求回答问题:
(1)下列关于 Ca、Bk(锫)、Ts和 Ts的说法中不正确的是________(填字母)。
A.117号元素的相对原子质量为293.5
B.Ts和 Ts互为同位素
C.Ca、Bk表示两种原子、两种元素
D.上述元素都位于长周期中
(2)根据元素周期表结构推知,117号元素在周期表中的位置是________(填字母)。
A.第7周期ⅣA族 B.第7周期ⅦA族
C.第6周期ⅣA族 D.第6周期ⅦA族
(3)117号元素Ts的气态氢化物稳定性比砹的气态氢化物稳定性________(填“强”或“弱”);它的最高价氧化物的化学式为________。
(4)下列关于上述元素及其化合物的判断中,正确的是________(填字母)。
A.I、Cs和 Cs放射性元素变成其他元素,发生了化学变化
B.氢化物稳定性:e>d
C.j元素与d元素组成的化合物颜色相同
D.加碘食盐中“碘”不是 I
三、实验题。
23、某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________
__________________ 。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________ 。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________ 。
第1章 原子结构 元素周期律 复习练习2023-2024学年高一下学期化学鲁科版(2019)必修第二册(附答案)
一、选择题。(18题)
1、已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子数相同,则下列关系式正确的是( )
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
【答案】A
2、下列叙述中一定能说明金属A比金属B的活泼性强的是( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1 mol A从酸中置换H+生成H2比1 mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢气,而B不能
【答案】D
3、元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
A.X有三种同位素
B.其中一种同位素的质量数为80
C.X2的平均相对分子质量为159
D.质量数为79的同位素的原子百分数为50%
【答案】C
4、如图是部分1~18号元素原子半径与原子序数的关系图,下列说法不正确的是( )
A.离子半径:N>Z B.原子序数:M<N
C.失电子能力:Y>Z D.单质的氧化性:N<X
【答案】C
5、下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为36的是 ( )
【答案】D。
6、如图所示是某另类元素周期表的一部分,下列说法正确的是( )
A.单质的氧化性:X>Y>Z
B.简单阴离子的半径大小:X>Y>Z
C.稳定性:XH3>YH3
D.的最高价氧化物对应的水化物为强酸
【答案】B
7、如图为从元素周期表截取的短周期主族元素的一部分,Y是所在周期中原子半径最小的元素。下列说法正确的是 ( )
X Y
Z W
A.Y的最高价氧化物对应的水化物酸性最强
B.X的一种氢化物具有强氧化性
C.Z的单质在O2中燃烧生成气体
D.简单离子的还原性:W
8、R、S、T、W、X、Y、Z七种短周期主族元素,其原子半径及主要化合价如下表所示,其中化合物S2T2为淡黄色粉末。下列说法错误的是 ( )
元素代号 原子半径/nm 主要化合价
R 0.030 +1
S 0.186 +1
T 0.066 -2
W 0.106 +6、-2
X 0.143 +3
Y 0.160 +2
Z 0.099 -1
A.X(TR)3、STR、R2WT4三种化合物在一定条件下能够相互反应
B.简单氢化物的稳定性:W
D.Z元素位于第2周期ⅦA族
【答案】D
9、短周期主族元素R、X、Y、Z的原子序数依次增大,R元素最高正价和最低负价的代数和为2,在短周期主族元素中X原子半径最大,Y的单质可与某些金属氧化物反应用于焊接钢轨,Z元素形成的单质可使湿润的有色布条褪色。下列说法错误的是( )
A.最高价氧化物对应水化物的碱性:X>Y
B.R元素的氢化物可用作制冷剂
C.Z元素分别与X、Y元素形成的化合物一定是离子化合物
D.工业上常用电解法冶炼X和Y的单质
【答案】C
10、同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:W
11、有下列结论:①微粒半径:S2->Cl>S>F;②氢化物的稳定性:HF>HCl>H2S>H2Se;③离子的还原性:S2->Cl->Br->I-;④氧化性:Cl2>S>Se>Te;⑤酸性:H2SO4>HClO4>H2SeO4;⑥非金属性:F>Cl>S>Se。其中正确的是( )
A.②④⑥ B.①③④ C.只有① D.只有⑥
【答案】A
12、下列物质属于硅酸盐材料的是( )
A.碳纤维 B.石灰石 C.普通水泥 D.石英玻璃
【答案】C
13、下列有关钯原子(Pd)的说法错误的是( )
A.原子序数为46 B.质子数为46
C.电子数为46 D.中子数为46
【答案】D
14、如图所示为元素周期表的一部分,都为短周期元素,Z元素的核电荷数为Q元素的2倍。下列说法不正确的是( )
A.X的位置是第3周期、第ⅣA族
B.根据元素周期律,可以推测M元素的单质具有半导体特性
C.X、Y、Z、Q的原子半径依次减小,非金属性依次降低
D.W的单质和Q的氢化物在一定条件下可发生置换反应
【答案】C
15、短周期主族元素M、X、Y、Z原子序数依次增大,元素M的氢化物和其最高价氧化物对应水化物反应可生成盐。含X、Y和Z三种元素的常见化合物R有如图转化关系,下列说法正确的是( )
A.简单离子半径:M>X>Y>Z
B.简单气态氢化物的热稳定性:M>X
C.R与不同浓度的盐酸反应产物可能不同
D.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
【答案】C
16、NA是阿伏加德罗常数的值。下列说法正确的是( )
A.78gNa2O2与足量CO2反应转移电子数为NA
B.pH=2的HCl溶液中,H+的数目为0.02NA
C.18g2H2O分子中含有的电子数目为10NA
D.标准状况下,将22.4L的NO与11.2L的O2混合可得NA个分子
【答案】A
17、简单原子的原子结构可用如图形象地表示:
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
a.①②③互为同位素
b.①②③表示三种化学性质不同的粒子
c.①②③具有相同的质量数
d.①②③具有相同的质量
e.①②③是三种不同的原子
A.a、e B.b、e C.d、e D.a、c
【答案】A
18、水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2+O2+4OH-=Fe3O4+ +2H2O(已知Fe3O4可表示成FeO·Fe2O3),下列说法正确的是( )
A.铁位于周期表第四周期第ⅢB族
B.上述反应过程中仅Fe3+被氧化
C.Fe3O4纳米颗粒能够产生丁达尔效应
D.若有3mol Fe2+反应,则被Fe2+还原的O2,标准状况下为11.2L
【答案】D
二、填空题。(4题)
19、请按要求填空:
(1)简单原子的原子结构可用下图形象地表示:
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是__
A.①②③是三种不同的核素
B.①②③具有相同的质量数
C.①②③互为同位素
D.①②③是三种化学性质不同的粒子
(2)科学家已发现一种新型氢分子(H3),在相同条件下,等质量的H3和H2相同的是__
A 分子数 B 原子数 C 体积 D 电子数
(3)微粒AXn+ 核外有a个电子,则它的核内中子数为______
(4)与10克D2O含有相同电子数的NH3在标准状况下的体积是_____
【答案】 AC BD 11.2L
20、(1)硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。是玻璃的成分之一,与氢氧化钠溶液反应的离子方程式为:
,工艺师常用 (填物质名称)来雕刻玻璃。
(2)为实现燃煤脱硫,向煤中加入浆状,使燃烧产生的转化为稳定的化合物,写出该反应的化学方程式: 。
(3)工业上制取氯酸钾的主要步骤为:
Ⅰ、将通入石灰浆,在75℃左右充分反应,然后过滤;
Ⅱ、向滤液中加入稍过量的固体,进行适当操作可析出固体。
下图是有关物质的溶解度曲线。
①步骤Ⅱ中,若溶液中的含量为,则的物质的量浓度为 。
②步骤Ⅱ中的溶液经 、 、过滤、洗涤、干燥,即可得到较纯净的固体(填操作名称)。
③检验固体洗涤干净的操作方法是
。
【答案】(1) 氢氟酸
(2)
(3) 蒸发浓缩 冷却结晶
取少量最后一次洗涤液于试管中,滴加溶液,若无白色沉淀产生,则说明已洗涤干净(或其它合理答案)
21、六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是:_______________。
(2)A、C形成的四原子核化合物甲的电子式为_______,该化合物呈弱酸性,试写出这种化合物的电离方程式:_______________。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:__________________________________________________。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式:_______________________________________________________。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式:____________。
(6)A、E形成的四原子核化合物丙容易液化,其原因是:___________。
【答案】SO32-+H2OHSO3-+OH-(HSO3-+H2OH2SO3+OH-) H2O2HO2-+H+ H++HSO3-=SO2↑+H2O H2O2+H2SO3=H2SO4+H2O Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓ 分子间形成氢键,增加了分子之间的作用力,使之易液化
22、如图所示是部分元素在元素周期表中的位置,根据下列要求回答问题:
(1)下列关于 Ca、Bk(锫)、Ts和 Ts的说法中不正确的是________(填字母)。
A.117号元素的相对原子质量为293.5
B.Ts和 Ts互为同位素
C.Ca、Bk表示两种原子、两种元素
D.上述元素都位于长周期中
(2)根据元素周期表结构推知,117号元素在周期表中的位置是________(填字母)。
A.第7周期ⅣA族 B.第7周期ⅦA族
C.第6周期ⅣA族 D.第6周期ⅦA族
(3)117号元素Ts的气态氢化物稳定性比砹的气态氢化物稳定性________(填“强”或“弱”);它的最高价氧化物的化学式为________。
(4)下列关于上述元素及其化合物的判断中,正确的是________(填字母)。
A.I、Cs和 Cs放射性元素变成其他元素,发生了化学变化
B.氢化物稳定性:e>d
C.j元素与d元素组成的化合物颜色相同
D.加碘食盐中“碘”不是 I
【答案】(1)A (2)B (3)弱 Ts2O7 (4)BD
三、实验题。
23、某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________
__________________ 。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________ 。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________ 。
【答案】(1)坩埚 500 mL容量瓶
(2)向分液漏斗中加入少量水,检查旋塞处是否漏水;
将漏斗倒转过来,检查玻璃塞是否漏水 液
体分上下两层,下层呈紫红色 AB 过滤
主要由于碘易升华,会导致碘的损失
