2023北京重点校高二(上)期中化学汇编:金属的腐蚀与防护(含解析)
文档属性
| 名称 | 2023北京重点校高二(上)期中化学汇编:金属的腐蚀与防护(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 16:23:20 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2023北京重点校高二(上)期中化学汇编
金属的腐蚀与防护
一、单选题
1.(2023北京丰台高二上期中)化学小组研究金属的电化学腐蚀,实验如下:
序号 实验Ⅰ 实验Ⅱ
实验
现象 铁钉周边出现_________色 锌片周边未见明显变化 铁钉周边出现蓝色 铜片周边略显红色
下列说法不正确的是
A.实验Ⅰ中铁钉周边出现红色
B.实验I中负极的电极反应式:
C.实验Ⅱ中正极的电极反应式:
D.对比实验I、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀
2.(2023北京101中学高二上期中)关于如图所示的原电池,下列说法正确的是
A.电极上发生还原反应
B.电子由锌片通过导线流向石墨棒
C.将稀硫酸换成乙醇,灯泡也能发光
D.当电路中有电子发生转移时,生成的体积为
3.(2023北京海淀高二上期中)用如下装置进行铁的电化学腐蚀实验。下列说法正确的是
A.铁发生的电极反应:
B.铁腐蚀过程中,化学能转化为热能
C.炭粉的存在对铁腐蚀的速率无影响
D.导管口产生气泡证明铁发生了析氢腐蚀
4.(2023北京四中高二上期中)如图所示的实验,不能达到实验目的的是
A B C D
制备胶体 验证溶解度大于 比较碳酸、醋酸和硼酸的酸性强弱 验证铁发生吸氧腐蚀
A.A B.B C.C D.D
5.(2023北京第十二中学高二上期中)下列实验不能达到实验目的的是
选项 A B C D
实验 2NO2(g,红棕色)N2O4(g,无色)
结论 证明温度对平衡的影响 制作简单燃料电池 精炼粗铜 防止铁管道被腐蚀
A.A B.B C.C D.D
6.(2023北京北师大二附中高二上期中)下列实验装置(部分夹持装置已略去)能达到对应实验目的是
A B C D
实验目的 测定锌与稀硫酸反应速率 测定中和反应的反应热 比较 AgCl和 Ag2S 溶度积大小 探究铁的析氢腐蚀
实验装置
A.A B.B C.C D.D
二、填空题
7.(2023北京丰台高二上期中)电化学原理在能量转换、物质制备、防止金属腐蚀等方面应用广泛。
(1)下图是常见电化学装置图
① 负极材料为Zn,其在此装置中的作用是 。
② 若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应 。
(2)下图探究金属Fe是否腐蚀的示意图
在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为 端(填“左”或“右”),结合化学用语解释变红的原因 。
(3)下图是氯碱工业电解饱和NaCl溶液的示意图
①电解饱和NaCl溶液的化学方程式是 。
② NaOH溶液从 (填b或c)口导出。结合化学用语解释NaOH在此区域生成的原因 。
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 。
(4)我国科学家通过电解,从海水中提取到锂单质,其工作原理如图所示。
①金属锂在电极 (填“A”或“B”)生成,发生的是 (填“氧化”或“还原”)反应。
②阳极产生两种气体单质,电极反应式分别是 ; 。
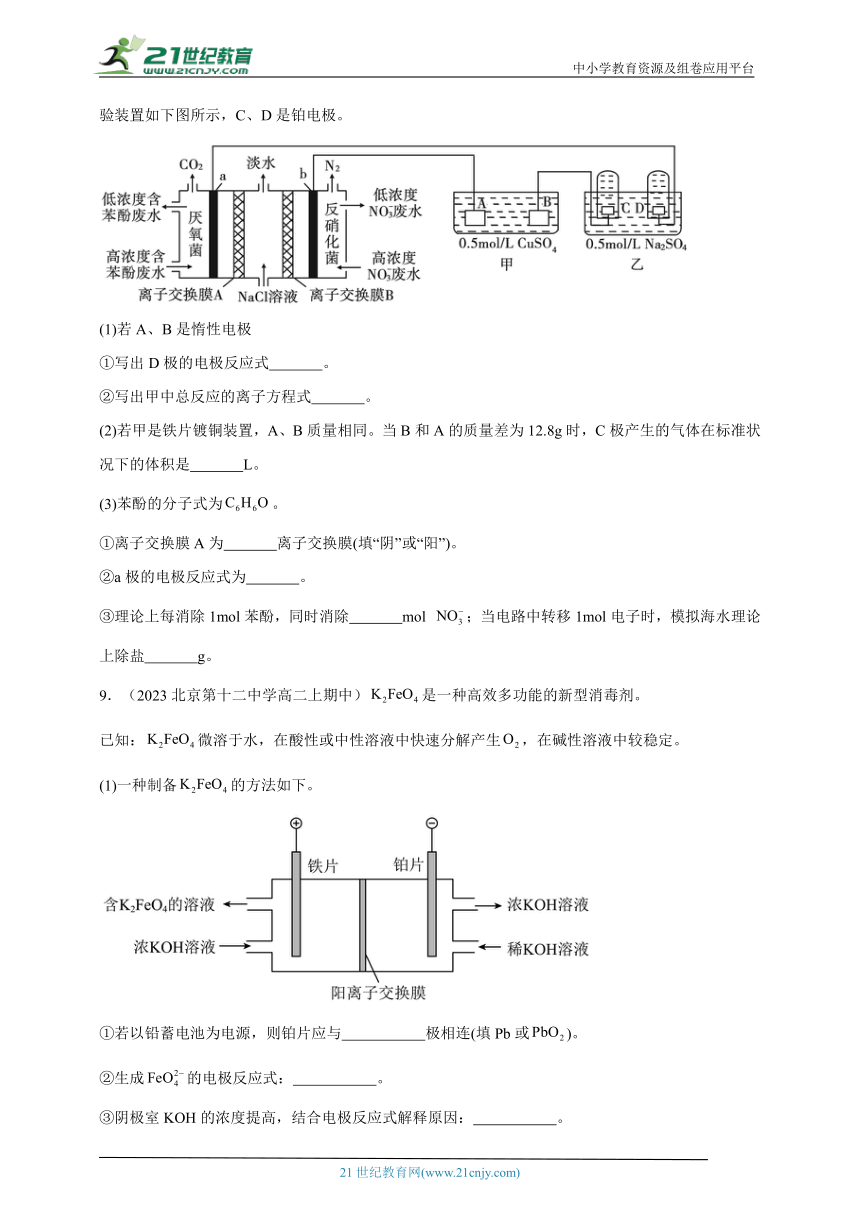
8.(2023北京汇文中学高二上期中)某研究小组用微生物电池模拟淡化海水,同时做电解实验,实验装置如下图所示,C、D是铂电极。
(1)若A、B是惰性电极
①写出D极的电极反应式 。
②写出甲中总反应的离子方程式 。
(2)若甲是铁片镀铜装置,A、B质量相同。当B和A的质量差为12.8g时,C极产生的气体在标准状况下的体积是 L。
(3)苯酚的分子式为。
①离子交换膜A为 离子交换膜(填“阴”或“阳”)。
②a极的电极反应式为 。
③理论上每消除1mol苯酚,同时消除 mol ;当电路中转移1mol电子时,模拟海水理论上除盐 g。
9.(2023北京第十二中学高二上期中)是一种高效多功能的新型消毒剂。
已知:微溶于水,在酸性或中性溶液中快速分解产生,在碱性溶液中较稳定。
(1)一种制备的方法如下。
①若以铅蓄电池为电源,则铂片应与 极相连(填Pb或)。
②生成的电极反应式: 。
③阴极室KOH的浓度提高,结合电极反应式解释原因: 。
(2)向含的溶液中加入KOH固体,析出固体,再用稀KOH溶液洗涤,得到粗品。用化学方程式解释不能用水洗涤的原因: 。
(3)电解1.5h后,测得,
已知:
①,说明除之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有和FeOOH,则 。
②判断阳极有水(或)放电,判断依据:
ⅰ.水(或)有还原性;
ⅱ. 。
参考答案
1.B
【详解】A.实验Ⅰ中锌做负极,铁做正极,铁钉极氧气得到电子发生还原反应生成氢氧根离子,溶液显碱性周边出现红色,故A正确;
B.实验I中锌做负极,负极的电极反应式:,故B错误;
C.实验Ⅱ中铜不活泼,铜作正极,正极的电极反应式:,故C正确;
D.对比实验I、Ⅱ可知,锌能保护铁,而铜铁形成原电池会加速铁锈蚀,故生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀,故D正确;
故选B。
2.B
【分析】由图知,电极锌为负极,失去电子,发生氧化反应,电极反应式为,石墨极为正极,得到电子,发生还原反应,电极反应式为,电子由负极经外电路流向正极。
【详解】A.由分析知,锌电极为负极,失去电子,发生氧化反应,A错误;
B.由分析知,电子由锌片通过导线流向石墨棒,B正确;
C.由于乙醇是非电解质,将稀硫酸换成乙醇,不能构成原电池,灯泡不发光,C错误;
D.未给定标准状况下,无法得知气体得体积,D错误;
故选B。
3.B
【详解】A.铁发生的电极反应:,故A错误;
B.铁腐蚀过程中,试管发热,说明化学能转化为热能,故B正确;
C.铁粉、炭粉、氯化钠溶液构成原电池,炭粉的存在加快铁腐蚀的速率,故C错误;
D.铁腐蚀过程中,试管内温度升高,气体膨胀,导管口产生气泡不能证明铁发生了析氢腐蚀,故D错误;
选B。
4.B
【详解】A.在沸水中滴加几滴饱和氯化铁溶液,加热至红褐色,可以制取氢氧化铁胶体,A项不符合题意;
B.由图中数据可知,硝酸银溶液是过量的,因此过量的银离子会直接和碘离子反应生成碘化银沉淀,不是沉淀的转化,因此无法证明AgCl溶解度大于AgI,B项符合题意;
C.向相同浓度的溶液和溶液中,滴加相同量的溶液,醋酸溶液中有气泡,生成了,说明醋酸酸性强于碳酸;而硼酸溶液中没有明显现象,说明硼酸酸性弱于碳酸;该实验能达到实验目的,C项不符合题意;
D.中性条件下,铁发生吸氧腐蚀,导致导气管中液面上升,因此可以实现目的,D项不符合题意;
故选B。
5.D
【详解】A.对于可逆反应,升高温度,气体的颜色变深,则平衡逆向移动;降低温度,气体颜色变浅,则平衡正向移动,A正确;
B.用惰性电极材料作电极,硫酸作电解质溶液,利用原电池原理,制作简单的燃料电池,B正确;
C.电解法精炼粗铜时,用纯铜作阴极,用粗铜作阳极,该装置能达到精炼铜的目的,C正确;
D.废铁、铁管道和电源形成电解池,为外加电流阴极保护法,但是应当将铁管道作阴极才能防止铁管道被腐蚀,图中铁管道作阳极,不能达到保护铁管道被腐蚀的目的,D错误;
故答案为:D。
6.A
【详解】A.针筒可测定氢气的体积,由单位时间内气体的体积可计算反应速率,故A正确;
B.图中保温效果差,不能测定中和热,故B错误;
C.硝酸银过量,分别与NaCl、Na2S反应生成沉淀,不能比较AgCl和Ag2S溶解度大小,故C错误;
D.食盐水为中性,Fe发生吸氧腐蚀,水沿导管上升可证明,故D错误;
答案选A。
7.(1) 做还原剂(或失电子),失电子的场所,电子导体,(任意两点即可) Cu 2e = Cu2+
(2) 左 铜、铁和溶液构成原电池,铜为正极,发生吸氧腐蚀,反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH ) > c(H+),溶液呈碱性
(3) 2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑ c c口为阴极区,阴极发生反应:2H2O + 2e =O2 ↑+ 2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出 Cl2 + H2O HCl + HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集
(4) A 还原 2H2O 4e = O2↑ + 4H+ 2Cl 2e =Cl2 ↑
【详解】(1)①该图装置为原电池,Zn易失电子作负极发生氧化反应、电子经锌和导线流向Cu极,Cu作正极,正极上铜离子得电子发生还原反应。负极材料为Zn,即Zn做还原剂(或失电子),失电子的场所,同时Zn也是导电,可以作为电子导体,故答案为:做还原剂(或失电子),失电子的场所,电子导体,(任意两点即可);
②若用一根铜丝代替盐桥插入烧杯,则左侧烧杯中发生锌的吸氧腐蚀,为原电池,右侧烧杯为电解池,a电极与原电池的正极相连,为阳极,电极反应Cu 2e = Cu2+;
故答案为:Cu 2e = Cu2+;
(2)铜、铁和溶液构成原电池,铜为正极,整个体系中发生Fe的吸氧腐蚀,正极反应为O2+4e +2H2O=4OH ,使左端附近溶液中,c(OH ) > c(H+),溶液呈碱性,所以铜端变红;
故答案为:左;铜、铁和溶液构成原电池,铜为正极,发生吸氧腐蚀,反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH ) > c(H+),溶液呈碱性;
(3)①电解饱和NaCl溶液时,阳极氯离子被氧化为氯气,阴极水电离出的氢离子被还原生成氢气,同时产生氢氧根,化学方程式是2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑,故答案为:2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑;
②由电源可知,与负极相连的为阴极,c口为阴极区,阴极发生反应:2H2O+2e-=O2↑+2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出,故答案为:c;c口为阴极区,阴极发生反应:2H2O + 2e =O2 ↑+ 2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出;
③阳极产生的氯气会和水发生反应,存在着下列平衡:Cl2+H2OHCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集,故答案为:Cl2 + H2O HCl + HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集;
(4)①Li+得到电子发生还原反应转化为锂单质,根据图示电子流向分析可知A极得到电子,所以金属锂在A电极生成,发生的是还原反应;
②阳极上失电子发生氧化反应,且阳极附近主要含有OH-和Cl-等,阳极产生两种气体单质,则阳极对应的电极反应式分别是2H2O 4e = O2↑ + 4H+;2Cl 2e =Cl2 ↑。
8.(1)
(2)1.12L
(3) 阴 5.6 58.5
【分析】根据装置图可以知道,左侧为原电池,右侧为电解池。原电池中电极a苯酚失电子转化为CO2,所以电极a为负极,则电极b为正极;在电解池中,根据电源正对阳极,负极对阴极,可知电极A、C为阳极,电极B、D为阴极。
【详解】(1)①电极D为阴极,阳离子H+和SO移向电极D,H+优先得电子,故电极反应为;②甲装置为电解池,且A、B为惰性电极,电解质为CuSO4;阳离子Cu2+和H+移向阴极B反应,Cu2+优先得电子被还原为Cu,阴离子OH-和SO移向阳极,OH-优先失电子被还原为O2,故甲中总反应的离子方程式为。
(2)若甲是铁片镀铜装置,则阳极A为单质Cu,电极反应为,阴极B为镀件铁片,电极反应为Cu2++2e-=Cu, 当B和A的质量差为17.8g时,电极A质量减小6.4g,电极B质量增加6.4g,通过电极反应可知,转移电子数为×2=0.2mol,根据电荷守恒,电极C(阳极)将失去0.2mol电子,根据电极C的电极反应,生成氧气为0.05mol,体积为0.05mol×22.4L/mol=1.12L。
(3)①左侧原电池中NaCl溶液转化为淡水,可知Na+移向正极b,Cl-移向负极a,所以离子交换膜A为阴离子交换膜;②电极a中反应物苯酚转化为CO2,其中苯酚中C的化合价为-价,CO2中的C的化合价为+4价,转移电子数目为28,故a电极反应为;③根据a电极反应可知,每消除1mol苯酚转移电子28mol,b电极反应为2NO+10e-+12H+=N2↑+6H2O,转移28mol电子时,消除NO=5.6mol;当电路中转移1mol电子时,有1mol的Na+移向正极,1molde Cl-移向负极,模拟海水理论上除去1mol,即58.5gNaCl。
【点睛】在书写电极反应式时,要根据电解质的酸碱性分析电极反应的产物是否能稳定存在,如果产物能与电解质的离子继续反应,就要合在一起写出总式,才是正确的电极反应式。有时燃料电池的负极反应会较复杂,我们可以先写出总反应,再写正极反应,最后根据总反应和正极反应写出负极反应。
9.(1) Pb 阴极反应,浓度增大;通过阳离子交换膜进入阴极室
(2)
(3) 13.3% (或其他合理答案)
【详解】(1)①铅蓄电池中Pb电极为负极,电极为正极,由图可知,铁片为阳极,失去电子生成,则铂片为阴极,与Pb极相连;
②铁片为阳极,失去电子生成,根据得失电子守恒和电荷守恒配平电极方程式为:;
③阴极反应,浓度增大;通过阳离子交换膜进入阴极室。
(2)K2FeO4在中性溶液中快速分解产生O2,可知K2FeO4和水反应产生O2,根据得失电子守恒和原子守恒配平化学方程式为。
(3)①Fe→,Fe的化合价从0价变为+6价,Fe→FeOOH,Fe的化合价从0变为+3价。S(K2FeO4)=60%,说明40%的Fe转化为了FeOOH,假设共有1molFe,则n(生成所用的电子)=1mol×60%×6=3.6mol,n(通过电极的电子)= =9mol,则n(生成FeOOH所用的电子)=1mol×40%×3=1.2mol,η(FeOOH)= ×100%=13.3%。
②η(K2FeO4)+η(FeOOH)<100%,说明不只有Fe被氧化失去电子,阳极还有水(或OH )放电。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2023北京重点校高二(上)期中化学汇编
金属的腐蚀与防护
一、单选题
1.(2023北京丰台高二上期中)化学小组研究金属的电化学腐蚀,实验如下:
序号 实验Ⅰ 实验Ⅱ
实验
现象 铁钉周边出现_________色 锌片周边未见明显变化 铁钉周边出现蓝色 铜片周边略显红色
下列说法不正确的是
A.实验Ⅰ中铁钉周边出现红色
B.实验I中负极的电极反应式:
C.实验Ⅱ中正极的电极反应式:
D.对比实验I、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀
2.(2023北京101中学高二上期中)关于如图所示的原电池,下列说法正确的是
A.电极上发生还原反应
B.电子由锌片通过导线流向石墨棒
C.将稀硫酸换成乙醇,灯泡也能发光
D.当电路中有电子发生转移时,生成的体积为
3.(2023北京海淀高二上期中)用如下装置进行铁的电化学腐蚀实验。下列说法正确的是
A.铁发生的电极反应:
B.铁腐蚀过程中,化学能转化为热能
C.炭粉的存在对铁腐蚀的速率无影响
D.导管口产生气泡证明铁发生了析氢腐蚀
4.(2023北京四中高二上期中)如图所示的实验,不能达到实验目的的是
A B C D
制备胶体 验证溶解度大于 比较碳酸、醋酸和硼酸的酸性强弱 验证铁发生吸氧腐蚀
A.A B.B C.C D.D
5.(2023北京第十二中学高二上期中)下列实验不能达到实验目的的是
选项 A B C D
实验 2NO2(g,红棕色)N2O4(g,无色)
结论 证明温度对平衡的影响 制作简单燃料电池 精炼粗铜 防止铁管道被腐蚀
A.A B.B C.C D.D
6.(2023北京北师大二附中高二上期中)下列实验装置(部分夹持装置已略去)能达到对应实验目的是
A B C D
实验目的 测定锌与稀硫酸反应速率 测定中和反应的反应热 比较 AgCl和 Ag2S 溶度积大小 探究铁的析氢腐蚀
实验装置
A.A B.B C.C D.D
二、填空题
7.(2023北京丰台高二上期中)电化学原理在能量转换、物质制备、防止金属腐蚀等方面应用广泛。
(1)下图是常见电化学装置图
① 负极材料为Zn,其在此装置中的作用是 。
② 若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应 。
(2)下图探究金属Fe是否腐蚀的示意图
在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为 端(填“左”或“右”),结合化学用语解释变红的原因 。
(3)下图是氯碱工业电解饱和NaCl溶液的示意图
①电解饱和NaCl溶液的化学方程式是 。
② NaOH溶液从 (填b或c)口导出。结合化学用语解释NaOH在此区域生成的原因 。
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 。
(4)我国科学家通过电解,从海水中提取到锂单质,其工作原理如图所示。
①金属锂在电极 (填“A”或“B”)生成,发生的是 (填“氧化”或“还原”)反应。
②阳极产生两种气体单质,电极反应式分别是 ; 。
8.(2023北京汇文中学高二上期中)某研究小组用微生物电池模拟淡化海水,同时做电解实验,实验装置如下图所示,C、D是铂电极。
(1)若A、B是惰性电极
①写出D极的电极反应式 。
②写出甲中总反应的离子方程式 。
(2)若甲是铁片镀铜装置,A、B质量相同。当B和A的质量差为12.8g时,C极产生的气体在标准状况下的体积是 L。
(3)苯酚的分子式为。
①离子交换膜A为 离子交换膜(填“阴”或“阳”)。
②a极的电极反应式为 。
③理论上每消除1mol苯酚,同时消除 mol ;当电路中转移1mol电子时,模拟海水理论上除盐 g。
9.(2023北京第十二中学高二上期中)是一种高效多功能的新型消毒剂。
已知:微溶于水,在酸性或中性溶液中快速分解产生,在碱性溶液中较稳定。
(1)一种制备的方法如下。
①若以铅蓄电池为电源,则铂片应与 极相连(填Pb或)。
②生成的电极反应式: 。
③阴极室KOH的浓度提高,结合电极反应式解释原因: 。
(2)向含的溶液中加入KOH固体,析出固体,再用稀KOH溶液洗涤,得到粗品。用化学方程式解释不能用水洗涤的原因: 。
(3)电解1.5h后,测得,
已知:
①,说明除之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有和FeOOH,则 。
②判断阳极有水(或)放电,判断依据:
ⅰ.水(或)有还原性;
ⅱ. 。
参考答案
1.B
【详解】A.实验Ⅰ中锌做负极,铁做正极,铁钉极氧气得到电子发生还原反应生成氢氧根离子,溶液显碱性周边出现红色,故A正确;
B.实验I中锌做负极,负极的电极反应式:,故B错误;
C.实验Ⅱ中铜不活泼,铜作正极,正极的电极反应式:,故C正确;
D.对比实验I、Ⅱ可知,锌能保护铁,而铜铁形成原电池会加速铁锈蚀,故生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀,故D正确;
故选B。
2.B
【分析】由图知,电极锌为负极,失去电子,发生氧化反应,电极反应式为,石墨极为正极,得到电子,发生还原反应,电极反应式为,电子由负极经外电路流向正极。
【详解】A.由分析知,锌电极为负极,失去电子,发生氧化反应,A错误;
B.由分析知,电子由锌片通过导线流向石墨棒,B正确;
C.由于乙醇是非电解质,将稀硫酸换成乙醇,不能构成原电池,灯泡不发光,C错误;
D.未给定标准状况下,无法得知气体得体积,D错误;
故选B。
3.B
【详解】A.铁发生的电极反应:,故A错误;
B.铁腐蚀过程中,试管发热,说明化学能转化为热能,故B正确;
C.铁粉、炭粉、氯化钠溶液构成原电池,炭粉的存在加快铁腐蚀的速率,故C错误;
D.铁腐蚀过程中,试管内温度升高,气体膨胀,导管口产生气泡不能证明铁发生了析氢腐蚀,故D错误;
选B。
4.B
【详解】A.在沸水中滴加几滴饱和氯化铁溶液,加热至红褐色,可以制取氢氧化铁胶体,A项不符合题意;
B.由图中数据可知,硝酸银溶液是过量的,因此过量的银离子会直接和碘离子反应生成碘化银沉淀,不是沉淀的转化,因此无法证明AgCl溶解度大于AgI,B项符合题意;
C.向相同浓度的溶液和溶液中,滴加相同量的溶液,醋酸溶液中有气泡,生成了,说明醋酸酸性强于碳酸;而硼酸溶液中没有明显现象,说明硼酸酸性弱于碳酸;该实验能达到实验目的,C项不符合题意;
D.中性条件下,铁发生吸氧腐蚀,导致导气管中液面上升,因此可以实现目的,D项不符合题意;
故选B。
5.D
【详解】A.对于可逆反应,升高温度,气体的颜色变深,则平衡逆向移动;降低温度,气体颜色变浅,则平衡正向移动,A正确;
B.用惰性电极材料作电极,硫酸作电解质溶液,利用原电池原理,制作简单的燃料电池,B正确;
C.电解法精炼粗铜时,用纯铜作阴极,用粗铜作阳极,该装置能达到精炼铜的目的,C正确;
D.废铁、铁管道和电源形成电解池,为外加电流阴极保护法,但是应当将铁管道作阴极才能防止铁管道被腐蚀,图中铁管道作阳极,不能达到保护铁管道被腐蚀的目的,D错误;
故答案为:D。
6.A
【详解】A.针筒可测定氢气的体积,由单位时间内气体的体积可计算反应速率,故A正确;
B.图中保温效果差,不能测定中和热,故B错误;
C.硝酸银过量,分别与NaCl、Na2S反应生成沉淀,不能比较AgCl和Ag2S溶解度大小,故C错误;
D.食盐水为中性,Fe发生吸氧腐蚀,水沿导管上升可证明,故D错误;
答案选A。
7.(1) 做还原剂(或失电子),失电子的场所,电子导体,(任意两点即可) Cu 2e = Cu2+
(2) 左 铜、铁和溶液构成原电池,铜为正极,发生吸氧腐蚀,反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH ) > c(H+),溶液呈碱性
(3) 2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑ c c口为阴极区,阴极发生反应:2H2O + 2e =O2 ↑+ 2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出 Cl2 + H2O HCl + HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集
(4) A 还原 2H2O 4e = O2↑ + 4H+ 2Cl 2e =Cl2 ↑
【详解】(1)①该图装置为原电池,Zn易失电子作负极发生氧化反应、电子经锌和导线流向Cu极,Cu作正极,正极上铜离子得电子发生还原反应。负极材料为Zn,即Zn做还原剂(或失电子),失电子的场所,同时Zn也是导电,可以作为电子导体,故答案为:做还原剂(或失电子),失电子的场所,电子导体,(任意两点即可);
②若用一根铜丝代替盐桥插入烧杯,则左侧烧杯中发生锌的吸氧腐蚀,为原电池,右侧烧杯为电解池,a电极与原电池的正极相连,为阳极,电极反应Cu 2e = Cu2+;
故答案为:Cu 2e = Cu2+;
(2)铜、铁和溶液构成原电池,铜为正极,整个体系中发生Fe的吸氧腐蚀,正极反应为O2+4e +2H2O=4OH ,使左端附近溶液中,c(OH ) > c(H+),溶液呈碱性,所以铜端变红;
故答案为:左;铜、铁和溶液构成原电池,铜为正极,发生吸氧腐蚀,反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH ) > c(H+),溶液呈碱性;
(3)①电解饱和NaCl溶液时,阳极氯离子被氧化为氯气,阴极水电离出的氢离子被还原生成氢气,同时产生氢氧根,化学方程式是2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑,故答案为:2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑;
②由电源可知,与负极相连的为阴极,c口为阴极区,阴极发生反应:2H2O+2e-=O2↑+2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出,故答案为:c;c口为阴极区,阴极发生反应:2H2O + 2e =O2 ↑+ 2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出;
③阳极产生的氯气会和水发生反应,存在着下列平衡:Cl2+H2OHCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集,故答案为:Cl2 + H2O HCl + HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集;
(4)①Li+得到电子发生还原反应转化为锂单质,根据图示电子流向分析可知A极得到电子,所以金属锂在A电极生成,发生的是还原反应;
②阳极上失电子发生氧化反应,且阳极附近主要含有OH-和Cl-等,阳极产生两种气体单质,则阳极对应的电极反应式分别是2H2O 4e = O2↑ + 4H+;2Cl 2e =Cl2 ↑。
8.(1)
(2)1.12L
(3) 阴 5.6 58.5
【分析】根据装置图可以知道,左侧为原电池,右侧为电解池。原电池中电极a苯酚失电子转化为CO2,所以电极a为负极,则电极b为正极;在电解池中,根据电源正对阳极,负极对阴极,可知电极A、C为阳极,电极B、D为阴极。
【详解】(1)①电极D为阴极,阳离子H+和SO移向电极D,H+优先得电子,故电极反应为;②甲装置为电解池,且A、B为惰性电极,电解质为CuSO4;阳离子Cu2+和H+移向阴极B反应,Cu2+优先得电子被还原为Cu,阴离子OH-和SO移向阳极,OH-优先失电子被还原为O2,故甲中总反应的离子方程式为。
(2)若甲是铁片镀铜装置,则阳极A为单质Cu,电极反应为,阴极B为镀件铁片,电极反应为Cu2++2e-=Cu, 当B和A的质量差为17.8g时,电极A质量减小6.4g,电极B质量增加6.4g,通过电极反应可知,转移电子数为×2=0.2mol,根据电荷守恒,电极C(阳极)将失去0.2mol电子,根据电极C的电极反应,生成氧气为0.05mol,体积为0.05mol×22.4L/mol=1.12L。
(3)①左侧原电池中NaCl溶液转化为淡水,可知Na+移向正极b,Cl-移向负极a,所以离子交换膜A为阴离子交换膜;②电极a中反应物苯酚转化为CO2,其中苯酚中C的化合价为-价,CO2中的C的化合价为+4价,转移电子数目为28,故a电极反应为;③根据a电极反应可知,每消除1mol苯酚转移电子28mol,b电极反应为2NO+10e-+12H+=N2↑+6H2O,转移28mol电子时,消除NO=5.6mol;当电路中转移1mol电子时,有1mol的Na+移向正极,1molde Cl-移向负极,模拟海水理论上除去1mol,即58.5gNaCl。
【点睛】在书写电极反应式时,要根据电解质的酸碱性分析电极反应的产物是否能稳定存在,如果产物能与电解质的离子继续反应,就要合在一起写出总式,才是正确的电极反应式。有时燃料电池的负极反应会较复杂,我们可以先写出总反应,再写正极反应,最后根据总反应和正极反应写出负极反应。
9.(1) Pb 阴极反应,浓度增大;通过阳离子交换膜进入阴极室
(2)
(3) 13.3% (或其他合理答案)
【详解】(1)①铅蓄电池中Pb电极为负极,电极为正极,由图可知,铁片为阳极,失去电子生成,则铂片为阴极,与Pb极相连;
②铁片为阳极,失去电子生成,根据得失电子守恒和电荷守恒配平电极方程式为:;
③阴极反应,浓度增大;通过阳离子交换膜进入阴极室。
(2)K2FeO4在中性溶液中快速分解产生O2,可知K2FeO4和水反应产生O2,根据得失电子守恒和原子守恒配平化学方程式为。
(3)①Fe→,Fe的化合价从0价变为+6价,Fe→FeOOH,Fe的化合价从0变为+3价。S(K2FeO4)=60%,说明40%的Fe转化为了FeOOH,假设共有1molFe,则n(生成所用的电子)=1mol×60%×6=3.6mol,n(通过电极的电子)= =9mol,则n(生成FeOOH所用的电子)=1mol×40%×3=1.2mol,η(FeOOH)= ×100%=13.3%。
②η(K2FeO4)+η(FeOOH)<100%,说明不只有Fe被氧化失去电子,阳极还有水(或OH )放电。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
