5.3无机非金属材料练习题(含解析)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.3无机非金属材料练习题(含解析)2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 433.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 00:00:00 | ||
图片预览




文档简介
5.3 无机非金属材料 练习题
一、单选题
1.从古至今,绘画艺术传颂着文明的发展,下列绘画的载体属于无机非金属材料的是( )
A.青铜器上的龙纹 B.粉彩瓷 C.绢布上的中国刺绣 D.木版上刻画
A.A B.B C.C D.D
2.下列有关硅及其化合物的说法中错误的是( )
A.“玉兔号”月球车太阳能电池的主要材料是二氧化硅
B.传统硅酸盐材料包括陶瓷、水泥、普通玻璃
C.氢氟酸可用于蚀刻普通玻璃
D.北斗导航系统计算机的芯片材料是单质硅
3.下列有关物质的用途与化学原理具有对应关系的是( )
选项 用途 化学原理
A 用氢氟酸雕刻玻璃 氢氟酸显弱酸性
B 用FeCl3溶液蚀刻印刷电路板 FeCl3溶液显酸性
C 用SiO2制造坩埚 SiO2熔点高
D 用HNO3制备硝酸铵 HNO3具有强氧化性
A.A B.B C.C D.D
4.下列元素在自然界既可以游离态存在,又可以化合态存在的是( )
A.氯 B.钠 C.氮 D.硅
5.纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,反应时接触面积大,反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
6.下列物质的变化,不能通过一步化学反应完成的是( )
A. B.
C. D.
7.下列关于古代化学的应用和记载的说明不合理的是( )
A.“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为Fe3O4
B.苏轼的《格物粗谈》中记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指氧气
C.《本草经集注》中记载鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“强烧之,紫青烟起,云是真硝石也”,利用了焰色反应。
D.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”是指传统无机非金属材料,主要成分为硅酸盐
8.现代光学及光纤制品的基本原料是( )
A.SiO2 B.Cu C.Al D.C
9.2020年2月24日,华为MateXs新款5G折叠屏手机开启线上预约销售。下列说法错误的是( )
A.制造手机芯片的关键材料是硅
B.用铜制作手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.手机电池工作时,电池中化学能完全转化为电能
10.下列对物质的主要用途、原因解释的描述都正确的是( )
选项 物质 主要用途 原因解释
A 晶体硅 高纯硅可用于制备光导纤维、光电池、集成电路和计算机芯片 硅是良好的半导体材料
B 金属铝 高铁车厢采用铝合金材料 铝与氧气不反应
C 氯气 与石灰乳或烧碱反应制备消毒剂 氯气有强氧化性
D 金属钠 高温时能从熔融TiCl4中置换出金属Ti 钠具有很强的还原性
A.A B.B C.C D.D
11.下列物质属于复合材料的是( )
A.玻璃钢 B.人造皮革 C.钢化玻璃 D.再生塑料
12.陶瓷是火与土的结晶,是中华文明的象征之一,宋代五大名窑分别为钧窑、汝窑、官窑、定窑、哥窑。其中钧窑以“人窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法错误的是( )
A.窑变是高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
D.高品质的瓷器晶莹剔透,属于纯净物
13.下列说法不正确的是( )
A.硅酸钠是一种难溶于水的硅酸盐
B.镁在空气中燃烧可生成氧化镁和氮化镁
C.钠与水反应生成氢氧化钠和氢气
D.常温下,铝遇浓硝酸或浓硫酸时会发生钝化
14.由粗 制备纯的 流程如图所示,下列说法错误的是( )
A. 属于酸性氧化物
B.二氧化硅是将太阳能转变为电能的常用材料
C.若在实验室中完成步骤Ⅲ,应该在坩埚中进行
D.步骤Ⅱ反应的离子方程式为
15.柳州工业博物馆是柳州工业史的见证。下列展品主要由硅酸盐制成的是( )。
展品
选项 A.柳工吊车轮胎 B.水泥管 C.火车头 D.五菱汽车
A.A B.B C.C D.D
16.下列有关说法正确的是( )
A.铁粉与氯气反应只能生成FeCl3
B.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
C.11.2LCl2的质量为35.5g
D.保存氢氟酸时, 常用带橡胶塞的玻璃瓶
17.下列物质中属于耐高温非金属材料的是
A. B. C. D.
18.纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新型材料给予了极大的关注。纳米粒子是指直径为1 ~ 100 nm的超细粒子(1 nm=10-9 m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性质,可开发为新型功能材料,有关纳米粒子的叙述中错误的是( )
A.因纳米粒子半径太小,故不能将其制成胶体
B.一定条件下,纳米粒子可催化水的分解
C.一定条件下,纳米TiO2陶瓷可任意弯曲,可塑性好
D.纳米粒子半径小,表面活性高
19.材料与化学密切相关。下列物质与材料对应关系不正确的是( )
A.铁碳合金——生铁 B.硅酸盐——陶瓷
C.晶体硅——光导纤维 D.氧化镁——耐高温材料
20.下列物质性质和用途都正确且相关的是( )
选项 性质 用途
A FeCl3溶液显酸性 用于刻蚀电路板
B SO2具有氧化性 SO2常用于漂白秸秆、织物
C HF溶液具有酸性 HF溶液能在玻璃上刻图案
D CH3CH2OH完全燃烧生成二氧化碳和水并放出大量热量 乙醇常作清洁能源
A.A B.B C.C D.D
二、综合题
21.请根据要求书写出方程式。
(1)2021年3月18日,在由全球权威电子行业媒体ASPENCORE主办的2021年中国IC领袖峰会上,苏州芯联成软件有限公司获优异表现,芯片的主要成分是 ,写出其工业用二氧化硅制备其粗产品的化学反应方程式
(2)精美的雕花玻璃使我们的世界变得绚丽多彩,雕花玻璃涉及的主要反应的化学方程式为 。
(3)1754年,Briestly用硵砂(主要成分NH4Cl)和熟石灰共热制得了氨,化学反应方程式为 。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式 。
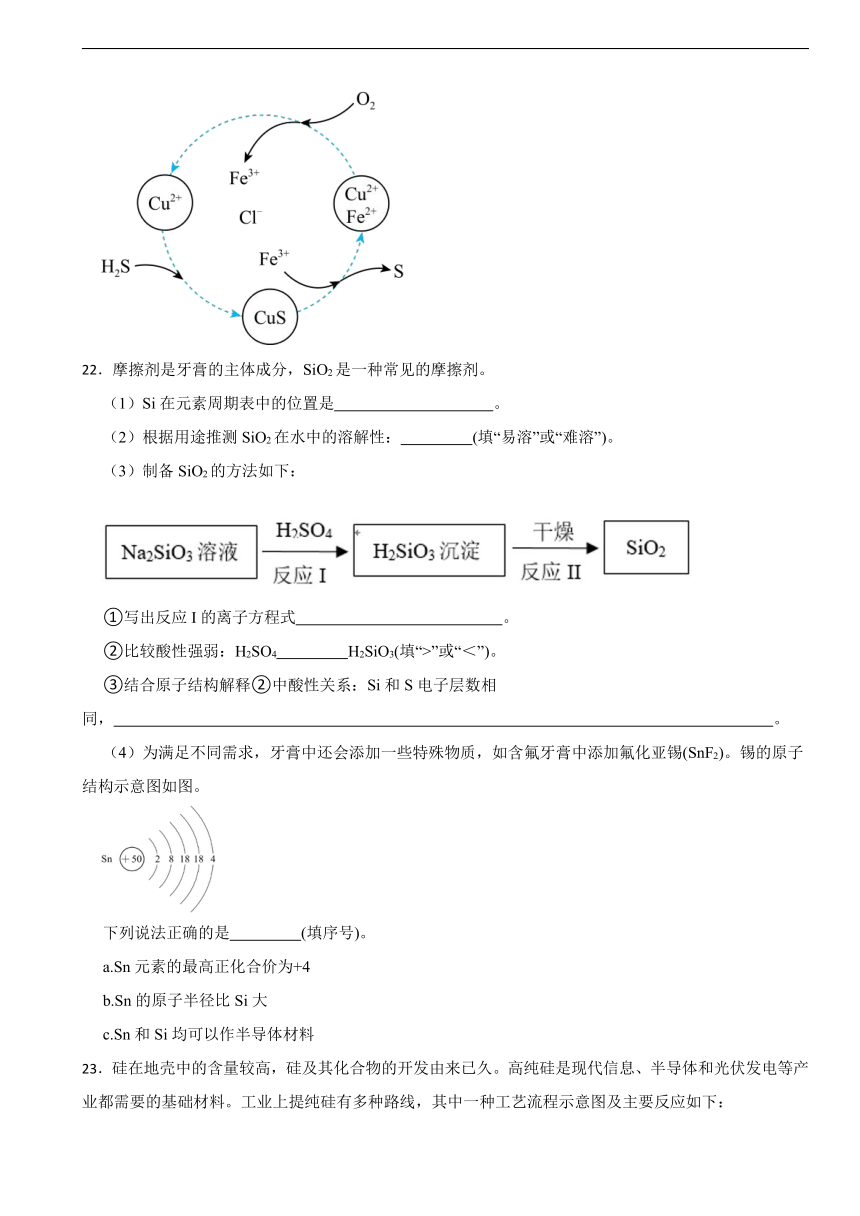
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。该图示的总反应为 。
22.摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1)Si在元素周期表中的位置是 。
(2)根据用途推测SiO2在水中的溶解性: (填“易溶”或“难溶”)。
(3)制备SiO2的方法如下:
①写出反应I的离子方程式 。
②比较酸性强弱:H2SO4 H2SiO3(填“>”或“<”)。
③结合原子结构解释②中酸性关系:Si和S电子层数相同, 。
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。
下列说法正确的是 (填序号)。
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
23.硅在地壳中的含量较高,硅及其化合物的开发由来已久。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为 。
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_ 。
(3)有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_ ;
SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_ 。
物质 Si SiCl4 SiHCl3 SiH2Cl2 SiH3Cl HCl SiH4
熔点/℃ 1410 -70.4 -126.5 -122 -118 -114.2 -185
沸点/℃ 2355 57.6 31.8 8.2 -30.4 -84.9 -111.9
(4)还原炉中发生的化学反应为: 。.
(5)上述工艺生产中循环使用的物质除Si、SiHCl3外, 还有_ 。
24.我国考古学家对“南澳一号”沉船进行了考古探索,从沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。青花瓷胎体的原料——高岭土,可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石,在左右一次烧成的釉可形成精美的青花瓷。
(1)求高岭土化学式中 。
(2)硅酸盐可以改写成氧化物形式,如钾长石可写成,写出高岭土的氧化物形式 。
(3)以高岭土为原料可以提取高纯度的二氧化硅,二氧化硅性质很稳定,但常温下可以溶于氢氧化钠溶液和氢氟酸,写出其溶于氢氟酸的化学方程式 。
(4)与硅同周期的某元素的氧化物常温下是一种常见气体,足量的该气体依次通过A.品红溶液 B.高锰酸钾溶液 C.氢氧化钠溶液(滴有酚酞),发现三种溶液都褪色了,则该气体在三种溶液中表现的性质依次是:A ;B ;C 。写出该气体与B溶液反应的离子方程式 。
25.回答下列问题
(1)已知金刚石的莫氏硬度为10,石墨的莫氏硬度为,从晶体结构的角度解释金刚石硬度很大,石墨很软的原因 。
(2)在相同温度时,酸性条件下都能被氧化,通过控制溶液中探究同浓度的还原性强弱,预测同浓度的被氧化需要的最小的是 ,试从离子结构角度解释的还原性逐渐增强的原因 。
答案解析部分
1.【答案】B
【解析】【解答】A、青铜器属于合金,是一种金属材料,故A选项错误;
B、粉彩瓷为硅酸盐,属于无机非金属材料,故B选项正确;
C、绢布属于有机高分子材料,故C选项错误;
D、木版的主要成分是纤维素,属于有机高分子材料,故D选项错误。
故答案为:B
【分析】考点:硅酸盐,属于无机非金属材料。
2.【答案】A
【解析】【解答】A. 太阳能电池的主要材料是硅单质,A项符合题意;
B. 传统硅酸盐材料包括陶瓷、水泥、普通玻璃,B项不符合题意;
C. 普通玻璃的主要成分为二氧化硅,氢氟酸能与二氧化硅反应,故可用于蚀刻普通玻璃,C项不符合题意;
D. 计算机的芯片材料是单质硅,D项不符合题意;
故答案为:A。
【分析】太阳能电池板和计算机芯片的材料的是硅单质,而二氧化硅主要是制备的是光导纤维,其他选项均正确
3.【答案】C
【解析】【解答】A.用氢氟酸雕刻玻璃化学原理为HF能与玻璃中的二氧化硅反应生成SiF4气体和水,其用途与HF是否为弱酸无关,故不选A;
B.用FeCl3溶液蚀刻印刷电路板,反应方程式为2Fe3++Fe=3Fe2+,化学原理为Fe3+具有氧化性,能将单质铜氧化为铜离子,与铁离子的酸性无关,故不选B;
C.SiO2是原子晶体,SiO2的熔点高,所以可用SiO2制造坩埚,故选C;
D.硝酸铵是一种盐,利用硝酸制备硝酸铵体现了硝酸的酸性,与硝酸的强氧化性无关,故不选D;
故答案为:C。
【分析】A.HF能二氧化硅反应生成SiF4和水,该反应中HF并未体现酸性;
B.用FeCl3溶液蚀刻印刷电路板利用的是其氧化性;
D.硝酸反应生成硝酸铵体现硝酸的酸性。
4.【答案】C
【解析】【解答】A. 氯在自然界中只能以化合态存在,A不符合题意;
B. 钠在自然界中只能以化合态存在,B不符合题意;
C. 氮在自然界既可以游离态存在,又可以化合态存在,C符合题意;
D. 硅是亲氧元素,在自然界中只能以化合态存在,D不符合题意,
故答案为:C。
【分析】根据元素在自然界中的存在形式进行判断即可。
5.【答案】B
【解析】【解答】A.常温下“纳米铜”比铜片的与氧气的接触面积大,活动性强,反应时反应速率快,A不符合题意;
B.Cu是固体,把Cu制成“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快,B符合题意;
C.“纳米铜”与铜都是Cu元素的同种单质,只是颗粒大小不同而已,C不符合题意;
D.常温下“纳米铜”比铜片更易失去电子,反应时反应速率快,D不符合题意;
故答案为:B。
【分析】铜本身不能在空气中燃烧只能加热到红热,但是增大了与氧气的接触面积之后可以迅速达到铜燃烧的着火点,反应速率更快
6.【答案】D
【解析】【解答】A、氮气和氢气在高温、高压和催化剂条件下合成氨气,可以一步转化,故A不符合题意;
B、二氧化硅和氢氧化钠反应生成硅酸钠和水,能一步转化,故B不符合题意;
C、浓硫酸和铜加热反应生成二氧化硫、硫酸铜和水,能一步转化,故C不符合题意;
D、二氧化硅不溶于水, 不能一步转化,故D符合题意;
故答案为:D。
【分析】A、氮气和氢气在一定条件下可合成氨气;
B、二氧化硅和氢氧化钠反应生成硅酸钠;
C、浓硫酸和铜在加热条件下反应可制得二氧化硫;
D、二氧化硅不溶于水。
7.【答案】B
【解析】【解答】A.司南中“杓”能指示方向,说明具有磁性,主要成分应为Fe3O4,A不符合题意;
B.“气”起了催熟作用,故“气”为乙烯,B符合题意;
C.K元素的焰色反应为紫色,故“紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色,C不符合题意;
D.粘土主要成分为硅酸盐,则“瓦”为传统无机非金属材料,主要成分为硅酸盐,故D不符合题意;
故答案为:B。
【分析】木瓜不会产生氧气,只会消耗氧气,这里的气指的是具有催熟效果的乙烯,不是氧气
8.【答案】A
【解析】【解答】A. 二氧化硅具有良好的光学效果,是高性能通讯材料光导纤维的主要原料,故A符合题意;
B. 铜是电的良导体,不是良好的光学材料,故B不符合题意;
C. 铝是电的导体,不是良好的光学材料,故C不符合题意;
D. 碳元素形成的单质石墨是电的良导体,不是良好的光学材料,故D不符合题意;
故答案为:A。
【分析】现代光学及光纤制品的基本原料是二氧化硅,铜、铝、碳不具有良好的光学性,不是现代光学及光纤的基本原料,据此即可解答。
9.【答案】D
【解析】【解答】A.单晶硅是良好的半导体材料,可以制作芯片,A选项不符合题意;
B.铜属于金属,具有良好的导电性,可以做手机线路板,B选项不符合题意;
C.镁铝合金密度小强度高,具有轻便抗压的特点,C选项不符合题意;
D.手机电池工作时,电池中化学能主要转化为电能,但有一部分能量以热能形式会散失,D选项符合题意;
故答案为:D。
【分析】A.硅的主要用途有芯片和太阳能电池;
B.同具有优良的导电性;
C.镁铝合金密度小强度高,具有轻便抗压的特点;
D.原电池是将化学能转化为电能,但是转化率达不到100%,还有一部分转化为热能散失。
10.【答案】D
【解析】【解答】A.光导纤维的主要成分为SiO2,故A不符合题意;
B.高铁车厢采用铝合金材料的原因是铝合金质量轻,且硬度高,铝与氧气在常温下能反应生成氧化铝,故B不符合题意;
C.氯气与石灰乳或烧碱反应制备消毒剂过程中,氯气既体现出氧化性,也体现出还原性,故C不符合题意;
D.钠单质在高温时能从熔融TiCl4中置换出金属Ti,属于置换反应,该反应中钠单质被氧化,体现出还原性,故D符合题意;
故答案为D。
【分析】A.光导纤维的主要成分为SiO2;
B.Al能与空气中的O2形成致密的氧化铝薄膜;
C.Cl2与Ca(OH)2反应过程中同时体现氧化性和还原性;
D.金属钠具有强还原性;
11.【答案】A
【解析】【解答】A.玻璃钢是由玻璃与树脂混合成的,前者是无机非金属材料,后者是有机高分子合成材料,故玻璃钢是两种材料复合成的,A符合题意;
B.人造皮革也叫仿皮或胶料,是PVC和PU等人造材料的总称,B不符合题意;
C.钢化玻璃属于硅酸盐材料,属无机非金属材料,C不符合题意;
D.再生塑料是塑料的再利用,通过进行机械刀片粉碎等操作以后,从而完成塑料的再次利用,D不符合题意。
故答案为:A。
【分析】复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料。
12.【答案】D
【解析】【解答】A.窑变在高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化,窑变是复杂的物理化学变化,故A不符合题意;
B.陶制品主要原料是黏土,经高温烧结而成,故B不符合题意;
C.陶瓷是硅酸盐产品,化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点,故C不符合题意;
D.高品质的瓷器晶莹剔透,属于混合物,故D符合题意。
故答案为:D。
【分析】A.窑变是复杂的物理化学变化;
B.陶瓷是硅酸盐产品;
C.硅酸盐化学性质稳定;
D.陶瓷属于混合物。
13.【答案】A
【解析】【解答】A.硅酸钠是可以溶于水的硅酸盐,故A不符合题意
B.空气中含有氮气和氧气,均可与镁单质作用,因此产物为氧化镁和氮化镁,故B不符合题意
C. 钠与水反应生成氢氧化钠和氢气 ,故C不符合题意
D. 常温下,铝遇浓硝酸或浓硫酸时会发生钝化 ,故D不符合题意
故答案为:A
【分析】硅酸钠的水溶液叫水玻璃,因此硅酸钠可以溶于水,其他选项均正确
14.【答案】B
【解析】【解答】A.SiO2能和碱反应生成盐和水,属于酸性氧化物,A不符合题意;
B.二氧化硅为光导纤维的常用材料,将太阳能转变为电能的常用材料为硅单质,B符合题意;
C.灼烧时所用温度较高,应在坩埚中进行,C不符合题意;
D.步骤Ⅱ中CO2过量,所以得到硅酸沉淀和碳酸氢钠,离子方程式为 ,D不符合题意;
故答案为B。
【分析】粗硅和NaOH溶液反应得到硅酸钠溶液,通入过量CO2过滤得到硅酸沉淀,灼烧得到SiO2。
15.【答案】B
【解析】【解答】A.轮胎书友有机物,故A不符合题意;
B.水泥管属于无机非金属材料,主要含有硅酸盐,故B符合题意;
C.火车头主要是金属材料,故C不符合题意;
D.汽车材料有金属和有机物,故D不符合题意;
故答案为:B
【分析】根据给出的选项判断物质类别即可。
16.【答案】A
【解析】【解答】A. 氯气具有强氧化性,铁粉与氯气反应只能生成FeCl3,A符合题意;
B. Cl2具有很强的氧化性,在化学反应中既能作氧化剂,也能作还原剂,例如氯气与氢氧化钠溶液反应,B不符合题意;
C. 11.2LCl2的物质的量不一定是0.5mol,其质量不一定为35.5g,C不符合题意;
D. 氢氟酸能与玻璃中的二氧化硅反应,因此保存氢氟酸时需要用塑料瓶,不能用玻璃瓶,D不符合题意。
故答案为:A。
【分析】铁与强氧化剂反应生成高价态铁;
B.氯气中Cl元素的化合价处于中间价态,既可升高也可降低;
C.利用气体摩尔体积计算气体的物质的量需要知道温度和压强;
D.HF能与玻璃中的二氧化硅反应。
17.【答案】B
【解析】【解答】A.二氧化碳形成的晶体是熔沸点低的分子晶体,不属于耐高温非金属材料,故A不符合题意;
B.碳化硅是熔沸点高的共价晶体,属于耐高温非金属材料,故B符合题意;
C.镁铝合金属于金属材料,不属于非金属材料,故C不符合题意;
D.五氧化二磷形成的晶体是熔沸点低的分子晶体,不属于耐高温非金属材料,故D不符合题意;
故答案为:B。
【分析】依据非金属材料由非金属元素或化合物构成的材料。
18.【答案】A
【解析】【解答】纳米粒子的大小符合胶体粒子的特征,能将其制成胶体,A符合题意;
某些物质达到纳米粒子状态时有奇特的性质,可催化水的分解,B不符合题意;
纳米粒子可开发为新型功能材料,C不符合题意;
纳米粒子半径小,表面活性高,D不符合题意。
【分析】纳米材料的基本构成微粒处于纳米数量级,有奇特的性质,可开发为新型功能材料。
19.【答案】C
【解析】【解答】A.生铁为铁碳合金,A不符合题意;
B.陶瓷的成分为硅酸盐,B不符合题意;
C.光导纤维的主要成分为二氧化硅,C符合题意;
D.氧化镁熔点很高,可作耐高温材料,D不符合题意;
故答案为:C。
【分析】本题主要考查物质的性质、组成以及用途,能够认识到光导纤维的原料是二氧化硅;氧化镁熔点很高;生铁是铁碳合金;陶瓷主要是硅酸盐。题目难度不大,学习中注意相关基础知识的积累。
20.【答案】D
【解析】【解答】A.FeCl3溶液能够与铜发生氧化还原反应,可用于刻蚀电路板,体现了铁离子的氧化性,A不符合题意;
B.SO2具有漂白性,所以SO2常用于漂白秸秆、织物,B不符合题意;
C.氢氟酸与二氧化硅反应,是特性反应,与酸性无关,C不符合题意;
D.CH3CH2OH完全燃烧生成二氧化碳和水并放出大量热量,无污染,D符合题意;
故答案为:D。
【分析】A.氯化铁刻蚀电路板体现的是氧化性;
B.SO2用于漂白秸秆、织物是利用其漂白性;
C.氢氟酸能够与玻璃中二氧化硅反应生成四氟化硅和水。
21.【答案】(1)Si;
(2)4HF+SiO2=SiF4↑+2H2O
(3)
(4)
(5)2H2S+O2=2S↓+2H2O
【解析】【解答】(1)芯片的主要成分是硅,粗硅可以用石墨高温下冶炼,生成一氧化碳和硅,故答案为:Si; ;
(2)氢氟酸可以用于蚀刻玻璃,氢氟酸和二氧化硅反应生成四氟化硅和水,故答案为: 4HF+SiO2=SiF4↑+2H2O ;
(3)氯化铵和氢氧化钙反应生成氯化钙、水和氨气,故答案为: ;
(4)甲烷可以和一氧化氮发生氧化还原反应,氮元素化合价降低,生成氮气,碳元素化合价升高,生成二氧化碳,故答案为: ;
(5)根据图示,可知反应物为O2和H2S,生成物为S,则总反应为 2H2S+O2=2S↓+2H2O ,故答案为: 2H2S+O2=2S↓+2H2O 。
【分析】(1)芯片的主要成分是硅,粗硅可以用石墨高温下冶炼,生成一氧化碳和硅;
(2)氢氟酸可以用于蚀刻玻璃,氢氟酸和二氧化硅反应生成四氟化硅和水;
(3)氯化铵和氢氧化钙反应生成氯化钙、水和氨气;
(4)甲烷可以和一氧化氮发生氧化还原反应,氮元素化合价降低,生成氮气,碳元素化合价升高,生成二氧化碳;
(5)箭头起点为反应物,终点为生成物。
22.【答案】(1)第三周期第ⅣA族
(2)难溶
(3)SiO+2H+=H2SiO3↓;>;核电荷数Si<S,原子半径Si>S,得电子能力Si<S,非金属性Si<S,硫酸酸性强于硅酸
(4)ab
【解析】【解答】(1)Si为第14号元素,其在元素周期表中的位置为第三周期第ⅣA族;
(2)SiO2为常见的摩擦剂,其在牙膏中以固体形式存在,因此SiO2在水中难溶;
(3)①H2SiO3难溶于水,因此可以用Na2SiO3和酸反应生成,反应的离子方程式为:SiO +2H+=H2SiO3↓;
②根据强酸制弱酸的原理,硫酸可以制备硅酸,因此硫酸酸性强于硅酸;
③Si和S电子层数相同,核电荷数Si<S,原子半径Si>S,得电子能力Si<S,非金属性Si<S,硫酸酸性强于硅酸;
(4)a.Sn为主族元素,主族元素的最高正化合价等于其族序数,Sn为第ⅣA族元素,因此Sn的最高正化合价为+4价,a正确;
b.同一主族元素原子从上到下原子半径逐渐增大,因此Sn的原子半径大于Si,b正确;
c.Sn为金属元素,可以导电,Sn不是半导体,Si为非金属元素,可以导电,Si是半导体,c不正确;
故答案为:ab。
【分析】硅酸钠与硫酸反应生成硅酸沉淀,离子方程式:SiO32-+2H+=H2SiO3↓,原硅酸经过加热变为二氧化硅,再结合元素周期表和元素周期律的相关知识分析解答。
23.【答案】(1)SiO2+ 2C Si + 2CO↑
(2)Si + 3HCl SiHCl3+ H2 (或加热)
(3)蒸馏;H4SiO4 (或H2SiO3). H2、HCl
(4)SiHCl3+ H2 Si+ 3HCl
(5)H2、HCl
【解析】【解答】(1)化学方程式为 SiO2+ 2C Si + 2CO↑
(2)由反应物和生成物可推方程式为 Si + 3HCl SiHCl3+ H2 (或加热)
(3)根据熔沸点可知,操作流程依次为沉降、冷凝、和蒸馏
可燃性气体为氢气, 能生成氢气则说明硅元素的化合价要升高,则产物为硅酸,剩下来的氯就形成HCl
(4)还原炉中是得到纯硅的反应,根据反应物和生成物可推化学方程式为 SiHCl3+ H2 Si+ 3HCl
(5)根据示意图可知,水解过程中产生的氢气和氯化氢也能循环使用
【分析】(1)注意:该条件下C只能变成CO,不能到二氧化碳
(3)可根据熔沸点来选择提纯方法
(5)可根据示意图来找出循环物质。
24.【答案】(1)4
(2)Al2O3·2SiO2·2H2O
(3)SiO2+4HF=SiF4↑+2H2O
(4)漂白性;还原性;酸性气体(或酸性氧化物);5SO2+2MnO +2H2O=5SO +2Mn2++4H+
【解析】【解答】(1)根据化合物中化合价的代数和为0可得,(+3)×2+(+4)×2+(-2)×5+(-1)×x=0,解得 x=4。
(2)[Al2Si2O5(OH)4]写成氧化物的形式为Al2O3·2SiO2·2H2O。
(3)SiO2能与HF反应生成SiF4和H2O,该反应的化学方程式为SiO2+4HF=SiF4↑+2H2O。
(4)由分析可知,该气体为SO2,SO2使品红溶液褪色,体现了SO2的漂白性;使酸性KMnO4溶液褪色,体现了SO2的还原性;使滴有酚酞的NaOH溶液褪色,体现了SO2酸性气体的性质。酸性KMnO4溶液具有强氧化性,能将SO2氧化成SO42-,自身还原为Mn2+,该反应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
【分析】(1)根据化合价代数和为0计算x的值。
(2)硅酸盐写成氧化物形式时,先写金属性强的金属氧化物,再写非金属氧化物,最后写H2O,书写过程中应注意原子个数比保持不变。
(3)SiO2能与HF反应生成SiF4和H2O,据此写出反应的化学方程式。
(4)该气体能使品红溶液褪色、使酸性KMnO4溶液褪色、使滴有酚酞的NaOH溶液褪色,则该气体为SO2,结合SO2的性质分析。
25.【答案】(1)影响金刚石硬度的因素是共价键,影响石墨硬度的因素是分子间作用力,共价键强于分子间作用力
(2);离子结构相似,电子层数逐渐增加,离子半径逐渐增大,原子核对最外层电子吸引力减弱,还原性逐渐增强
【解析】【解答】(1)金刚石为空间网状结构的原子晶体,晶体的硬度取决于碳原子间形成共价键的强弱,而石墨是层状结构的混合型晶体,晶体的硬度取决于层间分子间作用力的大小,共价键强于分子间作用力,所以金刚石硬度很大,石墨很软,故答案为:影响金刚石硬度的因素是共价键,影响石墨硬度的因素是分子间作用力,共价键强于分子间作用力;
(2)同主族元素,从上到下,离子的离子半径逐渐增大,原子核对最外层电子吸引力减弱,离子的还原性逐渐增强,所以氯离子、溴离子、碘离子的还原性逐渐增强,与二氧化锰反应时需要氢离子的浓度逐渐减小,则需要氢离子浓度最小的是碘离子,故答案为:KI;离子结构相似,电子层数逐渐增加,离子半径逐渐增大,原子核对最外层电子吸引力减弱,还原性逐渐增强。
【分析】(1)石墨和金刚石的空间结构不同,金刚石是共价键,石墨是分子间作用力;
(2)同主族元素,从上到下,离子的离子半径逐渐增大,原子核对最外层电子吸引力减弱,离子的还原性逐渐增强,所以氯离子、溴离子、碘离子的还原性逐渐增强,与二氧化锰反应时需要氢离子的浓度逐渐减小,则需要氢离子浓度最小的是碘离子。
一、单选题
1.从古至今,绘画艺术传颂着文明的发展,下列绘画的载体属于无机非金属材料的是( )
A.青铜器上的龙纹 B.粉彩瓷 C.绢布上的中国刺绣 D.木版上刻画
A.A B.B C.C D.D
2.下列有关硅及其化合物的说法中错误的是( )
A.“玉兔号”月球车太阳能电池的主要材料是二氧化硅
B.传统硅酸盐材料包括陶瓷、水泥、普通玻璃
C.氢氟酸可用于蚀刻普通玻璃
D.北斗导航系统计算机的芯片材料是单质硅
3.下列有关物质的用途与化学原理具有对应关系的是( )
选项 用途 化学原理
A 用氢氟酸雕刻玻璃 氢氟酸显弱酸性
B 用FeCl3溶液蚀刻印刷电路板 FeCl3溶液显酸性
C 用SiO2制造坩埚 SiO2熔点高
D 用HNO3制备硝酸铵 HNO3具有强氧化性
A.A B.B C.C D.D
4.下列元素在自然界既可以游离态存在,又可以化合态存在的是( )
A.氯 B.钠 C.氮 D.硅
5.纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,反应时接触面积大,反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
6.下列物质的变化,不能通过一步化学反应完成的是( )
A. B.
C. D.
7.下列关于古代化学的应用和记载的说明不合理的是( )
A.“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为Fe3O4
B.苏轼的《格物粗谈》中记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指氧气
C.《本草经集注》中记载鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“强烧之,紫青烟起,云是真硝石也”,利用了焰色反应。
D.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”是指传统无机非金属材料,主要成分为硅酸盐
8.现代光学及光纤制品的基本原料是( )
A.SiO2 B.Cu C.Al D.C
9.2020年2月24日,华为MateXs新款5G折叠屏手机开启线上预约销售。下列说法错误的是( )
A.制造手机芯片的关键材料是硅
B.用铜制作手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.手机电池工作时,电池中化学能完全转化为电能
10.下列对物质的主要用途、原因解释的描述都正确的是( )
选项 物质 主要用途 原因解释
A 晶体硅 高纯硅可用于制备光导纤维、光电池、集成电路和计算机芯片 硅是良好的半导体材料
B 金属铝 高铁车厢采用铝合金材料 铝与氧气不反应
C 氯气 与石灰乳或烧碱反应制备消毒剂 氯气有强氧化性
D 金属钠 高温时能从熔融TiCl4中置换出金属Ti 钠具有很强的还原性
A.A B.B C.C D.D
11.下列物质属于复合材料的是( )
A.玻璃钢 B.人造皮革 C.钢化玻璃 D.再生塑料
12.陶瓷是火与土的结晶,是中华文明的象征之一,宋代五大名窑分别为钧窑、汝窑、官窑、定窑、哥窑。其中钧窑以“人窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法错误的是( )
A.窑变是高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
D.高品质的瓷器晶莹剔透,属于纯净物
13.下列说法不正确的是( )
A.硅酸钠是一种难溶于水的硅酸盐
B.镁在空气中燃烧可生成氧化镁和氮化镁
C.钠与水反应生成氢氧化钠和氢气
D.常温下,铝遇浓硝酸或浓硫酸时会发生钝化
14.由粗 制备纯的 流程如图所示,下列说法错误的是( )
A. 属于酸性氧化物
B.二氧化硅是将太阳能转变为电能的常用材料
C.若在实验室中完成步骤Ⅲ,应该在坩埚中进行
D.步骤Ⅱ反应的离子方程式为
15.柳州工业博物馆是柳州工业史的见证。下列展品主要由硅酸盐制成的是( )。
展品
选项 A.柳工吊车轮胎 B.水泥管 C.火车头 D.五菱汽车
A.A B.B C.C D.D
16.下列有关说法正确的是( )
A.铁粉与氯气反应只能生成FeCl3
B.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
C.11.2LCl2的质量为35.5g
D.保存氢氟酸时, 常用带橡胶塞的玻璃瓶
17.下列物质中属于耐高温非金属材料的是
A. B. C. D.
18.纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新型材料给予了极大的关注。纳米粒子是指直径为1 ~ 100 nm的超细粒子(1 nm=10-9 m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性质,可开发为新型功能材料,有关纳米粒子的叙述中错误的是( )
A.因纳米粒子半径太小,故不能将其制成胶体
B.一定条件下,纳米粒子可催化水的分解
C.一定条件下,纳米TiO2陶瓷可任意弯曲,可塑性好
D.纳米粒子半径小,表面活性高
19.材料与化学密切相关。下列物质与材料对应关系不正确的是( )
A.铁碳合金——生铁 B.硅酸盐——陶瓷
C.晶体硅——光导纤维 D.氧化镁——耐高温材料
20.下列物质性质和用途都正确且相关的是( )
选项 性质 用途
A FeCl3溶液显酸性 用于刻蚀电路板
B SO2具有氧化性 SO2常用于漂白秸秆、织物
C HF溶液具有酸性 HF溶液能在玻璃上刻图案
D CH3CH2OH完全燃烧生成二氧化碳和水并放出大量热量 乙醇常作清洁能源
A.A B.B C.C D.D
二、综合题
21.请根据要求书写出方程式。
(1)2021年3月18日,在由全球权威电子行业媒体ASPENCORE主办的2021年中国IC领袖峰会上,苏州芯联成软件有限公司获优异表现,芯片的主要成分是 ,写出其工业用二氧化硅制备其粗产品的化学反应方程式
(2)精美的雕花玻璃使我们的世界变得绚丽多彩,雕花玻璃涉及的主要反应的化学方程式为 。
(3)1754年,Briestly用硵砂(主要成分NH4Cl)和熟石灰共热制得了氨,化学反应方程式为 。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式 。
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。该图示的总反应为 。
22.摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1)Si在元素周期表中的位置是 。
(2)根据用途推测SiO2在水中的溶解性: (填“易溶”或“难溶”)。
(3)制备SiO2的方法如下:
①写出反应I的离子方程式 。
②比较酸性强弱:H2SO4 H2SiO3(填“>”或“<”)。
③结合原子结构解释②中酸性关系:Si和S电子层数相同, 。
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。
下列说法正确的是 (填序号)。
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
23.硅在地壳中的含量较高,硅及其化合物的开发由来已久。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为 。
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_ 。
(3)有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_ ;
SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_ 。
物质 Si SiCl4 SiHCl3 SiH2Cl2 SiH3Cl HCl SiH4
熔点/℃ 1410 -70.4 -126.5 -122 -118 -114.2 -185
沸点/℃ 2355 57.6 31.8 8.2 -30.4 -84.9 -111.9
(4)还原炉中发生的化学反应为: 。.
(5)上述工艺生产中循环使用的物质除Si、SiHCl3外, 还有_ 。
24.我国考古学家对“南澳一号”沉船进行了考古探索,从沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。青花瓷胎体的原料——高岭土,可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石,在左右一次烧成的釉可形成精美的青花瓷。
(1)求高岭土化学式中 。
(2)硅酸盐可以改写成氧化物形式,如钾长石可写成,写出高岭土的氧化物形式 。
(3)以高岭土为原料可以提取高纯度的二氧化硅,二氧化硅性质很稳定,但常温下可以溶于氢氧化钠溶液和氢氟酸,写出其溶于氢氟酸的化学方程式 。
(4)与硅同周期的某元素的氧化物常温下是一种常见气体,足量的该气体依次通过A.品红溶液 B.高锰酸钾溶液 C.氢氧化钠溶液(滴有酚酞),发现三种溶液都褪色了,则该气体在三种溶液中表现的性质依次是:A ;B ;C 。写出该气体与B溶液反应的离子方程式 。
25.回答下列问题
(1)已知金刚石的莫氏硬度为10,石墨的莫氏硬度为,从晶体结构的角度解释金刚石硬度很大,石墨很软的原因 。
(2)在相同温度时,酸性条件下都能被氧化,通过控制溶液中探究同浓度的还原性强弱,预测同浓度的被氧化需要的最小的是 ,试从离子结构角度解释的还原性逐渐增强的原因 。
答案解析部分
1.【答案】B
【解析】【解答】A、青铜器属于合金,是一种金属材料,故A选项错误;
B、粉彩瓷为硅酸盐,属于无机非金属材料,故B选项正确;
C、绢布属于有机高分子材料,故C选项错误;
D、木版的主要成分是纤维素,属于有机高分子材料,故D选项错误。
故答案为:B
【分析】考点:硅酸盐,属于无机非金属材料。
2.【答案】A
【解析】【解答】A. 太阳能电池的主要材料是硅单质,A项符合题意;
B. 传统硅酸盐材料包括陶瓷、水泥、普通玻璃,B项不符合题意;
C. 普通玻璃的主要成分为二氧化硅,氢氟酸能与二氧化硅反应,故可用于蚀刻普通玻璃,C项不符合题意;
D. 计算机的芯片材料是单质硅,D项不符合题意;
故答案为:A。
【分析】太阳能电池板和计算机芯片的材料的是硅单质,而二氧化硅主要是制备的是光导纤维,其他选项均正确
3.【答案】C
【解析】【解答】A.用氢氟酸雕刻玻璃化学原理为HF能与玻璃中的二氧化硅反应生成SiF4气体和水,其用途与HF是否为弱酸无关,故不选A;
B.用FeCl3溶液蚀刻印刷电路板,反应方程式为2Fe3++Fe=3Fe2+,化学原理为Fe3+具有氧化性,能将单质铜氧化为铜离子,与铁离子的酸性无关,故不选B;
C.SiO2是原子晶体,SiO2的熔点高,所以可用SiO2制造坩埚,故选C;
D.硝酸铵是一种盐,利用硝酸制备硝酸铵体现了硝酸的酸性,与硝酸的强氧化性无关,故不选D;
故答案为:C。
【分析】A.HF能二氧化硅反应生成SiF4和水,该反应中HF并未体现酸性;
B.用FeCl3溶液蚀刻印刷电路板利用的是其氧化性;
D.硝酸反应生成硝酸铵体现硝酸的酸性。
4.【答案】C
【解析】【解答】A. 氯在自然界中只能以化合态存在,A不符合题意;
B. 钠在自然界中只能以化合态存在,B不符合题意;
C. 氮在自然界既可以游离态存在,又可以化合态存在,C符合题意;
D. 硅是亲氧元素,在自然界中只能以化合态存在,D不符合题意,
故答案为:C。
【分析】根据元素在自然界中的存在形式进行判断即可。
5.【答案】B
【解析】【解答】A.常温下“纳米铜”比铜片的与氧气的接触面积大,活动性强,反应时反应速率快,A不符合题意;
B.Cu是固体,把Cu制成“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快,B符合题意;
C.“纳米铜”与铜都是Cu元素的同种单质,只是颗粒大小不同而已,C不符合题意;
D.常温下“纳米铜”比铜片更易失去电子,反应时反应速率快,D不符合题意;
故答案为:B。
【分析】铜本身不能在空气中燃烧只能加热到红热,但是增大了与氧气的接触面积之后可以迅速达到铜燃烧的着火点,反应速率更快
6.【答案】D
【解析】【解答】A、氮气和氢气在高温、高压和催化剂条件下合成氨气,可以一步转化,故A不符合题意;
B、二氧化硅和氢氧化钠反应生成硅酸钠和水,能一步转化,故B不符合题意;
C、浓硫酸和铜加热反应生成二氧化硫、硫酸铜和水,能一步转化,故C不符合题意;
D、二氧化硅不溶于水, 不能一步转化,故D符合题意;
故答案为:D。
【分析】A、氮气和氢气在一定条件下可合成氨气;
B、二氧化硅和氢氧化钠反应生成硅酸钠;
C、浓硫酸和铜在加热条件下反应可制得二氧化硫;
D、二氧化硅不溶于水。
7.【答案】B
【解析】【解答】A.司南中“杓”能指示方向,说明具有磁性,主要成分应为Fe3O4,A不符合题意;
B.“气”起了催熟作用,故“气”为乙烯,B符合题意;
C.K元素的焰色反应为紫色,故“紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色,C不符合题意;
D.粘土主要成分为硅酸盐,则“瓦”为传统无机非金属材料,主要成分为硅酸盐,故D不符合题意;
故答案为:B。
【分析】木瓜不会产生氧气,只会消耗氧气,这里的气指的是具有催熟效果的乙烯,不是氧气
8.【答案】A
【解析】【解答】A. 二氧化硅具有良好的光学效果,是高性能通讯材料光导纤维的主要原料,故A符合题意;
B. 铜是电的良导体,不是良好的光学材料,故B不符合题意;
C. 铝是电的导体,不是良好的光学材料,故C不符合题意;
D. 碳元素形成的单质石墨是电的良导体,不是良好的光学材料,故D不符合题意;
故答案为:A。
【分析】现代光学及光纤制品的基本原料是二氧化硅,铜、铝、碳不具有良好的光学性,不是现代光学及光纤的基本原料,据此即可解答。
9.【答案】D
【解析】【解答】A.单晶硅是良好的半导体材料,可以制作芯片,A选项不符合题意;
B.铜属于金属,具有良好的导电性,可以做手机线路板,B选项不符合题意;
C.镁铝合金密度小强度高,具有轻便抗压的特点,C选项不符合题意;
D.手机电池工作时,电池中化学能主要转化为电能,但有一部分能量以热能形式会散失,D选项符合题意;
故答案为:D。
【分析】A.硅的主要用途有芯片和太阳能电池;
B.同具有优良的导电性;
C.镁铝合金密度小强度高,具有轻便抗压的特点;
D.原电池是将化学能转化为电能,但是转化率达不到100%,还有一部分转化为热能散失。
10.【答案】D
【解析】【解答】A.光导纤维的主要成分为SiO2,故A不符合题意;
B.高铁车厢采用铝合金材料的原因是铝合金质量轻,且硬度高,铝与氧气在常温下能反应生成氧化铝,故B不符合题意;
C.氯气与石灰乳或烧碱反应制备消毒剂过程中,氯气既体现出氧化性,也体现出还原性,故C不符合题意;
D.钠单质在高温时能从熔融TiCl4中置换出金属Ti,属于置换反应,该反应中钠单质被氧化,体现出还原性,故D符合题意;
故答案为D。
【分析】A.光导纤维的主要成分为SiO2;
B.Al能与空气中的O2形成致密的氧化铝薄膜;
C.Cl2与Ca(OH)2反应过程中同时体现氧化性和还原性;
D.金属钠具有强还原性;
11.【答案】A
【解析】【解答】A.玻璃钢是由玻璃与树脂混合成的,前者是无机非金属材料,后者是有机高分子合成材料,故玻璃钢是两种材料复合成的,A符合题意;
B.人造皮革也叫仿皮或胶料,是PVC和PU等人造材料的总称,B不符合题意;
C.钢化玻璃属于硅酸盐材料,属无机非金属材料,C不符合题意;
D.再生塑料是塑料的再利用,通过进行机械刀片粉碎等操作以后,从而完成塑料的再次利用,D不符合题意。
故答案为:A。
【分析】复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料。
12.【答案】D
【解析】【解答】A.窑变在高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化,窑变是复杂的物理化学变化,故A不符合题意;
B.陶制品主要原料是黏土,经高温烧结而成,故B不符合题意;
C.陶瓷是硅酸盐产品,化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点,故C不符合题意;
D.高品质的瓷器晶莹剔透,属于混合物,故D符合题意。
故答案为:D。
【分析】A.窑变是复杂的物理化学变化;
B.陶瓷是硅酸盐产品;
C.硅酸盐化学性质稳定;
D.陶瓷属于混合物。
13.【答案】A
【解析】【解答】A.硅酸钠是可以溶于水的硅酸盐,故A不符合题意
B.空气中含有氮气和氧气,均可与镁单质作用,因此产物为氧化镁和氮化镁,故B不符合题意
C. 钠与水反应生成氢氧化钠和氢气 ,故C不符合题意
D. 常温下,铝遇浓硝酸或浓硫酸时会发生钝化 ,故D不符合题意
故答案为:A
【分析】硅酸钠的水溶液叫水玻璃,因此硅酸钠可以溶于水,其他选项均正确
14.【答案】B
【解析】【解答】A.SiO2能和碱反应生成盐和水,属于酸性氧化物,A不符合题意;
B.二氧化硅为光导纤维的常用材料,将太阳能转变为电能的常用材料为硅单质,B符合题意;
C.灼烧时所用温度较高,应在坩埚中进行,C不符合题意;
D.步骤Ⅱ中CO2过量,所以得到硅酸沉淀和碳酸氢钠,离子方程式为 ,D不符合题意;
故答案为B。
【分析】粗硅和NaOH溶液反应得到硅酸钠溶液,通入过量CO2过滤得到硅酸沉淀,灼烧得到SiO2。
15.【答案】B
【解析】【解答】A.轮胎书友有机物,故A不符合题意;
B.水泥管属于无机非金属材料,主要含有硅酸盐,故B符合题意;
C.火车头主要是金属材料,故C不符合题意;
D.汽车材料有金属和有机物,故D不符合题意;
故答案为:B
【分析】根据给出的选项判断物质类别即可。
16.【答案】A
【解析】【解答】A. 氯气具有强氧化性,铁粉与氯气反应只能生成FeCl3,A符合题意;
B. Cl2具有很强的氧化性,在化学反应中既能作氧化剂,也能作还原剂,例如氯气与氢氧化钠溶液反应,B不符合题意;
C. 11.2LCl2的物质的量不一定是0.5mol,其质量不一定为35.5g,C不符合题意;
D. 氢氟酸能与玻璃中的二氧化硅反应,因此保存氢氟酸时需要用塑料瓶,不能用玻璃瓶,D不符合题意。
故答案为:A。
【分析】铁与强氧化剂反应生成高价态铁;
B.氯气中Cl元素的化合价处于中间价态,既可升高也可降低;
C.利用气体摩尔体积计算气体的物质的量需要知道温度和压强;
D.HF能与玻璃中的二氧化硅反应。
17.【答案】B
【解析】【解答】A.二氧化碳形成的晶体是熔沸点低的分子晶体,不属于耐高温非金属材料,故A不符合题意;
B.碳化硅是熔沸点高的共价晶体,属于耐高温非金属材料,故B符合题意;
C.镁铝合金属于金属材料,不属于非金属材料,故C不符合题意;
D.五氧化二磷形成的晶体是熔沸点低的分子晶体,不属于耐高温非金属材料,故D不符合题意;
故答案为:B。
【分析】依据非金属材料由非金属元素或化合物构成的材料。
18.【答案】A
【解析】【解答】纳米粒子的大小符合胶体粒子的特征,能将其制成胶体,A符合题意;
某些物质达到纳米粒子状态时有奇特的性质,可催化水的分解,B不符合题意;
纳米粒子可开发为新型功能材料,C不符合题意;
纳米粒子半径小,表面活性高,D不符合题意。
【分析】纳米材料的基本构成微粒处于纳米数量级,有奇特的性质,可开发为新型功能材料。
19.【答案】C
【解析】【解答】A.生铁为铁碳合金,A不符合题意;
B.陶瓷的成分为硅酸盐,B不符合题意;
C.光导纤维的主要成分为二氧化硅,C符合题意;
D.氧化镁熔点很高,可作耐高温材料,D不符合题意;
故答案为:C。
【分析】本题主要考查物质的性质、组成以及用途,能够认识到光导纤维的原料是二氧化硅;氧化镁熔点很高;生铁是铁碳合金;陶瓷主要是硅酸盐。题目难度不大,学习中注意相关基础知识的积累。
20.【答案】D
【解析】【解答】A.FeCl3溶液能够与铜发生氧化还原反应,可用于刻蚀电路板,体现了铁离子的氧化性,A不符合题意;
B.SO2具有漂白性,所以SO2常用于漂白秸秆、织物,B不符合题意;
C.氢氟酸与二氧化硅反应,是特性反应,与酸性无关,C不符合题意;
D.CH3CH2OH完全燃烧生成二氧化碳和水并放出大量热量,无污染,D符合题意;
故答案为:D。
【分析】A.氯化铁刻蚀电路板体现的是氧化性;
B.SO2用于漂白秸秆、织物是利用其漂白性;
C.氢氟酸能够与玻璃中二氧化硅反应生成四氟化硅和水。
21.【答案】(1)Si;
(2)4HF+SiO2=SiF4↑+2H2O
(3)
(4)
(5)2H2S+O2=2S↓+2H2O
【解析】【解答】(1)芯片的主要成分是硅,粗硅可以用石墨高温下冶炼,生成一氧化碳和硅,故答案为:Si; ;
(2)氢氟酸可以用于蚀刻玻璃,氢氟酸和二氧化硅反应生成四氟化硅和水,故答案为: 4HF+SiO2=SiF4↑+2H2O ;
(3)氯化铵和氢氧化钙反应生成氯化钙、水和氨气,故答案为: ;
(4)甲烷可以和一氧化氮发生氧化还原反应,氮元素化合价降低,生成氮气,碳元素化合价升高,生成二氧化碳,故答案为: ;
(5)根据图示,可知反应物为O2和H2S,生成物为S,则总反应为 2H2S+O2=2S↓+2H2O ,故答案为: 2H2S+O2=2S↓+2H2O 。
【分析】(1)芯片的主要成分是硅,粗硅可以用石墨高温下冶炼,生成一氧化碳和硅;
(2)氢氟酸可以用于蚀刻玻璃,氢氟酸和二氧化硅反应生成四氟化硅和水;
(3)氯化铵和氢氧化钙反应生成氯化钙、水和氨气;
(4)甲烷可以和一氧化氮发生氧化还原反应,氮元素化合价降低,生成氮气,碳元素化合价升高,生成二氧化碳;
(5)箭头起点为反应物,终点为生成物。
22.【答案】(1)第三周期第ⅣA族
(2)难溶
(3)SiO+2H+=H2SiO3↓;>;核电荷数Si<S,原子半径Si>S,得电子能力Si<S,非金属性Si<S,硫酸酸性强于硅酸
(4)ab
【解析】【解答】(1)Si为第14号元素,其在元素周期表中的位置为第三周期第ⅣA族;
(2)SiO2为常见的摩擦剂,其在牙膏中以固体形式存在,因此SiO2在水中难溶;
(3)①H2SiO3难溶于水,因此可以用Na2SiO3和酸反应生成,反应的离子方程式为:SiO +2H+=H2SiO3↓;
②根据强酸制弱酸的原理,硫酸可以制备硅酸,因此硫酸酸性强于硅酸;
③Si和S电子层数相同,核电荷数Si<S,原子半径Si>S,得电子能力Si<S,非金属性Si<S,硫酸酸性强于硅酸;
(4)a.Sn为主族元素,主族元素的最高正化合价等于其族序数,Sn为第ⅣA族元素,因此Sn的最高正化合价为+4价,a正确;
b.同一主族元素原子从上到下原子半径逐渐增大,因此Sn的原子半径大于Si,b正确;
c.Sn为金属元素,可以导电,Sn不是半导体,Si为非金属元素,可以导电,Si是半导体,c不正确;
故答案为:ab。
【分析】硅酸钠与硫酸反应生成硅酸沉淀,离子方程式:SiO32-+2H+=H2SiO3↓,原硅酸经过加热变为二氧化硅,再结合元素周期表和元素周期律的相关知识分析解答。
23.【答案】(1)SiO2+ 2C Si + 2CO↑
(2)Si + 3HCl SiHCl3+ H2 (或加热)
(3)蒸馏;H4SiO4 (或H2SiO3). H2、HCl
(4)SiHCl3+ H2 Si+ 3HCl
(5)H2、HCl
【解析】【解答】(1)化学方程式为 SiO2+ 2C Si + 2CO↑
(2)由反应物和生成物可推方程式为 Si + 3HCl SiHCl3+ H2 (或加热)
(3)根据熔沸点可知,操作流程依次为沉降、冷凝、和蒸馏
可燃性气体为氢气, 能生成氢气则说明硅元素的化合价要升高,则产物为硅酸,剩下来的氯就形成HCl
(4)还原炉中是得到纯硅的反应,根据反应物和生成物可推化学方程式为 SiHCl3+ H2 Si+ 3HCl
(5)根据示意图可知,水解过程中产生的氢气和氯化氢也能循环使用
【分析】(1)注意:该条件下C只能变成CO,不能到二氧化碳
(3)可根据熔沸点来选择提纯方法
(5)可根据示意图来找出循环物质。
24.【答案】(1)4
(2)Al2O3·2SiO2·2H2O
(3)SiO2+4HF=SiF4↑+2H2O
(4)漂白性;还原性;酸性气体(或酸性氧化物);5SO2+2MnO +2H2O=5SO +2Mn2++4H+
【解析】【解答】(1)根据化合物中化合价的代数和为0可得,(+3)×2+(+4)×2+(-2)×5+(-1)×x=0,解得 x=4。
(2)[Al2Si2O5(OH)4]写成氧化物的形式为Al2O3·2SiO2·2H2O。
(3)SiO2能与HF反应生成SiF4和H2O,该反应的化学方程式为SiO2+4HF=SiF4↑+2H2O。
(4)由分析可知,该气体为SO2,SO2使品红溶液褪色,体现了SO2的漂白性;使酸性KMnO4溶液褪色,体现了SO2的还原性;使滴有酚酞的NaOH溶液褪色,体现了SO2酸性气体的性质。酸性KMnO4溶液具有强氧化性,能将SO2氧化成SO42-,自身还原为Mn2+,该反应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
【分析】(1)根据化合价代数和为0计算x的值。
(2)硅酸盐写成氧化物形式时,先写金属性强的金属氧化物,再写非金属氧化物,最后写H2O,书写过程中应注意原子个数比保持不变。
(3)SiO2能与HF反应生成SiF4和H2O,据此写出反应的化学方程式。
(4)该气体能使品红溶液褪色、使酸性KMnO4溶液褪色、使滴有酚酞的NaOH溶液褪色,则该气体为SO2,结合SO2的性质分析。
25.【答案】(1)影响金刚石硬度的因素是共价键,影响石墨硬度的因素是分子间作用力,共价键强于分子间作用力
(2);离子结构相似,电子层数逐渐增加,离子半径逐渐增大,原子核对最外层电子吸引力减弱,还原性逐渐增强
【解析】【解答】(1)金刚石为空间网状结构的原子晶体,晶体的硬度取决于碳原子间形成共价键的强弱,而石墨是层状结构的混合型晶体,晶体的硬度取决于层间分子间作用力的大小,共价键强于分子间作用力,所以金刚石硬度很大,石墨很软,故答案为:影响金刚石硬度的因素是共价键,影响石墨硬度的因素是分子间作用力,共价键强于分子间作用力;
(2)同主族元素,从上到下,离子的离子半径逐渐增大,原子核对最外层电子吸引力减弱,离子的还原性逐渐增强,所以氯离子、溴离子、碘离子的还原性逐渐增强,与二氧化锰反应时需要氢离子的浓度逐渐减小,则需要氢离子浓度最小的是碘离子,故答案为:KI;离子结构相似,电子层数逐渐增加,离子半径逐渐增大,原子核对最外层电子吸引力减弱,还原性逐渐增强。
【分析】(1)石墨和金刚石的空间结构不同,金刚石是共价键,石墨是分子间作用力;
(2)同主族元素,从上到下,离子的离子半径逐渐增大,原子核对最外层电子吸引力减弱,离子的还原性逐渐增强,所以氯离子、溴离子、碘离子的还原性逐渐增强,与二氧化锰反应时需要氢离子的浓度逐渐减小,则需要氢离子浓度最小的是碘离子。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
