2023北京重点校高二(上)期中化学汇编:化学反应的快慢和限度(含解析)
文档属性
| 名称 | 2023北京重点校高二(上)期中化学汇编:化学反应的快慢和限度(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 16:23:48 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2023北京重点校高二(上)期中化学汇编
化学反应的快慢和限度
一、单选题
1.(2023北京汇文中学高二上期中)在3A(g)+2B(g)C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=0.9mol/(L·s) B.v(B)=0.3mol/(L·s)
C.v(C)=0.4mol/(L·s) D.v(D)=0.8mol/(L·s)
2.(2023北京通州高二上期中)下列过程中,化学反应速率的增大对人类有益的是
A.金属的腐蚀 B.食物的腐败 C.塑料的老化 D.氨的合成
3.(2023北京丰台高二上期中)在反应中,有关反应条件改变使反应速率增大的原因分析中,不正确的是
A.加入适宜的催化剂,可降低反应的活化能 B.增大,单位体积内活化分子数增大
C.升高温度,单位时间内有效碰撞次数增加 D.增大压强,活化分子的百分数增大
4.(2023北京首师大附中高二上期中) 实验发现,一定条件下向一密闭容器中充入和,下列分析不正确的是
A.与O2的化学性质基本相同
B.断裂中共价键的能量大于断裂2molSO3中共价键的能量
C.1个核素中含有10个中子和8个质子
D.反应一段时间后,核素可能存在于SO2、O2、SO3中
5.(2023北京北师大实验中学高二上期中)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075mol·L-1·min-1
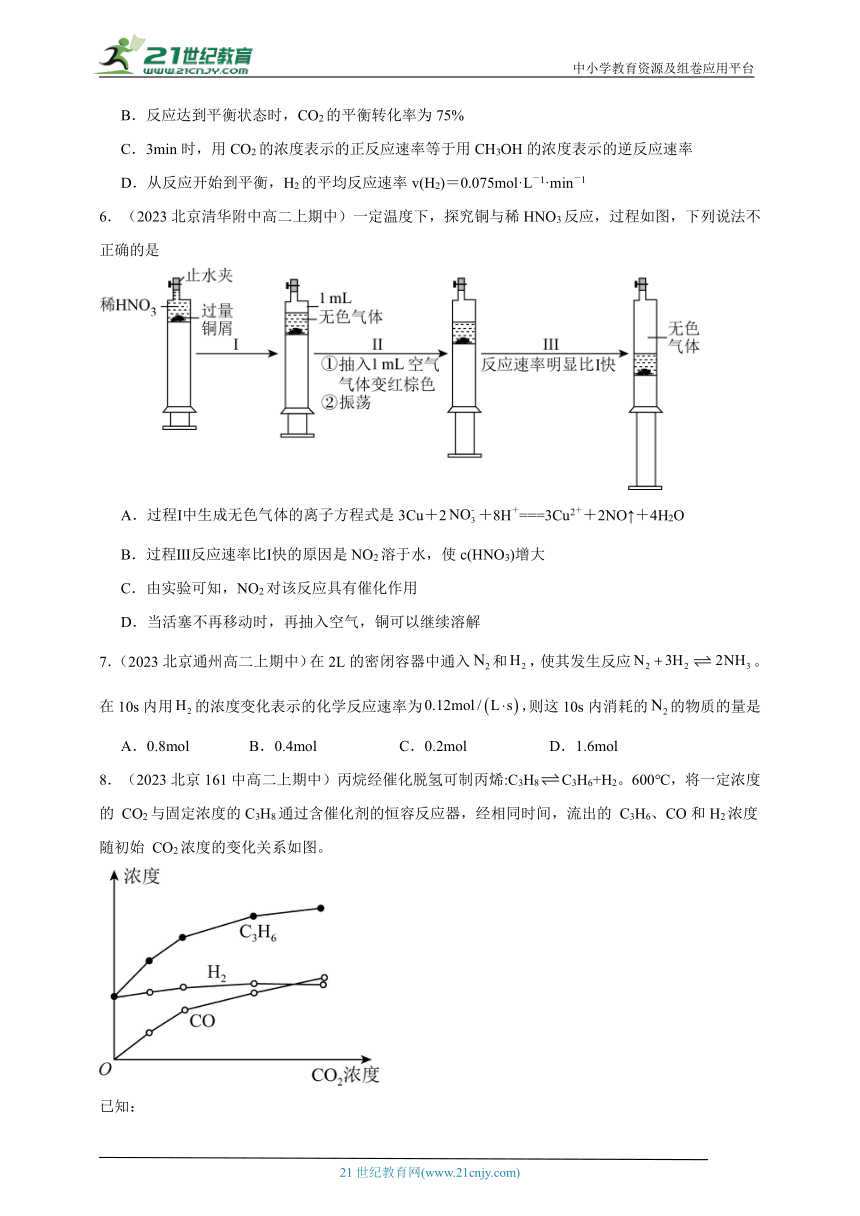
6.(2023北京清华附中高二上期中)一定温度下,探究铜与稀HNO3反应,过程如图,下列说法不正确的是
A.过程Ⅰ中生成无色气体的离子方程式是3Cu+2+8H+===3Cu2++2NO↑+4H2O
B.过程Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
7.(2023北京通州高二上期中)在2L的密闭容器中通入和,使其发生反应。在10s内用的浓度变化表示的化学反应速率为,则这10s内消耗的的物质的量是
A.0.8mol B.0.4mol C.0.2mol D.1.6mol
8.(2023北京161中高二上期中)丙烷经催化脱氢可制丙烯:C3H8C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
已知:
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
A.C3H8(g)=C3H6(g)+H2(g) △H=+124kJ/mol
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2CO+H2O
C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大
D.若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)
9.(2023北京15中高二上期中)在一定条件下发生反应:2A(g)=2B(g)+C(g),将2molA通入2L容积恒定的密闭容器中,若维持容器内温度不变,5min末测得A的物质的量为0.8mol。用B的浓度变化来表示该反应的速率[mol·(L·min)-1]为
A.0.24 B.0.08 C.0.06 D.0.12
10.(2023北京通州高二上期中)已知: ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是
A.反应的
B.过程b使用了催化剂
C.使用催化剂可以提高的平衡转化率
D.过程b发生两步反应,第一步为吸热反应
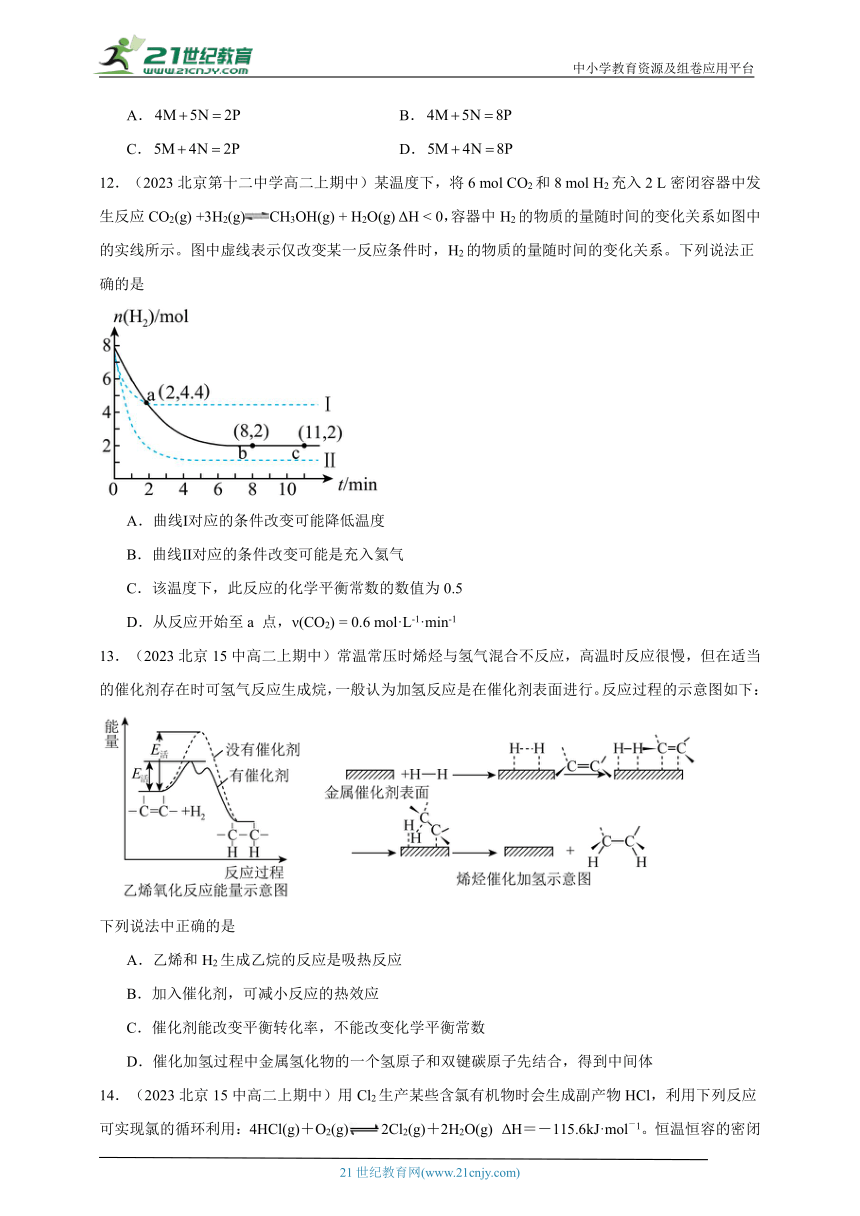
11.(2023北京海淀高二上期中)M与N在密闭容器中反应生成P,其反应速率分别用、、表示。已知、、之间有以下关系:、,则此反应可表示为
A. B.
C. D.
12.(2023北京第十二中学高二上期中)某温度下,将6 mol CO2和8 mol H2充入2 L密闭容器中发生反应CO2(g) +3H2(g)CH3OH(g) + H2O(g) ΔH < 0,容器中H2的物质的量随时间的变化关系如图中的实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系。下列说法正确的是
A.曲线Ⅰ对应的条件改变可能降低温度
B.曲线Ⅱ对应的条件改变可能是充入氦气
C.该温度下,此反应的化学平衡常数的数值为0.5
D.从反应开始至a 点,ν(CO2) = 0.6 mol·L-1·min-1
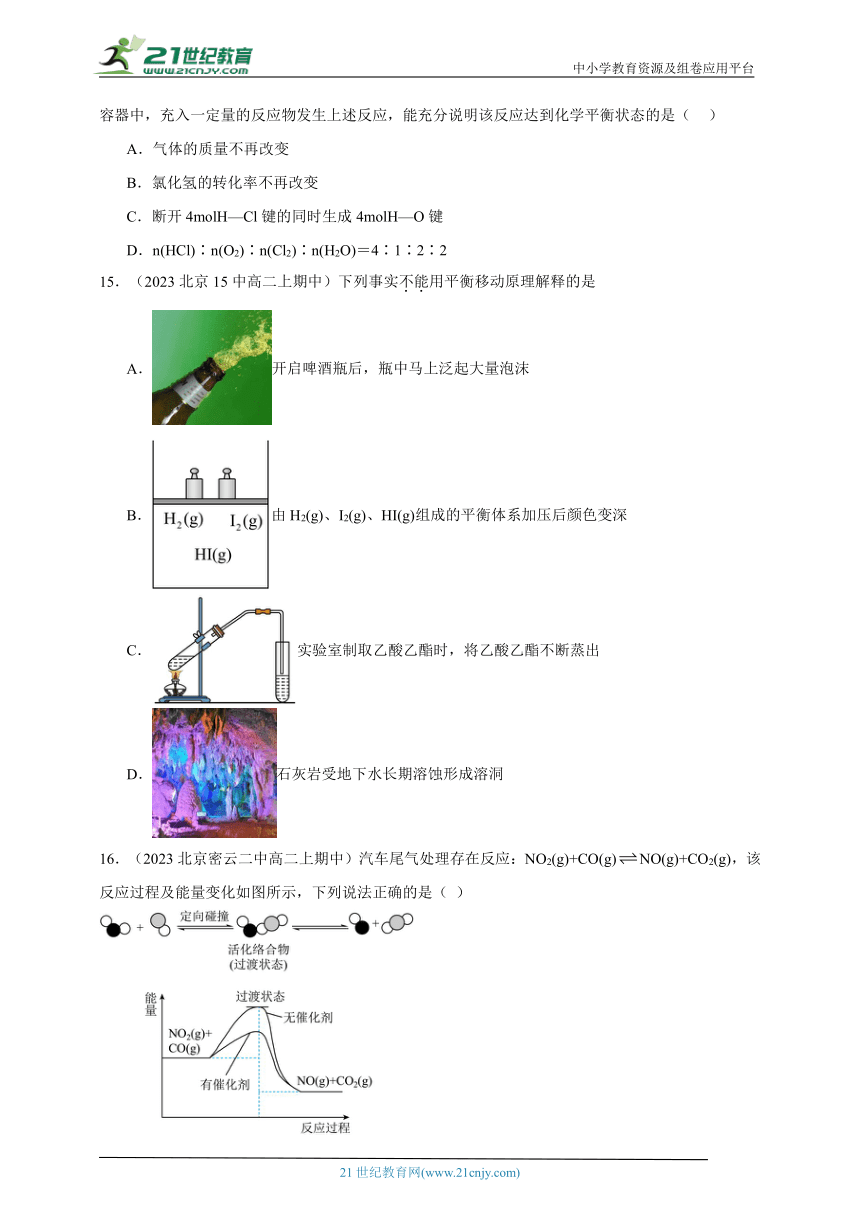
13.(2023北京15中高二上期中)常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可氢气反应生成烷,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
下列说法中正确的是
A.乙烯和H2生成乙烷的反应是吸热反应
B.加入催化剂,可减小反应的热效应
C.催化剂能改变平衡转化率,不能改变化学平衡常数
D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
14.(2023北京15中高二上期中)用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开4molH—Cl键的同时生成4molH—O键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
15.(2023北京15中高二上期中)下列事实不能用平衡移动原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
C.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
D.石灰岩受地下水长期溶蚀形成溶洞
16.(2023北京密云二中高二上期中)汽车尾气处理存在反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
A.升高温度,平衡正向移动
B.该反应生成了具有非极性共价键的CO2
C.反应物转化为活化络合物需要吸收能量
D.使用催化剂可以有效提高反应物的平衡转化率
17.(2023北京15中高二上期中)某温度下N2O5按下式分解:2N2O5(g) 4NO2(g)+O2(g)。测得恒容密闭容器内,N2O5的浓度随时间的变化如下表:
t/min 0 1 2 3 4 5 ……
c(N2O5)/(mol/L) 1.00 0.71 0.50 0.35 0.25 0.17 ……
下列说法不正确的是
A.4min时,c(NO2)=1.50mol/L
B.5min时,N2O5的转化率为83%
C.0~2min内平均反应速率v(O2)=0.125mol/(Lmin)
D.其他条件不变,若起始c(N2O5)=0.50mol/L,则2min时c(N2O5)<0.25mol/L
18.(2023北京15中高二上期中)25℃,K2Cr2O7溶液中含铬微粒的浓度与溶液pH的关系(局部)如下图所示。K2Cr2O7溶液中存在平衡:(橙色)+H2O 2(黄色)+2H+。
下列说法不正确的是
A.曲线Ⅱ代表浓度
B.改变溶液的pH,溶液颜色不一定发生变化
C.溶液中存在c()+c()+c(-)=0.2mol/L
D.pH=7的K2Cr2O7和KOH混合溶液存在c(K+)=c()+2c()+2c()
参考答案
1.C
【分析】化学反应速率之比等于化学计量数之比,转化为同种物质的反应速率比较反应的快慢,以此来解答。
【详解】A.,转化为;
B.,转化为;
C.;
D.,转化为;
C中数值最大,反应速率最快;
故答案选C。
【点睛】本题考查化学反应速率,把握化学反应速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意速率单位统一及转化法的应用。
2.D
【详解】
A.金属的腐蚀越慢越好,故增大速率对人类无益,A错误;
B.食物的腐败越慢越好,故增大速率对人类无益,B错误;
C.塑料的老化越慢越好,故增大速率对人类无益,C错误;
D.氨的合成越快越好,缩短生产周期,故增大速率对人类有益,D正确;
故选D。
3.D
【详解】A.加入合适的催化剂,能降低反应的活化能,反应速率增大,A正确;
B.增大碘化氢的浓度,单位体积内活化分子数增多,反应速率增大,B正确;
C.升高温度,单位时间内有效碰撞次数增加,反应速率增大,C正确;
D.增大压强,单位体积内活化分子数增多,反应速率增大,但活化分子百分数不变,D错误;
答案选D。
4.B
【详解】A.16O与18O是同位素,与O2的结构相同,化学性质基本相同,故A正确;
B.由于该反应为放热反应,所以断裂中的共价键的能量小于断裂2molSO3中的共价键的能量,故B错误;
C.该核素质量数为18,质子数为8,则含中子数=质量数-质子数=18-8=10,故C正确;
D.由于该反应为可逆反应,则反应一段时间后,核素可能存在于SO2、O2、SO3中,故D正确;
答案选B。
5.B
【详解】A. CO2(g)+3H2(g) CH3OH(g)+H2O(g)正反应放热,升高温度,平衡逆向移动,升高温度能使减小,故A错误;
B. 反应达到平衡状态时,CO2的平衡转化率为75%,故B正确;
C. 3min时,反应没有达到平衡状态,用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,故C错误;
D. 从反应开始到平衡,H2的浓度变化为0. 75mol·L-1×3=2.25 mol·L-1,平均反应速率(H2)=2.25 mol·L-1÷10min=0.225mol·L-1·min-1,故D错误;
选B。
6.B
【详解】A.过程发生的反应为Cu和稀HNO3的反应离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O,故A正确;
B.随着反应的进行,溶液里生成硝酸铜,根据氮元素守恒,溶液中c(HNO3)应比原硝酸浓度减小,不会增大,故B错误;
C.加入NO2后反应速率加快,说明NO2对该反应具有催化剂,故C正确;
D.反应停止后,再抽入空气,空气中的氧气能与一氧化氮,水继续反应生成硝酸,可继续溶解铜,故D正确;
故选B。
7.A
【详解】10s内用的浓度变化表示的化学反应速率为,则10s内的物质的量的变化为: 根据方程式,10s内消耗的的物质的量是,故A正确。
答案为:A。
8.C
【详解】A.根据盖斯定律结合题干信息①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol ③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol 可知,可由①-②-③得到目标反应C3H8(g)=C3H6(g)+H2(g),该反应的△H==+124kJ/mol,A正确;
B.仅按C3H8(g)=C3H6(g)+H2(g)可知C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,因此可以推断高温下能够发生反应CO2+H2CO+H2O,从而导致C3H6、H2的浓度随CO2浓度变化趋势出现这样的差异,B正确;
C.投料比增大,相当于增大C3H8浓度,浓度增大,转化率减小, C错误;
D.根据质量守恒定律,抓住碳原子守恒即可得出,如果生成物只有C3H6、CO、H2O、H2,那么入口各气体的浓度c0和出口各气体的浓度符合3c0(C3H8)+c0(CO2)=3c(C3H6)+c(CO)+3c(C3H8)+c(CO2),D正确;
答案为:C。
9.D
【详解】5min末测得A的物质的量由2mol变为0.8mol,
所以v(A)= =0.12mol/(L·min),
速率之比等于化学计量数之比,所以v(B)=v(A)=0.12mol/(L·min).
答案选D。
10.C
【详解】A.由图中信息可知,该反应的反应物的总能量高于生成物的总能量,故该反应为放热反应,反应的ΔH<0,A正确;
B.使用催化剂可以降低反应的活化能,由图中信息可知,过程b的活化能比过程a的活化能低,因此可以判断过程b使用了催化剂,B正确;
C.催化剂可以同等程度地加快正反应速率和逆反应速率,不影响平衡移动,使用催化剂不能提高SO2的平衡转化率,C错误;
D.由图中信息可知,过程b发生两步反应,第一步生成中间产物,中间产物的总能量高于反应物的总能量,因此第一步为吸热反应,D正确;
答案选C。
11.C
【详解】根据速率之比为反应的系数之比,+;
故答案为:C。
12.C
【详解】A.曲线Ⅰ和原平衡相比,氢气的转化率降低,但到达平衡的时间减少,说明反应速率加快。若降低温度,速率减慢,平衡向正反应方向移动,氢气的转化率增大,错误;
B.充入氦气,平衡不移动,而曲线Ⅱ到达平衡的时间减少,说明反应速率加快,不可能是充入氦气,错误;
C.平衡时氢气是2mol,则消耗氢气是6mol,所以同时消耗CO2是2mol,平衡时CO2是4mol,生成2mol甲醇和2mol水,所以平衡常数=,正确;
D.根据图象,在a点时,消耗氢气3.6mol,同时消耗CO2是1.2mol,所以ν(CO2)==0.3 mol·L-1·min-1,错误。
13.D
【详解】A、根据图示可知,反应物的能量高于产物的能量,所以该反应是放热反应,故A错误;
B、催化剂可以降低活化能,不会引起反应热的变化,反应的热效应不变,故B错误;
C、催化剂可以加快反应速率,不能改变平衡转化率,不能改变化学反应的平衡常数,故C错误;
D、根据化学反应的历程:化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体,故D正确;
故选D。
14.B
【分析】学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论。
【详解】A.气体的质量一直不变,所以不一定达平衡状态,故A错误;
B.氯化氢的转化率不再改变,说明各物质的量不变,反应达平衡状态,故B正确;
C.只要反应发生就存在断开4 mol H-Cl键的同时生成4 mol H-O键,故C错误;
D.n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2,不能说明各物质的量不变,故D错误;
故答案为B。
【点睛】考查化学平衡状态的判断。注意反应达到平衡状态时,正逆反应速率相等,必须是同一物质的正逆反应速率相等;反应达到平衡状态时,平衡时各种物质的物质的量、浓度等不再发生变化,此类试题中容易发生错误的情况往往有:平衡时浓度不变,不是表示浓度之间有特定的大小关系;正逆反应速率相等,不表示是数值大小相等;对于密度、相对分子质量等是否不变,要具体情况具体分析等。
15.B
【详解】A.啤酒中存在平衡:H2CO3H2O+CO2,开启啤酒瓶,瓶内压强降低,平衡向气体体积增大的方向移动,即向生成二氧化碳气体的方向移动,故能用平衡移动原理解释,A不选;
B.反应H2+I22HI是一个反应前后气体分子数不变的反应,压强改变并不能使平衡发生移动,混合气体加压后颜色变深,是因为I2的浓度增大,不能用平衡移动原理解释,B选;
C.实验室制取乙酸乙酯时,采用加热的方式将乙酸乙酯不断蒸出,从而平衡向生成乙酸乙酯的方向移动,能用平衡移动原理解释,C不选;
D.石灰岩形成与反应:CaCO3+CO2+H2OCa(HCO3)2,能用平衡移动原理解释,D不选;
答案选B。
16.C
【详解】A.由图象可知,该反应是一个能量降低的反应,即正反应是放热反应,升高温度,平衡向吸热方向移动,即逆向移动,故A错误;
B.CO2分子中含有碳氧共价键为极性共价键,故B错误;
C.由图象可知,反应物的总能量小于活化络合物的总能量,所以由反应物转化为活化络合物需要吸收能量,故C正确;
D.催化剂能改变反应速率,对化学平衡无影响,所以使用催化剂不能提高反应物的平衡转化率,故D错误;
故答案选C。
17.D
【详解】A.由题给表格数据可知,4min时,N2O5的消耗量为(1.00—0.25) mol/L=0.75 mol/L,由各物质的化学计量数之比等于变化量之比可得反应生成c(NO2)= 0.75 mol/L ×2=1.50mol/L,故A正确;
B.5min时,N2O5的消耗量为(1.00—0.17) mol/L=0.83 mol/L,则N2O5的转化率为×100%=83%,故B正确;
C.0~2min内,N2O5的消耗量为(1.00—0.50) mol/L=0.50mol/L,由各物质的化学计量数之比等于变化量之比可得反应生成c(O2)= 0.50 mol/L ×=0.25mol/L,则v(O2)==0.125mol/(Lmin),故C正确;
D.由题给表格数据可知,2min时N2O5的消耗浓度为起始的一半,其他条件不变,若起始c(N2O5)=0.50mol/L,反应物浓度减小,化学反应速率减小,反应消耗N2O5的浓度小于起始的一半,则2min时c(N2O5) >0.25mol/L,故D错误;
故选D。
18.C
【详解】A.pH值减少,氢离子浓度增大,反应(橙色)+H2O 2(黄色)+2H+逆向移动,浓度增大,则曲线Ⅱ代表浓度,故A不选;
B.当pH值在8以后,增大pH值,浓度、浓度几乎不变,溶液颜色不一定发生变化,故B不选;
C.K2Cr2O7溶液浓度未知,则c()+2c()+c(-)≠0.2mol/L,故C选;
D.pH=7的K2Cr2O7和KOH混合溶液存在c(K+)=c()+2c()+2c(),是电荷守恒,故D不选;
故选:C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2023北京重点校高二(上)期中化学汇编
化学反应的快慢和限度
一、单选题
1.(2023北京汇文中学高二上期中)在3A(g)+2B(g)C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=0.9mol/(L·s) B.v(B)=0.3mol/(L·s)
C.v(C)=0.4mol/(L·s) D.v(D)=0.8mol/(L·s)
2.(2023北京通州高二上期中)下列过程中,化学反应速率的增大对人类有益的是
A.金属的腐蚀 B.食物的腐败 C.塑料的老化 D.氨的合成
3.(2023北京丰台高二上期中)在反应中,有关反应条件改变使反应速率增大的原因分析中,不正确的是
A.加入适宜的催化剂,可降低反应的活化能 B.增大,单位体积内活化分子数增大
C.升高温度,单位时间内有效碰撞次数增加 D.增大压强,活化分子的百分数增大
4.(2023北京首师大附中高二上期中) 实验发现,一定条件下向一密闭容器中充入和,下列分析不正确的是
A.与O2的化学性质基本相同
B.断裂中共价键的能量大于断裂2molSO3中共价键的能量
C.1个核素中含有10个中子和8个质子
D.反应一段时间后,核素可能存在于SO2、O2、SO3中
5.(2023北京北师大实验中学高二上期中)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075mol·L-1·min-1
6.(2023北京清华附中高二上期中)一定温度下,探究铜与稀HNO3反应,过程如图,下列说法不正确的是
A.过程Ⅰ中生成无色气体的离子方程式是3Cu+2+8H+===3Cu2++2NO↑+4H2O
B.过程Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
7.(2023北京通州高二上期中)在2L的密闭容器中通入和,使其发生反应。在10s内用的浓度变化表示的化学反应速率为,则这10s内消耗的的物质的量是
A.0.8mol B.0.4mol C.0.2mol D.1.6mol
8.(2023北京161中高二上期中)丙烷经催化脱氢可制丙烯:C3H8C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
已知:
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
A.C3H8(g)=C3H6(g)+H2(g) △H=+124kJ/mol
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2CO+H2O
C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大
D.若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)
9.(2023北京15中高二上期中)在一定条件下发生反应:2A(g)=2B(g)+C(g),将2molA通入2L容积恒定的密闭容器中,若维持容器内温度不变,5min末测得A的物质的量为0.8mol。用B的浓度变化来表示该反应的速率[mol·(L·min)-1]为
A.0.24 B.0.08 C.0.06 D.0.12
10.(2023北京通州高二上期中)已知: ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是
A.反应的
B.过程b使用了催化剂
C.使用催化剂可以提高的平衡转化率
D.过程b发生两步反应,第一步为吸热反应
11.(2023北京海淀高二上期中)M与N在密闭容器中反应生成P,其反应速率分别用、、表示。已知、、之间有以下关系:、,则此反应可表示为
A. B.
C. D.
12.(2023北京第十二中学高二上期中)某温度下,将6 mol CO2和8 mol H2充入2 L密闭容器中发生反应CO2(g) +3H2(g)CH3OH(g) + H2O(g) ΔH < 0,容器中H2的物质的量随时间的变化关系如图中的实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系。下列说法正确的是
A.曲线Ⅰ对应的条件改变可能降低温度
B.曲线Ⅱ对应的条件改变可能是充入氦气
C.该温度下,此反应的化学平衡常数的数值为0.5
D.从反应开始至a 点,ν(CO2) = 0.6 mol·L-1·min-1
13.(2023北京15中高二上期中)常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可氢气反应生成烷,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
下列说法中正确的是
A.乙烯和H2生成乙烷的反应是吸热反应
B.加入催化剂,可减小反应的热效应
C.催化剂能改变平衡转化率,不能改变化学平衡常数
D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
14.(2023北京15中高二上期中)用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开4molH—Cl键的同时生成4molH—O键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
15.(2023北京15中高二上期中)下列事实不能用平衡移动原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
C.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
D.石灰岩受地下水长期溶蚀形成溶洞
16.(2023北京密云二中高二上期中)汽车尾气处理存在反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
A.升高温度,平衡正向移动
B.该反应生成了具有非极性共价键的CO2
C.反应物转化为活化络合物需要吸收能量
D.使用催化剂可以有效提高反应物的平衡转化率
17.(2023北京15中高二上期中)某温度下N2O5按下式分解:2N2O5(g) 4NO2(g)+O2(g)。测得恒容密闭容器内,N2O5的浓度随时间的变化如下表:
t/min 0 1 2 3 4 5 ……
c(N2O5)/(mol/L) 1.00 0.71 0.50 0.35 0.25 0.17 ……
下列说法不正确的是
A.4min时,c(NO2)=1.50mol/L
B.5min时,N2O5的转化率为83%
C.0~2min内平均反应速率v(O2)=0.125mol/(Lmin)
D.其他条件不变,若起始c(N2O5)=0.50mol/L,则2min时c(N2O5)<0.25mol/L
18.(2023北京15中高二上期中)25℃,K2Cr2O7溶液中含铬微粒的浓度与溶液pH的关系(局部)如下图所示。K2Cr2O7溶液中存在平衡:(橙色)+H2O 2(黄色)+2H+。
下列说法不正确的是
A.曲线Ⅱ代表浓度
B.改变溶液的pH,溶液颜色不一定发生变化
C.溶液中存在c()+c()+c(-)=0.2mol/L
D.pH=7的K2Cr2O7和KOH混合溶液存在c(K+)=c()+2c()+2c()
参考答案
1.C
【分析】化学反应速率之比等于化学计量数之比,转化为同种物质的反应速率比较反应的快慢,以此来解答。
【详解】A.,转化为;
B.,转化为;
C.;
D.,转化为;
C中数值最大,反应速率最快;
故答案选C。
【点睛】本题考查化学反应速率,把握化学反应速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意速率单位统一及转化法的应用。
2.D
【详解】
A.金属的腐蚀越慢越好,故增大速率对人类无益,A错误;
B.食物的腐败越慢越好,故增大速率对人类无益,B错误;
C.塑料的老化越慢越好,故增大速率对人类无益,C错误;
D.氨的合成越快越好,缩短生产周期,故增大速率对人类有益,D正确;
故选D。
3.D
【详解】A.加入合适的催化剂,能降低反应的活化能,反应速率增大,A正确;
B.增大碘化氢的浓度,单位体积内活化分子数增多,反应速率增大,B正确;
C.升高温度,单位时间内有效碰撞次数增加,反应速率增大,C正确;
D.增大压强,单位体积内活化分子数增多,反应速率增大,但活化分子百分数不变,D错误;
答案选D。
4.B
【详解】A.16O与18O是同位素,与O2的结构相同,化学性质基本相同,故A正确;
B.由于该反应为放热反应,所以断裂中的共价键的能量小于断裂2molSO3中的共价键的能量,故B错误;
C.该核素质量数为18,质子数为8,则含中子数=质量数-质子数=18-8=10,故C正确;
D.由于该反应为可逆反应,则反应一段时间后,核素可能存在于SO2、O2、SO3中,故D正确;
答案选B。
5.B
【详解】A. CO2(g)+3H2(g) CH3OH(g)+H2O(g)正反应放热,升高温度,平衡逆向移动,升高温度能使减小,故A错误;
B. 反应达到平衡状态时,CO2的平衡转化率为75%,故B正确;
C. 3min时,反应没有达到平衡状态,用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,故C错误;
D. 从反应开始到平衡,H2的浓度变化为0. 75mol·L-1×3=2.25 mol·L-1,平均反应速率(H2)=2.25 mol·L-1÷10min=0.225mol·L-1·min-1,故D错误;
选B。
6.B
【详解】A.过程发生的反应为Cu和稀HNO3的反应离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O,故A正确;
B.随着反应的进行,溶液里生成硝酸铜,根据氮元素守恒,溶液中c(HNO3)应比原硝酸浓度减小,不会增大,故B错误;
C.加入NO2后反应速率加快,说明NO2对该反应具有催化剂,故C正确;
D.反应停止后,再抽入空气,空气中的氧气能与一氧化氮,水继续反应生成硝酸,可继续溶解铜,故D正确;
故选B。
7.A
【详解】10s内用的浓度变化表示的化学反应速率为,则10s内的物质的量的变化为: 根据方程式,10s内消耗的的物质的量是,故A正确。
答案为:A。
8.C
【详解】A.根据盖斯定律结合题干信息①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol ③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol 可知,可由①-②-③得到目标反应C3H8(g)=C3H6(g)+H2(g),该反应的△H==+124kJ/mol,A正确;
B.仅按C3H8(g)=C3H6(g)+H2(g)可知C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,因此可以推断高温下能够发生反应CO2+H2CO+H2O,从而导致C3H6、H2的浓度随CO2浓度变化趋势出现这样的差异,B正确;
C.投料比增大,相当于增大C3H8浓度,浓度增大,转化率减小, C错误;
D.根据质量守恒定律,抓住碳原子守恒即可得出,如果生成物只有C3H6、CO、H2O、H2,那么入口各气体的浓度c0和出口各气体的浓度符合3c0(C3H8)+c0(CO2)=3c(C3H6)+c(CO)+3c(C3H8)+c(CO2),D正确;
答案为:C。
9.D
【详解】5min末测得A的物质的量由2mol变为0.8mol,
所以v(A)= =0.12mol/(L·min),
速率之比等于化学计量数之比,所以v(B)=v(A)=0.12mol/(L·min).
答案选D。
10.C
【详解】A.由图中信息可知,该反应的反应物的总能量高于生成物的总能量,故该反应为放热反应,反应的ΔH<0,A正确;
B.使用催化剂可以降低反应的活化能,由图中信息可知,过程b的活化能比过程a的活化能低,因此可以判断过程b使用了催化剂,B正确;
C.催化剂可以同等程度地加快正反应速率和逆反应速率,不影响平衡移动,使用催化剂不能提高SO2的平衡转化率,C错误;
D.由图中信息可知,过程b发生两步反应,第一步生成中间产物,中间产物的总能量高于反应物的总能量,因此第一步为吸热反应,D正确;
答案选C。
11.C
【详解】根据速率之比为反应的系数之比,+;
故答案为:C。
12.C
【详解】A.曲线Ⅰ和原平衡相比,氢气的转化率降低,但到达平衡的时间减少,说明反应速率加快。若降低温度,速率减慢,平衡向正反应方向移动,氢气的转化率增大,错误;
B.充入氦气,平衡不移动,而曲线Ⅱ到达平衡的时间减少,说明反应速率加快,不可能是充入氦气,错误;
C.平衡时氢气是2mol,则消耗氢气是6mol,所以同时消耗CO2是2mol,平衡时CO2是4mol,生成2mol甲醇和2mol水,所以平衡常数=,正确;
D.根据图象,在a点时,消耗氢气3.6mol,同时消耗CO2是1.2mol,所以ν(CO2)==0.3 mol·L-1·min-1,错误。
13.D
【详解】A、根据图示可知,反应物的能量高于产物的能量,所以该反应是放热反应,故A错误;
B、催化剂可以降低活化能,不会引起反应热的变化,反应的热效应不变,故B错误;
C、催化剂可以加快反应速率,不能改变平衡转化率,不能改变化学反应的平衡常数,故C错误;
D、根据化学反应的历程:化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体,故D正确;
故选D。
14.B
【分析】学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论。
【详解】A.气体的质量一直不变,所以不一定达平衡状态,故A错误;
B.氯化氢的转化率不再改变,说明各物质的量不变,反应达平衡状态,故B正确;
C.只要反应发生就存在断开4 mol H-Cl键的同时生成4 mol H-O键,故C错误;
D.n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2,不能说明各物质的量不变,故D错误;
故答案为B。
【点睛】考查化学平衡状态的判断。注意反应达到平衡状态时,正逆反应速率相等,必须是同一物质的正逆反应速率相等;反应达到平衡状态时,平衡时各种物质的物质的量、浓度等不再发生变化,此类试题中容易发生错误的情况往往有:平衡时浓度不变,不是表示浓度之间有特定的大小关系;正逆反应速率相等,不表示是数值大小相等;对于密度、相对分子质量等是否不变,要具体情况具体分析等。
15.B
【详解】A.啤酒中存在平衡:H2CO3H2O+CO2,开启啤酒瓶,瓶内压强降低,平衡向气体体积增大的方向移动,即向生成二氧化碳气体的方向移动,故能用平衡移动原理解释,A不选;
B.反应H2+I22HI是一个反应前后气体分子数不变的反应,压强改变并不能使平衡发生移动,混合气体加压后颜色变深,是因为I2的浓度增大,不能用平衡移动原理解释,B选;
C.实验室制取乙酸乙酯时,采用加热的方式将乙酸乙酯不断蒸出,从而平衡向生成乙酸乙酯的方向移动,能用平衡移动原理解释,C不选;
D.石灰岩形成与反应:CaCO3+CO2+H2OCa(HCO3)2,能用平衡移动原理解释,D不选;
答案选B。
16.C
【详解】A.由图象可知,该反应是一个能量降低的反应,即正反应是放热反应,升高温度,平衡向吸热方向移动,即逆向移动,故A错误;
B.CO2分子中含有碳氧共价键为极性共价键,故B错误;
C.由图象可知,反应物的总能量小于活化络合物的总能量,所以由反应物转化为活化络合物需要吸收能量,故C正确;
D.催化剂能改变反应速率,对化学平衡无影响,所以使用催化剂不能提高反应物的平衡转化率,故D错误;
故答案选C。
17.D
【详解】A.由题给表格数据可知,4min时,N2O5的消耗量为(1.00—0.25) mol/L=0.75 mol/L,由各物质的化学计量数之比等于变化量之比可得反应生成c(NO2)= 0.75 mol/L ×2=1.50mol/L,故A正确;
B.5min时,N2O5的消耗量为(1.00—0.17) mol/L=0.83 mol/L,则N2O5的转化率为×100%=83%,故B正确;
C.0~2min内,N2O5的消耗量为(1.00—0.50) mol/L=0.50mol/L,由各物质的化学计量数之比等于变化量之比可得反应生成c(O2)= 0.50 mol/L ×=0.25mol/L,则v(O2)==0.125mol/(Lmin),故C正确;
D.由题给表格数据可知,2min时N2O5的消耗浓度为起始的一半,其他条件不变,若起始c(N2O5)=0.50mol/L,反应物浓度减小,化学反应速率减小,反应消耗N2O5的浓度小于起始的一半,则2min时c(N2O5) >0.25mol/L,故D错误;
故选D。
18.C
【详解】A.pH值减少,氢离子浓度增大,反应(橙色)+H2O 2(黄色)+2H+逆向移动,浓度增大,则曲线Ⅱ代表浓度,故A不选;
B.当pH值在8以后,增大pH值,浓度、浓度几乎不变,溶液颜色不一定发生变化,故B不选;
C.K2Cr2O7溶液浓度未知,则c()+2c()+c(-)≠0.2mol/L,故C选;
D.pH=7的K2Cr2O7和KOH混合溶液存在c(K+)=c()+2c()+2c(),是电荷守恒,故D不选;
故选:C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
