河南省中牟县第二高级中学高中化学鲁科版选修四1-1-2化学反应的热量效应课件(共13张PPT)
文档属性
| 名称 | 河南省中牟县第二高级中学高中化学鲁科版选修四1-1-2化学反应的热量效应课件(共13张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 55.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-09-30 00:00:00 | ||
图片预览





文档简介
课件13张PPT。第二课时化学反应与能量转化第一节化学反应的热效应 教学目标
知识与技能
1.理解焓和焓变的含义
2.正确书写热化学方程式
过程与方法
通过化学反应中的能量变化,理解吸热反应和放热反应的关系,会正确的书写热化学方程式。
情感态度与价值观
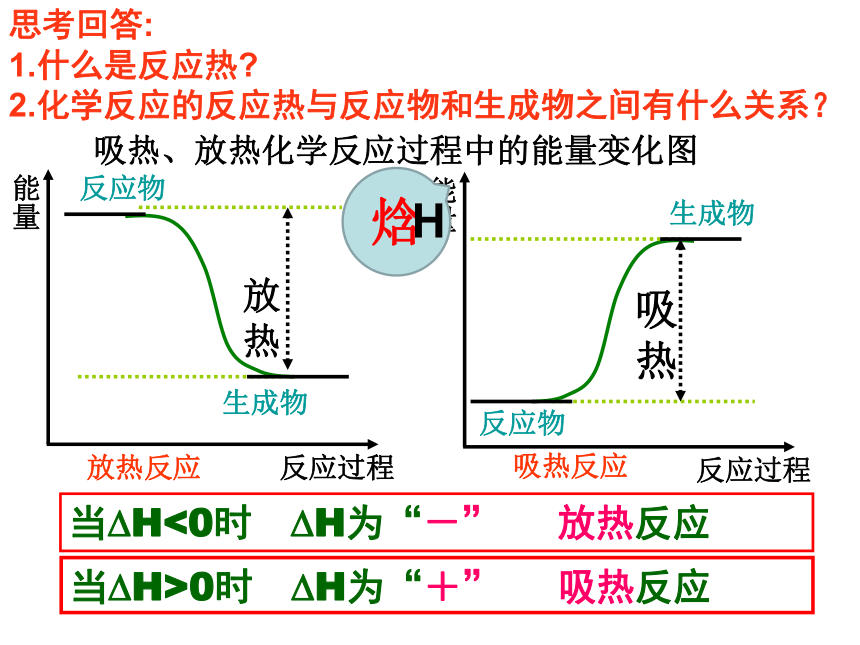
通过学习,培养学生学习化学的兴趣,乐于探究物质变化的奥秘,感受化学世界的奇妙。吸热、放热化学反应过程中的能量变化图1.什么是反应热?
2.化学反应的反应热与反应物和生成物之间有什么关系?思考回答:焓H当?H<0时 ?H为“-” 放热反应当?H>0时 ?H为“+” 吸热反应焓变与反应热的关系:在恒压的条件下,化学反应过程中能量变化全部转化为热能,则△H=QP(QP:等压条件下化学反应的反应热)例 1:1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该焓变为△H= 。 例 2:拆开 lmol H—H键、lmolN-H
键、lmolN≡N键分别需要的能量是
436kJ、391kJ、946kJ,则1mol N2生
成NH3的焓变为 +131.5 KJ·mol-1 -92 KJ·mol-1【练习】三、热化学方程式1.定义把一个化学反应中的物质变化和反应的焓变同时表示出来的化学方程式,叫做热化学方程式。例如,在298K时, 1molH2(g)和0.5molO2(g)反
应生成1molH2O(l)放热285.8KJ,此反应的热化学方程式可写为:H2(g)+1/2O2(g)=H2O(l) △H(298K)=-285.9 KJ·mol-1交流研讨1.已知在298K时,由氢气和氮气反应生成1molNH3(g)
放热46.11kJ,请将下列化学方程式写成热化学方程式。3/2H2+1/2N2=NH33/2H2(g) +1/2N2(g)=NH3(g)
?H=-46.11KJ·mol-1NH3 (g) = 3/2H2(g) + 1/2N2 (g)
ΔH= +46.11KJ·mol-1 NH3 = 3/2H2+ 1/2N23H2+N2=2NH33H2(g)+N2(g)=2NH3(g)
?H=-92.22 KJ·mol-1 2.已知在298K时,由1molH2(g)和0.5molO2(g)反
应生成1molH2O(l)放热285.8KJ,生成1molH2O(g)
放热241.8KJ。请分析两种情况下反应热为何不 同,并写出热化学方程式。H2(g)+1/2O2(g)=H2O(l) △H=-285.9 KJ·mol-1H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1(5)方程式中的化学计量数只表示物质的量,不表分子数,可整可分。(3)?H要注明单位: KJ·mol-1(4)方程式系数加倍,?H绝对值加倍,若逆向进行,?H改变符号,绝对值不变。3.热化学方程式书写注意事项 (1) 物质的状态
(固s,液l,气g,溶液中的溶质aq) (2)在?H后要注明反应的温度,常温(298K)可以不注明热化学方程式2H2(g)+O2(g)=2H2O (l)
ΔH (298K) =-571.6 KJ·mol-1表示的意义
含义:298K时,2mol的H2(g)与1mol的O2(g)反应生
成2mol的H2O(l) ,放出热量571.6KJ。【例题】1、当1mol气态H2与1mol气态Cl2反应,生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。H2(g)+Cl2(g)=2HCl(g) ?H=-184.6KJ·mol-12.已知1g甲烷完全燃烧生成二氧化碳和液态水放出55.625KJ热量写出该反应的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 KJ·mol-13、已知在1×105Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出484kJ热量,下列热化学
方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2 (g) ΔH=+242k J·mol-1
B. 2H2 (g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1 A1.写出下列反应的热化学方程式(1).1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
(2)1g硫粉在氧气中充分燃烧放出 9.36kJ热
量,写出硫燃烧的热化学方程式。N2 (g) + O2(g) =2NO (g) ΔH = +68 KJ·mol-1S (S) + O2(g) =SO2(g) ΔH = -299.5 KJ·mol-1【课堂检测】
知识与技能
1.理解焓和焓变的含义
2.正确书写热化学方程式
过程与方法
通过化学反应中的能量变化,理解吸热反应和放热反应的关系,会正确的书写热化学方程式。
情感态度与价值观
通过学习,培养学生学习化学的兴趣,乐于探究物质变化的奥秘,感受化学世界的奇妙。吸热、放热化学反应过程中的能量变化图1.什么是反应热?
2.化学反应的反应热与反应物和生成物之间有什么关系?思考回答:焓H当?H<0时 ?H为“-” 放热反应当?H>0时 ?H为“+” 吸热反应焓变与反应热的关系:在恒压的条件下,化学反应过程中能量变化全部转化为热能,则△H=QP(QP:等压条件下化学反应的反应热)例 1:1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该焓变为△H= 。 例 2:拆开 lmol H—H键、lmolN-H
键、lmolN≡N键分别需要的能量是
436kJ、391kJ、946kJ,则1mol N2生
成NH3的焓变为 +131.5 KJ·mol-1 -92 KJ·mol-1【练习】三、热化学方程式1.定义把一个化学反应中的物质变化和反应的焓变同时表示出来的化学方程式,叫做热化学方程式。例如,在298K时, 1molH2(g)和0.5molO2(g)反
应生成1molH2O(l)放热285.8KJ,此反应的热化学方程式可写为:H2(g)+1/2O2(g)=H2O(l) △H(298K)=-285.9 KJ·mol-1交流研讨1.已知在298K时,由氢气和氮气反应生成1molNH3(g)
放热46.11kJ,请将下列化学方程式写成热化学方程式。3/2H2+1/2N2=NH33/2H2(g) +1/2N2(g)=NH3(g)
?H=-46.11KJ·mol-1NH3 (g) = 3/2H2(g) + 1/2N2 (g)
ΔH= +46.11KJ·mol-1 NH3 = 3/2H2+ 1/2N23H2+N2=2NH33H2(g)+N2(g)=2NH3(g)
?H=-92.22 KJ·mol-1 2.已知在298K时,由1molH2(g)和0.5molO2(g)反
应生成1molH2O(l)放热285.8KJ,生成1molH2O(g)
放热241.8KJ。请分析两种情况下反应热为何不 同,并写出热化学方程式。H2(g)+1/2O2(g)=H2O(l) △H=-285.9 KJ·mol-1H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1(5)方程式中的化学计量数只表示物质的量,不表分子数,可整可分。(3)?H要注明单位: KJ·mol-1(4)方程式系数加倍,?H绝对值加倍,若逆向进行,?H改变符号,绝对值不变。3.热化学方程式书写注意事项 (1) 物质的状态
(固s,液l,气g,溶液中的溶质aq) (2)在?H后要注明反应的温度,常温(298K)可以不注明热化学方程式2H2(g)+O2(g)=2H2O (l)
ΔH (298K) =-571.6 KJ·mol-1表示的意义
含义:298K时,2mol的H2(g)与1mol的O2(g)反应生
成2mol的H2O(l) ,放出热量571.6KJ。【例题】1、当1mol气态H2与1mol气态Cl2反应,生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。H2(g)+Cl2(g)=2HCl(g) ?H=-184.6KJ·mol-12.已知1g甲烷完全燃烧生成二氧化碳和液态水放出55.625KJ热量写出该反应的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 KJ·mol-13、已知在1×105Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出484kJ热量,下列热化学
方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2 (g) ΔH=+242k J·mol-1
B. 2H2 (g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1 A1.写出下列反应的热化学方程式(1).1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
(2)1g硫粉在氧气中充分燃烧放出 9.36kJ热
量,写出硫燃烧的热化学方程式。N2 (g) + O2(g) =2NO (g) ΔH = +68 KJ·mol-1S (S) + O2(g) =SO2(g) ΔH = -299.5 KJ·mol-1【课堂检测】
