河南省中牟县第二高级中学高中化学鲁科版选修四1-3-1化学能转化为电能-电池课件(共11张PPT)
文档属性
| 名称 | 河南省中牟县第二高级中学高中化学鲁科版选修四1-3-1化学能转化为电能-电池课件(共11张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-09-30 14:42:05 | ||
图片预览


文档简介
课件11张PPT。第1章
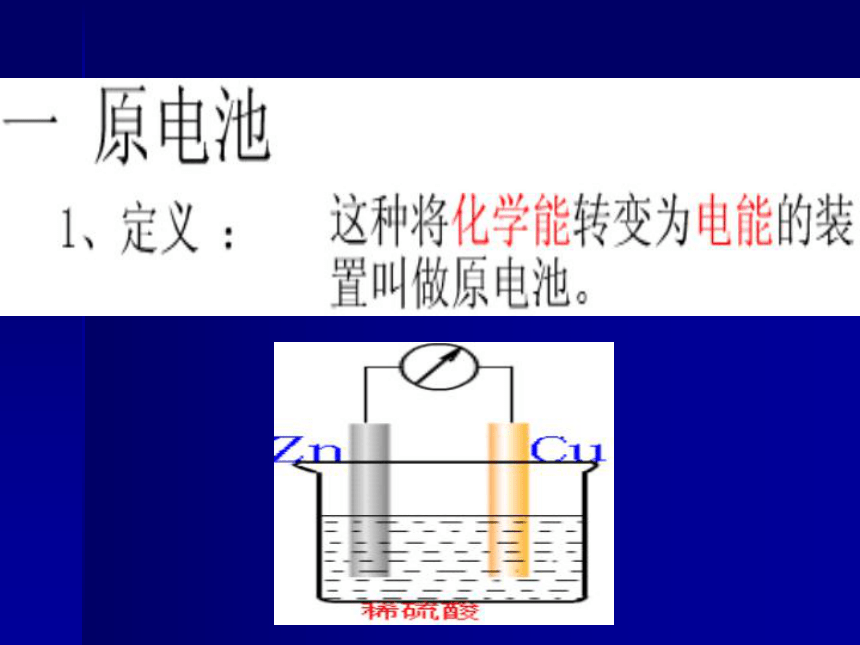
化学反应与能量转化第3节 化学能转化为电能
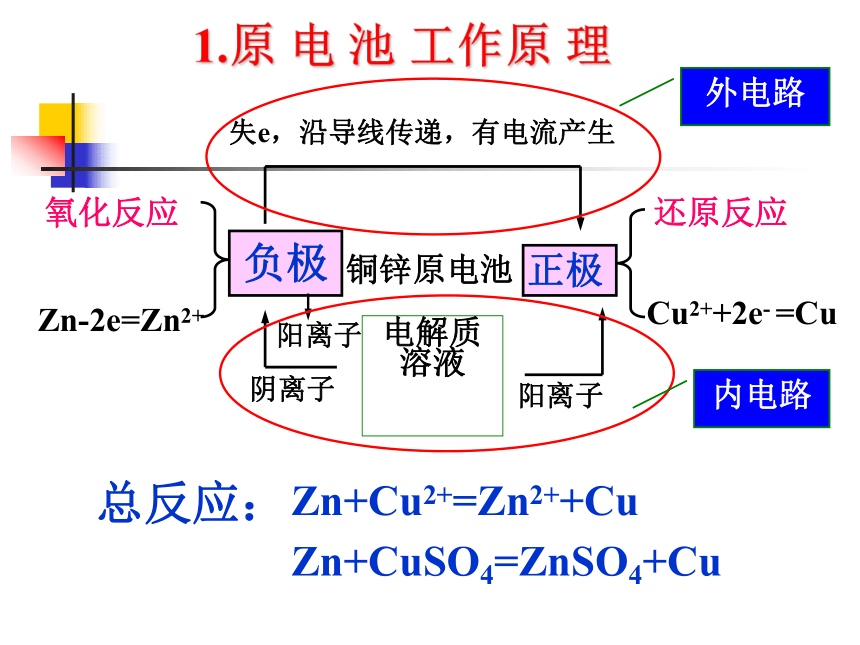
-电池氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液
失e,沿导线传递,有电流产生还原反应Cu2++2e- =Cu阴离子阳离子总反应:负极正极 Zn+Cu2+=Zn2++CuZn+CuSO4=ZnSO4+Cu阳离子1.原 电 池 工作原 理外电路内电路2.组成原电池的条件?(1)有两种活动性不同的金属(或另一种为石墨等非金属单质)作电极。 ? (2)电极材料均插入电解质溶液中。 ? (3)两极相连形成闭合电路。 ? (4)能自发进行氧化还原反应。1. 反应原理Zn+CuSO4=ZnSO4+Cu盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。负极(锌):Zn- 2e- = Zn2+
正极(铜):Cu2+ + 2e- = Cu
盐桥的作用:
(1)构成闭合回路
(2)使两溶液保持电
中性(平衡电荷)电池总反应:Zn + Cu2+ = Zn 2+ + Cu Cu CFeCl3溶液负极: Cu 失电子 Cu - 2e- = Cu2+
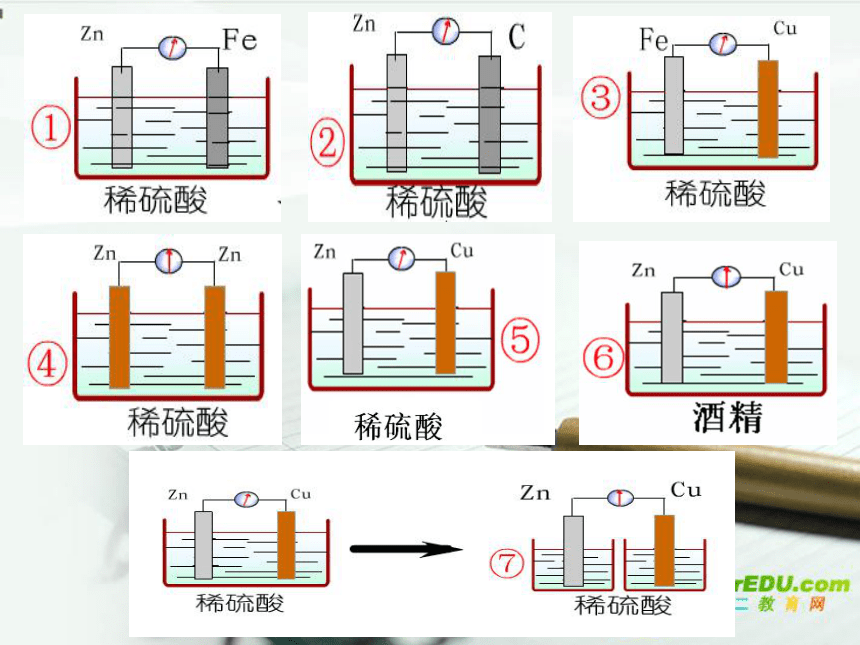
正极: Fe3+得电子 2Fe3+ + 2e- = 2Fe2+ Cu+2FeCl3 =CuCl2 +2FeCl2先写出总反应:即负极与电解质溶液反应拆成离子方程式:Cu+2Fe3+ =Cu2+ +2Fe2+根据化合价升降判断正负极三、电极方程式的书写知 识 小 结1、定义:把化学能转化成电能的装置。2、原电池的工作原理3、形成原电池的条件4、原电池的正负极的判断方法5、电极反应式的书写较活泼的金属失去电子发生氧化反应,电子从较活泼
的金属(负极)通过外电路流向较不活泼的金属(正极)。
内电路中 ,阴离子移向负极,阳离子移向正极。1.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,该反应的的原电池正确组合是( )C课堂练习2.请写出右边原电池的电极方程式。总反应方程式:负极(Al,失e- ) 2Al - 6e- = 2Al3+2Al3+ + 8OH- =2[Al(OH)4]-负极总反应 2Al +8OH- -6e- = 2[Al(OH)4]- 正极(总反应-负极反应)6H2O +6e- =6OH-+ 3H2↑Mg AlNaOH溶液A拆成离子方程式:2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑根据化合价升降判断正负极2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
-电池氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液
失e,沿导线传递,有电流产生还原反应Cu2++2e- =Cu阴离子阳离子总反应:负极正极 Zn+Cu2+=Zn2++CuZn+CuSO4=ZnSO4+Cu阳离子1.原 电 池 工作原 理外电路内电路2.组成原电池的条件?(1)有两种活动性不同的金属(或另一种为石墨等非金属单质)作电极。 ? (2)电极材料均插入电解质溶液中。 ? (3)两极相连形成闭合电路。 ? (4)能自发进行氧化还原反应。1. 反应原理Zn+CuSO4=ZnSO4+Cu盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。负极(锌):Zn- 2e- = Zn2+
正极(铜):Cu2+ + 2e- = Cu
盐桥的作用:
(1)构成闭合回路
(2)使两溶液保持电
中性(平衡电荷)电池总反应:Zn + Cu2+ = Zn 2+ + Cu Cu CFeCl3溶液负极: Cu 失电子 Cu - 2e- = Cu2+
正极: Fe3+得电子 2Fe3+ + 2e- = 2Fe2+ Cu+2FeCl3 =CuCl2 +2FeCl2先写出总反应:即负极与电解质溶液反应拆成离子方程式:Cu+2Fe3+ =Cu2+ +2Fe2+根据化合价升降判断正负极三、电极方程式的书写知 识 小 结1、定义:把化学能转化成电能的装置。2、原电池的工作原理3、形成原电池的条件4、原电池的正负极的判断方法5、电极反应式的书写较活泼的金属失去电子发生氧化反应,电子从较活泼
的金属(负极)通过外电路流向较不活泼的金属(正极)。
内电路中 ,阴离子移向负极,阳离子移向正极。1.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,该反应的的原电池正确组合是( )C课堂练习2.请写出右边原电池的电极方程式。总反应方程式:负极(Al,失e- ) 2Al - 6e- = 2Al3+2Al3+ + 8OH- =2[Al(OH)4]-负极总反应 2Al +8OH- -6e- = 2[Al(OH)4]- 正极(总反应-负极反应)6H2O +6e- =6OH-+ 3H2↑Mg AlNaOH溶液A拆成离子方程式:2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑根据化合价升降判断正负极2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
