河南省中牟县第二高级中学高中化学鲁科版选修四1-3-3化学能转化为电能-电池课件(共15张PPT)
文档属性
| 名称 | 河南省中牟县第二高级中学高中化学鲁科版选修四1-3-3化学能转化为电能-电池课件(共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 402.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-09-30 14:47:24 | ||
图片预览






文档简介
课件15张PPT。
金属的腐蚀与防护一、金属的电化学腐蚀自主探究: [阅读教材P27,回答]
1、什么是金属的腐蚀?特点是什么?
2、金属的腐蚀可分为哪几类?
类别:a. 化学腐蚀
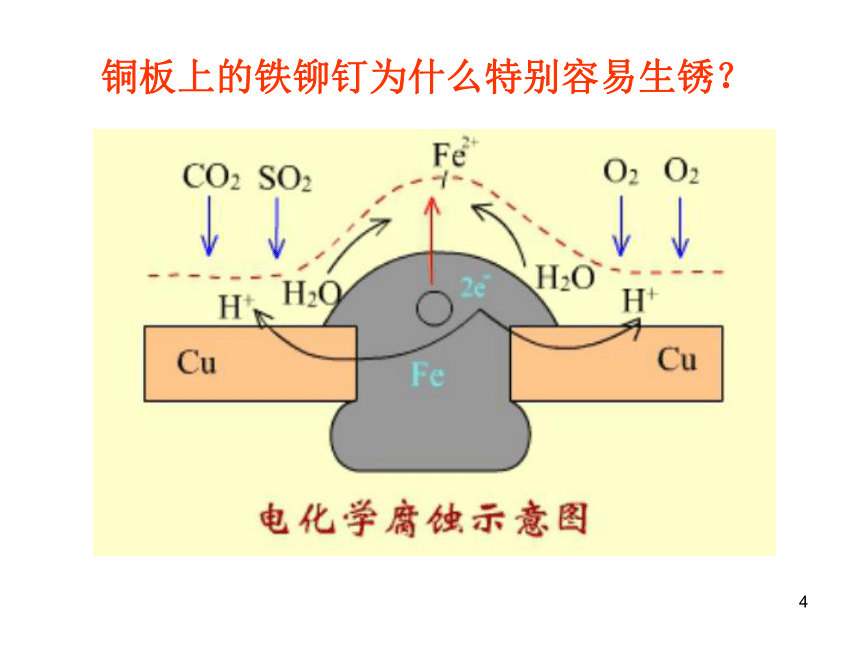
b.电化学腐蚀本质:金属原子失去电子被氧化的过程。 金属腐蚀4铜板上的铁铆钉为什么特别容易生锈?1、吸氧腐蚀(弱酸性或中性或碱性水溶液)负极:2Fe - 4e =2Fe2+正极:O2 + 2H2O + 4e = 4OH-总反应:2Fe+2H2O+O2= 2 Fe(OH)2后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3Fe2O3(一)、钢铁的腐蚀2、析氢腐蚀(酸性水溶液)负极:Fe - 2e - = Fe2+ 总反应:Fe + 2H+ = Fe2+ + H2↑正极:2H+ + 2e- = H2↑归纳小结金属的化学腐蚀与电化学腐蚀比较 金属原子失去电子被氧化而消耗的过程:
M-ne-=Mn+ 化学腐蚀电化学腐蚀金属和其它物质直接接触发生氧化还原反应而引起的腐蚀不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀直接发生氧化还原反应发生原电池反应腐蚀过程无电流产生有电流产生金属直接被腐蚀较活泼金属被腐蚀电化学腐蚀>化学腐蚀往往同时发生,但电化学腐蚀更普遍,危害更大【交流与讨论】: 铁生锈除了必须有空气及水的参与外,还受其他一些因素的影响.请解释下列有关铁生锈现象的原因.1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀. 海轮更容易被腐蚀,是因为海水中含有较多的氯化钠等盐类,导电能力比内河的水更强,而在电解质溶液中,电化学腐蚀更易进行.2.用于连接铜板的铁螺丝容易生锈.由于铁与铜及空气中的水蒸气构成了原电池,铁作电池的负极,因此更容易腐蚀而生锈.
1.改变金属的内部组织结构
例如制造各种耐腐蚀的合金,如在普通钢铁中加入铬、镍等制成不锈钢。
二、金属的防护2.保护层法:在金属表面覆盖保护层,使金属制品与周围腐蚀介质隔离,从而防止腐蚀。 在钢铁制件表面涂上机油、凡士林、油漆或覆盖搪瓷、塑料等耐腐蚀的非金属材料。3)、电化学
保护法a金属做原电池正极:牺牲负极
保护正极法b金属做电解池阴极:牺牲阳极
保护阴极法练习1:如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈________性,发生_______
腐蚀,电极反应式为:负极:_____________________,
正极:______________________; (2)若液面下降,则溶液呈______性,发生_________
腐蚀,电极反应式为:负极:______________________
正极:______________________。中性或碱吸氧2Fe – 4e-=2Fe2+O2+2H2O+4e-=4OH-酸析氢Fe –2e-=Fe2+2H++2e-=H2↑ 2、下列现象与电化学腐蚀无关的是:( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比纯铁更易生锈
C.铁质器件附有铜质配件,在接触处易生锈
D银质奖牌久置表面变暗D3.铁钉和碳棒用导线连接后,浸入到食盐溶液中,可能发生的反应是: ( )
A.碳棒上放出Cl2 B.碳棒附近产生OH-
C.碳棒上放出H2 D.铁钉被氧化BD及时反馈下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)小结:在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀
防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲负极保护法>有一般防腐条件保护>无防腐条件
金属的腐蚀与防护一、金属的电化学腐蚀自主探究: [阅读教材P27,回答]
1、什么是金属的腐蚀?特点是什么?
2、金属的腐蚀可分为哪几类?
类别:a. 化学腐蚀
b.电化学腐蚀本质:金属原子失去电子被氧化的过程。 金属腐蚀4铜板上的铁铆钉为什么特别容易生锈?1、吸氧腐蚀(弱酸性或中性或碱性水溶液)负极:2Fe - 4e =2Fe2+正极:O2 + 2H2O + 4e = 4OH-总反应:2Fe+2H2O+O2= 2 Fe(OH)2后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3Fe2O3(一)、钢铁的腐蚀2、析氢腐蚀(酸性水溶液)负极:Fe - 2e - = Fe2+ 总反应:Fe + 2H+ = Fe2+ + H2↑正极:2H+ + 2e- = H2↑归纳小结金属的化学腐蚀与电化学腐蚀比较 金属原子失去电子被氧化而消耗的过程:
M-ne-=Mn+ 化学腐蚀电化学腐蚀金属和其它物质直接接触发生氧化还原反应而引起的腐蚀不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀直接发生氧化还原反应发生原电池反应腐蚀过程无电流产生有电流产生金属直接被腐蚀较活泼金属被腐蚀电化学腐蚀>化学腐蚀往往同时发生,但电化学腐蚀更普遍,危害更大【交流与讨论】: 铁生锈除了必须有空气及水的参与外,还受其他一些因素的影响.请解释下列有关铁生锈现象的原因.1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀. 海轮更容易被腐蚀,是因为海水中含有较多的氯化钠等盐类,导电能力比内河的水更强,而在电解质溶液中,电化学腐蚀更易进行.2.用于连接铜板的铁螺丝容易生锈.由于铁与铜及空气中的水蒸气构成了原电池,铁作电池的负极,因此更容易腐蚀而生锈.
1.改变金属的内部组织结构
例如制造各种耐腐蚀的合金,如在普通钢铁中加入铬、镍等制成不锈钢。
二、金属的防护2.保护层法:在金属表面覆盖保护层,使金属制品与周围腐蚀介质隔离,从而防止腐蚀。 在钢铁制件表面涂上机油、凡士林、油漆或覆盖搪瓷、塑料等耐腐蚀的非金属材料。3)、电化学
保护法a金属做原电池正极:牺牲负极
保护正极法b金属做电解池阴极:牺牲阳极
保护阴极法练习1:如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈________性,发生_______
腐蚀,电极反应式为:负极:_____________________,
正极:______________________; (2)若液面下降,则溶液呈______性,发生_________
腐蚀,电极反应式为:负极:______________________
正极:______________________。中性或碱吸氧2Fe – 4e-=2Fe2+O2+2H2O+4e-=4OH-酸析氢Fe –2e-=Fe2+2H++2e-=H2↑ 2、下列现象与电化学腐蚀无关的是:( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比纯铁更易生锈
C.铁质器件附有铜质配件,在接触处易生锈
D银质奖牌久置表面变暗D3.铁钉和碳棒用导线连接后,浸入到食盐溶液中,可能发生的反应是: ( )
A.碳棒上放出Cl2 B.碳棒附近产生OH-
C.碳棒上放出H2 D.铁钉被氧化BD及时反馈下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)小结:在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀
防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲负极保护法>有一般防腐条件保护>无防腐条件
