化学人教版(2019)选择性必修1 2.4化学反应的调控(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4化学反应的调控(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 32.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 21:54:18 | ||
图片预览








文档简介
(共22张PPT)
特殊图像
T
v
v逆
v正
T1
T2
正反应___热
T
v
v正
v逆
正反应___热
T
C%
450℃
正反应____热
P
A%
P1
m+n___p+q
对于反应mA(g) + nB(g) pC(g) + qD(g)
吸
吸
放
<
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
【学习目标】
1.了解合成氨反应在工业上的重要应用;
2.了解如何让化学向着生活生产需要的方向进行,学会控制化学反应;
3.学会合理控制合成氨反应的条件,提高产量。
【重难点】
学会合理控制合成氨反应的条件,提高产量
阅读课本46-49页
工业合成氨是人类科学技术一项重大突破,其反应如下:
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
一、合成氨
导
1、合成氨反应及其特点
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
合成氨反应是可逆反应。
由化学方程式中的化学计量数关系可知,正反应是气体分子数减小的反应。
根据ΔH= 92.4 kJ mol 1可知,正反应是放热反应。
1
2
3
反应特点
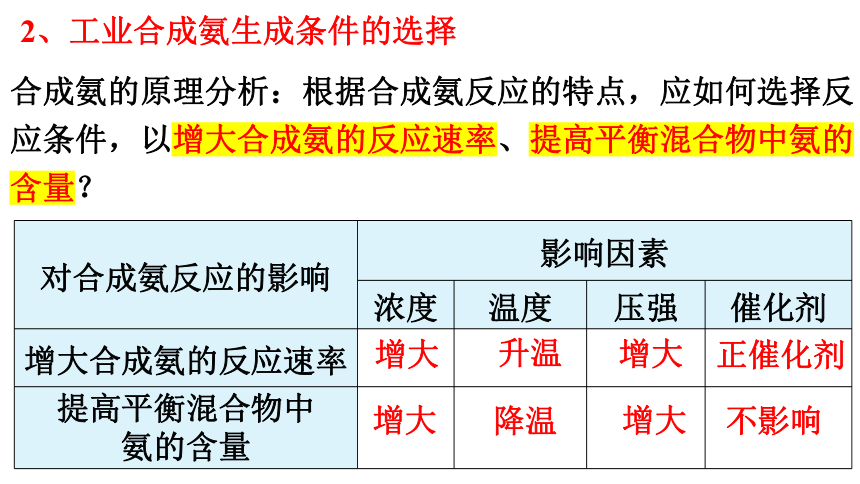
合成氨的原理分析:根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中 氨的含量
增大
增大
升温
降温
增大
增大
正催化剂
不影响
2、工业合成氨生成条件的选择
工业合成氨的适宜条件
压强
温度
催化剂
浓度
10~30 MPa
400~500 ℃
铁触媒
N2和H2的的投料比为1∶2.8,
及时分离氨
为什么不采用更高压强?
为什么不采用更高温度?
合成氨反应的条件调控:
3、调控化学反应需考虑的问题
(1) 反应限度:要考虑尽量增大反应物的__________,充分利用原料。
(2) 反应速率:要选择较快的____________,提高单位时间内的产量。
(3) 生产要求:要考虑设备的要求和技术条件。
转化率
反应速率
思
前8分钟
后5分钟 完成对应的练习题;
存在的疑问写在【我有问题要问】
通过阅读课本43-45页,回答下列问题:
1、工业合成氨时需要考虑哪些因素
2、压强、温度、催化剂、浓度对工业合成氨的影响分别是什么
3、工业合成氨时,如何才能提高氨气的产率
4、工业生产时从那些方面来考虑选择适宜的条件
(1)温度越高越利于合成氨反应平衡正向移动。( )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡
正向移动( )
(3)使用催化剂能提高合成氨反应物的平衡转化率。( )
(4)充入的N2越多越有利于NH3的合成。( )
(5)恒容条件下充入稀有气体有利于NH3的合成。( )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下
都可自发进行。( )
×
√
×
×
×
×
预设展
可逆反应3H2(g)+N2(g) 2NH3(g)ΔH<0, 达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是( )
A.升高温度,减小压强,增加氮气
B.降低温度,增大压强,加入催化剂
C.升高温度,增大压强,增加氮气
D.降低温度,增大压强,分离出部分氨
D
总原则:寻找以较高的反应速率获取适当的转化率。
温度的选择:催化剂活性最大的温度
压强的选择:既要考虑化学反应速率和化学平衡,
还要考虑动力、材料、设备等。
催化剂:一般要使用。提高生产效率,也提高经济
效益;
工业生产遵循的原则
评
在硫酸工业中,通过下列反应使SO2 氧化为SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。下表列出了在不同温度和压强下,反应达到平衡时SO2转化率的统计数据:
温度 不同压强下SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 ℃ 97.5 98.9 99.2 99.6 99.7
550 ℃ 85.6 92.9 94.9 97.7 98.3
(1)从理论上分析,使SO2尽可能多、尽可能快地转化为
SO3,应选择的条件是什么?
(2)在实际生产中,选定450 ℃,其原因是什么?
(3)在实际生产中,采用的压强为常压,其原因是什么?
低温、高压
该反应是放热反应,升高温度,转化率降低;
此温度下催化剂的活性最高
0.1 MPa(常压)下SO2的转化率已经很高,
若采用较大的压强,不仅SO2的转化率提高很少,
且需要更大动力,对设备的要求更高,增加成本
(4)在实际生产中,通入过量的空气,其原因是什么?
(5)尾气中的SO2必须回收,其原因是什么?
增大O2浓度,提高SO2的转化率
SO2有毒,防止污染环境
序号 影响因素 选择条件
1 温度 反应温度控制在700K左右
2 物质的量 N2、H2投料比1∶2.8
3 压强 1×107~1×108 Pa
4 催化剂 选择铁做催化剂
5 浓度 使NH3液化并及时分离出去,及时补充N2、H2
结
小结
化学反应的调控
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
化学平衡
设备可行
成本核算
反应速率
1、在合成氨工业中,为增加NH3的日产量,实施下列措施的变化过程中与平衡移动无关的是( )
A.不断将氨分离出来
B.使用催化剂
C.采用700 K左右的高温而不是900 K的高温
D.采用2×107 Pa~5×107 Pa的压强
检
B
2.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应2SO2+O2 2SO3的说法中正确的是( )
A、只要选择适宜的条件,SO2和O2就能全部转化为SO3
B、该反应达到平衡后,反应就完全停止,正、逆反应速率均为零
C、在达到平衡的体系中,充入由18O原子组成的O2后,SO2中
18O含量减少,SO3中18O含量增多
D、在工业合成SO3时,要同时考虑反应速率和反应能达到的限
度两方面的问题
D
3、下列生活和生产中的做法或事实,与调控反应速率无关的是( )
A.牛奶放在冰箱中冷藏
B.使用加酶洗衣粉洗涤衣物
C.汽车的橡胶轮胎中要添加抑制剂
D.工业合成氨时,及时将氨气液化分离
D
4、某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0下列有关该工业生产的说法正确的是( )
A、工业上合成M时,一定采用高压条件,因为高压有利
于M的生成
B、若物质B价廉易得,工业上一般采用加入过量的B以
提高A和B的转化率
C、工业上一般采用较高温度合成M,因温度越高,反应
物的转化率越高
D、工业生产中常采用催化剂,因为生产中使用催化剂可
提高M的日产量
D
下节内容:
第三章 第一节 电离平衡(1)
特殊图像
T
v
v逆
v正
T1
T2
正反应___热
T
v
v正
v逆
正反应___热
T
C%
450℃
正反应____热
P
A%
P1
m+n___p+q
对于反应mA(g) + nB(g) pC(g) + qD(g)
吸
吸
放
<
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
【学习目标】
1.了解合成氨反应在工业上的重要应用;
2.了解如何让化学向着生活生产需要的方向进行,学会控制化学反应;
3.学会合理控制合成氨反应的条件,提高产量。
【重难点】
学会合理控制合成氨反应的条件,提高产量
阅读课本46-49页
工业合成氨是人类科学技术一项重大突破,其反应如下:
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
一、合成氨
导
1、合成氨反应及其特点
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
合成氨反应是可逆反应。
由化学方程式中的化学计量数关系可知,正反应是气体分子数减小的反应。
根据ΔH= 92.4 kJ mol 1可知,正反应是放热反应。
1
2
3
反应特点
合成氨的原理分析:根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中 氨的含量
增大
增大
升温
降温
增大
增大
正催化剂
不影响
2、工业合成氨生成条件的选择
工业合成氨的适宜条件
压强
温度
催化剂
浓度
10~30 MPa
400~500 ℃
铁触媒
N2和H2的的投料比为1∶2.8,
及时分离氨
为什么不采用更高压强?
为什么不采用更高温度?
合成氨反应的条件调控:
3、调控化学反应需考虑的问题
(1) 反应限度:要考虑尽量增大反应物的__________,充分利用原料。
(2) 反应速率:要选择较快的____________,提高单位时间内的产量。
(3) 生产要求:要考虑设备的要求和技术条件。
转化率
反应速率
思
前8分钟
后5分钟 完成对应的练习题;
存在的疑问写在【我有问题要问】
通过阅读课本43-45页,回答下列问题:
1、工业合成氨时需要考虑哪些因素
2、压强、温度、催化剂、浓度对工业合成氨的影响分别是什么
3、工业合成氨时,如何才能提高氨气的产率
4、工业生产时从那些方面来考虑选择适宜的条件
(1)温度越高越利于合成氨反应平衡正向移动。( )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡
正向移动( )
(3)使用催化剂能提高合成氨反应物的平衡转化率。( )
(4)充入的N2越多越有利于NH3的合成。( )
(5)恒容条件下充入稀有气体有利于NH3的合成。( )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下
都可自发进行。( )
×
√
×
×
×
×
预设展
可逆反应3H2(g)+N2(g) 2NH3(g)ΔH<0, 达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是( )
A.升高温度,减小压强,增加氮气
B.降低温度,增大压强,加入催化剂
C.升高温度,增大压强,增加氮气
D.降低温度,增大压强,分离出部分氨
D
总原则:寻找以较高的反应速率获取适当的转化率。
温度的选择:催化剂活性最大的温度
压强的选择:既要考虑化学反应速率和化学平衡,
还要考虑动力、材料、设备等。
催化剂:一般要使用。提高生产效率,也提高经济
效益;
工业生产遵循的原则
评
在硫酸工业中,通过下列反应使SO2 氧化为SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。下表列出了在不同温度和压强下,反应达到平衡时SO2转化率的统计数据:
温度 不同压强下SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 ℃ 97.5 98.9 99.2 99.6 99.7
550 ℃ 85.6 92.9 94.9 97.7 98.3
(1)从理论上分析,使SO2尽可能多、尽可能快地转化为
SO3,应选择的条件是什么?
(2)在实际生产中,选定450 ℃,其原因是什么?
(3)在实际生产中,采用的压强为常压,其原因是什么?
低温、高压
该反应是放热反应,升高温度,转化率降低;
此温度下催化剂的活性最高
0.1 MPa(常压)下SO2的转化率已经很高,
若采用较大的压强,不仅SO2的转化率提高很少,
且需要更大动力,对设备的要求更高,增加成本
(4)在实际生产中,通入过量的空气,其原因是什么?
(5)尾气中的SO2必须回收,其原因是什么?
增大O2浓度,提高SO2的转化率
SO2有毒,防止污染环境
序号 影响因素 选择条件
1 温度 反应温度控制在700K左右
2 物质的量 N2、H2投料比1∶2.8
3 压强 1×107~1×108 Pa
4 催化剂 选择铁做催化剂
5 浓度 使NH3液化并及时分离出去,及时补充N2、H2
结
小结
化学反应的调控
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
化学平衡
设备可行
成本核算
反应速率
1、在合成氨工业中,为增加NH3的日产量,实施下列措施的变化过程中与平衡移动无关的是( )
A.不断将氨分离出来
B.使用催化剂
C.采用700 K左右的高温而不是900 K的高温
D.采用2×107 Pa~5×107 Pa的压强
检
B
2.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应2SO2+O2 2SO3的说法中正确的是( )
A、只要选择适宜的条件,SO2和O2就能全部转化为SO3
B、该反应达到平衡后,反应就完全停止,正、逆反应速率均为零
C、在达到平衡的体系中,充入由18O原子组成的O2后,SO2中
18O含量减少,SO3中18O含量增多
D、在工业合成SO3时,要同时考虑反应速率和反应能达到的限
度两方面的问题
D
3、下列生活和生产中的做法或事实,与调控反应速率无关的是( )
A.牛奶放在冰箱中冷藏
B.使用加酶洗衣粉洗涤衣物
C.汽车的橡胶轮胎中要添加抑制剂
D.工业合成氨时,及时将氨气液化分离
D
4、某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0下列有关该工业生产的说法正确的是( )
A、工业上合成M时,一定采用高压条件,因为高压有利
于M的生成
B、若物质B价廉易得,工业上一般采用加入过量的B以
提高A和B的转化率
C、工业上一般采用较高温度合成M,因温度越高,反应
物的转化率越高
D、工业生产中常采用催化剂,因为生产中使用催化剂可
提高M的日产量
D
下节内容:
第三章 第一节 电离平衡(1)
