化学人教版(2019)选择性必修1 2.2.3压强对化学平衡的影响(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2.3压强对化学平衡的影响(共22张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 21:55:37 | ||
图片预览







文档简介
(共22张PPT)
压强对化学平衡的影响
第二章 化学反应速率与化学平衡
第二节 化学平衡
第3课时
平衡向正反应
方向移动
平衡向逆反应
方向移动
●
●
v'正
v'逆
v'正=v'逆
●
●
v'正
v'逆
增大反应物的浓度
减小生成物的浓度
●
●
v'正
v'逆
●
●
v'正
v'逆
增大生成物的浓度
减小反应物的浓度
v'正=v'逆
v'正=v'逆
v'正=v'逆
●
v
t
0
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
浓度
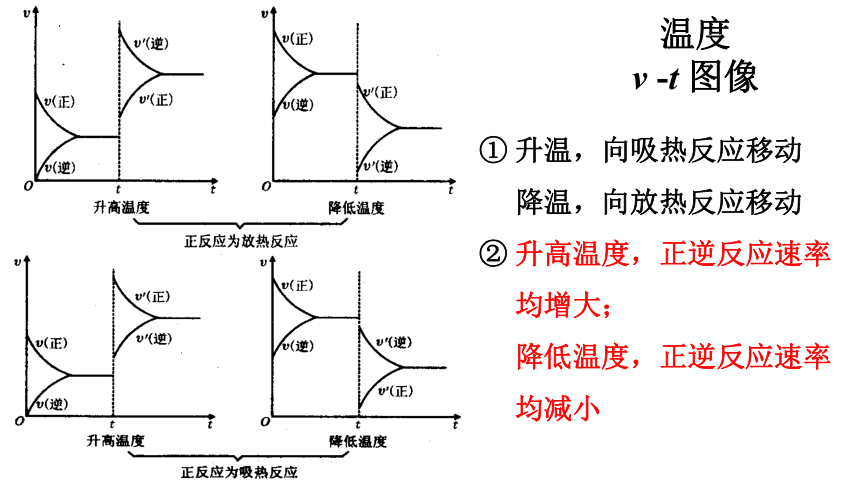
v -t 图像
① 升温,向吸热反应移动
降温,向放热反应移动
② 升高温度,正逆反应速率
均增大;
降低温度,正逆反应速率
均减小
温度
v -t 图像
【学习目标】
【重难点】
压强对平衡移动的影响
勒夏特列原理
1. 通过阅读课本38-39页,掌握压强对化学平衡的影响。
2. 通过阅读课本38-39页,掌握催化剂对化学平衡的影响。
3. 通过阅读课本40页,掌握勒夏特列原理。
压强的改变,可能影响反应体系中多种物质的浓度。
如果增大压强(缩小容积)以下反应各物质的浓度会如何变化?
2NO2(g) N2O4(g)
红棕色
无色
研究压强对化学平衡的影响
思考:
二、压强对化学平衡的影响
如图2-6所示,用50 mL注射器吸入20 mL NO2和N2O4的混合气体(使注射器的活塞位于Ⅰ处),将细管端用橡胶塞封闭。
然后把活塞拉到Ⅱ处,观察管内混合气体颜色的变化。
当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化。
探讨压强对化学平衡的影响
【实验2-2】课本38页
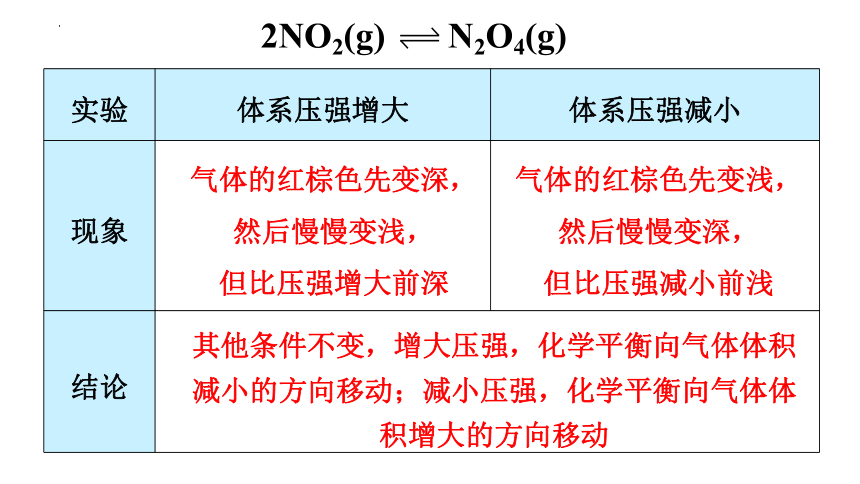
2NO2(g) N2O4(g)
红棕色
无色
实验 体系压强增大 体系压强减小
现象
结论 气体的红棕色先变深,然后慢慢变浅,
但比压强增大前深
气体的红棕色先变浅,然后慢慢变深,
但比压强减小前浅
其他条件不变,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动
2NO2(g) N2O4(g)
容积增大
原平衡气①
颜色变浅②
颜色又变深③
实验现象与分析
减压
向逆反应方向移动
物质浓度瞬间减小
减压前
NO2浓度比②中的增大
2NO2(g) N2O4(g)
红棕色
无色
二、压强对化学平衡的影响
向正反应方向移动
容积减小
原平衡气①
颜色变深②
颜色又变浅③
物质浓度瞬间增大
加压前
加压
NO2浓度比②中的减小
阅读课本38-40页,回答下列问题:
思
后5分钟
前8分钟
1、压强对化学平衡的影响图像?
2、勒夏特列原理的适用范围?
完成导学提纲的基础感知;
存在的疑问写在【我有问题要问】
(1) 有气体参与的反应,改变压强,平衡一定发生移动( )
(2) 增大压强可使反应:2SO2(g)+O2(g) 2SO3(g)平衡正向移动,
原因是增大压强,v正增大,v逆减小( )
(3) 对于反应:2HI(g) H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动( )
(4) H2(g)+I2(g) 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大
容积、减小压强的措施,因为平衡移动,故体系颜色不变。( )
预设展
×
×
×
×
2.在密闭容器中,反应 xA(g) + yB(g) zC(g),在一定条件下
达到平衡状态,试回答下列问题。
(1) 若x+y>z,缩小体积,增大压强,平衡向 方向移动。
(2) 若保持体积不变,通入He,则平衡 移动。
(3) 若保持压强不变,通入He,平衡向正反应方向移动,
则x、y、z的关系为 。
(4) 若x+y=z,缩小体积,增大压强,则平衡 移动。
正反应
不
x+y不
(1) 适用对象:有气体参加的可逆反应。
(2) 影响规律:当其他条件不变时,
①若为体积不等的反应:
②若为等体积反应:
压强对化学平衡的影响
增大压强,向气体体积减小方向移动;
减小压强,向气体体积增大方向移动。
增大压强时,v正、v逆同等程度地增大;
减小压强时,v正、v逆同等程度地减小;
平衡均不发生移动。
●
●
v'正
v'逆
v'正=v'逆
●
●
v'逆
v'正
a+b>c 加压
a+b>c 减压
●
●
v'正
v'逆
●
●
v'逆
v'正
a+ba+bv'正=v'逆
v'正=v'逆
v'正=v'逆
●
v
t
0
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
aA(g) + bB(g) cC(g)
压强 v -t 图像
增大压强
向气体分子数减小方向移动
减小压强
向气体分子数增大方向移动
a+b = c 加压
a+b = c 减压
●
●
v'正=v'逆
v
t
0
●
●
v正
v逆
t1
●
●
v'正=v'逆
v
t
0
●
●
v正
v逆
t1
aA(g) + bB(g) cC(g)
压强 v -t 图像
●
●
v'正=v'逆
v
t
0
●
●
v正
v逆
t1
催化剂 v -t 图像
对于任何反应平衡不移动
“无关气体”(指不与原平衡体系中各物质反应的气体)
对化学平衡的影响:
①恒温、恒容条件下:
原平衡体系 充入“无关气体” 体系总压强增大 体系中各组分的浓度不变 平衡不移动
②恒温、恒压条件下:
原平衡体系 充入“无关气体” 容器容积增大 体系中各组分的浓度减小 等效于减压 对于反应前后气体体积相等的反应,平衡不移动;对于反应前后气体体积不相等的反应,平衡向气体体积增大的方向移动。
评
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度) ,平衡就向能够减弱这种改变的方向移动。
(1)适用范围
处于平衡状态的可逆反应
(2)适用条件
只适用改变一个条件
(3)判断内容
三. 勒夏特列原理(平衡移动原理)
“减弱”外界条件的影响,而不能消除外界条件的影响。
(3)平衡移动的结果
平衡移动的方向
注意:
不涉及平衡移动的问题都不能用勒夏特列原理解释:
1、使用催化剂,化学平衡不移动
2、对于反应前后气体分子数不变的可逆反应,改变压强,化学
平衡不移动
3、化学反应本身不是可逆反应
4、外界条件改变对平衡移动的影响与生产要求不一致的反应。
450℃时N2与H2反应生成NH3的实验数据
压强/MPa
NH3/%
1
2.0
5
9.2
10
16.4
30
35.5
60
53.6
100
69.4
在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。
N2 (g) + 3H2 (g) 2NH3 (g)
1体积
3体积
2体积
利用勒夏特列原理来解释一下平衡移动的方向
条件的改变 平衡移动方向 新平衡建立时
具 体 增大反应物浓度
减小反应物浓度
增大体系压强
减小体系压强
升高温度
降低温度
向正反应方向移动
向逆反应方向移动
向体积缩小方向移动
向体积增大方向移动
向吸热方向移动
向放热方向移动
向减弱这种改变的方向移动
反应物浓度减小
反应物浓度增大
体系压强减小
体系压强增大
体系温度减小
体系温度增大
减弱这种改变
规
律
改变一个条件
催化剂对化学平衡无影响,能缩短平衡到达的时间。
结
改变反应条件时平衡移动的方向
⑥
检
1. 下列不能用勒夏特列原理解释的是( )
① 棕红色NO2加压后颜色先变深后变浅
② Fe(SCN)3溶液中加入固体KSCN后颜色变深
③ 氯水宜保存在低温、避光条件下
④ SO2催化氧化成SO3的反应,往往加入过量的空气
⑤ 打开易拉罐有大量气泡冒出
⑥ 加催化剂,使氮气和氢气在一定条件下转化为氨气
课堂练习
2. 在一密闭容器中发生反应:2A(g)+2B(g) C(s)+3D(g) ΔH<0,
达到平衡时采取下列措施, 可以使正反应速率(v正)增大、c(D)增大的是( )
A. 移走少量C B. 增大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入稀有气体
C
解析: A项:C为固体,改变其量,对反应速率无影响;
B项:增大容积,v正减小,c(D)也减小;
C项:缩小容积,浓度增大,速率也增大,平衡正向移动,c(D)也增大;
D项:容积不变,充入稀有气体,反应物浓度不变,速率不变,平衡不移动。
下节提示:
化学平衡常数(4)
压强对化学平衡的影响
第二章 化学反应速率与化学平衡
第二节 化学平衡
第3课时
平衡向正反应
方向移动
平衡向逆反应
方向移动
●
●
v'正
v'逆
v'正=v'逆
●
●
v'正
v'逆
增大反应物的浓度
减小生成物的浓度
●
●
v'正
v'逆
●
●
v'正
v'逆
增大生成物的浓度
减小反应物的浓度
v'正=v'逆
v'正=v'逆
v'正=v'逆
●
v
t
0
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
浓度
v -t 图像
① 升温,向吸热反应移动
降温,向放热反应移动
② 升高温度,正逆反应速率
均增大;
降低温度,正逆反应速率
均减小
温度
v -t 图像
【学习目标】
【重难点】
压强对平衡移动的影响
勒夏特列原理
1. 通过阅读课本38-39页,掌握压强对化学平衡的影响。
2. 通过阅读课本38-39页,掌握催化剂对化学平衡的影响。
3. 通过阅读课本40页,掌握勒夏特列原理。
压强的改变,可能影响反应体系中多种物质的浓度。
如果增大压强(缩小容积)以下反应各物质的浓度会如何变化?
2NO2(g) N2O4(g)
红棕色
无色
研究压强对化学平衡的影响
思考:
二、压强对化学平衡的影响
如图2-6所示,用50 mL注射器吸入20 mL NO2和N2O4的混合气体(使注射器的活塞位于Ⅰ处),将细管端用橡胶塞封闭。
然后把活塞拉到Ⅱ处,观察管内混合气体颜色的变化。
当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化。
探讨压强对化学平衡的影响
【实验2-2】课本38页
2NO2(g) N2O4(g)
红棕色
无色
实验 体系压强增大 体系压强减小
现象
结论 气体的红棕色先变深,然后慢慢变浅,
但比压强增大前深
气体的红棕色先变浅,然后慢慢变深,
但比压强减小前浅
其他条件不变,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动
2NO2(g) N2O4(g)
容积增大
原平衡气①
颜色变浅②
颜色又变深③
实验现象与分析
减压
向逆反应方向移动
物质浓度瞬间减小
减压前
NO2浓度比②中的增大
2NO2(g) N2O4(g)
红棕色
无色
二、压强对化学平衡的影响
向正反应方向移动
容积减小
原平衡气①
颜色变深②
颜色又变浅③
物质浓度瞬间增大
加压前
加压
NO2浓度比②中的减小
阅读课本38-40页,回答下列问题:
思
后5分钟
前8分钟
1、压强对化学平衡的影响图像?
2、勒夏特列原理的适用范围?
完成导学提纲的基础感知;
存在的疑问写在【我有问题要问】
(1) 有气体参与的反应,改变压强,平衡一定发生移动( )
(2) 增大压强可使反应:2SO2(g)+O2(g) 2SO3(g)平衡正向移动,
原因是增大压强,v正增大,v逆减小( )
(3) 对于反应:2HI(g) H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动( )
(4) H2(g)+I2(g) 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大
容积、减小压强的措施,因为平衡移动,故体系颜色不变。( )
预设展
×
×
×
×
2.在密闭容器中,反应 xA(g) + yB(g) zC(g),在一定条件下
达到平衡状态,试回答下列问题。
(1) 若x+y>z,缩小体积,增大压强,平衡向 方向移动。
(2) 若保持体积不变,通入He,则平衡 移动。
(3) 若保持压强不变,通入He,平衡向正反应方向移动,
则x、y、z的关系为 。
(4) 若x+y=z,缩小体积,增大压强,则平衡 移动。
正反应
不
x+y
(1) 适用对象:有气体参加的可逆反应。
(2) 影响规律:当其他条件不变时,
①若为体积不等的反应:
②若为等体积反应:
压强对化学平衡的影响
增大压强,向气体体积减小方向移动;
减小压强,向气体体积增大方向移动。
增大压强时,v正、v逆同等程度地增大;
减小压强时,v正、v逆同等程度地减小;
平衡均不发生移动。
●
●
v'正
v'逆
v'正=v'逆
●
●
v'逆
v'正
a+b>c 加压
a+b>c 减压
●
●
v'正
v'逆
●
●
v'逆
v'正
a+b
v'正=v'逆
v'正=v'逆
●
v
t
0
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
v
t
0
●
●
v正
v逆
t1
aA(g) + bB(g) cC(g)
压强 v -t 图像
增大压强
向气体分子数减小方向移动
减小压强
向气体分子数增大方向移动
a+b = c 加压
a+b = c 减压
●
●
v'正=v'逆
v
t
0
●
●
v正
v逆
t1
●
●
v'正=v'逆
v
t
0
●
●
v正
v逆
t1
aA(g) + bB(g) cC(g)
压强 v -t 图像
●
●
v'正=v'逆
v
t
0
●
●
v正
v逆
t1
催化剂 v -t 图像
对于任何反应平衡不移动
“无关气体”(指不与原平衡体系中各物质反应的气体)
对化学平衡的影响:
①恒温、恒容条件下:
原平衡体系 充入“无关气体” 体系总压强增大 体系中各组分的浓度不变 平衡不移动
②恒温、恒压条件下:
原平衡体系 充入“无关气体” 容器容积增大 体系中各组分的浓度减小 等效于减压 对于反应前后气体体积相等的反应,平衡不移动;对于反应前后气体体积不相等的反应,平衡向气体体积增大的方向移动。
评
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度) ,平衡就向能够减弱这种改变的方向移动。
(1)适用范围
处于平衡状态的可逆反应
(2)适用条件
只适用改变一个条件
(3)判断内容
三. 勒夏特列原理(平衡移动原理)
“减弱”外界条件的影响,而不能消除外界条件的影响。
(3)平衡移动的结果
平衡移动的方向
注意:
不涉及平衡移动的问题都不能用勒夏特列原理解释:
1、使用催化剂,化学平衡不移动
2、对于反应前后气体分子数不变的可逆反应,改变压强,化学
平衡不移动
3、化学反应本身不是可逆反应
4、外界条件改变对平衡移动的影响与生产要求不一致的反应。
450℃时N2与H2反应生成NH3的实验数据
压强/MPa
NH3/%
1
2.0
5
9.2
10
16.4
30
35.5
60
53.6
100
69.4
在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。
N2 (g) + 3H2 (g) 2NH3 (g)
1体积
3体积
2体积
利用勒夏特列原理来解释一下平衡移动的方向
条件的改变 平衡移动方向 新平衡建立时
具 体 增大反应物浓度
减小反应物浓度
增大体系压强
减小体系压强
升高温度
降低温度
向正反应方向移动
向逆反应方向移动
向体积缩小方向移动
向体积增大方向移动
向吸热方向移动
向放热方向移动
向减弱这种改变的方向移动
反应物浓度减小
反应物浓度增大
体系压强减小
体系压强增大
体系温度减小
体系温度增大
减弱这种改变
规
律
改变一个条件
催化剂对化学平衡无影响,能缩短平衡到达的时间。
结
改变反应条件时平衡移动的方向
⑥
检
1. 下列不能用勒夏特列原理解释的是( )
① 棕红色NO2加压后颜色先变深后变浅
② Fe(SCN)3溶液中加入固体KSCN后颜色变深
③ 氯水宜保存在低温、避光条件下
④ SO2催化氧化成SO3的反应,往往加入过量的空气
⑤ 打开易拉罐有大量气泡冒出
⑥ 加催化剂,使氮气和氢气在一定条件下转化为氨气
课堂练习
2. 在一密闭容器中发生反应:2A(g)+2B(g) C(s)+3D(g) ΔH<0,
达到平衡时采取下列措施, 可以使正反应速率(v正)增大、c(D)增大的是( )
A. 移走少量C B. 增大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入稀有气体
C
解析: A项:C为固体,改变其量,对反应速率无影响;
B项:增大容积,v正减小,c(D)也减小;
C项:缩小容积,浓度增大,速率也增大,平衡正向移动,c(D)也增大;
D项:容积不变,充入稀有气体,反应物浓度不变,速率不变,平衡不移动。
下节提示:
化学平衡常数(4)
