化学人教版(2019)选择性必修1 2.1.2化学反应速率及影响因素(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.1.2化学反应速率及影响因素(共20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 400.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 22:00:16 | ||
图片预览








文档简介
(共20张PPT)
DIYIKESHI
第二章
化学反应速率
旧知回顾
1、离子化合物的组成元素?共价化合物的组成元素?
2、如何有利于降低碳排放?维生素C具有什么作用?
3、有机物中常见官能团有哪些?
4、如何区别苯环与其他六元环?
5、硅和二氧化硅的常见用途有哪些?
6、同位素、同分异构体、同系物、同素异形体的概念?
7、能净水的物质有哪些?能杀菌消毒的物质有哪些?
8、酸性废水如何处理?
【学习目标】
通过阅读课本24-25页,掌握化学反应速率的计算,
学会比较化学反应速率的快慢
通过阅读课本24-25页,掌握化学反应速率的影响因素
【重难点】
化学反应速率的计算及影响因素。
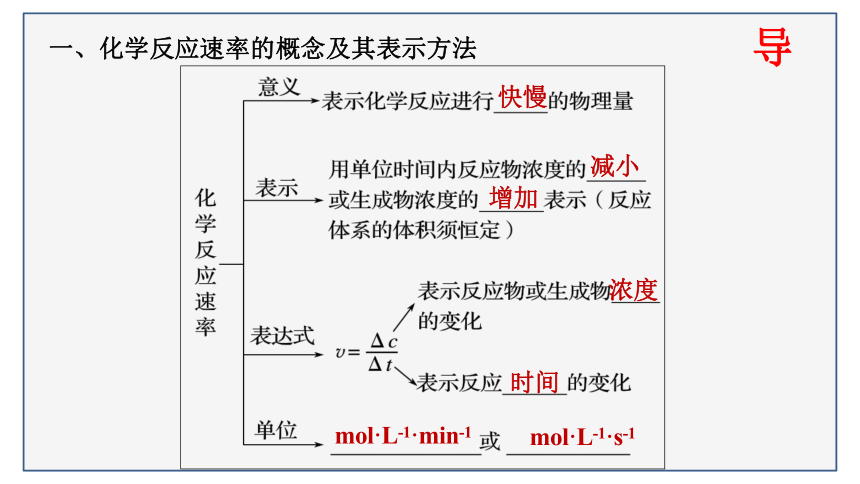
一、化学反应速率的概念及其表示方法
快慢
减小
增加
浓度
时间
mol·L-1·min-1
mol·L-1·s-1
导
1、化学反应速率的计算
(1)公式法
(2)运用同一反应中“速率之比等于化学计量数之比”进行计算。
(3) “三段式”法
①求解化学反应速率计算题的一般步骤:
a. 写出有关反应的化学方程式;
b. 找出各物质的起始量、转化量、某时刻量;转化量之比等于化学计量数之比;
c. 根据已知条件列方程计算。
2、化学反应速率的比较方法
(1)定性比较
通过明显的实验现象,如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所需时间的长短等来定性判断化学反应的快慢。如K与水反应比Na与水反应剧烈,则反应速率:K>Na。
(2) 定量比较
①“一看”:看化学反应速率的单位是否一致,若不一致,转化为同一单位。
②“二化”:将不同物质的化学反应速率转化成同一物质的化学反应速率,或分别除以相应物质的化学计量数。
③“三比较”:标准统一后比较数值大小,数值越大,反应速率越大。
前8分钟 通过阅读课本24—27页,完成下列问题:
1、不能用固体和纯液体的浓度变化量表示化学反应速率,应该用什么来
表示反应速率?
2、影响化学反应速率的因素有哪些?如何影响?
3、改变压强影响哪类反应的化学反应速率?
4、本身性质、温度、浓度、催化剂、压强以及反应物状态对反应速率
的影响程度比较?
后5分钟
1、完成学案深入学习;
2、存在的疑问写在【我有问题要问】;
书写展
1、铝-镁-氢氧化钠原电池的正负极电极方程式书写
2、海水提溴中用SO2的水溶液富集溴单质的离子方程式
3、金属钠放入氯化镁溶液中的离子方程式
4、少量SO2通入次氯酸钠的离子方程式
5、过量SO2通入次氯酸钠的离子方程式
6、氯化铁溶液刻蚀覆铜板的离子方程式
7、乙烯和水反应的化学方程式
8、乙醇和丙烯酸反应的化学方程式
1、已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下:
①v(CO)=1.5 mol·L-1·min-1
②v(NO2)=0.7 mol·L-1·min-1
③v(N2)=0.4 mol·L-1·min-1
④v(CO2)=1.1 mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
请比较上述5种情况反应的快慢: (由大到小的顺序)。
③>①>②>⑤>④
预设展
2、为测定一定时间内锌和稀硫酸反应的速率,下列测量依据可行的是_______(填序号)。
① m(Zn)的变化 ② c(H+)的变化
③ c( )的变化 ④ V(H2) 的变化
①②④
3、化学反应速率是描述化学反应进行快慢的物理量。某同学利用如图所示装置测定化学反应速率。
(已知: +2H+===H2O+S↓+SO2↑)
(1)为保证实验的准确性、可靠性,利用该装置进行实验前应先进行的步骤是_________________;除如图所示装置的实验用品、仪器外,还需要的一种实验仪器是 。
检查装置的气密性
秒表
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出这2 min内H+的反应速率,但该测定值比实际值偏小,其原因是___________________________________________。
(3)试简述测定该反应的反应速率的其他方法:______________________
__________________________________________________(写一种即可)。
部分SO2溶于水,使得气体体积偏小
测定一定时间内生成硫单质的质量、H+浓度的变化
评
影响因素 影响结果(其他条件不变)
浓度 固体或纯液体 浓度为常数,增加反应物的量,反应速率不变(固体物质的表面积影响反应速率)
气体或溶液 增大反应物的浓度,反应速率加快
升高温度 反应速率加快
增大压强(缩小体积) 对于气体,反应速率加快
使用正催化剂 反应速率加快
影响化学反应速率的外界因素
解答压强对化学反应速率影响的关键——弄清“真”变还是“假”变
若体系的压强变化而使反应物或生成物的浓度发生变化即“真”变,否则是“假”变。如:2SO2(g)+O2(g) 2SO3(g)
(1) 恒温恒容时
①充入气体反应物→反应物浓度增大→总压增大→反应速率增大。
②充入不参与反应的气体(如He、N2等)→引起总压增大,各物质的浓度不变→反应速率不变。
(2) 恒温恒压时
充入不参与反应的气体(如He、N2等)→引起体积增大→各反应物浓度减少→反应速率减小。
1、在一密闭容器中充入1 mol H2和1 mol I2,在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。下列说法正确的是
A.保持容器容积不变,向其中加入1 mol H2(g),反应速率加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速
率一定加快
√
检
2、某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验方案 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1= ,V2= 。
(2)设计实验方案①和②的目的是:
_______________________________________________
(3)设计实验方案②和④的目的: 。
(4)各实验方案均需加入一定体积水的原因:
____________________________________________。
5
10
探究Na2S2O3的浓度对化学反应速率的影响
探究温度对化学反应速率的影响
各实验方案中混合液的体积均相等
DIYIKESHI
第二章
化学反应速率
旧知回顾
1、离子化合物的组成元素?共价化合物的组成元素?
2、如何有利于降低碳排放?维生素C具有什么作用?
3、有机物中常见官能团有哪些?
4、如何区别苯环与其他六元环?
5、硅和二氧化硅的常见用途有哪些?
6、同位素、同分异构体、同系物、同素异形体的概念?
7、能净水的物质有哪些?能杀菌消毒的物质有哪些?
8、酸性废水如何处理?
【学习目标】
通过阅读课本24-25页,掌握化学反应速率的计算,
学会比较化学反应速率的快慢
通过阅读课本24-25页,掌握化学反应速率的影响因素
【重难点】
化学反应速率的计算及影响因素。
一、化学反应速率的概念及其表示方法
快慢
减小
增加
浓度
时间
mol·L-1·min-1
mol·L-1·s-1
导
1、化学反应速率的计算
(1)公式法
(2)运用同一反应中“速率之比等于化学计量数之比”进行计算。
(3) “三段式”法
①求解化学反应速率计算题的一般步骤:
a. 写出有关反应的化学方程式;
b. 找出各物质的起始量、转化量、某时刻量;转化量之比等于化学计量数之比;
c. 根据已知条件列方程计算。
2、化学反应速率的比较方法
(1)定性比较
通过明显的实验现象,如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所需时间的长短等来定性判断化学反应的快慢。如K与水反应比Na与水反应剧烈,则反应速率:K>Na。
(2) 定量比较
①“一看”:看化学反应速率的单位是否一致,若不一致,转化为同一单位。
②“二化”:将不同物质的化学反应速率转化成同一物质的化学反应速率,或分别除以相应物质的化学计量数。
③“三比较”:标准统一后比较数值大小,数值越大,反应速率越大。
前8分钟 通过阅读课本24—27页,完成下列问题:
1、不能用固体和纯液体的浓度变化量表示化学反应速率,应该用什么来
表示反应速率?
2、影响化学反应速率的因素有哪些?如何影响?
3、改变压强影响哪类反应的化学反应速率?
4、本身性质、温度、浓度、催化剂、压强以及反应物状态对反应速率
的影响程度比较?
后5分钟
1、完成学案深入学习;
2、存在的疑问写在【我有问题要问】;
书写展
1、铝-镁-氢氧化钠原电池的正负极电极方程式书写
2、海水提溴中用SO2的水溶液富集溴单质的离子方程式
3、金属钠放入氯化镁溶液中的离子方程式
4、少量SO2通入次氯酸钠的离子方程式
5、过量SO2通入次氯酸钠的离子方程式
6、氯化铁溶液刻蚀覆铜板的离子方程式
7、乙烯和水反应的化学方程式
8、乙醇和丙烯酸反应的化学方程式
1、已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下:
①v(CO)=1.5 mol·L-1·min-1
②v(NO2)=0.7 mol·L-1·min-1
③v(N2)=0.4 mol·L-1·min-1
④v(CO2)=1.1 mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
请比较上述5种情况反应的快慢: (由大到小的顺序)。
③>①>②>⑤>④
预设展
2、为测定一定时间内锌和稀硫酸反应的速率,下列测量依据可行的是_______(填序号)。
① m(Zn)的变化 ② c(H+)的变化
③ c( )的变化 ④ V(H2) 的变化
①②④
3、化学反应速率是描述化学反应进行快慢的物理量。某同学利用如图所示装置测定化学反应速率。
(已知: +2H+===H2O+S↓+SO2↑)
(1)为保证实验的准确性、可靠性,利用该装置进行实验前应先进行的步骤是_________________;除如图所示装置的实验用品、仪器外,还需要的一种实验仪器是 。
检查装置的气密性
秒表
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出这2 min内H+的反应速率,但该测定值比实际值偏小,其原因是___________________________________________。
(3)试简述测定该反应的反应速率的其他方法:______________________
__________________________________________________(写一种即可)。
部分SO2溶于水,使得气体体积偏小
测定一定时间内生成硫单质的质量、H+浓度的变化
评
影响因素 影响结果(其他条件不变)
浓度 固体或纯液体 浓度为常数,增加反应物的量,反应速率不变(固体物质的表面积影响反应速率)
气体或溶液 增大反应物的浓度,反应速率加快
升高温度 反应速率加快
增大压强(缩小体积) 对于气体,反应速率加快
使用正催化剂 反应速率加快
影响化学反应速率的外界因素
解答压强对化学反应速率影响的关键——弄清“真”变还是“假”变
若体系的压强变化而使反应物或生成物的浓度发生变化即“真”变,否则是“假”变。如:2SO2(g)+O2(g) 2SO3(g)
(1) 恒温恒容时
①充入气体反应物→反应物浓度增大→总压增大→反应速率增大。
②充入不参与反应的气体(如He、N2等)→引起总压增大,各物质的浓度不变→反应速率不变。
(2) 恒温恒压时
充入不参与反应的气体(如He、N2等)→引起体积增大→各反应物浓度减少→反应速率减小。
1、在一密闭容器中充入1 mol H2和1 mol I2,在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。下列说法正确的是
A.保持容器容积不变,向其中加入1 mol H2(g),反应速率加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速
率一定加快
√
检
2、某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验方案 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1= ,V2= 。
(2)设计实验方案①和②的目的是:
_______________________________________________
(3)设计实验方案②和④的目的: 。
(4)各实验方案均需加入一定体积水的原因:
____________________________________________。
5
10
探究Na2S2O3的浓度对化学反应速率的影响
探究温度对化学反应速率的影响
各实验方案中混合液的体积均相等
