第一部分 题型8 微型化工流程(含解析)2024高考化学二轮复习
文档属性
| 名称 | 第一部分 题型8 微型化工流程(含解析)2024高考化学二轮复习 |  | |
| 格式 | doc | ||
| 文件大小 | 598.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 22:30:52 | ||
图片预览




文档简介
题型8 微型化工流程
1.利用NaClO氧化尿素制备N2H4·H2O(水合肼),同时可制备Na2SO3,制备流程如图所示:
已知:N2H4·H2O有强还原性,N2H4·H2O能与NaClO反应生成N2;0.1 mol/L亚硫酸钠溶液的pH约为9.5。
下列说法错误的是( )
A.步骤Ⅰ反应时,若产物中n(NaClO)∶n(NaClO3)=5∶1,则n(NaCl)∶n(NaClO)=2∶1
B.步骤Ⅱ中须将尿素缓慢加入NaClO碱性溶液中
C.步骤Ⅱ反应的离子方程式为ClO-+CO(NH2)2+2OH-===Cl-+N2H4·H2O+CO
D.步骤Ⅳ反应过程中控制溶液为碱性,有利于吸收SO2
2.(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
3.(2023·河北张家口高三模拟)由制铝工业废渣(主要含Fe、Ca、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下:
下列有关说法不正确的是( )
A.控制反应温度并不断搅拌,有利于提高铁、铝浸取率
B.Al2O3与稀硫酸反应的离子方程式:Al2O3+6H+===2Al3++3H2O
C.滤液中主要存在的阳离子有H+、Fe2+、Ca2+、Al3+
D.聚合硫酸铁铝水解形成的胶体具有吸附作用
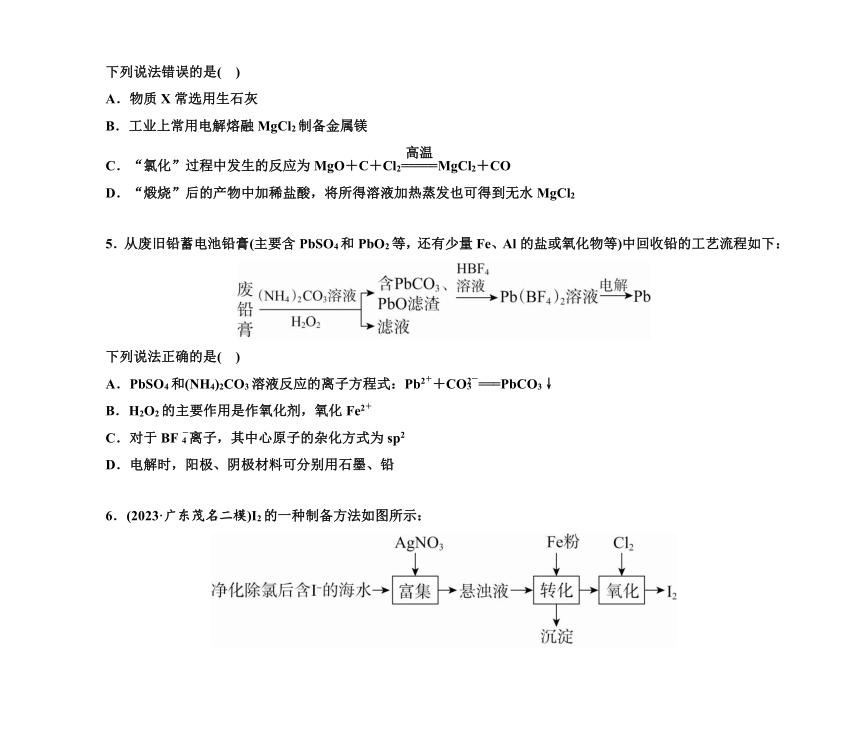
4.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
5.从废旧铅蓄电池铅膏(主要含PbSO4和PbO2等,还有少量Fe、Al的盐或氧化物等)中回收铅的工艺流程如下:
下列说法正确的是( )
A.PbSO4和(NH4)2CO3溶液反应的离子方程式:Pb2++CO===PbCO3↓
B.H2O2的主要作用是作氧化剂,氧化Fe2+
C.对于BF离子,其中心原子的杂化方式为sp2
D.电解时,阳极、阴极材料可分别用石墨、铅
6.(2023·广东茂名二模)I2的一种制备方法如图所示:
下列说法正确的是( )
A.“富集”时发生反应的离子方程式为Ag++I-===AgI↓
B.“转化”反应为Fe+2AgI===Fe2++2Ag+2I-,说明Ag的还原性大于Fe
C.通入过量Cl2,氧化产物只有一种
D.制备的I2可直接用于加碘盐
7.(2023·湖南怀化高三模拟)用反渗透法将海水淡化,剩余的浓缩液(主要含Cl-、Na+、Ca2+、Mg2+、SO等离子)可加工获得其他产品。某学习小组模拟工业生产流程进行实验。下列说法正确的是( )
A.反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B.反应Ⅲ的离子方程式为Mg2++2OH-===Mg(OH)2↓
C.反应Ⅱ加入适量CaCl2固体可以获得CaSO4
D.粗盐提纯中,加入试剂的顺序依次为Na2CO3、BaCl2、NaOH、盐酸
8.水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如下:
下列说法错误的是( )
A.上述三步反应过程均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中每消耗1 mol CO(NH2)2,转移电子数为NA
D.反应2完成后要用到过滤操作
9.(2022·湖南邵阳高三模拟)我国制碱工业先驱侯德榜发明了将制碱与制氨结合起来的联合制碱法,即“侯氏制碱法”。其主要生产工艺流程如下图,下列说法中正确的是( )
A.粗盐水中主要含有Ca2+、Mg2+、SO杂质离子,可以依次加入Na2CO3溶液、NaOH溶液、BaCl2溶液及适量的盐酸除杂进行精制
B.该流程中可循环使用的物质有CO2和NH3
C.饱和食盐水中应该先通入CO2再通入NH3,操作a是过滤
D.母液中的溶质只有NH4Cl,可直接作氮肥
10.为研究废旧电池的再利用,实验室利用旧电池的铜帽和锌皮(主要成分为Zn和Cu)回收Cu并制备皓矾(ZnSO4·7H2O)的部分实验过程如图所示。下列叙述错误的是( )
A.“溶解”操作中溶液温度不宜过高
B.“溶解”时铜发生的反应为Cu+H2O2+2H+===Cu2++2H2O
C.加入NaOH溶液后,若pH过高会使海绵铜中混有氢氧化铜杂质
D.“过滤”操作后,将滤液蒸发浓缩、冷却结晶即可得到纯净的ZnSO4·7H2O
11.(2022·河北石家庄一模)以铝土矿粉(主要含Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料生产Al2O3和Fe3O4的部分流程如下:
下列说法正确的是( )
A.“焙烧Ⅰ”时,加入少量CaO可提高矿粉中硫的去除率
B.用NaOH溶液吸收过量SO2的离子方程式为2OH-+SO2===SO+H2O
C.滤液中通入足量CO2,过滤后可得到Al2O3
D.无氧条件下进行“焙烧Ⅱ”时,理论上消耗的n(FeS2)∶n(Fe2O3)=1∶16
12.明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
下列说法错误的是( )
A.FeSO4的分解产物X为FeO
B.本流程涉及复分解反应
C.HNO3的沸点比H2SO4的低
D.制备使用的铁锅易损坏
题型8 微型化工流程
1.利用NaClO氧化尿素制备N2H4·H2O(水合肼),同时可制备Na2SO3,制备流程如图所示:
已知:N2H4·H2O有强还原性,N2H4·H2O能与NaClO反应生成N2;0.1 mol/L亚硫酸钠溶液的pH约为9.5。
下列说法错误的是( B )
A.步骤Ⅰ反应时,若产物中n(NaClO)∶n(NaClO3)=5∶1,则n(NaCl)∶n(NaClO)=2∶1
B.步骤Ⅱ中须将尿素缓慢加入NaClO碱性溶液中
C.步骤Ⅱ反应的离子方程式为ClO-+CO(NH2)2+2OH-===Cl-+N2H4·H2O+CO
D.步骤Ⅳ反应过程中控制溶液为碱性,有利于吸收SO2
解析 由流程可知,步骤Ⅰ中发生反应Cl2+2OH-===ClO-+Cl-+H2O,温度过高时易发生反应3Cl2+6OH-===ClO+5Cl-+3H2O,若产物中n(NaClO)∶n(NaClO3)=5∶1,假设产物中n(NaClO)=5 mol,n(NaClO3)=1 mol,根据得失电子守恒可知n(NaCl)=10 mol,故n(NaCl)∶n(NaClO)=2∶1,A项正确;步骤Ⅱ中发生反应ClO-+CO(NH2)2+2OH-===Cl-+N2H4·H2O+CO,且应将NaClO溶液逐滴滴加到尿素中,可防止过量的NaClO溶液将N2H4·H2O氧化,B项错误,C项正确;步骤Ⅳ向碳酸钠溶液中通入SO2,反应过程中控制溶液为碱性有利于吸收SO2,将碳酸钠转化为亚硫酸钠,D项正确。
2.(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( C )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
解析 流程梳理:
陶瓷中的SiO2能与HF反应,A项正确;喷淋法能使溶液与烟气充分接触,提高吸收效率,B项正确;根据流程梳理知,C项错误;滤液中含有Na2CO3,可用作吸收塔中的吸收剂,D项正确。
3.(2023·河北张家口高三模拟)由制铝工业废渣(主要含Fe、Ca、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下:
下列有关说法不正确的是( C )
A.控制反应温度并不断搅拌,有利于提高铁、铝浸取率
B.Al2O3与稀硫酸反应的离子方程式:Al2O3+6H+===2Al3++3H2O
C.滤液中主要存在的阳离子有H+、Fe2+、Ca2+、Al3+
D.聚合硫酸铁铝水解形成的胶体具有吸附作用
解析 控制反应温度并不断搅拌,可以加快反应速率,充分反应,有利于提高铁、铝浸取率,故A正确;Al2O3与稀硫酸反应生成硫酸铝和水,离子方程式为Al2O3+6H+===2Al3++3H2O,故B正确;双氧水会将亚铁离子氧化,所以滤液中主要存在的阳离子没有Fe2+,而是Fe3+,故C错误;聚合硫酸铁铝水解可以生成氢氧化铝和氢氧化铁胶体,胶体表面积较大,具有吸附作用,故D正确。
4.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( D )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
解析 物质X的作用是使Mg2+转化为Mg(OH)2,工业上常采用CaO,发生反应CaO+H2O===Ca(OH)2、Ca(OH)2+Mg2+===Mg(OH)2+Ca2+,A正确;Mg是较活泼金属,工业上常用电解熔融MgCl2制备金属镁,B正确;由题图可知“氯化”过程反应物为MgO、氯气、C,生成物之一为MgCl2,C在高温下能将二氧化碳还原为CO,则“气体”为CO,化学方程式为MgO+C+Cl2MgCl2+CO,C正确;“煅烧”后得到MgO,MgO和盐酸反应得到MgCl2溶液,由于MgCl2在溶液中水解为氢氧化镁和HCl,将所得溶液加热蒸发HCl会逸出,MgCl2水解平衡正向移动,得到氢氧化镁,得不到无水MgCl2,D错误。
5.从废旧铅蓄电池铅膏(主要含PbSO4和PbO2等,还有少量Fe、Al的盐或氧化物等)中回收铅的工艺流程如下:
下列说法正确的是( D )
A.PbSO4和(NH4)2CO3溶液反应的离子方程式:Pb2++CO===PbCO3↓
B.H2O2的主要作用是作氧化剂,氧化Fe2+
C.对于BF离子,其中心原子的杂化方式为sp2
D.电解时,阳极、阴极材料可分别用石墨、铅
解析 PbSO4与(NH4)2CO3溶液反应生成更难溶的PbCO3,转化后生成的碳酸铅可由酸浸进入溶液中,转化反应的离子方程式:PbSO4(s)+CO??PbCO3(s)+SO,A错误;PbO2中Pb元素的化合价降低,PbO2作氧化剂,H2O2作还原剂,B错误;对于BF,其中心原子的价层电子对数为4,杂化方式为sp3,C错误;电解Pb(BF4)2溶液时,石墨是电解池的阳极,铅是阴极,铅离子在阴极得到电子发生还原反应生成铅,D正确。
6.(2023·广东茂名二模)I2的一种制备方法如图所示:
下列说法正确的是( A )
A.“富集”时发生反应的离子方程式为Ag++I-===AgI↓
B.“转化”反应为Fe+2AgI===Fe2++2Ag+2I-,说明Ag的还原性大于Fe
C.通入过量Cl2,氧化产物只有一种
D.制备的I2可直接用于加碘盐
解析 “富集”时AgNO3与碘离子发生反应生成AgI黄色沉淀,离子方程式为Ag++I-===AgI↓,A项正确;“转化”反应的离子方程式为Fe+2AgI===Fe2++2Ag+2I-,Fe化合价由0价升高到+2价,发生氧化反应,Fe为还原剂,根据氧化还原反应中,还原剂的还原性大于还原产物可知,Fe的还原性大于Ag,B项错误;经过“转化”后溶液中有Fe2+和I-,还原性:I->Fe2+,通入过量Cl2后氧化产物有两种,分别为I2和Fe3+,C项错误;加碘食盐中碘以KIO3形式存在,I2不可直接用于加碘盐中,D项错误。
7.(2023·湖南怀化高三模拟)用反渗透法将海水淡化,剩余的浓缩液(主要含Cl-、Na+、Ca2+、Mg2+、SO等离子)可加工获得其他产品。某学习小组模拟工业生产流程进行实验。下列说法正确的是( C )
A.反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B.反应Ⅲ的离子方程式为Mg2++2OH-===Mg(OH)2↓
C.反应Ⅱ加入适量CaCl2固体可以获得CaSO4
D.粗盐提纯中,加入试剂的顺序依次为Na2CO3、BaCl2、NaOH、盐酸
解析 由题干流程图可知,反应Ⅰ为2NaCl(熔融)2Na+Cl2↑或2NaCl+2H2O2NaOH+H2↑+Cl2↑,反应Ⅱ为Ca2++SO===CaSO4↓,反应Ⅲ为MgCl2+Ca(OH)2===Mg(OH)2+CaCl2,反应Ⅳ为MgCl2(熔融)Mg+Cl2↑,则Ⅰ、Ⅳ均属于氧化还原反应,Ⅱ、Ⅲ不属于氧化还原反应,A错误;反应Ⅲ中使用石灰乳,离子方程式书写时不能拆,则反应Ⅲ的离子方程式为Mg2++Ca(OH)2===Mg(OH)2+Ca2+,B错误;反应Ⅱ加入适量CaCl2固体可以获得CaSO4,离子方程式为Ca2++SO===CaSO4↓,C正确;粗盐提纯中,Na2CO3需除去原溶液中的Ca2+,同时还要除去除SO过程中过量的Ba2+,故加入试剂必须保证Na2CO3在BaCl2之后加入,可以依次为BaCl2、Na2CO3、NaOH、盐酸或BaCl2、NaOH、Na2CO3、盐酸,D错误。
8.水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如下:
下列说法错误的是( C )
A.上述三步反应过程均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中每消耗1 mol CO(NH2)2,转移电子数为NA
D.反应2完成后要用到过滤操作
解析 反应1是氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,氯元素化合价变化;合成水合肼是次氯酸钠把尿素氧化为水合肼,氯元素、氮元素化合价变化;反应2是{[Cu(NH3)4]2+}被水合肼还原为Cu,铜元素、氮元素化合价变化,上述三步反应过程均为氧化还原反应,故A正确。反应1的目的是制备NaClO,用NaClO把尿素氧化为水合肼,故B正确。次氯酸钠把尿素氧化为水合肼,氮元素化合价由-3价升高为-2价,每消耗1 mol CO(NH2)2转移电子数为2NA,故C错误。反应2完成后要把铜粉分离出来,用到过滤操作,故D正确。
9.(2022·湖南邵阳高三模拟)我国制碱工业先驱侯德榜发明了将制碱与制氨结合起来的联合制碱法,即“侯氏制碱法”。其主要生产工艺流程如下图,下列说法中正确的是( B )
A.粗盐水中主要含有Ca2+、Mg2+、SO杂质离子,可以依次加入Na2CO3溶液、NaOH溶液、BaCl2溶液及适量的盐酸除杂进行精制
B.该流程中可循环使用的物质有CO2和NH3
C.饱和食盐水中应该先通入CO2再通入NH3,操作a是过滤
D.母液中的溶质只有NH4Cl,可直接作氮肥
解析 氯化钡除去粗盐中的硫酸根离子,氯化钡需要放在碳酸钠的前面,碳酸钠才能除去过量的钡离子和粗盐中的钙离子,故A错误;由题图工艺流程可知,可用于循环使用的物质有氨气和二氧化碳,故B正确;饱和食盐水中应该先通入氨气,再通二氧化碳,这样有利于二氧化碳的吸收,过滤可以将不溶性固体从溶液中分离出来,操作a是过滤,故C错误;母液中的溶质有NH4Cl和没有析出的碳酸氢钠,不可直接作氮肥,故D错误。
10.为研究废旧电池的再利用,实验室利用旧电池的铜帽和锌皮(主要成分为Zn和Cu)回收Cu并制备皓矾(ZnSO4·7H2O)的部分实验过程如图所示。下列叙述错误的是( D )
A.“溶解”操作中溶液温度不宜过高
B.“溶解”时铜发生的反应为Cu+H2O2+2H+===Cu2++2H2O
C.加入NaOH溶液后,若pH过高会使海绵铜中混有氢氧化铜杂质
D.“过滤”操作后,将滤液蒸发浓缩、冷却结晶即可得到纯净的ZnSO4·7H2O
解析 废旧电池的铜帽和锌皮主要成分为Zn和Cu,加入稀硫酸、30%过氧化氢溶液溶解,得到硫酸铜、硫酸锌溶液,加入氢氧化钠溶液调节溶液pH=2,加入适量锌粉置换出铜,过滤得到海绵铜,滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得ZnSO4·7H2O。H2O2在加热条件下易分解,所以“溶解”操作中溶液温度不宜过高,故A正确;“溶解”时铜在酸性条件下被双氧水氧化为Cu2+,发生的反应为Cu+H2O2+2H+===Cu2++2H2O,故B正确;加入NaOH溶液后,若pH过高会生成氢氧化铜沉淀,使海绵铜中混有氢氧化铜杂质,故C正确;“过滤”操作后,将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到纯净的ZnSO4·7H2O,故D错误。
11.(2022·河北石家庄一模)以铝土矿粉(主要含Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料生产Al2O3和Fe3O4的部分流程如下:
下列说法正确的是( D )
A.“焙烧Ⅰ”时,加入少量CaO可提高矿粉中硫的去除率
B.用NaOH溶液吸收过量SO2的离子方程式为2OH-+SO2===SO+H2O
C.滤液中通入足量CO2,过滤后可得到Al2O3
D.无氧条件下进行“焙烧Ⅱ”时,理论上消耗的n(FeS2)∶n(Fe2O3)=1∶16
解析 铝土矿粉在空气中焙烧,将FeS2转化为氧化铁和二氧化硫,加入氢氧化钠溶液,氧化铝、二氧化硅和氢氧化钠溶液反应生成可溶于水的偏铝酸钠和硅酸钠,过滤得到氧化铁,氧化铁加入FeS2隔绝氧气焙烧得到四氧化三铁和二氧化硫,据此解答。氧化钙和含硫元素化合物反应转化为硫酸钙留在矿粉中,导致矿粉中硫的去除率下降,A错误;用NaOH溶液吸收过量SO2生成亚硫酸氢钠:OH-+SO2===HSO,B错误;滤液中通入足量CO2,偏铝酸钠溶液和二氧化碳反应生成的是氢氧化铝沉淀,不是Al2O3,C错误;无氧条件下进行“焙烧Ⅱ”,FeS2和Fe2O3反应生成四氧化三铁和二氧化硫,化学方程式为FeS2+16Fe2O32SO2+11Fe3O4,理论上消耗的n(FeS2)∶n(Fe2O3)=1∶16,D正确。
12.明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
下列说法错误的是( A )
A.FeSO4的分解产物X为FeO
B.本流程涉及复分解反应
C.HNO3的沸点比H2SO4的低
D.制备使用的铁锅易损坏
解析 据流程图可知FeSO4分解时生成SO2和SO3,部分S元素被还原,则Fe元素应被氧化,X为Fe2O3,A错误;H2SO4与KNO3在蒸馏条件下生成HNO3和K2SO4,为复分解反应,B正确;H2SO4与KNO3混合后,蒸馏过程中生成HNO3,说明HNO3的沸点比H2SO4的低,C正确;硫酸、硝酸均可以和铁反应,所以制备使用的铁锅易损坏,D正确。
1.利用NaClO氧化尿素制备N2H4·H2O(水合肼),同时可制备Na2SO3,制备流程如图所示:
已知:N2H4·H2O有强还原性,N2H4·H2O能与NaClO反应生成N2;0.1 mol/L亚硫酸钠溶液的pH约为9.5。
下列说法错误的是( )
A.步骤Ⅰ反应时,若产物中n(NaClO)∶n(NaClO3)=5∶1,则n(NaCl)∶n(NaClO)=2∶1
B.步骤Ⅱ中须将尿素缓慢加入NaClO碱性溶液中
C.步骤Ⅱ反应的离子方程式为ClO-+CO(NH2)2+2OH-===Cl-+N2H4·H2O+CO
D.步骤Ⅳ反应过程中控制溶液为碱性,有利于吸收SO2
2.(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
3.(2023·河北张家口高三模拟)由制铝工业废渣(主要含Fe、Ca、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下:
下列有关说法不正确的是( )
A.控制反应温度并不断搅拌,有利于提高铁、铝浸取率
B.Al2O3与稀硫酸反应的离子方程式:Al2O3+6H+===2Al3++3H2O
C.滤液中主要存在的阳离子有H+、Fe2+、Ca2+、Al3+
D.聚合硫酸铁铝水解形成的胶体具有吸附作用
4.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
5.从废旧铅蓄电池铅膏(主要含PbSO4和PbO2等,还有少量Fe、Al的盐或氧化物等)中回收铅的工艺流程如下:
下列说法正确的是( )
A.PbSO4和(NH4)2CO3溶液反应的离子方程式:Pb2++CO===PbCO3↓
B.H2O2的主要作用是作氧化剂,氧化Fe2+
C.对于BF离子,其中心原子的杂化方式为sp2
D.电解时,阳极、阴极材料可分别用石墨、铅
6.(2023·广东茂名二模)I2的一种制备方法如图所示:
下列说法正确的是( )
A.“富集”时发生反应的离子方程式为Ag++I-===AgI↓
B.“转化”反应为Fe+2AgI===Fe2++2Ag+2I-,说明Ag的还原性大于Fe
C.通入过量Cl2,氧化产物只有一种
D.制备的I2可直接用于加碘盐
7.(2023·湖南怀化高三模拟)用反渗透法将海水淡化,剩余的浓缩液(主要含Cl-、Na+、Ca2+、Mg2+、SO等离子)可加工获得其他产品。某学习小组模拟工业生产流程进行实验。下列说法正确的是( )
A.反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B.反应Ⅲ的离子方程式为Mg2++2OH-===Mg(OH)2↓
C.反应Ⅱ加入适量CaCl2固体可以获得CaSO4
D.粗盐提纯中,加入试剂的顺序依次为Na2CO3、BaCl2、NaOH、盐酸
8.水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如下:
下列说法错误的是( )
A.上述三步反应过程均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中每消耗1 mol CO(NH2)2,转移电子数为NA
D.反应2完成后要用到过滤操作
9.(2022·湖南邵阳高三模拟)我国制碱工业先驱侯德榜发明了将制碱与制氨结合起来的联合制碱法,即“侯氏制碱法”。其主要生产工艺流程如下图,下列说法中正确的是( )
A.粗盐水中主要含有Ca2+、Mg2+、SO杂质离子,可以依次加入Na2CO3溶液、NaOH溶液、BaCl2溶液及适量的盐酸除杂进行精制
B.该流程中可循环使用的物质有CO2和NH3
C.饱和食盐水中应该先通入CO2再通入NH3,操作a是过滤
D.母液中的溶质只有NH4Cl,可直接作氮肥
10.为研究废旧电池的再利用,实验室利用旧电池的铜帽和锌皮(主要成分为Zn和Cu)回收Cu并制备皓矾(ZnSO4·7H2O)的部分实验过程如图所示。下列叙述错误的是( )
A.“溶解”操作中溶液温度不宜过高
B.“溶解”时铜发生的反应为Cu+H2O2+2H+===Cu2++2H2O
C.加入NaOH溶液后,若pH过高会使海绵铜中混有氢氧化铜杂质
D.“过滤”操作后,将滤液蒸发浓缩、冷却结晶即可得到纯净的ZnSO4·7H2O
11.(2022·河北石家庄一模)以铝土矿粉(主要含Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料生产Al2O3和Fe3O4的部分流程如下:
下列说法正确的是( )
A.“焙烧Ⅰ”时,加入少量CaO可提高矿粉中硫的去除率
B.用NaOH溶液吸收过量SO2的离子方程式为2OH-+SO2===SO+H2O
C.滤液中通入足量CO2,过滤后可得到Al2O3
D.无氧条件下进行“焙烧Ⅱ”时,理论上消耗的n(FeS2)∶n(Fe2O3)=1∶16
12.明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
下列说法错误的是( )
A.FeSO4的分解产物X为FeO
B.本流程涉及复分解反应
C.HNO3的沸点比H2SO4的低
D.制备使用的铁锅易损坏
题型8 微型化工流程
1.利用NaClO氧化尿素制备N2H4·H2O(水合肼),同时可制备Na2SO3,制备流程如图所示:
已知:N2H4·H2O有强还原性,N2H4·H2O能与NaClO反应生成N2;0.1 mol/L亚硫酸钠溶液的pH约为9.5。
下列说法错误的是( B )
A.步骤Ⅰ反应时,若产物中n(NaClO)∶n(NaClO3)=5∶1,则n(NaCl)∶n(NaClO)=2∶1
B.步骤Ⅱ中须将尿素缓慢加入NaClO碱性溶液中
C.步骤Ⅱ反应的离子方程式为ClO-+CO(NH2)2+2OH-===Cl-+N2H4·H2O+CO
D.步骤Ⅳ反应过程中控制溶液为碱性,有利于吸收SO2
解析 由流程可知,步骤Ⅰ中发生反应Cl2+2OH-===ClO-+Cl-+H2O,温度过高时易发生反应3Cl2+6OH-===ClO+5Cl-+3H2O,若产物中n(NaClO)∶n(NaClO3)=5∶1,假设产物中n(NaClO)=5 mol,n(NaClO3)=1 mol,根据得失电子守恒可知n(NaCl)=10 mol,故n(NaCl)∶n(NaClO)=2∶1,A项正确;步骤Ⅱ中发生反应ClO-+CO(NH2)2+2OH-===Cl-+N2H4·H2O+CO,且应将NaClO溶液逐滴滴加到尿素中,可防止过量的NaClO溶液将N2H4·H2O氧化,B项错误,C项正确;步骤Ⅳ向碳酸钠溶液中通入SO2,反应过程中控制溶液为碱性有利于吸收SO2,将碳酸钠转化为亚硫酸钠,D项正确。
2.(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( C )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
解析 流程梳理:
陶瓷中的SiO2能与HF反应,A项正确;喷淋法能使溶液与烟气充分接触,提高吸收效率,B项正确;根据流程梳理知,C项错误;滤液中含有Na2CO3,可用作吸收塔中的吸收剂,D项正确。
3.(2023·河北张家口高三模拟)由制铝工业废渣(主要含Fe、Ca、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下:
下列有关说法不正确的是( C )
A.控制反应温度并不断搅拌,有利于提高铁、铝浸取率
B.Al2O3与稀硫酸反应的离子方程式:Al2O3+6H+===2Al3++3H2O
C.滤液中主要存在的阳离子有H+、Fe2+、Ca2+、Al3+
D.聚合硫酸铁铝水解形成的胶体具有吸附作用
解析 控制反应温度并不断搅拌,可以加快反应速率,充分反应,有利于提高铁、铝浸取率,故A正确;Al2O3与稀硫酸反应生成硫酸铝和水,离子方程式为Al2O3+6H+===2Al3++3H2O,故B正确;双氧水会将亚铁离子氧化,所以滤液中主要存在的阳离子没有Fe2+,而是Fe3+,故C错误;聚合硫酸铁铝水解可以生成氢氧化铝和氢氧化铁胶体,胶体表面积较大,具有吸附作用,故D正确。
4.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( D )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
解析 物质X的作用是使Mg2+转化为Mg(OH)2,工业上常采用CaO,发生反应CaO+H2O===Ca(OH)2、Ca(OH)2+Mg2+===Mg(OH)2+Ca2+,A正确;Mg是较活泼金属,工业上常用电解熔融MgCl2制备金属镁,B正确;由题图可知“氯化”过程反应物为MgO、氯气、C,生成物之一为MgCl2,C在高温下能将二氧化碳还原为CO,则“气体”为CO,化学方程式为MgO+C+Cl2MgCl2+CO,C正确;“煅烧”后得到MgO,MgO和盐酸反应得到MgCl2溶液,由于MgCl2在溶液中水解为氢氧化镁和HCl,将所得溶液加热蒸发HCl会逸出,MgCl2水解平衡正向移动,得到氢氧化镁,得不到无水MgCl2,D错误。
5.从废旧铅蓄电池铅膏(主要含PbSO4和PbO2等,还有少量Fe、Al的盐或氧化物等)中回收铅的工艺流程如下:
下列说法正确的是( D )
A.PbSO4和(NH4)2CO3溶液反应的离子方程式:Pb2++CO===PbCO3↓
B.H2O2的主要作用是作氧化剂,氧化Fe2+
C.对于BF离子,其中心原子的杂化方式为sp2
D.电解时,阳极、阴极材料可分别用石墨、铅
解析 PbSO4与(NH4)2CO3溶液反应生成更难溶的PbCO3,转化后生成的碳酸铅可由酸浸进入溶液中,转化反应的离子方程式:PbSO4(s)+CO??PbCO3(s)+SO,A错误;PbO2中Pb元素的化合价降低,PbO2作氧化剂,H2O2作还原剂,B错误;对于BF,其中心原子的价层电子对数为4,杂化方式为sp3,C错误;电解Pb(BF4)2溶液时,石墨是电解池的阳极,铅是阴极,铅离子在阴极得到电子发生还原反应生成铅,D正确。
6.(2023·广东茂名二模)I2的一种制备方法如图所示:
下列说法正确的是( A )
A.“富集”时发生反应的离子方程式为Ag++I-===AgI↓
B.“转化”反应为Fe+2AgI===Fe2++2Ag+2I-,说明Ag的还原性大于Fe
C.通入过量Cl2,氧化产物只有一种
D.制备的I2可直接用于加碘盐
解析 “富集”时AgNO3与碘离子发生反应生成AgI黄色沉淀,离子方程式为Ag++I-===AgI↓,A项正确;“转化”反应的离子方程式为Fe+2AgI===Fe2++2Ag+2I-,Fe化合价由0价升高到+2价,发生氧化反应,Fe为还原剂,根据氧化还原反应中,还原剂的还原性大于还原产物可知,Fe的还原性大于Ag,B项错误;经过“转化”后溶液中有Fe2+和I-,还原性:I->Fe2+,通入过量Cl2后氧化产物有两种,分别为I2和Fe3+,C项错误;加碘食盐中碘以KIO3形式存在,I2不可直接用于加碘盐中,D项错误。
7.(2023·湖南怀化高三模拟)用反渗透法将海水淡化,剩余的浓缩液(主要含Cl-、Na+、Ca2+、Mg2+、SO等离子)可加工获得其他产品。某学习小组模拟工业生产流程进行实验。下列说法正确的是( C )
A.反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B.反应Ⅲ的离子方程式为Mg2++2OH-===Mg(OH)2↓
C.反应Ⅱ加入适量CaCl2固体可以获得CaSO4
D.粗盐提纯中,加入试剂的顺序依次为Na2CO3、BaCl2、NaOH、盐酸
解析 由题干流程图可知,反应Ⅰ为2NaCl(熔融)2Na+Cl2↑或2NaCl+2H2O2NaOH+H2↑+Cl2↑,反应Ⅱ为Ca2++SO===CaSO4↓,反应Ⅲ为MgCl2+Ca(OH)2===Mg(OH)2+CaCl2,反应Ⅳ为MgCl2(熔融)Mg+Cl2↑,则Ⅰ、Ⅳ均属于氧化还原反应,Ⅱ、Ⅲ不属于氧化还原反应,A错误;反应Ⅲ中使用石灰乳,离子方程式书写时不能拆,则反应Ⅲ的离子方程式为Mg2++Ca(OH)2===Mg(OH)2+Ca2+,B错误;反应Ⅱ加入适量CaCl2固体可以获得CaSO4,离子方程式为Ca2++SO===CaSO4↓,C正确;粗盐提纯中,Na2CO3需除去原溶液中的Ca2+,同时还要除去除SO过程中过量的Ba2+,故加入试剂必须保证Na2CO3在BaCl2之后加入,可以依次为BaCl2、Na2CO3、NaOH、盐酸或BaCl2、NaOH、Na2CO3、盐酸,D错误。
8.水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如下:
下列说法错误的是( C )
A.上述三步反应过程均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中每消耗1 mol CO(NH2)2,转移电子数为NA
D.反应2完成后要用到过滤操作
解析 反应1是氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,氯元素化合价变化;合成水合肼是次氯酸钠把尿素氧化为水合肼,氯元素、氮元素化合价变化;反应2是{[Cu(NH3)4]2+}被水合肼还原为Cu,铜元素、氮元素化合价变化,上述三步反应过程均为氧化还原反应,故A正确。反应1的目的是制备NaClO,用NaClO把尿素氧化为水合肼,故B正确。次氯酸钠把尿素氧化为水合肼,氮元素化合价由-3价升高为-2价,每消耗1 mol CO(NH2)2转移电子数为2NA,故C错误。反应2完成后要把铜粉分离出来,用到过滤操作,故D正确。
9.(2022·湖南邵阳高三模拟)我国制碱工业先驱侯德榜发明了将制碱与制氨结合起来的联合制碱法,即“侯氏制碱法”。其主要生产工艺流程如下图,下列说法中正确的是( B )
A.粗盐水中主要含有Ca2+、Mg2+、SO杂质离子,可以依次加入Na2CO3溶液、NaOH溶液、BaCl2溶液及适量的盐酸除杂进行精制
B.该流程中可循环使用的物质有CO2和NH3
C.饱和食盐水中应该先通入CO2再通入NH3,操作a是过滤
D.母液中的溶质只有NH4Cl,可直接作氮肥
解析 氯化钡除去粗盐中的硫酸根离子,氯化钡需要放在碳酸钠的前面,碳酸钠才能除去过量的钡离子和粗盐中的钙离子,故A错误;由题图工艺流程可知,可用于循环使用的物质有氨气和二氧化碳,故B正确;饱和食盐水中应该先通入氨气,再通二氧化碳,这样有利于二氧化碳的吸收,过滤可以将不溶性固体从溶液中分离出来,操作a是过滤,故C错误;母液中的溶质有NH4Cl和没有析出的碳酸氢钠,不可直接作氮肥,故D错误。
10.为研究废旧电池的再利用,实验室利用旧电池的铜帽和锌皮(主要成分为Zn和Cu)回收Cu并制备皓矾(ZnSO4·7H2O)的部分实验过程如图所示。下列叙述错误的是( D )
A.“溶解”操作中溶液温度不宜过高
B.“溶解”时铜发生的反应为Cu+H2O2+2H+===Cu2++2H2O
C.加入NaOH溶液后,若pH过高会使海绵铜中混有氢氧化铜杂质
D.“过滤”操作后,将滤液蒸发浓缩、冷却结晶即可得到纯净的ZnSO4·7H2O
解析 废旧电池的铜帽和锌皮主要成分为Zn和Cu,加入稀硫酸、30%过氧化氢溶液溶解,得到硫酸铜、硫酸锌溶液,加入氢氧化钠溶液调节溶液pH=2,加入适量锌粉置换出铜,过滤得到海绵铜,滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得ZnSO4·7H2O。H2O2在加热条件下易分解,所以“溶解”操作中溶液温度不宜过高,故A正确;“溶解”时铜在酸性条件下被双氧水氧化为Cu2+,发生的反应为Cu+H2O2+2H+===Cu2++2H2O,故B正确;加入NaOH溶液后,若pH过高会生成氢氧化铜沉淀,使海绵铜中混有氢氧化铜杂质,故C正确;“过滤”操作后,将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到纯净的ZnSO4·7H2O,故D错误。
11.(2022·河北石家庄一模)以铝土矿粉(主要含Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料生产Al2O3和Fe3O4的部分流程如下:
下列说法正确的是( D )
A.“焙烧Ⅰ”时,加入少量CaO可提高矿粉中硫的去除率
B.用NaOH溶液吸收过量SO2的离子方程式为2OH-+SO2===SO+H2O
C.滤液中通入足量CO2,过滤后可得到Al2O3
D.无氧条件下进行“焙烧Ⅱ”时,理论上消耗的n(FeS2)∶n(Fe2O3)=1∶16
解析 铝土矿粉在空气中焙烧,将FeS2转化为氧化铁和二氧化硫,加入氢氧化钠溶液,氧化铝、二氧化硅和氢氧化钠溶液反应生成可溶于水的偏铝酸钠和硅酸钠,过滤得到氧化铁,氧化铁加入FeS2隔绝氧气焙烧得到四氧化三铁和二氧化硫,据此解答。氧化钙和含硫元素化合物反应转化为硫酸钙留在矿粉中,导致矿粉中硫的去除率下降,A错误;用NaOH溶液吸收过量SO2生成亚硫酸氢钠:OH-+SO2===HSO,B错误;滤液中通入足量CO2,偏铝酸钠溶液和二氧化碳反应生成的是氢氧化铝沉淀,不是Al2O3,C错误;无氧条件下进行“焙烧Ⅱ”,FeS2和Fe2O3反应生成四氧化三铁和二氧化硫,化学方程式为FeS2+16Fe2O32SO2+11Fe3O4,理论上消耗的n(FeS2)∶n(Fe2O3)=1∶16,D正确。
12.明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
下列说法错误的是( A )
A.FeSO4的分解产物X为FeO
B.本流程涉及复分解反应
C.HNO3的沸点比H2SO4的低
D.制备使用的铁锅易损坏
解析 据流程图可知FeSO4分解时生成SO2和SO3,部分S元素被还原,则Fe元素应被氧化,X为Fe2O3,A错误;H2SO4与KNO3在蒸馏条件下生成HNO3和K2SO4,为复分解反应,B正确;H2SO4与KNO3混合后,蒸馏过程中生成HNO3,说明HNO3的沸点比H2SO4的低,C正确;硫酸、硝酸均可以和铁反应,所以制备使用的铁锅易损坏,D正确。
同课章节目录
