3.1卤代烃课件(共39张PPT) 人教版(2019)选择性必修3
文档属性
| 名称 | 3.1卤代烃课件(共39张PPT) 人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 22:35:35 | ||
图片预览










文档简介
(共39张PPT)
人教版(2019)选择性必修3
第三章烃的衍生物
第一节 卤代烃
第一课时 卤代烃
1.通过从卤代烃的官能团及其转化角度认识卤代烃取代反应、消去反应的特点和规律,培养学生宏观辨识与微观探析、变化观念的核心素养。
2.掌握卤代烃在有机合成中的桥梁作用,培养学生科学探究与社会责任的核心素养。
运动中的急性损伤通常用氯乙烷进行快速镇痛
CH3CH2Cl
CH3Cl
CH2=CH2Cl
观察下列物质有什么共同点,如何对它们进行分类?
Br
共同点:都是由相应的烃被卤素原子取代后得到的有机物
分类:
烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃
结合前一章内容,想一想如何由烃制备卤代烃?
制备卤代烃的方法
1、烷烃在光照条件下与X2(气态)发生取代反应
CH4+Cl2 CH3Cl +HCl
光照
2、烯烃、炔烃与X2或HX在一定条件下发生加成反应
CH3CH=CH2+Br2→CH3CHBrCH2Br
CH3CH=CH2+HCl→CH3CH2CH2Cl
CH≡CH+Br CH=CH
Br
Br
△
CH≡CH+HCl CH2=CHCl
催化剂
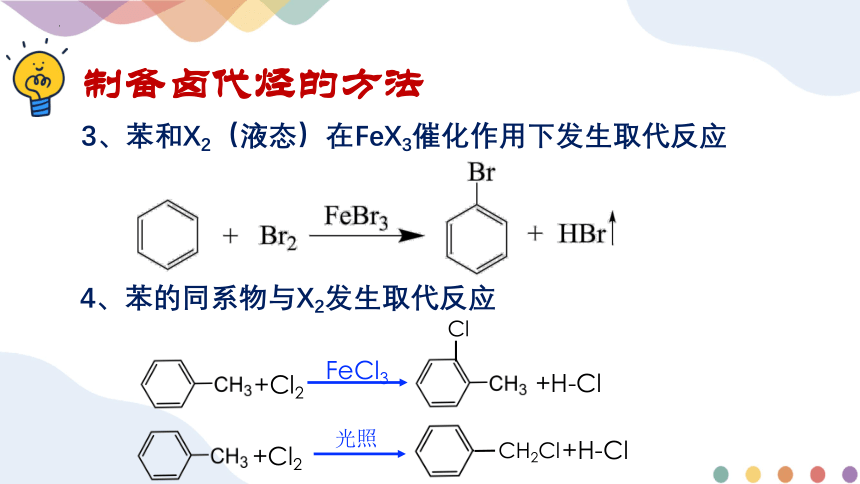
4、苯的同系物与X2发生取代反应
制备卤代烃的方法
3、苯和X2(液态)在FeX3催化作用下发生取代反应
+Cl2
FeCl3
Cl
+H-Cl
+Cl2
+H-Cl
光照
CH2Cl
卤代烃
1、概念
烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃
2、官能团
碳卤键
C
X
3、表示方法
R—X (X=F、Cl、Br、I)
饱和一卤代烃的通式:CnH2n+1X
4、卤代烃的分类
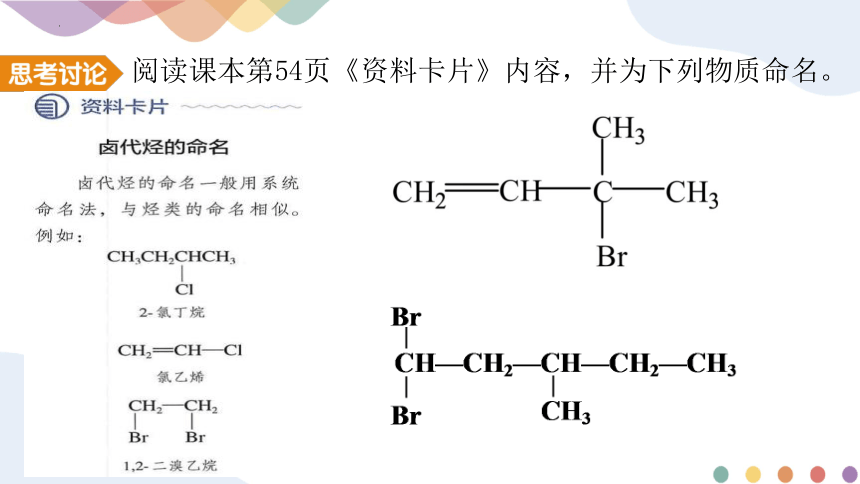
阅读课本第54页《资料卡片》内容,并为下列物质命名。
5、卤代烃的命名
(1)选主链
“最长”、“最多”定主链,若有双键(三键)碳原子则主链必须包含双键(三键)碳原子。
与烃类的命名相似
(2)编碳号
“近”、“简”、“小”,将卤素原子看做取代基,编号时从距简单取代基近的一端编号。若有碳碳双键(三键)则从距离碳碳双键(三键)近的一端开始编号
(3)写名称
取代基位次+取代基名称+主链名称
不同基,简到繁;相同基,合并算
阅读课本第54页《资料卡片》内容,并为下列物质命名。
3-甲基-3-溴-1-丁烯
1
2
3
4
1
2
3
4
5
3-甲基- 1,1-二溴戊烷
阅读教材,以氯代烃的密度和沸点为例,同时结合烷烃的物理性质的变化规律,总结卤代烃的物理性质。
名称 结构简式 液态时密度(g·cm-3) 沸点/℃
氯甲烷 CH3Cl 0.916 -24
氯乙烷 CH3CH2Cl 0.898 12
1-氯丙烷 CH3CH2CH2Cl 0.890 46
1-氯丁烷 CH3CH2CH2CH2Cl 0.886 78
1-氯戊烷 CH3CH2CH2CH2CH2Cl 0.882 108
表3-1 几种氯代烃的密度和沸点
6、卤代烃的物理性质
高
升高
大
溴乙烷的结构和性质
1、组成和结构
C2H5Br
CH3CH2Br 或 C2H5Br
分子式:
结构式:
结构简式:
官能团:
C—Br
(碳溴键)
电子式:
球棍模型
空间填充模型
2、物理性质
颜色 状态 沸点 密度 溶解性
. . 38.4 ℃ 比水大 溶于水,可溶于多种有机溶剂
无色
液体
难
溴乙烷有2种化学环境的H原子,则核磁共振氢谱有2组峰,强度比为3:2
溴乙烷到底有怎样的化学性质?分析卤代烃的结构特点,推测溴乙烷的性质。
碳卤键
官能团:
X
C
电负性:X>C,卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子。使C原子带部分正电荷(δ+)带部分负电荷(δ-),X原子使C—X键具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
取一支试管,滴入10~15滴溴乙烷,再加入1mL5%NaOH溶液,振荡后加热,静置。待溶液分层后,用胶头滴管小心吸取少量上层水溶液,移入另一支盛有1mL稀硝酸的试管中,然后加入2滴AgNO3溶液,观察现象。
「实验3-1」
实验现象
①中溶液分层;
②中有机层厚度减小,直至消失;
④中有浅黄色沉淀生成
现象说明溴乙烷与NaOH水溶液共热产生了Br-
3、化学性质
(1)取代反应(水解反应)
反应条件
NaOH水溶液、加热
C2H5—Br + H--OH C2H5—OH + HBr
△
NaOH + HBr == NaBr + H2O
反应原理
水中羟基(-OH)取代卤代烃中卤素原子(-X),生成醇。
CH3CH2—Br + Na—OH CH3CH2—OH + NaBr
H2O
总反应
△
水
X
C
+ H-OH
OH
C
+ H- X
卤代烃都具有以下化学性质
由实验原理思考以下问题:
问题1:该反应条件中NaOH溶液和加热分别起什么作用?
问题2:在实验中加入过量稀硝酸的目的是什么?若直接滴加AgNO3(aq),将会看到什么现象?
NaOH作用: NaOH不断中和水解产生的HBr,从反应平衡角度分析,促进了反应正向进行,提高产率。
加热作用:加热加快反应速率,且水解吸热,加热可使反应正向移动。
稀硝酸作用:①中和过量的NaOH溶液
②检验生成的沉淀是否溶于稀HNO3
若不加稀硝酸,AgNO3会和碱反应生成AgOH,最终转化为Ag2O黑色沉淀,干扰试验现象。
问题3:如何检验卤代烃分子中的卤素原子?
卤代烃中卤素原子的检验:
关键步骤!
「实验探究」
向试管中加入5mL溴乙烷和15mL饱和NaOH乙醇溶液,振荡后加热。将产生的气体先通入盛水的试管,再通入盛有酸性高锰酸钾的试管中,观察现象。
「实验探究」
「实验探究」
向试管中加入5mL溴乙烷和15mL饱和NaOH乙醇溶液,振荡后加热。将产生的气体先通入盛水的试管,再通入盛有酸性高锰酸钾的试管中,观察现象。
实验现象
反应产生的气体经水洗后,使酸性KMnO4溶液褪色
现象说明反应后生成的气体分子中含有碳碳不饱和键
由实验探究思考以下问题:
(1)分析反应产生的气体中可能含有哪些杂质?
水能除去挥发出来的乙醇,乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。
(3)除了酸性高锰酸钾溶液,还可以用什么方法检验生成物,此时还有必要将气体先通入水中吗?
溴水或溴的四氯化碳溶液。不用。乙醇与溴不反应,不会干扰乙烯的检验。
溴乙烷、乙醇、水蒸气
(2)为什么要在气体通入酸性KMnO4溶液前加一个盛有水的试管?
(实验产生的气流 也可能带出溴导致褪色,可设计空白对照实验----将空气通入同浓度同体积的溴的四氯化碳,对比现象)
(2)消去反应
溴乙烷与强碱(如NaOH或KOH)的乙醇溶液共热,溴乙烷可以从分子中脱去HBr,生成乙烯。
CH2—CH2 +NaOH CH2=CH2↑ +NaBr +H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而形成不饱和键(双键或三键)的化合物的反应。。
反应条件
强碱的醇溶液,加热
反应原理
分子中相邻的两个碳原子脱去一个HX分子,HX分子与强碱反应生成盐和水。
结构条件
卤代烃分子中存在 氢原子( -H)
①卤代烃中碳原子数≥2。
②卤素原子所连碳原子( -C)的邻位碳原子( -C)上必须有氢原子( -H) 。
X
C
C
H
△
乙醇
C
C
+ NaX+H2O
+ NaOH
小组讨论并判断下列物质是否能发生消去反应以及下列反应类型是否为消去反应
2-丁烯
CH3—CH—CH2—CH3
Br
CH3—CH=CH—CH3
CH3—CH2—CH=CH2
(主产物)
1-丁烯
消去反应规则
当有多个产物时,以消H少的C原子上的H为主。
预测2-溴丁烷发生消去反应的可能产物。
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
卤代烃的消去反应与取代(水解)反应的比较
(3)加成和加聚反应
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加成聚合反应。
氯乙烯能加成聚合生成聚氯乙烯
四氟乙烯加成聚合生成聚四氟乙烯
聚氯乙烯管道
聚四氟乙烯材料
D
考向一 卤代烃的水解和消去反应
2.为了检验2 溴丁烷中含有溴元素,有以下操作,顺序合理的是( )
①加AgNO3溶液 ②加NaOH水溶液 ③加热
④加蒸馏水 ⑤加稀硝酸至溶液显酸性
A.②①③⑤ B.②④⑤③
C.②③⑤① D.②①⑤③
C
考向二 卤代烃在有机合成中的桥梁作用
1.设计乙烯制备乙二醇的合成路线。
2.设计丙烯制备丙炔的合成路线。
环己烷
取代反应
加成反应
卤代烃的用途与危害
1、卤代烃的用途
常用作制冷剂(氟利昂)、灭火剂(CCl4)、溶剂(CCl4、氯仿)、麻醉剂、合成有机物等
2、卤代烃的危害
含氯、溴的氟代烷可对臭氧层产生破坏作用,形成臭氧空洞,危及地球上的生物。氟利昂(以CCl3F为例)破坏臭氧层的反应过程可表示为
人教版(2019)选择性必修3
第三章烃的衍生物
第一节 卤代烃
第一课时 卤代烃
1.通过从卤代烃的官能团及其转化角度认识卤代烃取代反应、消去反应的特点和规律,培养学生宏观辨识与微观探析、变化观念的核心素养。
2.掌握卤代烃在有机合成中的桥梁作用,培养学生科学探究与社会责任的核心素养。
运动中的急性损伤通常用氯乙烷进行快速镇痛
CH3CH2Cl
CH3Cl
CH2=CH2Cl
观察下列物质有什么共同点,如何对它们进行分类?
Br
共同点:都是由相应的烃被卤素原子取代后得到的有机物
分类:
烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃
结合前一章内容,想一想如何由烃制备卤代烃?
制备卤代烃的方法
1、烷烃在光照条件下与X2(气态)发生取代反应
CH4+Cl2 CH3Cl +HCl
光照
2、烯烃、炔烃与X2或HX在一定条件下发生加成反应
CH3CH=CH2+Br2→CH3CHBrCH2Br
CH3CH=CH2+HCl→CH3CH2CH2Cl
CH≡CH+Br CH=CH
Br
Br
△
CH≡CH+HCl CH2=CHCl
催化剂
4、苯的同系物与X2发生取代反应
制备卤代烃的方法
3、苯和X2(液态)在FeX3催化作用下发生取代反应
+Cl2
FeCl3
Cl
+H-Cl
+Cl2
+H-Cl
光照
CH2Cl
卤代烃
1、概念
烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃
2、官能团
碳卤键
C
X
3、表示方法
R—X (X=F、Cl、Br、I)
饱和一卤代烃的通式:CnH2n+1X
4、卤代烃的分类
阅读课本第54页《资料卡片》内容,并为下列物质命名。
5、卤代烃的命名
(1)选主链
“最长”、“最多”定主链,若有双键(三键)碳原子则主链必须包含双键(三键)碳原子。
与烃类的命名相似
(2)编碳号
“近”、“简”、“小”,将卤素原子看做取代基,编号时从距简单取代基近的一端编号。若有碳碳双键(三键)则从距离碳碳双键(三键)近的一端开始编号
(3)写名称
取代基位次+取代基名称+主链名称
不同基,简到繁;相同基,合并算
阅读课本第54页《资料卡片》内容,并为下列物质命名。
3-甲基-3-溴-1-丁烯
1
2
3
4
1
2
3
4
5
3-甲基- 1,1-二溴戊烷
阅读教材,以氯代烃的密度和沸点为例,同时结合烷烃的物理性质的变化规律,总结卤代烃的物理性质。
名称 结构简式 液态时密度(g·cm-3) 沸点/℃
氯甲烷 CH3Cl 0.916 -24
氯乙烷 CH3CH2Cl 0.898 12
1-氯丙烷 CH3CH2CH2Cl 0.890 46
1-氯丁烷 CH3CH2CH2CH2Cl 0.886 78
1-氯戊烷 CH3CH2CH2CH2CH2Cl 0.882 108
表3-1 几种氯代烃的密度和沸点
6、卤代烃的物理性质
高
升高
大
溴乙烷的结构和性质
1、组成和结构
C2H5Br
CH3CH2Br 或 C2H5Br
分子式:
结构式:
结构简式:
官能团:
C—Br
(碳溴键)
电子式:
球棍模型
空间填充模型
2、物理性质
颜色 状态 沸点 密度 溶解性
. . 38.4 ℃ 比水大 溶于水,可溶于多种有机溶剂
无色
液体
难
溴乙烷有2种化学环境的H原子,则核磁共振氢谱有2组峰,强度比为3:2
溴乙烷到底有怎样的化学性质?分析卤代烃的结构特点,推测溴乙烷的性质。
碳卤键
官能团:
X
C
电负性:X>C,卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子。使C原子带部分正电荷(δ+)带部分负电荷(δ-),X原子使C—X键具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
取一支试管,滴入10~15滴溴乙烷,再加入1mL5%NaOH溶液,振荡后加热,静置。待溶液分层后,用胶头滴管小心吸取少量上层水溶液,移入另一支盛有1mL稀硝酸的试管中,然后加入2滴AgNO3溶液,观察现象。
「实验3-1」
实验现象
①中溶液分层;
②中有机层厚度减小,直至消失;
④中有浅黄色沉淀生成
现象说明溴乙烷与NaOH水溶液共热产生了Br-
3、化学性质
(1)取代反应(水解反应)
反应条件
NaOH水溶液、加热
C2H5—Br + H--OH C2H5—OH + HBr
△
NaOH + HBr == NaBr + H2O
反应原理
水中羟基(-OH)取代卤代烃中卤素原子(-X),生成醇。
CH3CH2—Br + Na—OH CH3CH2—OH + NaBr
H2O
总反应
△
水
X
C
+ H-OH
OH
C
+ H- X
卤代烃都具有以下化学性质
由实验原理思考以下问题:
问题1:该反应条件中NaOH溶液和加热分别起什么作用?
问题2:在实验中加入过量稀硝酸的目的是什么?若直接滴加AgNO3(aq),将会看到什么现象?
NaOH作用: NaOH不断中和水解产生的HBr,从反应平衡角度分析,促进了反应正向进行,提高产率。
加热作用:加热加快反应速率,且水解吸热,加热可使反应正向移动。
稀硝酸作用:①中和过量的NaOH溶液
②检验生成的沉淀是否溶于稀HNO3
若不加稀硝酸,AgNO3会和碱反应生成AgOH,最终转化为Ag2O黑色沉淀,干扰试验现象。
问题3:如何检验卤代烃分子中的卤素原子?
卤代烃中卤素原子的检验:
关键步骤!
「实验探究」
向试管中加入5mL溴乙烷和15mL饱和NaOH乙醇溶液,振荡后加热。将产生的气体先通入盛水的试管,再通入盛有酸性高锰酸钾的试管中,观察现象。
「实验探究」
「实验探究」
向试管中加入5mL溴乙烷和15mL饱和NaOH乙醇溶液,振荡后加热。将产生的气体先通入盛水的试管,再通入盛有酸性高锰酸钾的试管中,观察现象。
实验现象
反应产生的气体经水洗后,使酸性KMnO4溶液褪色
现象说明反应后生成的气体分子中含有碳碳不饱和键
由实验探究思考以下问题:
(1)分析反应产生的气体中可能含有哪些杂质?
水能除去挥发出来的乙醇,乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。
(3)除了酸性高锰酸钾溶液,还可以用什么方法检验生成物,此时还有必要将气体先通入水中吗?
溴水或溴的四氯化碳溶液。不用。乙醇与溴不反应,不会干扰乙烯的检验。
溴乙烷、乙醇、水蒸气
(2)为什么要在气体通入酸性KMnO4溶液前加一个盛有水的试管?
(实验产生的气流 也可能带出溴导致褪色,可设计空白对照实验----将空气通入同浓度同体积的溴的四氯化碳,对比现象)
(2)消去反应
溴乙烷与强碱(如NaOH或KOH)的乙醇溶液共热,溴乙烷可以从分子中脱去HBr,生成乙烯。
CH2—CH2 +NaOH CH2=CH2↑ +NaBr +H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而形成不饱和键(双键或三键)的化合物的反应。。
反应条件
强碱的醇溶液,加热
反应原理
分子中相邻的两个碳原子脱去一个HX分子,HX分子与强碱反应生成盐和水。
结构条件
卤代烃分子中存在 氢原子( -H)
①卤代烃中碳原子数≥2。
②卤素原子所连碳原子( -C)的邻位碳原子( -C)上必须有氢原子( -H) 。
X
C
C
H
△
乙醇
C
C
+ NaX+H2O
+ NaOH
小组讨论并判断下列物质是否能发生消去反应以及下列反应类型是否为消去反应
2-丁烯
CH3—CH—CH2—CH3
Br
CH3—CH=CH—CH3
CH3—CH2—CH=CH2
(主产物)
1-丁烯
消去反应规则
当有多个产物时,以消H少的C原子上的H为主。
预测2-溴丁烷发生消去反应的可能产物。
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
卤代烃的消去反应与取代(水解)反应的比较
(3)加成和加聚反应
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加成聚合反应。
氯乙烯能加成聚合生成聚氯乙烯
四氟乙烯加成聚合生成聚四氟乙烯
聚氯乙烯管道
聚四氟乙烯材料
D
考向一 卤代烃的水解和消去反应
2.为了检验2 溴丁烷中含有溴元素,有以下操作,顺序合理的是( )
①加AgNO3溶液 ②加NaOH水溶液 ③加热
④加蒸馏水 ⑤加稀硝酸至溶液显酸性
A.②①③⑤ B.②④⑤③
C.②③⑤① D.②①⑤③
C
考向二 卤代烃在有机合成中的桥梁作用
1.设计乙烯制备乙二醇的合成路线。
2.设计丙烯制备丙炔的合成路线。
环己烷
取代反应
加成反应
卤代烃的用途与危害
1、卤代烃的用途
常用作制冷剂(氟利昂)、灭火剂(CCl4)、溶剂(CCl4、氯仿)、麻醉剂、合成有机物等
2、卤代烃的危害
含氯、溴的氟代烷可对臭氧层产生破坏作用,形成臭氧空洞,危及地球上的生物。氟利昂(以CCl3F为例)破坏臭氧层的反应过程可表示为
