第一部分 题型11 物质结构与性质(含解析)2024高考化学二轮复习
文档属性
| 名称 | 第一部分 题型11 物质结构与性质(含解析)2024高考化学二轮复习 |  | |
| 格式 | doc | ||
| 文件大小 | 351.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 22:42:40 | ||
图片预览




文档简介
题型11 物质结构与性质
1.“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是( )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgO<CaO
C.硬度:金刚石<碳化硅<硅
D.第一电离能:Cl<P<S
2.(2023·天津河西一模)下列元素及相关物质的性质比较中,正确的是( )
A.酸性:H3PO4>H2SiO3
B.熔点:红磷>单晶硅
C.第一电离能:S>P
D.基态Mn2+的价电子轨道表示式:
3.(2022·辽宁卷)下列符号表征或说法正确的是( )
A.H2S电离:H2S??2H++S2-
B.Na位于元素周期表p区
C.CO空间结构:平面三角形
D.KOH电子式:
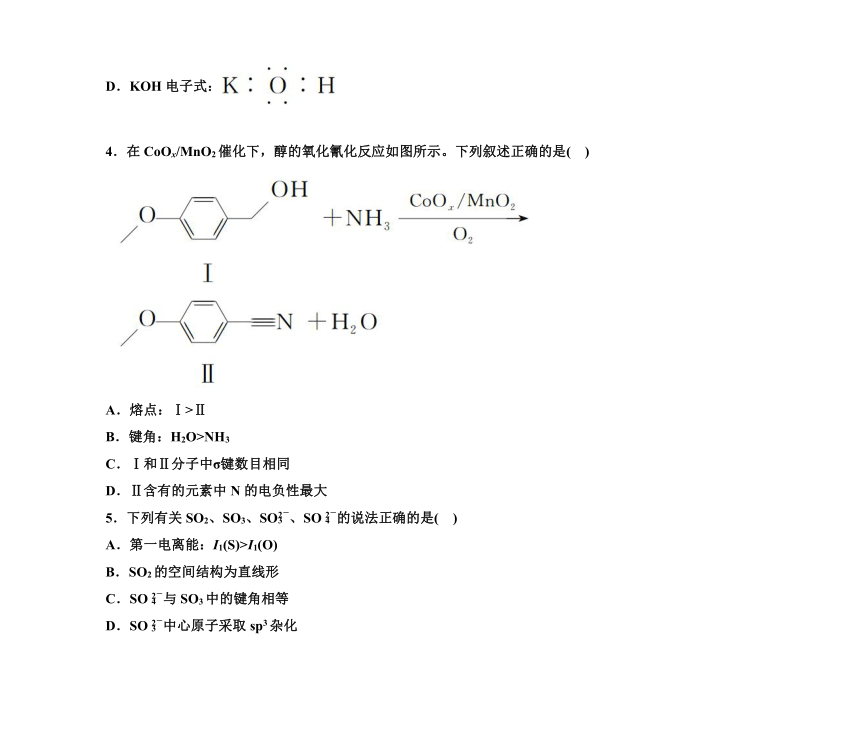
4.在CoOx/MnO2催化下,醇的氧化氰化反应如图所示。下列叙述正确的是( )
A.熔点:Ⅰ>Ⅱ
B.键角:H2O>NH3
C.Ⅰ和Ⅱ分子中σ键数目相同
D.Ⅱ含有的元素中N的电负性最大
5.下列有关SO2、SO3、SO、SO的说法正确的是( )
A.第一电离能:I1(S)>I1(O)
B.SO2的空间结构为直线形
C.SO与SO3中的键角相等
D.SO中心原子采取sp3杂化
6.(2023·北京朝阳高三期末质量检测)NaCl的晶胞结构如图所示。下列说法不正确的是( )
A.NaCl属于离子晶体
B.每个晶胞中平均含有4个Na+和4个Cl-
C.每个Na+周围有6个紧邻的Cl-和6个紧邻的Na+
D.Na+和Cl-间存在较强的离子键,因此NaCl具有较高的熔点
7.硅与碳同主族,是构成地壳的主要元素之一,下列说法正确的是( )
A.单质硅和金刚石中的键能:Si—SiB.CH4和SiH4中C、Si化合价均为-4价
C.SiO2中Si原子的杂化方式为sp
D.碳化硅硬度很大,属于分子晶体
8.(2023·北京丰台一模)硒(34Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如图所示。关于硒及其化合物,下列说法不正确的是( )
A.Se元素在周期表中位于p区
B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:气态SeO39.(2023·江苏南通模拟)下列说法正确的是( )
A.CO(NH2)2的晶体类型为离子晶体
B.氨气的沸点高于甲烷
C.NH3中的键角大于NH中的键角
D.HCO中C的杂化方式是sp3杂化
10.下列有关周期表中ⅥA族元素及其化合物的说法正确的是( )
A.H2S、SO2都是由极性键构成的极性分子
B.SO3与SO中的O—S—O夹角都是120°
C.硒原子基态核外电子排布式为[Ar]4s24p4
D.ⅥA族元素氢化物的沸点从上到下依次增大
11.(2023·江苏苏州高三联考)氮是生命的基础,氮及其化合物在生产、生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列有关NO、NO、NH3、NH的说法正确的是( )
A.NH3的键角大于NH的键角
B.NH3可用作配体是因为N原子存在空轨道
C.NH3的沸点高于PH3,是因为NH3和水分子间可形成氢键
D.NO和NH的空间结构模型相同,NO和NH3的空间结构模型相同
12.(2023·江苏无锡高三联考)NO能被FeSO4溶液吸收生成[Fe(NO)(H2O)5]SO4,减少环境污染,下列说法正确的是( )
A.Fe2+提供孤电子对用于形成配位键
B.该配合物中阴离子的空间结构为三角锥形
C.配离子为[Fe(NO)(H2O)5]2+,中心离子的配位数为6
D.该配合物中所含非金属元素均位于元素周期表的p区
13.NH3是重要的化工原料,可用于某些配合物的制备,如NiSO4溶于氨水形成[Ni(NH3)6]SO4。下列有关[Ni(NH3)6]SO4的说法正确的是( )
A.Ni的核外电子排布式为[Ar]3d64s2
B.1 mol [Ni(NH3)6]2+中σ键的物质的量为18 mol
C.[Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角
D.第ⅤA族元素单质的晶体类型相同
14.(2023·辽宁大连质检)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示,下列说法正确的是( )
A.B原子的杂化方式均为sp2
B.该阴离子中所存在的化学键类型有配位键、极性共价键、氢键
C.硼砂阴离子呈链状结构,则阴离子间以氢键结合
D.1、3原子之间的化学键为配位键
15.下列说法错误的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱与化学键强弱有关
B.三硫化磷(P4S3)分子结构如图:,1 mol P4S3分子中含有9 mol共价键
C.丙烯腈分子中,碳原子的杂化方式有sp3、sp2
D.CO的结构可以表示为,所以CO分子中有一个π键是配位键
16.(2023·湖北武汉模拟)C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:C2O3+H2O===HOOCCOOH。下列说法正确的是( )
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.晶体熔点:草酸>冰>三氧化二碳>干冰
D.CO2、C2O3和HOOCCOOH分子中碳原子的杂化方式均相同
17.(2023·广东佛山高三模拟)钙是构成人体骨骼和牙齿的主要元素之一,下列说法不正确的是( )
A.工业上通过电解法制备Ca
B.CaCO3可用于海水提镁,其阴离子的空间结构为平面三角形
C.钙钛矿晶体中钛离子周围与它最近且距离相等的钛离子个数为8
D.钙钛矿晶胞中氧、钙、钛的粒子个数比为3∶1∶1
题型11 物质结构与性质
1.“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是( A )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgO<CaO
C.硬度:金刚石<碳化硅<硅
D.第一电离能:Cl<P<S
解析 戊醇的烃基比乙醇的大,烃基是憎水基,所以戊醇溶解度比乙醇的小,故A正确;MgO和CaO都是离子晶体,都含有O2-,由于Ca2+的半径大于Mg2+,所以CaO的晶格能小于MgO的晶格能,则熔点:MgO>CaO,故B错误;三者都为共价晶体,原子半径越大,共价键的键能越小,则硬度越小,原子半径:Si>C,即硬度大小顺序是金刚石>碳化硅>硅,故C错误;同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,第一电离能:Cl>P>S,故D错误。
2.(2023·天津河西一模)下列元素及相关物质的性质比较中,正确的是( A )
A.酸性:H3PO4>H2SiO3
B.熔点:红磷>单晶硅
C.第一电离能:S>P
D.基态Mn2+的价电子轨道表示式:
解析 元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:P>Si,所以酸性:H3PO4>H2SiO3,故A正确;晶体硅为共价晶体,红磷为分子晶体,共价晶体的熔点高于分子晶体的,熔点:红磷<单晶硅,故B错误;同周期元素随核电荷数的增大,第一电离能呈增大趋势,但是P的最外层电子排布式为3s23p3,p能级的电子为半满状态,较稳定,第一电离能:S<P,故C错误;Mn2+的价电子排布式为3d5,其价电子轨道表示式为 ,故D错误。
3.(2022·辽宁卷)下列符号表征或说法正确的是( C )
A.H2S电离:H2S??2H++S2-
B.Na位于元素周期表p区
C.CO空间结构:平面三角形
D.KOH电子式:
解析 H2S是二元弱酸,电离分步进行,其一级电离方程式为H2S??H++HS-,A错误;基态Na原子的价电子排布式是3s1,最后一个电子填充在s能级,位于元素周期表s区,B错误;CO中心碳原子的价层电子对数为3+×(4+2-3×2)=3,不含孤电子对,故其空间结构为平面三角形,C正确;KOH是离子化合物,电子式为,D错误。
4.在CoOx/MnO2催化下,醇的氧化氰化反应如图所示。下列叙述正确的是( A )
A.熔点:Ⅰ>Ⅱ
B.键角:H2O>NH3
C.Ⅰ和Ⅱ分子中σ键数目相同
D.Ⅱ含有的元素中N的电负性最大
解析 物质Ⅰ中含有羟基,分子之间含有氢键,熔点较高,A正确;H2O分子中有2对孤电子对,NH3只有1对孤电子对,孤电子对与成键电子对的排斥力大于成键电子对之间的排斥力,所以键角:H2O5.下列有关SO2、SO3、SO、SO的说法正确的是( D )
A.第一电离能:I1(S)>I1(O)
B.SO2的空间结构为直线形
C.SO与SO3中的键角相等
D.SO中心原子采取sp3杂化
解析 同一主族元素从上到下,第一电离能逐渐减小,第一电离能:I1(S)6.(2023·北京朝阳高三期末质量检测)NaCl的晶胞结构如图所示。下列说法不正确的是( C )
A.NaCl属于离子晶体
B.每个晶胞中平均含有4个Na+和4个Cl-
C.每个Na+周围有6个紧邻的Cl-和6个紧邻的Na+
D.Na+和Cl-间存在较强的离子键,因此NaCl具有较高的熔点
解析 每个Na+周围有6个紧邻的Cl-和12个紧邻的Na+,C错误。
7.硅与碳同主族,是构成地壳的主要元素之一,下列说法正确的是( A )
A.单质硅和金刚石中的键能:Si—SiB.CH4和SiH4中C、Si化合价均为-4价
C.SiO2中Si原子的杂化方式为sp
D.碳化硅硬度很大,属于分子晶体
解析 原子半径:Si>C,键长:Si—Si>C—C,则键能:Si—Si<C—C,故A正确;H的电负性大于Si,SiH4中Si的化合价为+4价,故B错误;SiO2中Si的价层电子对数为4,原子的杂化方式为sp3杂化,故C错误;碳化硅的硬度很大,属于共价晶体,故D错误。
8.(2023·北京丰台一模)硒(34Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如图所示。关于硒及其化合物,下列说法不正确的是( D )
A.Se元素在周期表中位于p区
B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:气态SeO3解析 Se元素在周期表的位置是第四周期ⅥA族,价层电子排布式为4s24p4,位于p区,A正确;乙烷硒啉分子中,苯环上的C原子为sp2杂化,中“”处的C原子为sp3杂化,B正确;乙烷硒啉分子中有5种不同化学环境的氢原子,如,C正确;SeO3中硒原子的价层电子对数为3,孤电子对数为 0,分子的空间结构为平面三角形,键角为 120°,SeO中硒原子的价层电子对数为4,孤电子对数为1,离子的空间结构为三角锥形,键角小于120°,键角大小:气态SeO3>SeO,D错误。
9.(2023·江苏南通模拟)下列说法正确的是( B )
A.CO(NH2)2的晶体类型为离子晶体
B.氨气的沸点高于甲烷
C.NH3中的键角大于NH中的键角
D.HCO中C的杂化方式是sp3杂化
解析 CO(NH2)2由分子构成,属于分子晶体,故A错误;氨气分子间存在氢键,而甲烷分子间不存在氢键,因此氨气的沸点高于甲烷,故B正确;NH3、NH的中心原子N原子均采用sp3杂化,氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,孤电子对间排斥力>孤电子对和成键电子对之间的排斥力>成键电子对之间的排斥力,因此键角:NH>NH3,故C错误;HCO中C原子的价层电子对数为3,采用sp2杂化,故D错误。
10.下列有关周期表中ⅥA族元素及其化合物的说法正确的是( A )
A.H2S、SO2都是由极性键构成的极性分子
B.SO3与SO中的O—S—O夹角都是120°
C.硒原子基态核外电子排布式为[Ar]4s24p4
D.ⅥA族元素氢化物的沸点从上到下依次增大
解析 由价层电子对互斥模型可知,硫化氢、二氧化硫的空间结构都是结构不对称的V形,两者都是由极性键构成的极性分子,故A正确;由价层电子对互斥模型可知,三氧化硫的空间结构是平面三角形,亚硫酸根离子的空间结构是三角锥形,则亚硫酸根离子中O—S—O夹角不是120°,故B错误;硒元素的原子序数为34,基态原子核外电子排布式为[Ar]3d104s24p4,故C错误;ⅥA族元素氢化物中,水分子间能形成分子间氢键,分子间作用力大,所以水的沸点高于H2S,故D错误。
11.(2023·江苏苏州高三联考)氮是生命的基础,氮及其化合物在生产、生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列有关NO、NO、NH3、NH的说法正确的是( A )
A.NH3的键角大于NH的键角
B.NH3可用作配体是因为N原子存在空轨道
C.NH3的沸点高于PH3,是因为NH3和水分子间可形成氢键
D.NO和NH的空间结构模型相同,NO和NH3的空间结构模型相同
解析 NH3的孤电子对数为×(5-3×1)=1,NH的孤电子对数为×(5+1-2×1)=2,孤电子对数越多,键角越小,NH3的键角大于NH的键角,故A正确。NH3可用作配体是因为N原子存在孤电子对,故B错误。NH3分子之间存在氢键,NH3的沸点高于PH3,故C错误。NO的价层电子对数为2+×(5+1-2×2)=3,为V形结构,NH的价层电子对数为2+×(5+1-2×1)=4,为V形结构,NO和NH的空间结构模型相同;NO的价层电子对数为3+×(5+1-3×2)=3,为平面三角形结构,NH3为三角锥形结构,NO和NH3的空间结构模型不相同,故D错误。
12.(2023·江苏无锡高三联考)NO能被FeSO4溶液吸收生成[Fe(NO)(H2O)5]SO4,减少环境污染,下列说法正确的是( C )
A.Fe2+提供孤电子对用于形成配位键
B.该配合物中阴离子的空间结构为三角锥形
C.配离子为[Fe(NO)(H2O)5]2+,中心离子的配位数为6
D.该配合物中所含非金属元素均位于元素周期表的p区
解析 配合物中亚铁离子提供空轨道用于形成配位键,故A错误;配合物的阴离子为硫酸根离子,硫酸根离子中硫原子的价层电子对数为4、孤电子对数为0,则离子的空间结构为正四面体形,故B错误;配离子中亚铁离子为中心离子,一氧化氮、水分子为配体,配位数为6,故C正确;配合物中含有的氢元素位于元素周期表的s区,故D错误。
13.NH3是重要的化工原料,可用于某些配合物的制备,如NiSO4溶于氨水形成[Ni(NH3)6]SO4。下列有关[Ni(NH3)6]SO4的说法正确的是( C )
A.Ni的核外电子排布式为[Ar]3d64s2
B.1 mol [Ni(NH3)6]2+中σ键的物质的量为18 mol
C.[Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角
D.第ⅤA族元素单质的晶体类型相同
解析 Ni是28号元素,根据构造原理可知,其核外电子排布式为[Ar]3d84s2,A错误;1个[Ni(NH3)6]2+中 含有6个N→Ni配位键,配位键属于σ 键,1个配位体NH3中含有3个N—H共价键,共价键属于σ 键,则1个[Ni(NH3)6]2+中含有σ 键3×6+6=24个,所以1 mol [Ni(NH3)6]2+中 σ 键的物质的量为24 mol,B错误;NH3中N原子上含有一对孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,而[Ni(NH3)6]2+中N原子与Ni2+形成了配位键,所以[Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角,C正确;第ⅤA族元素单质的晶体类型不一定相同,如N2是分子晶体,而Sb是金属晶体,D错误。
14.(2023·辽宁大连质检)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示,下列说法正确的是( C )
A.B原子的杂化方式均为sp2
B.该阴离子中所存在的化学键类型有配位键、极性共价键、氢键
C.硼砂阴离子呈链状结构,则阴离子间以氢键结合
D.1、3原子之间的化学键为配位键
解析 形成4个B—O键的B原子杂化方式均为sp3,形成3个B—O键的B原子杂化方式均为sp2,故A错误;氢键不是化学键,故B错误;硼砂阴离子中含有O—H键,可以形成氢键,硼砂阴离子呈链状结构,阴离子间以氢键结合,故C正确;B原子一般形成3个共价键,1号B原子形成4个共价键,1、2原子之间的化学键为配位键,故D错误。
15.下列说法错误的是( C )
A.HF、HCl、HBr、HI的热稳定性依次减弱与化学键强弱有关
B.三硫化磷(P4S3)分子结构如图:,1 mol P4S3分子中含有9 mol共价键
C.丙烯腈分子中,碳原子的杂化方式有sp3、sp2
D.CO的结构可以表示为,所以CO分子中有一个π键是配位键
解析 键能:H—F>H—Cl>H—Br>H—I,其热稳定性:HF>HCl>HBr>HI,A项正确;由题图可知,1个P4S3分子中有6个P—S、3个P—P共价键,则1 mol P4S3分子中含有9 mol共价键,B项正确;由丙烯腈的结构可知,碳原子的杂化方式有sp、sp2,C项错误。
16.(2023·湖北武汉模拟)C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:C2O3+H2O===HOOCCOOH。下列说法正确的是( C )
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.晶体熔点:草酸>冰>三氧化二碳>干冰
D.CO2、C2O3和HOOCCOOH分子中碳原子的杂化方式均相同
解析 同系物是结构相似,分子组成上相差一个或若干个CH2原子团的化合物,甲酸(HCOOH)与草酸(HOOCCOOH)不符合要求,不互为同系物,A错误;由题图可知,C2O3正、负电中心不重合,是极性分子,B错误;草酸、冰、三氧化二碳、干冰均是分子晶体,草酸分子间和H2O分子间均能形成氢键,熔点会更高,草酸形成的氢键数目更多,熔点在四者中最大,CO2相对分子质量比C2O3小,熔点也低于C2O3,所以四者熔点大小为草酸>冰>三氧化二碳>干冰,C正确;CO2中碳原子的杂化方式为sp杂化,C2O3中碳原子的杂化方式为sp2杂化,HOOCCOOH分子中碳原子的杂化方式为sp2杂化,杂化方式不完全相同,D错误。
17.(2023·广东佛山高三模拟)钙是构成人体骨骼和牙齿的主要元素之一,下列说法不正确的是( C )
A.工业上通过电解法制备Ca
B.CaCO3可用于海水提镁,其阴离子的空间结构为平面三角形
C.钙钛矿晶体中钛离子周围与它最近且距离相等的钛离子个数为8
D.钙钛矿晶胞中氧、钙、钛的粒子个数比为3∶1∶1
解析 金属钙化学性质非常活泼,用电解熔融氯化钙的方法制备,A正确;CaCO3高温分解可得到氧化钙,CaO溶于水生成Ca(OH)2,Ca(OH)2可用于海水提镁,CO的空间结构是平面三角形,B正确;钙钛矿晶体中钛离子处于顶角位置,周围与它最近且距离相等的钛离子个数为6,C错误;晶胞中氧离子位于棱上,钙离子位于体心,钛离子位于顶角,根据“均摊法”可知,钙钛矿晶胞中氧、钙、钛的粒子个数分别为12×=3、1、8×=1,D正确。
1.“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是( )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgO<CaO
C.硬度:金刚石<碳化硅<硅
D.第一电离能:Cl<P<S
2.(2023·天津河西一模)下列元素及相关物质的性质比较中,正确的是( )
A.酸性:H3PO4>H2SiO3
B.熔点:红磷>单晶硅
C.第一电离能:S>P
D.基态Mn2+的价电子轨道表示式:
3.(2022·辽宁卷)下列符号表征或说法正确的是( )
A.H2S电离:H2S??2H++S2-
B.Na位于元素周期表p区
C.CO空间结构:平面三角形
D.KOH电子式:
4.在CoOx/MnO2催化下,醇的氧化氰化反应如图所示。下列叙述正确的是( )
A.熔点:Ⅰ>Ⅱ
B.键角:H2O>NH3
C.Ⅰ和Ⅱ分子中σ键数目相同
D.Ⅱ含有的元素中N的电负性最大
5.下列有关SO2、SO3、SO、SO的说法正确的是( )
A.第一电离能:I1(S)>I1(O)
B.SO2的空间结构为直线形
C.SO与SO3中的键角相等
D.SO中心原子采取sp3杂化
6.(2023·北京朝阳高三期末质量检测)NaCl的晶胞结构如图所示。下列说法不正确的是( )
A.NaCl属于离子晶体
B.每个晶胞中平均含有4个Na+和4个Cl-
C.每个Na+周围有6个紧邻的Cl-和6个紧邻的Na+
D.Na+和Cl-间存在较强的离子键,因此NaCl具有较高的熔点
7.硅与碳同主族,是构成地壳的主要元素之一,下列说法正确的是( )
A.单质硅和金刚石中的键能:Si—Si
C.SiO2中Si原子的杂化方式为sp
D.碳化硅硬度很大,属于分子晶体
8.(2023·北京丰台一模)硒(34Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如图所示。关于硒及其化合物,下列说法不正确的是( )
A.Se元素在周期表中位于p区
B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:气态SeO3
A.CO(NH2)2的晶体类型为离子晶体
B.氨气的沸点高于甲烷
C.NH3中的键角大于NH中的键角
D.HCO中C的杂化方式是sp3杂化
10.下列有关周期表中ⅥA族元素及其化合物的说法正确的是( )
A.H2S、SO2都是由极性键构成的极性分子
B.SO3与SO中的O—S—O夹角都是120°
C.硒原子基态核外电子排布式为[Ar]4s24p4
D.ⅥA族元素氢化物的沸点从上到下依次增大
11.(2023·江苏苏州高三联考)氮是生命的基础,氮及其化合物在生产、生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列有关NO、NO、NH3、NH的说法正确的是( )
A.NH3的键角大于NH的键角
B.NH3可用作配体是因为N原子存在空轨道
C.NH3的沸点高于PH3,是因为NH3和水分子间可形成氢键
D.NO和NH的空间结构模型相同,NO和NH3的空间结构模型相同
12.(2023·江苏无锡高三联考)NO能被FeSO4溶液吸收生成[Fe(NO)(H2O)5]SO4,减少环境污染,下列说法正确的是( )
A.Fe2+提供孤电子对用于形成配位键
B.该配合物中阴离子的空间结构为三角锥形
C.配离子为[Fe(NO)(H2O)5]2+,中心离子的配位数为6
D.该配合物中所含非金属元素均位于元素周期表的p区
13.NH3是重要的化工原料,可用于某些配合物的制备,如NiSO4溶于氨水形成[Ni(NH3)6]SO4。下列有关[Ni(NH3)6]SO4的说法正确的是( )
A.Ni的核外电子排布式为[Ar]3d64s2
B.1 mol [Ni(NH3)6]2+中σ键的物质的量为18 mol
C.[Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角
D.第ⅤA族元素单质的晶体类型相同
14.(2023·辽宁大连质检)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示,下列说法正确的是( )
A.B原子的杂化方式均为sp2
B.该阴离子中所存在的化学键类型有配位键、极性共价键、氢键
C.硼砂阴离子呈链状结构,则阴离子间以氢键结合
D.1、3原子之间的化学键为配位键
15.下列说法错误的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱与化学键强弱有关
B.三硫化磷(P4S3)分子结构如图:,1 mol P4S3分子中含有9 mol共价键
C.丙烯腈分子中,碳原子的杂化方式有sp3、sp2
D.CO的结构可以表示为,所以CO分子中有一个π键是配位键
16.(2023·湖北武汉模拟)C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:C2O3+H2O===HOOCCOOH。下列说法正确的是( )
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.晶体熔点:草酸>冰>三氧化二碳>干冰
D.CO2、C2O3和HOOCCOOH分子中碳原子的杂化方式均相同
17.(2023·广东佛山高三模拟)钙是构成人体骨骼和牙齿的主要元素之一,下列说法不正确的是( )
A.工业上通过电解法制备Ca
B.CaCO3可用于海水提镁,其阴离子的空间结构为平面三角形
C.钙钛矿晶体中钛离子周围与它最近且距离相等的钛离子个数为8
D.钙钛矿晶胞中氧、钙、钛的粒子个数比为3∶1∶1
题型11 物质结构与性质
1.“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是( A )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgO<CaO
C.硬度:金刚石<碳化硅<硅
D.第一电离能:Cl<P<S
解析 戊醇的烃基比乙醇的大,烃基是憎水基,所以戊醇溶解度比乙醇的小,故A正确;MgO和CaO都是离子晶体,都含有O2-,由于Ca2+的半径大于Mg2+,所以CaO的晶格能小于MgO的晶格能,则熔点:MgO>CaO,故B错误;三者都为共价晶体,原子半径越大,共价键的键能越小,则硬度越小,原子半径:Si>C,即硬度大小顺序是金刚石>碳化硅>硅,故C错误;同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,第一电离能:Cl>P>S,故D错误。
2.(2023·天津河西一模)下列元素及相关物质的性质比较中,正确的是( A )
A.酸性:H3PO4>H2SiO3
B.熔点:红磷>单晶硅
C.第一电离能:S>P
D.基态Mn2+的价电子轨道表示式:
解析 元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:P>Si,所以酸性:H3PO4>H2SiO3,故A正确;晶体硅为共价晶体,红磷为分子晶体,共价晶体的熔点高于分子晶体的,熔点:红磷<单晶硅,故B错误;同周期元素随核电荷数的增大,第一电离能呈增大趋势,但是P的最外层电子排布式为3s23p3,p能级的电子为半满状态,较稳定,第一电离能:S<P,故C错误;Mn2+的价电子排布式为3d5,其价电子轨道表示式为 ,故D错误。
3.(2022·辽宁卷)下列符号表征或说法正确的是( C )
A.H2S电离:H2S??2H++S2-
B.Na位于元素周期表p区
C.CO空间结构:平面三角形
D.KOH电子式:
解析 H2S是二元弱酸,电离分步进行,其一级电离方程式为H2S??H++HS-,A错误;基态Na原子的价电子排布式是3s1,最后一个电子填充在s能级,位于元素周期表s区,B错误;CO中心碳原子的价层电子对数为3+×(4+2-3×2)=3,不含孤电子对,故其空间结构为平面三角形,C正确;KOH是离子化合物,电子式为,D错误。
4.在CoOx/MnO2催化下,醇的氧化氰化反应如图所示。下列叙述正确的是( A )
A.熔点:Ⅰ>Ⅱ
B.键角:H2O>NH3
C.Ⅰ和Ⅱ分子中σ键数目相同
D.Ⅱ含有的元素中N的电负性最大
解析 物质Ⅰ中含有羟基,分子之间含有氢键,熔点较高,A正确;H2O分子中有2对孤电子对,NH3只有1对孤电子对,孤电子对与成键电子对的排斥力大于成键电子对之间的排斥力,所以键角:H2O
A.第一电离能:I1(S)>I1(O)
B.SO2的空间结构为直线形
C.SO与SO3中的键角相等
D.SO中心原子采取sp3杂化
解析 同一主族元素从上到下,第一电离能逐渐减小,第一电离能:I1(S)
A.NaCl属于离子晶体
B.每个晶胞中平均含有4个Na+和4个Cl-
C.每个Na+周围有6个紧邻的Cl-和6个紧邻的Na+
D.Na+和Cl-间存在较强的离子键,因此NaCl具有较高的熔点
解析 每个Na+周围有6个紧邻的Cl-和12个紧邻的Na+,C错误。
7.硅与碳同主族,是构成地壳的主要元素之一,下列说法正确的是( A )
A.单质硅和金刚石中的键能:Si—Si
C.SiO2中Si原子的杂化方式为sp
D.碳化硅硬度很大,属于分子晶体
解析 原子半径:Si>C,键长:Si—Si>C—C,则键能:Si—Si<C—C,故A正确;H的电负性大于Si,SiH4中Si的化合价为+4价,故B错误;SiO2中Si的价层电子对数为4,原子的杂化方式为sp3杂化,故C错误;碳化硅的硬度很大,属于共价晶体,故D错误。
8.(2023·北京丰台一模)硒(34Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如图所示。关于硒及其化合物,下列说法不正确的是( D )
A.Se元素在周期表中位于p区
B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:气态SeO3
9.(2023·江苏南通模拟)下列说法正确的是( B )
A.CO(NH2)2的晶体类型为离子晶体
B.氨气的沸点高于甲烷
C.NH3中的键角大于NH中的键角
D.HCO中C的杂化方式是sp3杂化
解析 CO(NH2)2由分子构成,属于分子晶体,故A错误;氨气分子间存在氢键,而甲烷分子间不存在氢键,因此氨气的沸点高于甲烷,故B正确;NH3、NH的中心原子N原子均采用sp3杂化,氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,孤电子对间排斥力>孤电子对和成键电子对之间的排斥力>成键电子对之间的排斥力,因此键角:NH>NH3,故C错误;HCO中C原子的价层电子对数为3,采用sp2杂化,故D错误。
10.下列有关周期表中ⅥA族元素及其化合物的说法正确的是( A )
A.H2S、SO2都是由极性键构成的极性分子
B.SO3与SO中的O—S—O夹角都是120°
C.硒原子基态核外电子排布式为[Ar]4s24p4
D.ⅥA族元素氢化物的沸点从上到下依次增大
解析 由价层电子对互斥模型可知,硫化氢、二氧化硫的空间结构都是结构不对称的V形,两者都是由极性键构成的极性分子,故A正确;由价层电子对互斥模型可知,三氧化硫的空间结构是平面三角形,亚硫酸根离子的空间结构是三角锥形,则亚硫酸根离子中O—S—O夹角不是120°,故B错误;硒元素的原子序数为34,基态原子核外电子排布式为[Ar]3d104s24p4,故C错误;ⅥA族元素氢化物中,水分子间能形成分子间氢键,分子间作用力大,所以水的沸点高于H2S,故D错误。
11.(2023·江苏苏州高三联考)氮是生命的基础,氮及其化合物在生产、生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列有关NO、NO、NH3、NH的说法正确的是( A )
A.NH3的键角大于NH的键角
B.NH3可用作配体是因为N原子存在空轨道
C.NH3的沸点高于PH3,是因为NH3和水分子间可形成氢键
D.NO和NH的空间结构模型相同,NO和NH3的空间结构模型相同
解析 NH3的孤电子对数为×(5-3×1)=1,NH的孤电子对数为×(5+1-2×1)=2,孤电子对数越多,键角越小,NH3的键角大于NH的键角,故A正确。NH3可用作配体是因为N原子存在孤电子对,故B错误。NH3分子之间存在氢键,NH3的沸点高于PH3,故C错误。NO的价层电子对数为2+×(5+1-2×2)=3,为V形结构,NH的价层电子对数为2+×(5+1-2×1)=4,为V形结构,NO和NH的空间结构模型相同;NO的价层电子对数为3+×(5+1-3×2)=3,为平面三角形结构,NH3为三角锥形结构,NO和NH3的空间结构模型不相同,故D错误。
12.(2023·江苏无锡高三联考)NO能被FeSO4溶液吸收生成[Fe(NO)(H2O)5]SO4,减少环境污染,下列说法正确的是( C )
A.Fe2+提供孤电子对用于形成配位键
B.该配合物中阴离子的空间结构为三角锥形
C.配离子为[Fe(NO)(H2O)5]2+,中心离子的配位数为6
D.该配合物中所含非金属元素均位于元素周期表的p区
解析 配合物中亚铁离子提供空轨道用于形成配位键,故A错误;配合物的阴离子为硫酸根离子,硫酸根离子中硫原子的价层电子对数为4、孤电子对数为0,则离子的空间结构为正四面体形,故B错误;配离子中亚铁离子为中心离子,一氧化氮、水分子为配体,配位数为6,故C正确;配合物中含有的氢元素位于元素周期表的s区,故D错误。
13.NH3是重要的化工原料,可用于某些配合物的制备,如NiSO4溶于氨水形成[Ni(NH3)6]SO4。下列有关[Ni(NH3)6]SO4的说法正确的是( C )
A.Ni的核外电子排布式为[Ar]3d64s2
B.1 mol [Ni(NH3)6]2+中σ键的物质的量为18 mol
C.[Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角
D.第ⅤA族元素单质的晶体类型相同
解析 Ni是28号元素,根据构造原理可知,其核外电子排布式为[Ar]3d84s2,A错误;1个[Ni(NH3)6]2+中 含有6个N→Ni配位键,配位键属于σ 键,1个配位体NH3中含有3个N—H共价键,共价键属于σ 键,则1个[Ni(NH3)6]2+中含有σ 键3×6+6=24个,所以1 mol [Ni(NH3)6]2+中 σ 键的物质的量为24 mol,B错误;NH3中N原子上含有一对孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,而[Ni(NH3)6]2+中N原子与Ni2+形成了配位键,所以[Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角,C正确;第ⅤA族元素单质的晶体类型不一定相同,如N2是分子晶体,而Sb是金属晶体,D错误。
14.(2023·辽宁大连质检)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示,下列说法正确的是( C )
A.B原子的杂化方式均为sp2
B.该阴离子中所存在的化学键类型有配位键、极性共价键、氢键
C.硼砂阴离子呈链状结构,则阴离子间以氢键结合
D.1、3原子之间的化学键为配位键
解析 形成4个B—O键的B原子杂化方式均为sp3,形成3个B—O键的B原子杂化方式均为sp2,故A错误;氢键不是化学键,故B错误;硼砂阴离子中含有O—H键,可以形成氢键,硼砂阴离子呈链状结构,阴离子间以氢键结合,故C正确;B原子一般形成3个共价键,1号B原子形成4个共价键,1、2原子之间的化学键为配位键,故D错误。
15.下列说法错误的是( C )
A.HF、HCl、HBr、HI的热稳定性依次减弱与化学键强弱有关
B.三硫化磷(P4S3)分子结构如图:,1 mol P4S3分子中含有9 mol共价键
C.丙烯腈分子中,碳原子的杂化方式有sp3、sp2
D.CO的结构可以表示为,所以CO分子中有一个π键是配位键
解析 键能:H—F>H—Cl>H—Br>H—I,其热稳定性:HF>HCl>HBr>HI,A项正确;由题图可知,1个P4S3分子中有6个P—S、3个P—P共价键,则1 mol P4S3分子中含有9 mol共价键,B项正确;由丙烯腈的结构可知,碳原子的杂化方式有sp、sp2,C项错误。
16.(2023·湖北武汉模拟)C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:C2O3+H2O===HOOCCOOH。下列说法正确的是( C )
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.晶体熔点:草酸>冰>三氧化二碳>干冰
D.CO2、C2O3和HOOCCOOH分子中碳原子的杂化方式均相同
解析 同系物是结构相似,分子组成上相差一个或若干个CH2原子团的化合物,甲酸(HCOOH)与草酸(HOOCCOOH)不符合要求,不互为同系物,A错误;由题图可知,C2O3正、负电中心不重合,是极性分子,B错误;草酸、冰、三氧化二碳、干冰均是分子晶体,草酸分子间和H2O分子间均能形成氢键,熔点会更高,草酸形成的氢键数目更多,熔点在四者中最大,CO2相对分子质量比C2O3小,熔点也低于C2O3,所以四者熔点大小为草酸>冰>三氧化二碳>干冰,C正确;CO2中碳原子的杂化方式为sp杂化,C2O3中碳原子的杂化方式为sp2杂化,HOOCCOOH分子中碳原子的杂化方式为sp2杂化,杂化方式不完全相同,D错误。
17.(2023·广东佛山高三模拟)钙是构成人体骨骼和牙齿的主要元素之一,下列说法不正确的是( C )
A.工业上通过电解法制备Ca
B.CaCO3可用于海水提镁,其阴离子的空间结构为平面三角形
C.钙钛矿晶体中钛离子周围与它最近且距离相等的钛离子个数为8
D.钙钛矿晶胞中氧、钙、钛的粒子个数比为3∶1∶1
解析 金属钙化学性质非常活泼,用电解熔融氯化钙的方法制备,A正确;CaCO3高温分解可得到氧化钙,CaO溶于水生成Ca(OH)2,Ca(OH)2可用于海水提镁,CO的空间结构是平面三角形,B正确;钙钛矿晶体中钛离子处于顶角位置,周围与它最近且距离相等的钛离子个数为6,C错误;晶胞中氧离子位于棱上,钙离子位于体心,钛离子位于顶角,根据“均摊法”可知,钙钛矿晶胞中氧、钙、钛的粒子个数分别为12×=3、1、8×=1,D正确。
同课章节目录
