第一部分 题型14 反应热及相关计算(含解析)2024高考化学二轮复习
文档属性
| 名称 | 第一部分 题型14 反应热及相关计算(含解析)2024高考化学二轮复习 | 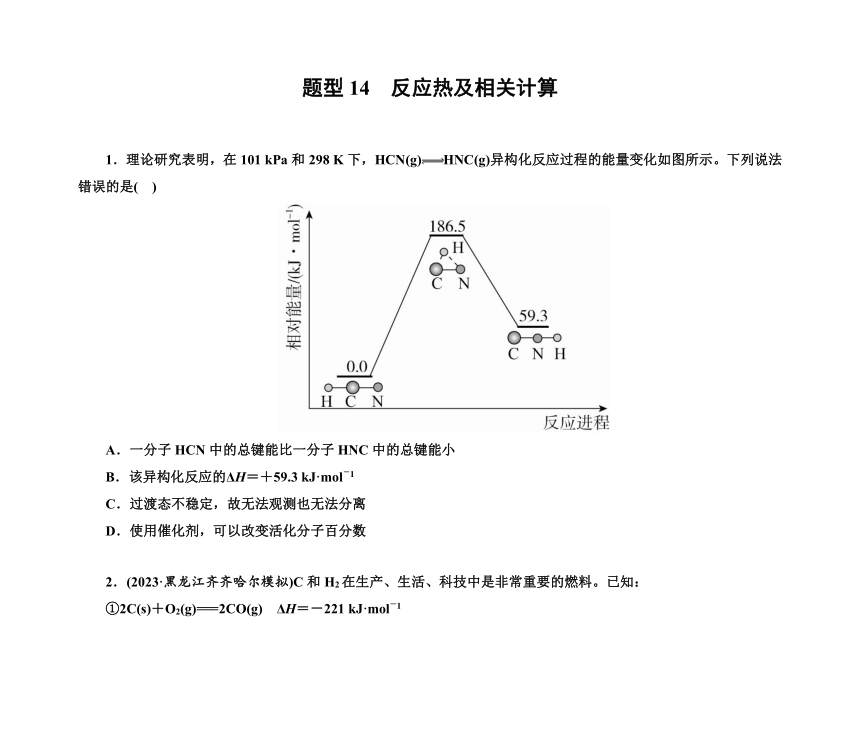 | |
| 格式 | doc | ||
| 文件大小 | 794.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 22:58:19 | ||
图片预览




文档简介
题型14 反应热及相关计算
1.理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是( )
A.一分子HCN中的总键能比一分子HNC中的总键能小
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.过渡态不稳定,故无法观测也无法分离
D.使用催化剂,可以改变活化分子百分数
2.(2023·黑龙江齐齐哈尔模拟)C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②H2O(g)
下列推断正确的是( )
A.C(s)的燃烧热为110.5 kJ·mol-1
B.H2(g)+O2(g)===H2O(g) ΔH=+241 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g) ΔH=+130.5 kJ·mol-1
D.由②可知该反应中,反应物化学键中储存的总能量比产物化学键中储存的总能量高
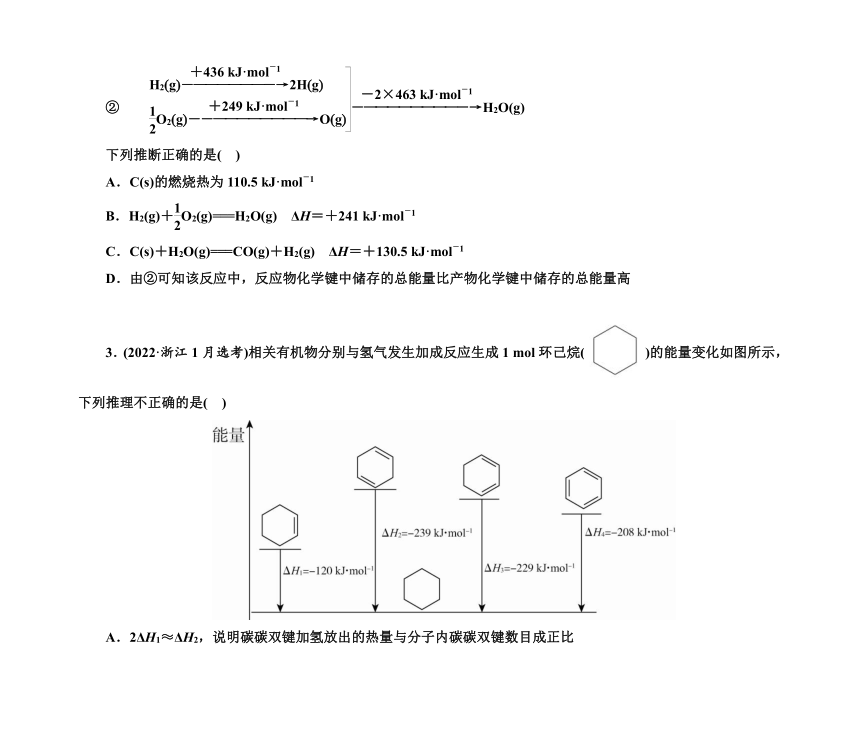
3.(2022·浙江1月选考)相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示,下列推理不正确的是( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
4.(2023·湖南永州统考)C(s)与O2(g)生成CO2(g)的反应可以一步完成,也可以分两步完成,各步反应之间的关系如图所示。下列说法不正确的是( )
A.CO的燃烧热ΔH=-283.0 kJ·mol-1
B.ΔH=-110.5 kJ·mol-1
C.1 mol金刚石与石墨完全燃烧放出的热量均为393.5 kJ
D.根据上图推出C(s)+CO2(g)===2CO(g) ΔH=+172.5 kJ·mol-1
5.根据图中各物质间的能量循环图,下列说法错误的是( )
A.ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8
B.ΔH3>0,ΔH7<0,ΔH8<0
C.ΔH2+ΔH3>ΔH4+ΔH8
D.将图中的“Cl”改为“Br”,则溴的ΔH3大于氯的ΔH3
6.(2023·辽宁鞍山质检)已知A转化为C和D分步进行:①A(g)B(g)+2D(g);②B(g)C(g)+D(g),其反应过程的能量变化如图所示。下列说法正确的是( )
A.1 mol A(g)的能量低于1 mol B(g)的能量
B.B(g)C(g)+D(g) ΔH=(Ea4-Ea3) kJ/mol
C.断裂1 mol A(g)化学键吸收的热量小于形成1 mol C(g)和3 mol D(g)化学键所放出的热量
D.反应过程中,由于Ea3<Ea1,反应②速率大于反应①,气体B很难大量积累
7.已知几种物质之间的能量关系如图所示,下列说法中不正确的是( )
A.使用合适的催化剂,不能减小反应的焓变
8.(2023·河北秦皇岛模拟)CH3CH===CH2与HCl可发生反应①和②:
①CH3CH===CH2+HCl―→CH3CH2CH2Cl
②CH3CH===CH2+HCl―→CH3CHClCH3
其能量与反应进程如图所示。下列说法不正确的是 ( )
A.①②的反应类型相同
B.反应②比①放出的热量多
C.CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
D.第Ⅰ步是化学键断裂的过程,第Ⅱ步是化学键生成的过程
9.根据下列能量变化示意图,说法不正确的是( )
A.破坏相同质量的NO2(g)和N2O4(g)中的化学键,后者所需的能量较高
B.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
C.2H2O(g)===2H2(g)+O2 (g) ΔH6<-ΔH5
D.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
10.(2023·北京西城模拟)甲烷与氯气发生取代反应分别生成1 mol相关有机物的能量变化如图所示:
已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,下列说法不正确的是( )
A.1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ
B.CH4与Cl2的取代反应是放热反应
C.ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应,难易程度相当
D.CH4(g)+Cl·(g)―→CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1
题型14 反应热及相关计算
1.理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是( A )
A.一分子HCN中的总键能比一分子HNC中的总键能小
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.过渡态不稳定,故无法观测也无法分离
D.使用催化剂,可以改变活化分子百分数
解析 根据图中信息得到HCN转化为HNC为吸热反应,1 mol HCN断键吸收的能量大于1 mol HNC成键放出的能量,故一分子HCN中的总键能比一分子HNC中的总键能大,故A错误。根据焓变等于生成物总能量减去反应物总能量可知,该反应的ΔH=59.3 kJ·mol-1-0 kJ·mol-1=+59.3 kJ·mol-1,故B正确。过渡态是指反应物体系转变成产物体系过程中,经过的能量最高状态,过渡态键的状况是旧键未完全断裂,新键未完全形成,过渡态是不稳定的,不能分离出来也不能观测,故C正确。使用催化剂,可以降低反应的活化能,部分普通分子转化为活化分子,由此可见,使用催化剂可改变活化分子百分数,故D正确。
2.(2023·黑龙江齐齐哈尔模拟)C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②H2O(g)
下列推断正确的是( C )
A.C(s)的燃烧热为110.5 kJ·mol-1
B.H2(g)+O2(g)===H2O(g) ΔH=+241 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g) ΔH=+130.5 kJ·mol-1
D.由②可知该反应中,反应物化学键中储存的总能量比产物化学键中储存的总能量高
解析 C(s)的燃烧热是101 kPa下,1 mol C(s)完全燃烧生成CO2(g)时放出的热量,根据题中信息无法计算,A错误;由②可知反应:H2(g)+O2(g)===H2O(g)的ΔH=(+436+249-2×463) kJ·mol-1=-241 kJ·mol-1,B错误;根据B项分析可知,H2(g)+O2(g)===H2O(g) ΔH=-241 kJ·mol-1,目标方程式的反应热ΔH=×(-221 kJ·mol-1)-(-241 kJ·mol-1)=+130.5 kJ·mol-1,C正确;由B项分析可知,该反应为放热反应,故反应物化学键中储存的总能量比产物化学键中储存的总能量低,D错误。
3.(2022·浙江1月选考)相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示,下列推理不正确的是( A )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
解析 2ΔH1<ΔH3,说明碳碳双键加氢放出的热量与分子内碳碳双键数目不一定成正比,故A错误;ΔH2<ΔH3,即单双键交替的物质能量低,更稳定,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定,故B正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,故C正确;ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子较单双键交替的结构稳定,具有特殊稳定性,故D正确。
4.(2023·湖南永州统考)C(s)与O2(g)生成CO2(g)的反应可以一步完成,也可以分两步完成,各步反应之间的关系如图所示。下列说法不正确的是( C )
A.CO的燃烧热ΔH=-283.0 kJ·mol-1
B.ΔH=-110.5 kJ·mol-1
C.1 mol金刚石与石墨完全燃烧放出的热量均为393.5 kJ
D.根据上图推出C(s)+CO2(g)===2CO(g) ΔH=+172.5 kJ·mol-1
解析 由题图可知,1 mol一氧化碳完全燃烧生成二氧化碳,反应的焓变为-283.0 kJ·mol-1,则一氧化碳的燃烧热ΔH=-283.0 kJ·mol-1,故A正确;由盖斯定律可知,碳与氧气反应生成一氧化碳的焓变ΔH=(-393.5 kJ·mol-1)-(-283.0 kJ·mol-1)=-110.5 kJ·mol-1,故B正确;金刚石与石墨的能量不同,所以1 mol金刚石与石墨完全燃烧放出的热量不可能均为393.5 kJ,故C错误;由题图可知,碳与氧气反应生成二氧化碳的焓变ΔH=-393.5 kJ·mol-1,由以上分析可知,碳与氧气反应生成一氧化碳的焓变ΔH=-110.5 kJ·mol-1,碳与二氧化碳反应生成一氧化碳的焓变ΔH=(-110.5 kJ·mol-1)×2-(-393.5 kJ·mol-1)=+172.5 kJ·mol-1,则碳与二氧化碳反应生成一氧化碳的热化学方程式为C(s)+CO2(g)===2CO(g) ΔH=+172.5 kJ·mol-1,故D正确。
5.根据图中各物质间的能量循环图,下列说法错误的是( D )
A.ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8
B.ΔH3>0,ΔH7<0,ΔH8<0
C.ΔH2+ΔH3>ΔH4+ΔH8
D.将图中的“Cl”改为“Br”,则溴的ΔH3大于氯的ΔH3
解析 根据盖斯定律可知,ΔH1=ΔH2+ΔH3+ΔH4+ΔH8或ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8,A正确;断裂共价键需要吸收能量,即ΔH3>0,钠离子与氯离子结合形成氯化钠为放热过程,即ΔH7<0,物质从气态到固态放热,即ΔH8<0,B正确;因为ΔH2>0,ΔH3>0,ΔH4<0,ΔH8<0,所以ΔH2+ΔH3>ΔH4+ΔH8,C正确;Cl2 (g)分子的键能大于Br2 (g)分子的键能,故溴的ΔH3小于氯的ΔH3,D错误。
6.(2023·辽宁鞍山质检)已知A转化为C和D分步进行:①A(g)B(g)+2D(g);②B(g)C(g)+D(g),其反应过程的能量变化如图所示。下列说法正确的是( D )
A.1 mol A(g)的能量低于1 mol B(g)的能量
B.B(g)C(g)+D(g) ΔH=(Ea4-Ea3) kJ/mol
C.断裂1 mol A(g)化学键吸收的热量小于形成1 mol C(g)和3 mol D(g)化学键所放出的热量
D.反应过程中,由于Ea3<Ea1,反应②速率大于反应①,气体B很难大量积累
解析 由题图可知,1 mol A(g)的能量低于1 mol B(g)和2 mol D(g)的总能量,不能比较1 mol A(g)的能量和1 mol B(g)的能量大小,A项错误;从图中反应前后能量变化可知,反应物总能量低于生成物总能量,B(g)C(g)+D(g)为吸热反应,ΔH>0,故ΔH=(Ea3-Ea4) kJ/mol,B项错误;由题图可知,A转化为C和D为吸热反应,断裂1 mol A(g)化学键吸收的热量应大于形成1 mol C(g)和3 mol D(g)化学键所放出的热量,C项错误;从反应过程的图像中可知,Ea3<Ea1,活化能越低,反应速率越快,故反应②速率大于反应①,气体B很难大量积累,D项正确。
7.已知几种物质之间的能量关系如图所示,下列说法中不正确的是( B )
A.使用合适的催化剂,不能减小反应的焓变
8.(2023·河北秦皇岛模拟)CH3CH===CH2与HCl可发生反应①和②:
①CH3CH===CH2+HCl―→CH3CH2CH2Cl
②CH3CH===CH2+HCl―→CH3CHClCH3
其能量与反应进程如图所示。下列说法不正确的是 ( D )
A.①②的反应类型相同
B.反应②比①放出的热量多
C.CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
D.第Ⅰ步是化学键断裂的过程,第Ⅱ步是化学键生成的过程
解析 A项,反应①②均是加成反应,正确;B项,根据能量关系图可知,反应②生成物能量更低,故反应放热更多,正确;C项,两个反应的产物分子式相同,结构不同,二者互为同分异构体,正确;D项,第Ⅰ步是反应物反应生成中间产物,第Ⅱ步是中间产物再反应生成最终产物,两步中均有完整的断键吸热和成键放热的过程,错误。
9.根据下列能量变化示意图,说法不正确的是( B )
A.破坏相同质量的NO2(g)和N2O4(g)中的化学键,后者所需的能量较高
B.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
C.2H2O(g)===2H2(g)+O2 (g) ΔH6<-ΔH5
D.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
解析 A项,ΔH3<0,即1 mol NO2(g)转化为 mol N2O4(g)的反应为放热反应,所以破坏1 mol NO2(g)分子中的化学键所吸收的能量比形成 mol N2O4(g)分子中的化学键所放出的热量少,所以破坏相同质量的NO2(g)和N2O4(g)中的化学键,后者所需的能量较高,正确;B项,N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,ΔH=ΔH4+ΔH3,因为ΔH3<0,故ΔH4>ΔH,错误;C项,ΔH5为生成2 mol液态水的反应热,则2 mol液态水分解吸收的热量为-ΔH5,而C项中是2 mol气态水分解,水由液态变为气态吸收热量,所以ΔH6<-ΔH5,正确;D项,由盖斯定律可知,ΔH5=ΔH1+ΔH2+ΔH3+ΔH4,正确。
10.(2023·北京西城模拟)甲烷与氯气发生取代反应分别生成1 mol相关有机物的能量变化如图所示:
已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,下列说法不正确的是( A )
A.1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ
B.CH4与Cl2的取代反应是放热反应
C.ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应,难易程度相当
D.CH4(g)+Cl·(g)―→CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1
解析 由题图可知,甲烷和氯气反应生成CH2Cl2(g)的同时还会生成氯化氢,故不能说明1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ,A错误;由题图可知,焓变均为负值,则为放热反应,B正确;ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应每取代1个氢原子的难易程度相当,C正确;CH4(g)+Cl·(g)―→CH3·(g)+HCl(g)反应中,断裂了1 mol C—H键,形成了1 mol H—Cl键,已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,则CH4(g)+Cl2(g)―→CH3Cl(g)+HCl(g)的焓变为ΔH1=4×E(C—H)+E(Cl—Cl)-3×E(C—H)-E(C—Cl)-E(H—Cl)=-99 kJ·mol-1,即E(C—H)+243 kJ· mol-1-327 kJ·mol-1-E(H—Cl)=-99 kJ·mol-1,E(C—H)-E(H—Cl)=ΔH=-15 kJ·mol-1,D正确。
1.理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是( )
A.一分子HCN中的总键能比一分子HNC中的总键能小
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.过渡态不稳定,故无法观测也无法分离
D.使用催化剂,可以改变活化分子百分数
2.(2023·黑龙江齐齐哈尔模拟)C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②H2O(g)
下列推断正确的是( )
A.C(s)的燃烧热为110.5 kJ·mol-1
B.H2(g)+O2(g)===H2O(g) ΔH=+241 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g) ΔH=+130.5 kJ·mol-1
D.由②可知该反应中,反应物化学键中储存的总能量比产物化学键中储存的总能量高
3.(2022·浙江1月选考)相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示,下列推理不正确的是( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
4.(2023·湖南永州统考)C(s)与O2(g)生成CO2(g)的反应可以一步完成,也可以分两步完成,各步反应之间的关系如图所示。下列说法不正确的是( )
A.CO的燃烧热ΔH=-283.0 kJ·mol-1
B.ΔH=-110.5 kJ·mol-1
C.1 mol金刚石与石墨完全燃烧放出的热量均为393.5 kJ
D.根据上图推出C(s)+CO2(g)===2CO(g) ΔH=+172.5 kJ·mol-1
5.根据图中各物质间的能量循环图,下列说法错误的是( )
A.ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8
B.ΔH3>0,ΔH7<0,ΔH8<0
C.ΔH2+ΔH3>ΔH4+ΔH8
D.将图中的“Cl”改为“Br”,则溴的ΔH3大于氯的ΔH3
6.(2023·辽宁鞍山质检)已知A转化为C和D分步进行:①A(g)B(g)+2D(g);②B(g)C(g)+D(g),其反应过程的能量变化如图所示。下列说法正确的是( )
A.1 mol A(g)的能量低于1 mol B(g)的能量
B.B(g)C(g)+D(g) ΔH=(Ea4-Ea3) kJ/mol
C.断裂1 mol A(g)化学键吸收的热量小于形成1 mol C(g)和3 mol D(g)化学键所放出的热量
D.反应过程中,由于Ea3<Ea1,反应②速率大于反应①,气体B很难大量积累
7.已知几种物质之间的能量关系如图所示,下列说法中不正确的是( )
A.使用合适的催化剂,不能减小反应的焓变
8.(2023·河北秦皇岛模拟)CH3CH===CH2与HCl可发生反应①和②:
①CH3CH===CH2+HCl―→CH3CH2CH2Cl
②CH3CH===CH2+HCl―→CH3CHClCH3
其能量与反应进程如图所示。下列说法不正确的是 ( )
A.①②的反应类型相同
B.反应②比①放出的热量多
C.CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
D.第Ⅰ步是化学键断裂的过程,第Ⅱ步是化学键生成的过程
9.根据下列能量变化示意图,说法不正确的是( )
A.破坏相同质量的NO2(g)和N2O4(g)中的化学键,后者所需的能量较高
B.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
C.2H2O(g)===2H2(g)+O2 (g) ΔH6<-ΔH5
D.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
10.(2023·北京西城模拟)甲烷与氯气发生取代反应分别生成1 mol相关有机物的能量变化如图所示:
已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,下列说法不正确的是( )
A.1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ
B.CH4与Cl2的取代反应是放热反应
C.ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应,难易程度相当
D.CH4(g)+Cl·(g)―→CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1
题型14 反应热及相关计算
1.理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是( A )
A.一分子HCN中的总键能比一分子HNC中的总键能小
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.过渡态不稳定,故无法观测也无法分离
D.使用催化剂,可以改变活化分子百分数
解析 根据图中信息得到HCN转化为HNC为吸热反应,1 mol HCN断键吸收的能量大于1 mol HNC成键放出的能量,故一分子HCN中的总键能比一分子HNC中的总键能大,故A错误。根据焓变等于生成物总能量减去反应物总能量可知,该反应的ΔH=59.3 kJ·mol-1-0 kJ·mol-1=+59.3 kJ·mol-1,故B正确。过渡态是指反应物体系转变成产物体系过程中,经过的能量最高状态,过渡态键的状况是旧键未完全断裂,新键未完全形成,过渡态是不稳定的,不能分离出来也不能观测,故C正确。使用催化剂,可以降低反应的活化能,部分普通分子转化为活化分子,由此可见,使用催化剂可改变活化分子百分数,故D正确。
2.(2023·黑龙江齐齐哈尔模拟)C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②H2O(g)
下列推断正确的是( C )
A.C(s)的燃烧热为110.5 kJ·mol-1
B.H2(g)+O2(g)===H2O(g) ΔH=+241 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g) ΔH=+130.5 kJ·mol-1
D.由②可知该反应中,反应物化学键中储存的总能量比产物化学键中储存的总能量高
解析 C(s)的燃烧热是101 kPa下,1 mol C(s)完全燃烧生成CO2(g)时放出的热量,根据题中信息无法计算,A错误;由②可知反应:H2(g)+O2(g)===H2O(g)的ΔH=(+436+249-2×463) kJ·mol-1=-241 kJ·mol-1,B错误;根据B项分析可知,H2(g)+O2(g)===H2O(g) ΔH=-241 kJ·mol-1,目标方程式的反应热ΔH=×(-221 kJ·mol-1)-(-241 kJ·mol-1)=+130.5 kJ·mol-1,C正确;由B项分析可知,该反应为放热反应,故反应物化学键中储存的总能量比产物化学键中储存的总能量低,D错误。
3.(2022·浙江1月选考)相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示,下列推理不正确的是( A )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
解析 2ΔH1<ΔH3,说明碳碳双键加氢放出的热量与分子内碳碳双键数目不一定成正比,故A错误;ΔH2<ΔH3,即单双键交替的物质能量低,更稳定,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定,故B正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,故C正确;ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子较单双键交替的结构稳定,具有特殊稳定性,故D正确。
4.(2023·湖南永州统考)C(s)与O2(g)生成CO2(g)的反应可以一步完成,也可以分两步完成,各步反应之间的关系如图所示。下列说法不正确的是( C )
A.CO的燃烧热ΔH=-283.0 kJ·mol-1
B.ΔH=-110.5 kJ·mol-1
C.1 mol金刚石与石墨完全燃烧放出的热量均为393.5 kJ
D.根据上图推出C(s)+CO2(g)===2CO(g) ΔH=+172.5 kJ·mol-1
解析 由题图可知,1 mol一氧化碳完全燃烧生成二氧化碳,反应的焓变为-283.0 kJ·mol-1,则一氧化碳的燃烧热ΔH=-283.0 kJ·mol-1,故A正确;由盖斯定律可知,碳与氧气反应生成一氧化碳的焓变ΔH=(-393.5 kJ·mol-1)-(-283.0 kJ·mol-1)=-110.5 kJ·mol-1,故B正确;金刚石与石墨的能量不同,所以1 mol金刚石与石墨完全燃烧放出的热量不可能均为393.5 kJ,故C错误;由题图可知,碳与氧气反应生成二氧化碳的焓变ΔH=-393.5 kJ·mol-1,由以上分析可知,碳与氧气反应生成一氧化碳的焓变ΔH=-110.5 kJ·mol-1,碳与二氧化碳反应生成一氧化碳的焓变ΔH=(-110.5 kJ·mol-1)×2-(-393.5 kJ·mol-1)=+172.5 kJ·mol-1,则碳与二氧化碳反应生成一氧化碳的热化学方程式为C(s)+CO2(g)===2CO(g) ΔH=+172.5 kJ·mol-1,故D正确。
5.根据图中各物质间的能量循环图,下列说法错误的是( D )
A.ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8
B.ΔH3>0,ΔH7<0,ΔH8<0
C.ΔH2+ΔH3>ΔH4+ΔH8
D.将图中的“Cl”改为“Br”,则溴的ΔH3大于氯的ΔH3
解析 根据盖斯定律可知,ΔH1=ΔH2+ΔH3+ΔH4+ΔH8或ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8,A正确;断裂共价键需要吸收能量,即ΔH3>0,钠离子与氯离子结合形成氯化钠为放热过程,即ΔH7<0,物质从气态到固态放热,即ΔH8<0,B正确;因为ΔH2>0,ΔH3>0,ΔH4<0,ΔH8<0,所以ΔH2+ΔH3>ΔH4+ΔH8,C正确;Cl2 (g)分子的键能大于Br2 (g)分子的键能,故溴的ΔH3小于氯的ΔH3,D错误。
6.(2023·辽宁鞍山质检)已知A转化为C和D分步进行:①A(g)B(g)+2D(g);②B(g)C(g)+D(g),其反应过程的能量变化如图所示。下列说法正确的是( D )
A.1 mol A(g)的能量低于1 mol B(g)的能量
B.B(g)C(g)+D(g) ΔH=(Ea4-Ea3) kJ/mol
C.断裂1 mol A(g)化学键吸收的热量小于形成1 mol C(g)和3 mol D(g)化学键所放出的热量
D.反应过程中,由于Ea3<Ea1,反应②速率大于反应①,气体B很难大量积累
解析 由题图可知,1 mol A(g)的能量低于1 mol B(g)和2 mol D(g)的总能量,不能比较1 mol A(g)的能量和1 mol B(g)的能量大小,A项错误;从图中反应前后能量变化可知,反应物总能量低于生成物总能量,B(g)C(g)+D(g)为吸热反应,ΔH>0,故ΔH=(Ea3-Ea4) kJ/mol,B项错误;由题图可知,A转化为C和D为吸热反应,断裂1 mol A(g)化学键吸收的热量应大于形成1 mol C(g)和3 mol D(g)化学键所放出的热量,C项错误;从反应过程的图像中可知,Ea3<Ea1,活化能越低,反应速率越快,故反应②速率大于反应①,气体B很难大量积累,D项正确。
7.已知几种物质之间的能量关系如图所示,下列说法中不正确的是( B )
A.使用合适的催化剂,不能减小反应的焓变
8.(2023·河北秦皇岛模拟)CH3CH===CH2与HCl可发生反应①和②:
①CH3CH===CH2+HCl―→CH3CH2CH2Cl
②CH3CH===CH2+HCl―→CH3CHClCH3
其能量与反应进程如图所示。下列说法不正确的是 ( D )
A.①②的反应类型相同
B.反应②比①放出的热量多
C.CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
D.第Ⅰ步是化学键断裂的过程,第Ⅱ步是化学键生成的过程
解析 A项,反应①②均是加成反应,正确;B项,根据能量关系图可知,反应②生成物能量更低,故反应放热更多,正确;C项,两个反应的产物分子式相同,结构不同,二者互为同分异构体,正确;D项,第Ⅰ步是反应物反应生成中间产物,第Ⅱ步是中间产物再反应生成最终产物,两步中均有完整的断键吸热和成键放热的过程,错误。
9.根据下列能量变化示意图,说法不正确的是( B )
A.破坏相同质量的NO2(g)和N2O4(g)中的化学键,后者所需的能量较高
B.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
C.2H2O(g)===2H2(g)+O2 (g) ΔH6<-ΔH5
D.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
解析 A项,ΔH3<0,即1 mol NO2(g)转化为 mol N2O4(g)的反应为放热反应,所以破坏1 mol NO2(g)分子中的化学键所吸收的能量比形成 mol N2O4(g)分子中的化学键所放出的热量少,所以破坏相同质量的NO2(g)和N2O4(g)中的化学键,后者所需的能量较高,正确;B项,N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,ΔH=ΔH4+ΔH3,因为ΔH3<0,故ΔH4>ΔH,错误;C项,ΔH5为生成2 mol液态水的反应热,则2 mol液态水分解吸收的热量为-ΔH5,而C项中是2 mol气态水分解,水由液态变为气态吸收热量,所以ΔH6<-ΔH5,正确;D项,由盖斯定律可知,ΔH5=ΔH1+ΔH2+ΔH3+ΔH4,正确。
10.(2023·北京西城模拟)甲烷与氯气发生取代反应分别生成1 mol相关有机物的能量变化如图所示:
已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,下列说法不正确的是( A )
A.1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ
B.CH4与Cl2的取代反应是放热反应
C.ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应,难易程度相当
D.CH4(g)+Cl·(g)―→CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1
解析 由题图可知,甲烷和氯气反应生成CH2Cl2(g)的同时还会生成氯化氢,故不能说明1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ,A错误;由题图可知,焓变均为负值,则为放热反应,B正确;ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应每取代1个氢原子的难易程度相当,C正确;CH4(g)+Cl·(g)―→CH3·(g)+HCl(g)反应中,断裂了1 mol C—H键,形成了1 mol H—Cl键,已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,则CH4(g)+Cl2(g)―→CH3Cl(g)+HCl(g)的焓变为ΔH1=4×E(C—H)+E(Cl—Cl)-3×E(C—H)-E(C—Cl)-E(H—Cl)=-99 kJ·mol-1,即E(C—H)+243 kJ· mol-1-327 kJ·mol-1-E(H—Cl)=-99 kJ·mol-1,E(C—H)-E(H—Cl)=ΔH=-15 kJ·mol-1,D正确。
同课章节目录
