3.2.1分子晶体课件 (共39张PPT)人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.1分子晶体课件 (共39张PPT)人教版(2019)选择性必修2 | 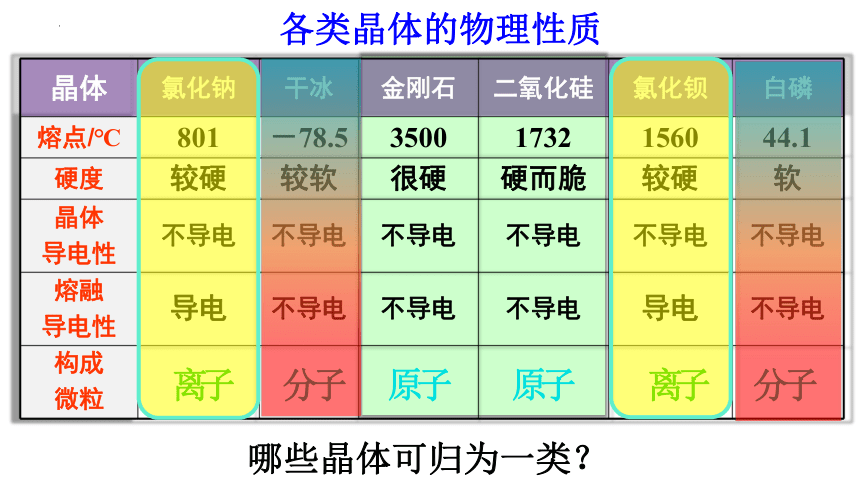 | |
| 格式 | pptx | ||
| 文件大小 | 15.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 23:56:34 | ||
图片预览






文档简介
(共39张PPT)
各类晶体的物理性质
晶体 氯化钠 干冰 金刚石 二氧化硅 氯化钡 白磷
熔点/℃ 801 -78.5 3500 1732 1560 44.1
硬度 较硬 较软 很硬 硬而脆 较硬 软
晶体 导电性 不导电 不导电 不导电 不导电 不导电 不导电
熔融 导电性 导电 不导电 不导电 不导电 导电 不导电
构成 微粒
哪些晶体可归为一类?
组成相似
化学性质相似
干冰 石英
样品
熔点
沸点
干冰、石英的溶沸点咋相差如此之大?
分子晶体与共价晶体
第三章·第二节
第一课时
分子晶体
PART 01
分子晶体
及其结构特点
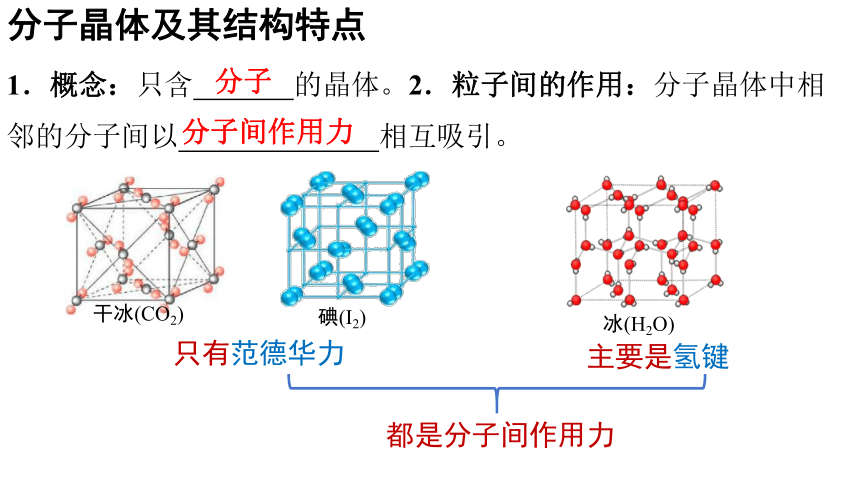
分子晶体及其结构特点
1.概念:只含 的晶体。2.粒子间的作用:分子晶体中相邻的分子间以 相互吸引。
分子
分子间作用力
只有范德华力
主要是氢键
都是分子间作用力
干冰(CO2)
碘(I2)
冰(H2O)
由于分子晶体的构成微粒是分子,所以分子晶体的化学式是分子式哦~
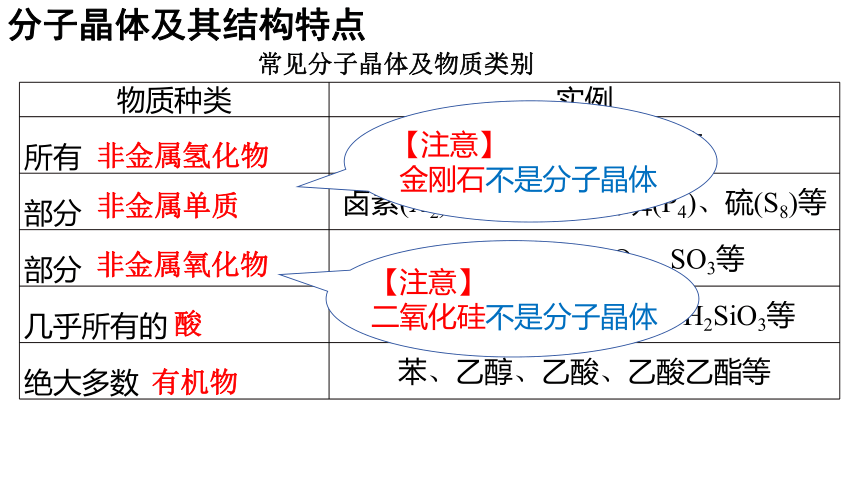
常见分子晶体及物质类别
分子晶体及其结构特点
物质种类 实例
所有 H2O、NH3、CH4等
部分 卤素(X2)、O2、N2、白磷(P4)、硫(S8)等
部分 CO2、P4O10、SO2、SO3等
几乎所有的 HNO3、H2SO4、H3PO4、H2SiO3等
绝大多数 苯、乙醇、乙酸、乙酸乙酯等
非金属氢化物
非金属单质
非金属氧化物
酸
有机物
【注意】
金刚石不是分子晶体
【注意】
二氧化硅不是分子晶体
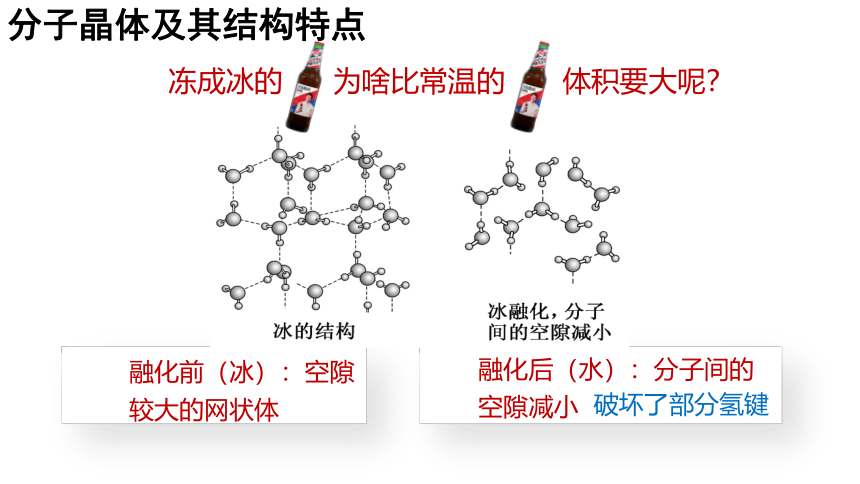
夏天喝冰镇啤酒的时候,如果忘了拿出来,玻璃瓶会炸,这是为啥??
大窑
冻成冰的 为啥比常温的 体积要大呢?
融化前(冰):空隙较大的网状体
融化后(水):分子间的空隙减小
破坏了部分氢键
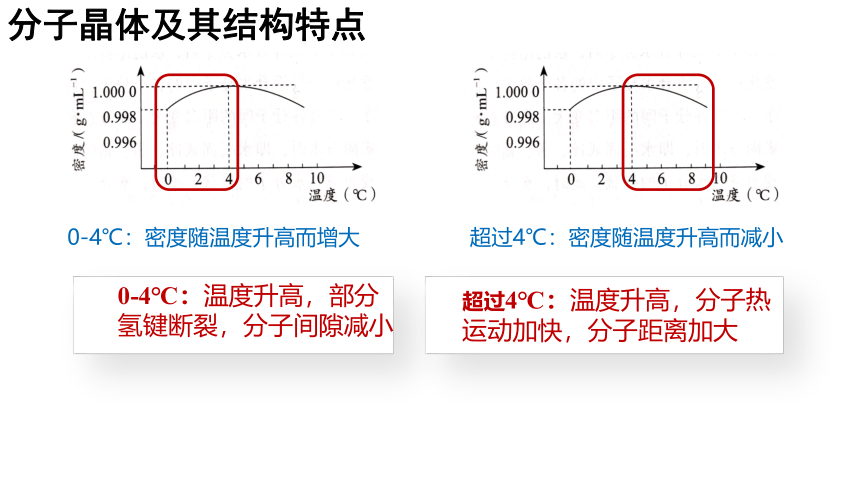
分子晶体及其结构特点
0-4℃:温度升高,部分氢键断裂,分子间隙减小
超过4℃:温度升高,分子热运动加快,分子距离加大
0-4℃:密度随温度升高而增大
超过4℃:密度随温度升高而减小
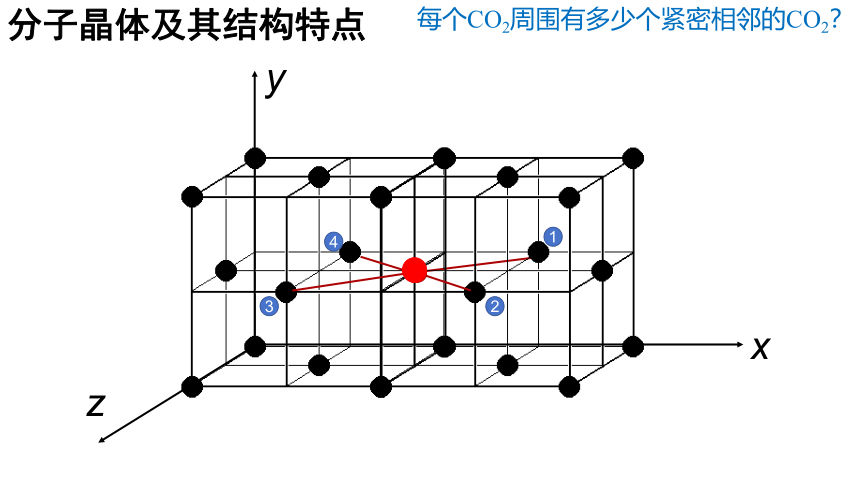
分子晶体及其结构特点
每个CO2周围有多少个紧密相邻的CO2?
1
x
y
z
2
3
4
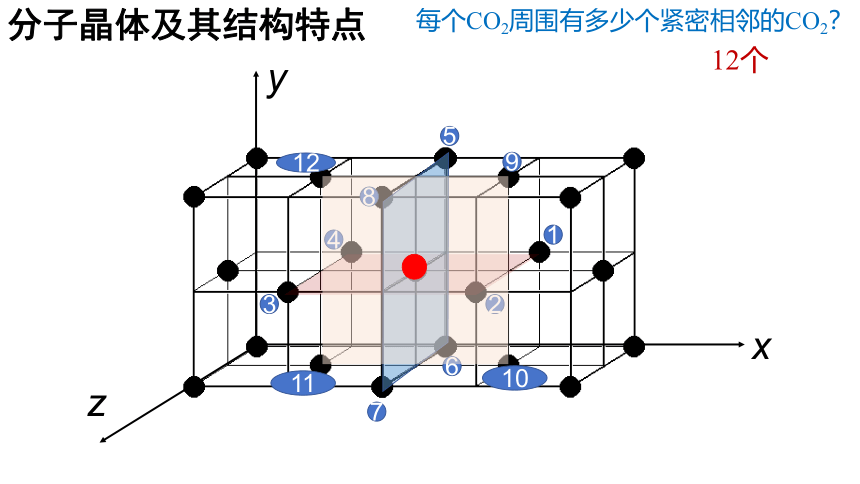
分子晶体及其结构特点
每个CO2周围有多少个紧密相邻的CO2?
x
y
z
1
2
3
4
5
6
7
8
9
10
11
12
12个
分子晶体及其结构特点
分子密堆积
只有范德华力
主要是氢键
分子非密堆积
每个分子周围有12个紧邻的分子
周围紧邻的分子少于12个
分子晶体及其结构特点
分子晶体及其结构特点
分子晶体的常见堆积方式
分子间作用力 堆积方式 实例
范德华力 分子采用 ,每个分子周围有个 紧邻的分子 如C60、干冰、I2、O2
范德华力、 分子不采用 ,每个分子周围紧邻的分子少于12个 如HF、NH3、冰
密堆积
12
氢键
密堆积
看来,喝啤酒,不能冻太久
如果把你炸成小猪头
我会感到很愧疚
yo~
【即学即练1】
1.下列有关分子晶体的说法中一定正确的是( )
A.分子内均存在共价键 B.分子间一定存在范德华力
C.分子间一定存在氢键 D.其结构一定为分子密堆积
√
√
课本79页思考与讨论
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
H2S:分子间只有范德华力,无饱和性与方向性,形成分子密堆积。
冰:分子间存在氢键,具有方向性,形成分子非密堆积。
PART 02
两种典型的分子晶体的组成和结构
冰
(1)水分子之间的主要作用力是 ,当然也存在 。(2) 有方向性,它的存在迫使在 的每个水分子与 方向的 个相邻水分子互相吸引。
氢键
范德华力
氢键
四面体中心
四面体顶角
4
干冰
(1)干冰中的CO2分子间只存在 力,不存在 。
(2)①每个晶胞中有 个CO2分子, 个原子。
②每个CO2分子周围等距离紧邻的CO2分子数为 个。
氢键
范德华
4
12
12
【即学即练2】
1.北京22年冬奥会采用CO2临界直冷技术,实现“水立方”变“冰立方”。干冰晶胞如上图所示。下列说法错误的是
A.冰、干冰晶体类型不同
B.“水立方”变为“冰立方”,密度减小
C.用干冰制冷比用氟利昂制冷环保
D.1个干冰晶胞的质量约为 g
√
【即学即练2】
2.如上图为冰晶体的结构模型,大球代表O原子,小球代表H原子,下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H—O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
√
PART 03
分子晶体的
物理性质
熔点较低
熔化时:一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
分子晶体的物理性质
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
分子晶体的物理性质
硬度小
分子间作用力较弱,容易被克服
本身不导电
构成分子晶体的微粒是分子,没有产生自由移动的离子。
分子晶体的物理性质
你觉得酒精导电嘛?
做个总结
1.物理特性(1)分子晶体的熔、沸点一般 ,密度 ,硬度较小,较易熔化、挥发(升华)。(2)一般是绝缘体,固态和熔融状态一般不导电。(3)溶解性符合“相似相溶规律”。
分子晶体的物理性质
较低
较小
2.分子晶体熔、沸点高低的比较规律(1)分子晶体中分子间作用力 ,物质熔、沸点 ,反之 。(2)具有氢键的分子晶体,熔、沸点 。
分子晶体的物理性质
越大
越低
越高
反常高
分子晶体的物理性质
(1)分子晶体具有较低的熔、沸点和较小的硬度。分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。(2)分子晶体不导电。分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
分子晶体的物理性质
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
如:H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶解度比N2、O2、CH4等非极性分子在水中的溶解度大。苯、CCl4是非极性溶剂,则Br2、I2等非极性分子易溶于其中,而水则不溶于苯和CCl4中。
分子晶体熔、沸点比较规律
(1)少数主要以氢键作用形成的分子晶体,比一般的分子晶体的熔、沸点高,如含有H—F、H—O、H—N等共价键的分子间可以形成氢键,所以HF、H2O、NH3、醇、羧酸等物质的熔、沸点相对较高。
(2)组成与结构相似,分子之间不含氢键而只利用范德华力形成的分子晶体,随着相对分子质量的增大,物质的熔、沸点逐渐升高。例如,常温下Cl2呈气态,Br2呈液态,而I2呈固态;CO2呈气态,CS2呈液态。
分子晶体熔、沸点比较规律
(3)相对分子质量相等或相近的极性分子构成的分子晶体,其熔、沸点一般比非极性分子构成的分子晶体的熔、沸点高,如CO的熔、沸点比N2的熔、沸点高。
(4)有机物中组成和结构相似且不存在氢键的同分异构体,相对分子质量相同,一般支链越多,分子间的相互作用力越弱,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷。
【即学即练3】
1.单质碘的熔、沸点较低,其原因是
A.碘的非金属性较弱
B.碘分子中键能较小
C.固态碘单质中碘分子间以范德华力结合
D.I-I 共价键的键长较长
√
【即学即练3】
2.某化学兴趣小组在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
根据表中数据分析,属于分子晶体的是
√
干冰能让镁持续燃烧吗?
课本80页资料卡片
2Mg+CO2
2MgO + C
现象:
镁粉继续燃烧,发出耀眼的白光,生成白色和黑色的固体
块状的干冰与镁粉接触面积不大,为什么镁粉可以继续燃烧呢?
干冰易升华
课本80页资料卡片
可燃冰
20 世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体,这种晶体的主要成分是甲烷,因而又称甲烷水合物,它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
课本80页科学·技术·社会
天然气在水合物晶体中,装在以氢键相连的几个水分子构成的笼中,因而又称笼状化合物。天然气水合物晶体中的水分子笼也是多种多样的,它们是一类笼状的分子晶体。
课本80页科学·技术·社会
各类晶体的物理性质
晶体 氯化钠 干冰 金刚石 二氧化硅 氯化钡 白磷
熔点/℃ 801 -78.5 3500 1732 1560 44.1
硬度 较硬 较软 很硬 硬而脆 较硬 软
晶体 导电性 不导电 不导电 不导电 不导电 不导电 不导电
熔融 导电性 导电 不导电 不导电 不导电 导电 不导电
构成 微粒
哪些晶体可归为一类?
组成相似
化学性质相似
干冰 石英
样品
熔点
沸点
干冰、石英的溶沸点咋相差如此之大?
分子晶体与共价晶体
第三章·第二节
第一课时
分子晶体
PART 01
分子晶体
及其结构特点
分子晶体及其结构特点
1.概念:只含 的晶体。2.粒子间的作用:分子晶体中相邻的分子间以 相互吸引。
分子
分子间作用力
只有范德华力
主要是氢键
都是分子间作用力
干冰(CO2)
碘(I2)
冰(H2O)
由于分子晶体的构成微粒是分子,所以分子晶体的化学式是分子式哦~
常见分子晶体及物质类别
分子晶体及其结构特点
物质种类 实例
所有 H2O、NH3、CH4等
部分 卤素(X2)、O2、N2、白磷(P4)、硫(S8)等
部分 CO2、P4O10、SO2、SO3等
几乎所有的 HNO3、H2SO4、H3PO4、H2SiO3等
绝大多数 苯、乙醇、乙酸、乙酸乙酯等
非金属氢化物
非金属单质
非金属氧化物
酸
有机物
【注意】
金刚石不是分子晶体
【注意】
二氧化硅不是分子晶体
夏天喝冰镇啤酒的时候,如果忘了拿出来,玻璃瓶会炸,这是为啥??
大窑
冻成冰的 为啥比常温的 体积要大呢?
融化前(冰):空隙较大的网状体
融化后(水):分子间的空隙减小
破坏了部分氢键
分子晶体及其结构特点
0-4℃:温度升高,部分氢键断裂,分子间隙减小
超过4℃:温度升高,分子热运动加快,分子距离加大
0-4℃:密度随温度升高而增大
超过4℃:密度随温度升高而减小
分子晶体及其结构特点
每个CO2周围有多少个紧密相邻的CO2?
1
x
y
z
2
3
4
分子晶体及其结构特点
每个CO2周围有多少个紧密相邻的CO2?
x
y
z
1
2
3
4
5
6
7
8
9
10
11
12
12个
分子晶体及其结构特点
分子密堆积
只有范德华力
主要是氢键
分子非密堆积
每个分子周围有12个紧邻的分子
周围紧邻的分子少于12个
分子晶体及其结构特点
分子晶体及其结构特点
分子晶体的常见堆积方式
分子间作用力 堆积方式 实例
范德华力 分子采用 ,每个分子周围有个 紧邻的分子 如C60、干冰、I2、O2
范德华力、 分子不采用 ,每个分子周围紧邻的分子少于12个 如HF、NH3、冰
密堆积
12
氢键
密堆积
看来,喝啤酒,不能冻太久
如果把你炸成小猪头
我会感到很愧疚
yo~
【即学即练1】
1.下列有关分子晶体的说法中一定正确的是( )
A.分子内均存在共价键 B.分子间一定存在范德华力
C.分子间一定存在氢键 D.其结构一定为分子密堆积
√
√
课本79页思考与讨论
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
H2S:分子间只有范德华力,无饱和性与方向性,形成分子密堆积。
冰:分子间存在氢键,具有方向性,形成分子非密堆积。
PART 02
两种典型的分子晶体的组成和结构
冰
(1)水分子之间的主要作用力是 ,当然也存在 。(2) 有方向性,它的存在迫使在 的每个水分子与 方向的 个相邻水分子互相吸引。
氢键
范德华力
氢键
四面体中心
四面体顶角
4
干冰
(1)干冰中的CO2分子间只存在 力,不存在 。
(2)①每个晶胞中有 个CO2分子, 个原子。
②每个CO2分子周围等距离紧邻的CO2分子数为 个。
氢键
范德华
4
12
12
【即学即练2】
1.北京22年冬奥会采用CO2临界直冷技术,实现“水立方”变“冰立方”。干冰晶胞如上图所示。下列说法错误的是
A.冰、干冰晶体类型不同
B.“水立方”变为“冰立方”,密度减小
C.用干冰制冷比用氟利昂制冷环保
D.1个干冰晶胞的质量约为 g
√
【即学即练2】
2.如上图为冰晶体的结构模型,大球代表O原子,小球代表H原子,下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H—O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
√
PART 03
分子晶体的
物理性质
熔点较低
熔化时:一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
分子晶体的物理性质
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
分子晶体的物理性质
硬度小
分子间作用力较弱,容易被克服
本身不导电
构成分子晶体的微粒是分子,没有产生自由移动的离子。
分子晶体的物理性质
你觉得酒精导电嘛?
做个总结
1.物理特性(1)分子晶体的熔、沸点一般 ,密度 ,硬度较小,较易熔化、挥发(升华)。(2)一般是绝缘体,固态和熔融状态一般不导电。(3)溶解性符合“相似相溶规律”。
分子晶体的物理性质
较低
较小
2.分子晶体熔、沸点高低的比较规律(1)分子晶体中分子间作用力 ,物质熔、沸点 ,反之 。(2)具有氢键的分子晶体,熔、沸点 。
分子晶体的物理性质
越大
越低
越高
反常高
分子晶体的物理性质
(1)分子晶体具有较低的熔、沸点和较小的硬度。分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。(2)分子晶体不导电。分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
分子晶体的物理性质
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
如:H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶解度比N2、O2、CH4等非极性分子在水中的溶解度大。苯、CCl4是非极性溶剂,则Br2、I2等非极性分子易溶于其中,而水则不溶于苯和CCl4中。
分子晶体熔、沸点比较规律
(1)少数主要以氢键作用形成的分子晶体,比一般的分子晶体的熔、沸点高,如含有H—F、H—O、H—N等共价键的分子间可以形成氢键,所以HF、H2O、NH3、醇、羧酸等物质的熔、沸点相对较高。
(2)组成与结构相似,分子之间不含氢键而只利用范德华力形成的分子晶体,随着相对分子质量的增大,物质的熔、沸点逐渐升高。例如,常温下Cl2呈气态,Br2呈液态,而I2呈固态;CO2呈气态,CS2呈液态。
分子晶体熔、沸点比较规律
(3)相对分子质量相等或相近的极性分子构成的分子晶体,其熔、沸点一般比非极性分子构成的分子晶体的熔、沸点高,如CO的熔、沸点比N2的熔、沸点高。
(4)有机物中组成和结构相似且不存在氢键的同分异构体,相对分子质量相同,一般支链越多,分子间的相互作用力越弱,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷。
【即学即练3】
1.单质碘的熔、沸点较低,其原因是
A.碘的非金属性较弱
B.碘分子中键能较小
C.固态碘单质中碘分子间以范德华力结合
D.I-I 共价键的键长较长
√
【即学即练3】
2.某化学兴趣小组在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
根据表中数据分析,属于分子晶体的是
√
干冰能让镁持续燃烧吗?
课本80页资料卡片
2Mg+CO2
2MgO + C
现象:
镁粉继续燃烧,发出耀眼的白光,生成白色和黑色的固体
块状的干冰与镁粉接触面积不大,为什么镁粉可以继续燃烧呢?
干冰易升华
课本80页资料卡片
可燃冰
20 世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体,这种晶体的主要成分是甲烷,因而又称甲烷水合物,它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
课本80页科学·技术·社会
天然气在水合物晶体中,装在以氢键相连的几个水分子构成的笼中,因而又称笼状化合物。天然气水合物晶体中的水分子笼也是多种多样的,它们是一类笼状的分子晶体。
课本80页科学·技术·社会
