化学人教版(2019)选择性必修2 3.4配合物与超分子(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.4配合物与超分子(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 158.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-29 15:19:36 | ||
图片预览










文档简介
(共35张PPT)
第四节 配合物与超分子
第三章 晶体结构与性质
配合物
01
超分子
02
学习目标
能知道常见的配合物制备过程。
能举例说明配合物常见的应用,
如配合物在生物、化学等领域的广泛应用。
了解超分子概念,知道超分子代表物杯酚和冠醚的应用。
配合物
配合物
实验3-2
配合物
实验3-2
固体
溶液颜色
无色离子:
CuSO4
CuCl2 2H2O
CuBr2
NaCl
K2SO4
KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
水溶液中Cu2+主要以水合离子[Cu(H2O)4]2+存在,呈天蓝色
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
配合物
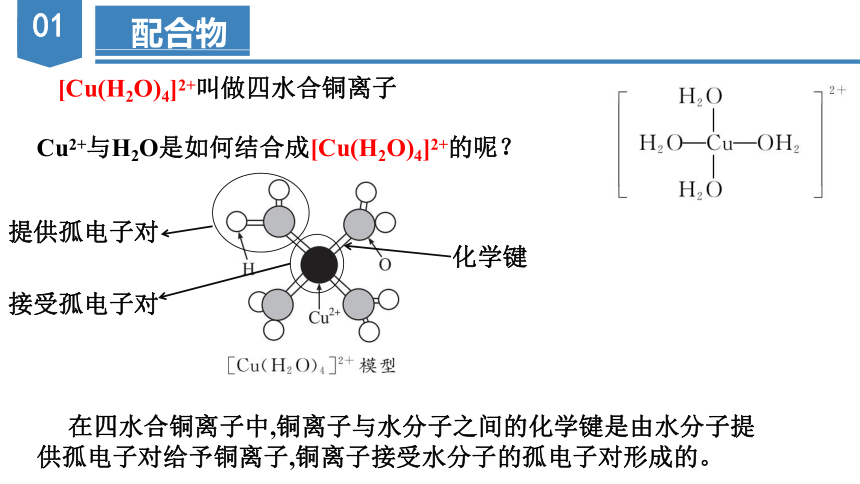
Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢?
[Cu(H2O)4]2+叫做四水合铜离子
在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
化学键
提供孤电子对
接受孤电子对
配合物
1.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。
配合物
如Ag+形成2个配位键;Cu2+形成4个配位键等。
1.配位键
配位键是一种特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的
配合物
2.配位化合物
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
配位化合物一定含有配位键
但含有配位键的化合物不一定是配位化合物
例如:CO、NH4+、H3O+、SO42-、P2O5
配合物
2.配位化合物
中心原子(离子):提供空轨道的金属离子或原子。
一般是过渡金属,必须有空轨道。
配位体:含有孤电子对的分子或离子
NH3 H2O CO Cl- SCN- CN-
配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
配离子的电荷:等于中心离子和配体总电荷的代数和,
如:[Fe(SCN)6]3-
配位原子:配位体中具有孤电子对的原子N O P S,
一般是ⅤA Ⅵ A ⅦA的非金属原子
配合物
3.配位化合物
对于配合物,外界在水溶液中易电离,但内界却难电离。
[Cu(H2O)4]SO4
中心离子
配体
配位数
内界
外界
配合物
课堂检测
0.01mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
配合物
实验3-3
配合物
实验3-3
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
难溶物溶解,得到深蓝色的透明溶液
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
配合物
实验3-4
配合物
实验3-4
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
配合物
实验3-5
配合物
实验3-5
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
配合物
4.配位化合物的性质与应用
配合物具有一定的稳定性,配位键越强,配合物越稳定。许多过渡金属元素的离子对多种配体具有很强对结合力,因而,过渡金属配合物远比主族金属配合物多。
配合物
4.配位化合物的性质与应用
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
超分子
超分子
1.定义
由两种或两种以上的分子通过分子间相互作用形成的
分子聚集体称为超分子
超分子定义中的分子是广义的,包括离子。
粒子间作用力—
非共价键
范德华力 氢键 静电作用等
超分子
2.超分子的实例
(1)分离C60和C70
超分子
超分子
2.超分子的实例
(1)分离C60和C70
C70
C60
超分子
C60
C70
C70
C60
甲苯
过滤
甲苯
超分子
C60
滤液
滤渣
氯仿
滤液
氯仿
滤渣
超分子
2.超分子的实例
冠
醚
是分子中含有多个“氧-亚甲基”-结构单元的大环多醚
皇冠状的分子
超分子
命名方法
12-冠-4
15-冠-5
C 原子:2×5=10 O 原子:5
10 + 5=15
O 原子:5
把环上所含C、O原子的总数标注在“冠”字之前,把其中所含氧原子数标注在“冠”之后。
超分子
冠醚有不同大小的空穴,能与阳离子,尤其是碱金属离子络合,并随环的大小不同而与不同的金属离子络合,利用此性质可以识别碱金属离子。
冠醚的空穴结构对离子有选择作用
超分子
2.超分子的实例
(2)冠醚识别碱金属离子(如K+)。
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152)
Na+(204)
K+(276)
Rb+(304)
Cs+(334)
超分子
3超分子的重要特征
分子识别
自组装
课堂检测
B
1.向盛有硫酸铜溶液的试管中滴加浓氨水,先生成难溶物,继续滴加浓氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.反应后的溶液中Cu2+的浓度增加了D.在配离子[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
课堂检测
A
2.某化合物的分子结构如图所示,其分子内不含有( )
A.离子键 B.非极性键C.极性键 D.配位键
课堂检测
D
3.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是( )①H2O ②NH3 ③F- ④CN- ⑤COA.①② B.①②③C.①②④ D.①②③④⑤
第1课时 配合物与超分子
第四节 配合物与超分子
第三章 晶体结构与性质
配合物
01
超分子
02
学习目标
能知道常见的配合物制备过程。
能举例说明配合物常见的应用,
如配合物在生物、化学等领域的广泛应用。
了解超分子概念,知道超分子代表物杯酚和冠醚的应用。
配合物
配合物
实验3-2
配合物
实验3-2
固体
溶液颜色
无色离子:
CuSO4
CuCl2 2H2O
CuBr2
NaCl
K2SO4
KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
水溶液中Cu2+主要以水合离子[Cu(H2O)4]2+存在,呈天蓝色
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
配合物
Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢?
[Cu(H2O)4]2+叫做四水合铜离子
在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
化学键
提供孤电子对
接受孤电子对
配合物
1.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。
配合物
如Ag+形成2个配位键;Cu2+形成4个配位键等。
1.配位键
配位键是一种特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的
配合物
2.配位化合物
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
配位化合物一定含有配位键
但含有配位键的化合物不一定是配位化合物
例如:CO、NH4+、H3O+、SO42-、P2O5
配合物
2.配位化合物
中心原子(离子):提供空轨道的金属离子或原子。
一般是过渡金属,必须有空轨道。
配位体:含有孤电子对的分子或离子
NH3 H2O CO Cl- SCN- CN-
配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
配离子的电荷:等于中心离子和配体总电荷的代数和,
如:[Fe(SCN)6]3-
配位原子:配位体中具有孤电子对的原子N O P S,
一般是ⅤA Ⅵ A ⅦA的非金属原子
配合物
3.配位化合物
对于配合物,外界在水溶液中易电离,但内界却难电离。
[Cu(H2O)4]SO4
中心离子
配体
配位数
内界
外界
配合物
课堂检测
0.01mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
配合物
实验3-3
配合物
实验3-3
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
难溶物溶解,得到深蓝色的透明溶液
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
配合物
实验3-4
配合物
实验3-4
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
配合物
实验3-5
配合物
实验3-5
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
配合物
4.配位化合物的性质与应用
配合物具有一定的稳定性,配位键越强,配合物越稳定。许多过渡金属元素的离子对多种配体具有很强对结合力,因而,过渡金属配合物远比主族金属配合物多。
配合物
4.配位化合物的性质与应用
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
超分子
超分子
1.定义
由两种或两种以上的分子通过分子间相互作用形成的
分子聚集体称为超分子
超分子定义中的分子是广义的,包括离子。
粒子间作用力—
非共价键
范德华力 氢键 静电作用等
超分子
2.超分子的实例
(1)分离C60和C70
超分子
超分子
2.超分子的实例
(1)分离C60和C70
C70
C60
超分子
C60
C70
C70
C60
甲苯
过滤
甲苯
超分子
C60
滤液
滤渣
氯仿
滤液
氯仿
滤渣
超分子
2.超分子的实例
冠
醚
是分子中含有多个“氧-亚甲基”-结构单元的大环多醚
皇冠状的分子
超分子
命名方法
12-冠-4
15-冠-5
C 原子:2×5=10 O 原子:5
10 + 5=15
O 原子:5
把环上所含C、O原子的总数标注在“冠”字之前,把其中所含氧原子数标注在“冠”之后。
超分子
冠醚有不同大小的空穴,能与阳离子,尤其是碱金属离子络合,并随环的大小不同而与不同的金属离子络合,利用此性质可以识别碱金属离子。
冠醚的空穴结构对离子有选择作用
超分子
2.超分子的实例
(2)冠醚识别碱金属离子(如K+)。
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152)
Na+(204)
K+(276)
Rb+(304)
Cs+(334)
超分子
3超分子的重要特征
分子识别
自组装
课堂检测
B
1.向盛有硫酸铜溶液的试管中滴加浓氨水,先生成难溶物,继续滴加浓氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.反应后的溶液中Cu2+的浓度增加了D.在配离子[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
课堂检测
A
2.某化合物的分子结构如图所示,其分子内不含有( )
A.离子键 B.非极性键C.极性键 D.配位键
课堂检测
D
3.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是( )①H2O ②NH3 ③F- ④CN- ⑤COA.①② B.①②③C.①②④ D.①②③④⑤
第1课时 配合物与超分子
