化学人教版(2019)选择性必修2 3.3金属晶体与离子晶体(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3金属晶体与离子晶体(共24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-29 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第 1-2 课 时
铜电缆
金属晶体
【问题1】金属晶体中的原子是通过什么作用结合在一起的?
铜的晶体结构模型
铜的晶胞模型
电子气理论
在金属晶体中,由于金属元素的电离能较小,金属原子的原子核对其价电子的吸引力较弱,价电子容易脱离原子核的束缚成为自由电子。
金属键:金属阳离子与自由电子之间的强烈的相互作用
金属键无方向性与饱和性
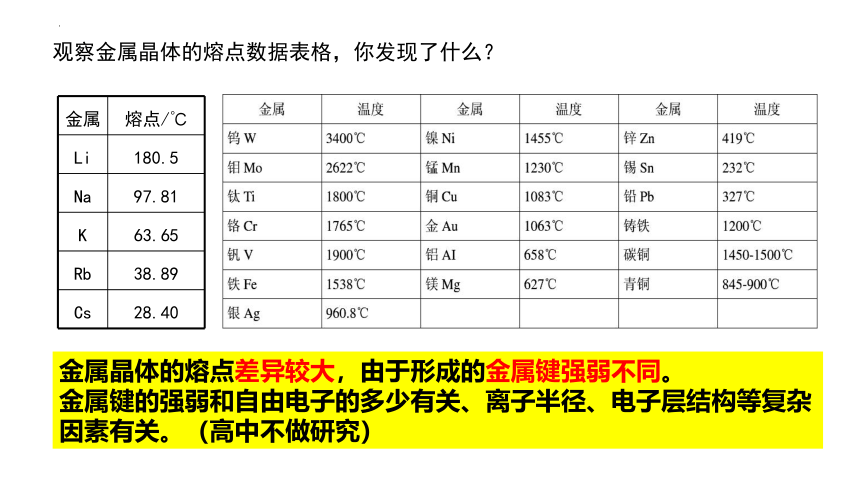
金属晶体的熔点差异较大,由于形成的金属键强弱不同。
金属键的强弱和自由电子的多少有关、离子半径、电子层结构等复杂因素有关。(高中不做研究)
观察金属晶体的熔点数据表格,你发现了什么?
金属 熔点/℃
Li 180.5
Na 97.81
K 63.65
Rb 38.89
Cs 28.40
铜电缆
铁锅
【问题2】金属晶体具有哪些性质?能否用电子气理论解释?
金箔玫瑰花
导热性
导电性
延展性
(1)电子气理论解释金属的导电性,金属的电导率随温度升高而降低。
金属晶体中,自由电子在外加电场作用下,发生定向移动,形成电流,使金属具有良好的导电性。
金属晶体中除自由电子外的金属阳离子在其位置附近振动,加热时,金属阳离子的振动加强,阻碍自由电子的运动,因而金属的电阻随温度升高而增大。
(2)电子气理论解释金属的导热性。
金属晶体中,自由电子在运动中不断地与金属阳离子碰撞,从而发生能量交换,当金属晶体的一端受热,加强了该端的金属阳离子的振动,自由电子将热能迅速地传递到另一端,使金属整体的温度很快的升高,所以金属有很好的导热性。
(3)电子气理论解释金属的延展性。
金属晶体中,当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属有良好的延展性。
钢
合金
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
离子晶体
NaCl晶体
【问题3】离子晶体中,构成的粒子和粒子间相互作用?
Cl
Na+
观察离子晶体的熔点、硬度数据表格,你发现了什么?
一般来说,离子半径越小,离子所带的电荷数越大,离子键就越强,熔沸点越高,硬度越大。
【问题4】NaCl等离子晶体在熔融状态下导电、水溶液导电与金属导电
有什么不同
【问题5】离子晶体是否具有较好的延展性?
发生滑动
施加外力
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
实例
构成晶体的 粒子
粒子间的相互作用或化学键类型
熔点
四类晶体的结构特点(课本P101)
分子
原子
金属阳离子、
自由电子
阴阳离子
分子间作用力
(范德华力、氢键)
共价键
金属键
离子键
较低
较高
差异较大
差异较大
【例】下列物质熔点的比较中,正确的是( )
A.金刚石 < 碳化硅 < 晶体硅
B.CO2 > SiO2 > NaCl
C.SiI4 > SiBr4 > SiCl4
D.Li < Na < K
【提示】
判断晶体的类型
一般地,熔点高低:共价晶体 > 离子晶体 > 分子晶体
共价键强弱←键长←原子半径
原子半径越小,熔点越高、硬度越大。
含有氢键的熔点更高
组成和结构相似时,相对分子质量越大,
分子间作用力越强,熔点越高,硬度越大。
C
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
【问题1】钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
(1)判断晶体的类型。
(2)解释熔点变化的原因。
离子晶体
X-半径增大,离子键减弱
分子晶体
相对分子质量增大,
分子间作用力增加
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
【问题1】TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔
点依次升高,请解释原因。
(1)TiF4是离子化合物,
熔点较高
(2)TiCl4 、 TiBr4、TiI4
是共价化合物
【问题2】为什么由金属元素和非金属元素组成的化合物可能是
共价化合物呢,如何判断?
事实上,纯粹的典型晶体是不多的,大多数晶体结构微粒之间的相互作用和性质是介于不同种类的晶型之间,存在键型过渡。
过渡晶体
电负性差值>1.7,主要形成离子键;
电负性差值<1.7,主要形成共价键。
1.7并不是绝对分界线,而是参考数据
氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键百分数% 62 50 41 33 离子键的百分数更小 过渡晶体
电负性差值越大,离子键成分的百分数越高
第三周期氧化物
离子
晶体
共价
晶体
分子
晶体
实验测定,石墨的熔点高达3850 ℃;有金属光泽、能导电、导热;质地很软,
是非常好的润滑剂。
石墨
问题3:依据石墨性质,判断石墨属于哪种类型的晶体
石墨的结构
二维结构
(2)层内1个C与几个C相连?
这几个C构成的空间结构为?
(3)你认为C的杂化类型为?
键角为?
(1)微粒间的相互作用力类型?
共价键
3个、平面三角
sp2
120°
(4)C价层4个电子,价层电子对数为3对,还有1个单电子,它的参与成键情况?
石墨的结构
未参与杂化的p轨道用于形成π键
离域大π键:所有π电子的游动不局限在2个原子之间,而是扩展到体系内多个原子之间。
范德华力
问题4:依据石墨的结构,解释石墨的性质
石墨的熔点高达3850 ℃;有金属光泽、能导电、导热;质地很软,是非常好的润滑剂。
范德华力
导电性只能沿石墨平面方向
反射性能(金属光泽)
导热性
导电性
金属晶体
具
有
结构中含有
离域大 π 键
石
墨
晶
体
决
定
质软(硬度小)
层与层间
范德华力
决定
分子晶体
具有
熔点高
层内部
共价键
决定
共价晶体
具有
混合晶体:内部结构包含有两种以上键型的晶体(类似石墨晶体)
(传热材料)
(储能材料)
(润滑材料)
(耐火材料)
混合型晶体
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第 1-2 课 时
铜电缆
金属晶体
【问题1】金属晶体中的原子是通过什么作用结合在一起的?
铜的晶体结构模型
铜的晶胞模型
电子气理论
在金属晶体中,由于金属元素的电离能较小,金属原子的原子核对其价电子的吸引力较弱,价电子容易脱离原子核的束缚成为自由电子。
金属键:金属阳离子与自由电子之间的强烈的相互作用
金属键无方向性与饱和性
金属晶体的熔点差异较大,由于形成的金属键强弱不同。
金属键的强弱和自由电子的多少有关、离子半径、电子层结构等复杂因素有关。(高中不做研究)
观察金属晶体的熔点数据表格,你发现了什么?
金属 熔点/℃
Li 180.5
Na 97.81
K 63.65
Rb 38.89
Cs 28.40
铜电缆
铁锅
【问题2】金属晶体具有哪些性质?能否用电子气理论解释?
金箔玫瑰花
导热性
导电性
延展性
(1)电子气理论解释金属的导电性,金属的电导率随温度升高而降低。
金属晶体中,自由电子在外加电场作用下,发生定向移动,形成电流,使金属具有良好的导电性。
金属晶体中除自由电子外的金属阳离子在其位置附近振动,加热时,金属阳离子的振动加强,阻碍自由电子的运动,因而金属的电阻随温度升高而增大。
(2)电子气理论解释金属的导热性。
金属晶体中,自由电子在运动中不断地与金属阳离子碰撞,从而发生能量交换,当金属晶体的一端受热,加强了该端的金属阳离子的振动,自由电子将热能迅速地传递到另一端,使金属整体的温度很快的升高,所以金属有很好的导热性。
(3)电子气理论解释金属的延展性。
金属晶体中,当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属有良好的延展性。
钢
合金
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
离子晶体
NaCl晶体
【问题3】离子晶体中,构成的粒子和粒子间相互作用?
Cl
Na+
观察离子晶体的熔点、硬度数据表格,你发现了什么?
一般来说,离子半径越小,离子所带的电荷数越大,离子键就越强,熔沸点越高,硬度越大。
【问题4】NaCl等离子晶体在熔融状态下导电、水溶液导电与金属导电
有什么不同
【问题5】离子晶体是否具有较好的延展性?
发生滑动
施加外力
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
实例
构成晶体的 粒子
粒子间的相互作用或化学键类型
熔点
四类晶体的结构特点(课本P101)
分子
原子
金属阳离子、
自由电子
阴阳离子
分子间作用力
(范德华力、氢键)
共价键
金属键
离子键
较低
较高
差异较大
差异较大
【例】下列物质熔点的比较中,正确的是( )
A.金刚石 < 碳化硅 < 晶体硅
B.CO2 > SiO2 > NaCl
C.SiI4 > SiBr4 > SiCl4
D.Li < Na < K
【提示】
判断晶体的类型
一般地,熔点高低:共价晶体 > 离子晶体 > 分子晶体
共价键强弱←键长←原子半径
原子半径越小,熔点越高、硬度越大。
含有氢键的熔点更高
组成和结构相似时,相对分子质量越大,
分子间作用力越强,熔点越高,硬度越大。
C
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
【问题1】钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
(1)判断晶体的类型。
(2)解释熔点变化的原因。
离子晶体
X-半径增大,离子键减弱
分子晶体
相对分子质量增大,
分子间作用力增加
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
【问题1】TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔
点依次升高,请解释原因。
(1)TiF4是离子化合物,
熔点较高
(2)TiCl4 、 TiBr4、TiI4
是共价化合物
【问题2】为什么由金属元素和非金属元素组成的化合物可能是
共价化合物呢,如何判断?
事实上,纯粹的典型晶体是不多的,大多数晶体结构微粒之间的相互作用和性质是介于不同种类的晶型之间,存在键型过渡。
过渡晶体
电负性差值>1.7,主要形成离子键;
电负性差值<1.7,主要形成共价键。
1.7并不是绝对分界线,而是参考数据
氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键百分数% 62 50 41 33 离子键的百分数更小 过渡晶体
电负性差值越大,离子键成分的百分数越高
第三周期氧化物
离子
晶体
共价
晶体
分子
晶体
实验测定,石墨的熔点高达3850 ℃;有金属光泽、能导电、导热;质地很软,
是非常好的润滑剂。
石墨
问题3:依据石墨性质,判断石墨属于哪种类型的晶体
石墨的结构
二维结构
(2)层内1个C与几个C相连?
这几个C构成的空间结构为?
(3)你认为C的杂化类型为?
键角为?
(1)微粒间的相互作用力类型?
共价键
3个、平面三角
sp2
120°
(4)C价层4个电子,价层电子对数为3对,还有1个单电子,它的参与成键情况?
石墨的结构
未参与杂化的p轨道用于形成π键
离域大π键:所有π电子的游动不局限在2个原子之间,而是扩展到体系内多个原子之间。
范德华力
问题4:依据石墨的结构,解释石墨的性质
石墨的熔点高达3850 ℃;有金属光泽、能导电、导热;质地很软,是非常好的润滑剂。
范德华力
导电性只能沿石墨平面方向
反射性能(金属光泽)
导热性
导电性
金属晶体
具
有
结构中含有
离域大 π 键
石
墨
晶
体
决
定
质软(硬度小)
层与层间
范德华力
决定
分子晶体
具有
熔点高
层内部
共价键
决定
共价晶体
具有
混合晶体:内部结构包含有两种以上键型的晶体(类似石墨晶体)
(传热材料)
(储能材料)
(润滑材料)
(耐火材料)
混合型晶体
