化学人教版(2019)选择性必修2 3.2分子晶体与共价晶体(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2分子晶体与共价晶体(共30张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-29 17:50:12 | ||
图片预览







文档简介
(共30张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第 1-2 课 时
【回顾】请判断下列固体是否属于晶体?并说明理由。
冰
食盐
钻石
玻璃
分子晶体
离子晶体
共价晶体
铜
金属晶体
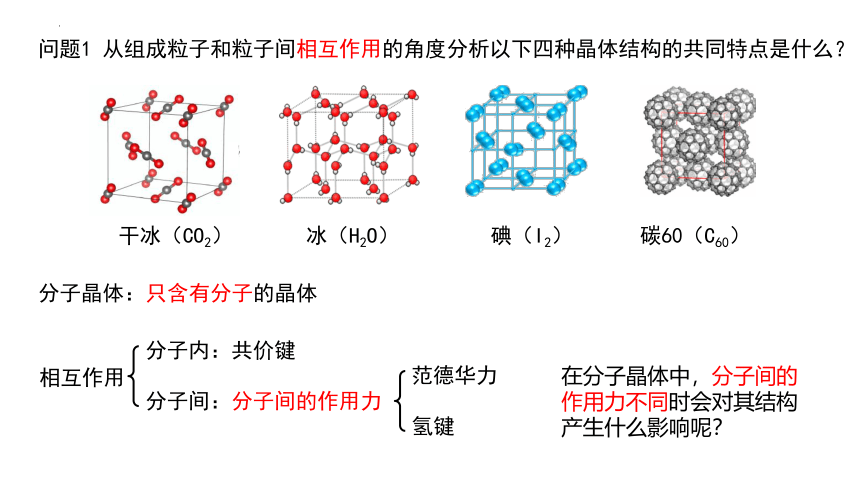
问题1 从组成粒子和粒子间相互作用的角度分析以下四种晶体结构的共同特点是什么?
干冰(CO2) 冰(H2O) 碘(I2) 碳60(C60)
相互作用
分子内:共价键
分子间:分子间的作用力
分子晶体:只含有分子的晶体
在分子晶体中,分子间的作用力不同时会对其结构产生什么影响呢?
范德华力
氢键
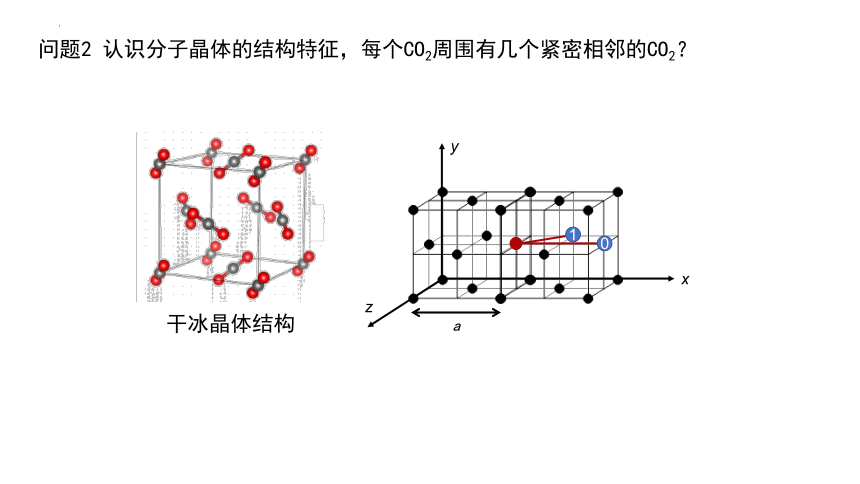
问题2 认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2?
干冰晶体结构
0
1
a
x
y
z
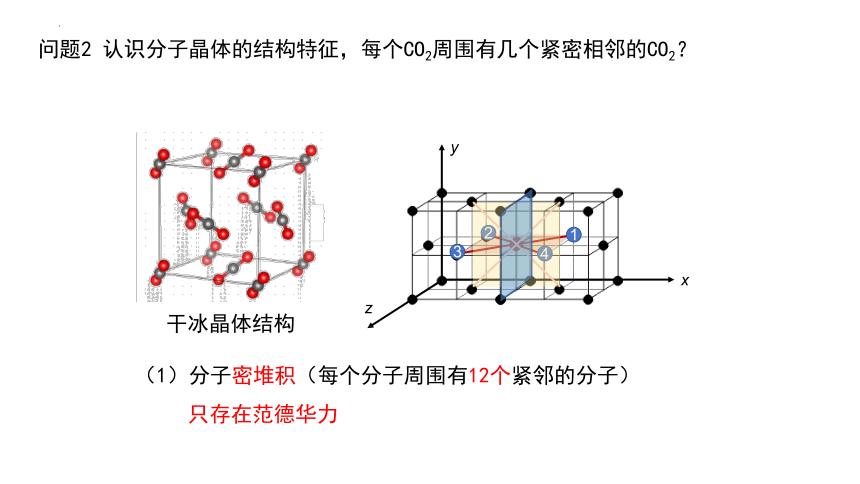
问题2 认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2?
干冰晶体结构
x
y
z
1
2
3
4
(1)分子密堆积(每个分子周围有12个紧邻的分子)
只存在范德华力
问题3 认识分子晶体的结构特征,每个H2O周围有几个紧密相邻的H2O?
冰的晶体结构
冰中的一个水分子
(2)分子非密堆积(每个分子周围紧邻的分子少于12个)
分子间存在氢键
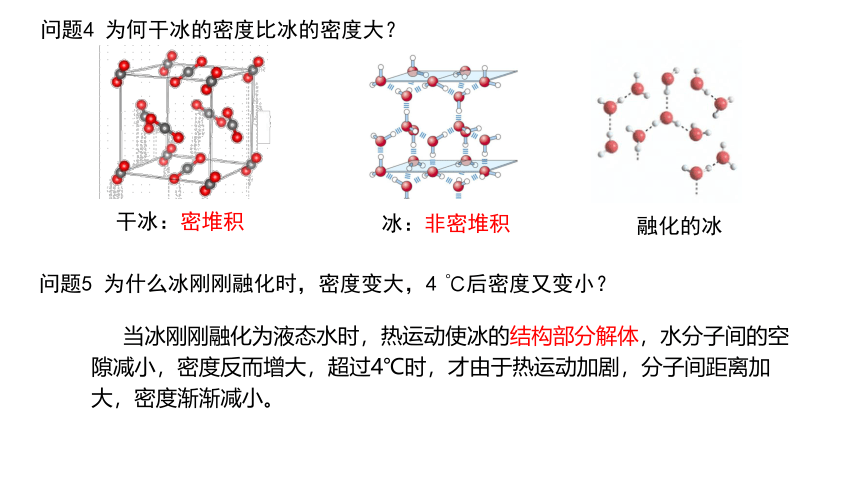
问题4 为何干冰的密度比冰的密度大?
冰:非密堆积
干冰:密堆积
融化的冰
问题5 为什么冰刚刚融化时,密度变大,4 ℃后密度又变小?
当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小。
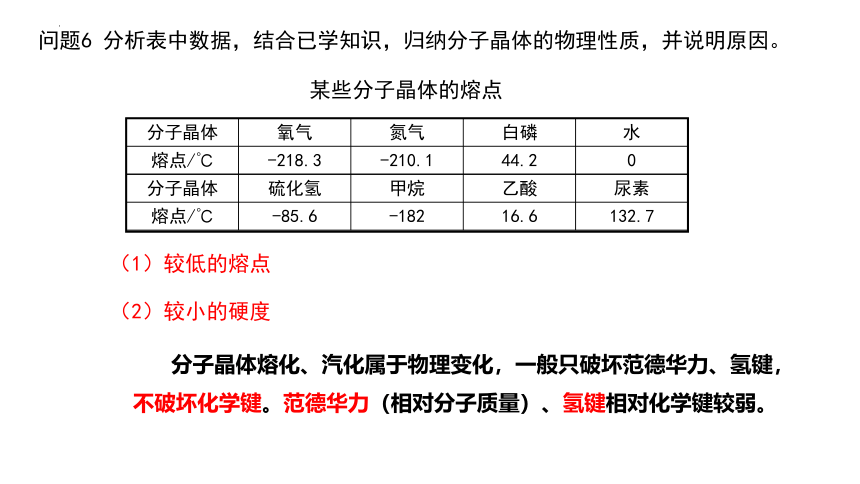
问题6 分析表中数据,结合已学知识,归纳分子晶体的物理性质,并说明原因。
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
某些分子晶体的熔点
分子晶体熔化、汽化属于物理变化,一般只破坏范德华力、氢键,不破坏化学键。范德华力(相对分子质量)、氢键相对化学键较弱。
(1)较低的熔点
(2)较小的硬度
分子
晶体
冰
性质
熔点低
硬度小
分子
分子间作用力
氢 键
范德华力
分子
密堆积
分子
非密堆积
干冰、碘、C60
性质
结构
分子晶体
1. SiCl4的分子结构与CCl4类似,对其做出如下推断:
①SiCl4晶体是分子晶体;②SiCl4熔点高于CCl4的熔点;③常温常压下SiCl4是气体。
其中正确的是( )
①②
2. 判断下列晶体是否属于分子晶体?
H2O 、O2 、 CO2 、 H2SO4 、乙醇、NaCl、Cu
√
√
√
√
√
╳
╳
(1)所有非金属氢化物:H2O 、
(2)部分非金属单质:O2 、
(3)部分非金属氧化物:CO2 、
(5)几乎所有的酸:H2SO4 、
(6)绝大多数有机化合物的晶体:乙醇、
H2S、 NH3 、HX 、CH4 等
H2 、 X2 、 P4 、S8 、C60 等
SO2 、 NO2 、 P4O6 、 P5O10等
HNO3 、H3PO4等
冰醋酸、蔗糖等
【典型的分子晶体】
(4)稀有气体
2Mg+CO2==2MgO+C
点燃
20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
固学案P33—P34:T3、T4、T9 不写
物质 熔点/℃ 沸点/℃
CO2 -56.2 (在527 kPa下测得) -78.5
SiO2 1 723 2 230
干冰
SiO2
【导课】请结合分子晶体的性质,判断SiO2固体是否属于分子晶体?并说明理由。
单晶硅(Si)
金刚石(C)
二氧化硅(SiO2)
【问题1】组成共价晶体的粒子和粒子间的作用力是什么?
共价晶体
共价晶体
(3)常见的共价晶体
某些单质:硼(B)、金刚石(C)、硅(Si)、锗(Ge)和灰锡(Sn)
某些非金属化合物:碳化硅(SiC)、氮化硅(Si3N4)和二氧化硅(SiO2)
(1)组成的粒子:原子
(2)粒子间的作用力:共价键
金刚石晶体的结构特征
金刚石的多面体外形、晶体结构和晶胞示意图
顶点
面心
体内
【问题2】一个金刚石晶胞中,含有几个碳原子?
【问题3】金刚石中,每个碳原子与多少个碳原子成键?
碳原子采取什么杂化方式?
【问题4】金刚石中,1 mol C 形成的共价键数目是多少?
109°28
sp3
共价键
顶点
面心
体内
109°28
sp3
共价键
【问题5】从金刚石结构的角度解释金刚石熔点高,硬度大的原因。
C-C键参数 键长 154 pm 键能
347.7 kJ·mol-1
金刚石性质 熔点 >3 500 ℃ 硬度大
二氧化硅晶体的结构特征
金刚石晶体空间结构
低温石英晶体的空间结构模型
【问题6】二氧化硅晶体结构与金刚石晶体结构有什么相同点和不同点?
在低温石英的结构中,顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
石英的左、右型晶体
二氧化硅晶体中硅氧四面体螺旋结构
石英表
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
*硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是划痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。
某些共价晶体的熔点和硬度
【问题7】根据表中数据,归纳共价晶体的性质特点,并从结构角度解释原因。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
*硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是划痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。
某些共价晶体的熔点和硬度
【问题8】怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
金刚石
SiC
单晶硅
【问题9】从原子结构的角度判断金刚石、碳化硅和硅的熔点和硬度
共价晶体
共价
晶体
原子
共价键
键长
健角
键能
方向性
饱和性
用途
性质
熔点高
硬度大
非密堆积
结构
氮化硅(Si3N4)航天耐高温材料
碳化硅(SiC)砂轮
晶体的类型 分子晶体 共价晶体
概念
组成的粒子
作用力
熔点
硬度
分子晶体与共价晶体对比
晶体的类型 分子晶体 共价晶体
概念 以分子间作用力结合 相邻原子间以共价键结合
组成的粒子 分子 原子
作用力 分子间作用力 共价键
熔点 较低 较高
硬度 小 大
分子晶体与共价晶体对比
1.有下列几种晶体:
A.干冰 B.冰 C.水晶 D.金刚石
(1) 属于共价晶体的是 (填序号,下同)。
(2) 属于分子晶体的是 。
(3) 含化学键且受热熔化时化学键不发生变化的晶体是 ,
受热熔化时需克服共价键的晶体 是 。
(4) 晶体中存在氢键的是 。
A、B
C、D
A、B
C、D
B
【练一练】
2.比较SiO2、CO2、H2O的熔点,并总结比较物质的熔点的方法。
熔点:SiO2 > H2O > CO2
判断
晶体的类型
共价晶体
分子晶体
有氢键
只有
范德华力
>
>
判断
键能的大小
键能越大
熔点越高
判断
分子间的
作用力
相对分子质量大小
氢键的数
目多少
方 法
(1)依据组成晶体的粒子和粒子间的作用力判断
(2)依据性质判断
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第 1-2 课 时
【回顾】请判断下列固体是否属于晶体?并说明理由。
冰
食盐
钻石
玻璃
分子晶体
离子晶体
共价晶体
铜
金属晶体
问题1 从组成粒子和粒子间相互作用的角度分析以下四种晶体结构的共同特点是什么?
干冰(CO2) 冰(H2O) 碘(I2) 碳60(C60)
相互作用
分子内:共价键
分子间:分子间的作用力
分子晶体:只含有分子的晶体
在分子晶体中,分子间的作用力不同时会对其结构产生什么影响呢?
范德华力
氢键
问题2 认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2?
干冰晶体结构
0
1
a
x
y
z
问题2 认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2?
干冰晶体结构
x
y
z
1
2
3
4
(1)分子密堆积(每个分子周围有12个紧邻的分子)
只存在范德华力
问题3 认识分子晶体的结构特征,每个H2O周围有几个紧密相邻的H2O?
冰的晶体结构
冰中的一个水分子
(2)分子非密堆积(每个分子周围紧邻的分子少于12个)
分子间存在氢键
问题4 为何干冰的密度比冰的密度大?
冰:非密堆积
干冰:密堆积
融化的冰
问题5 为什么冰刚刚融化时,密度变大,4 ℃后密度又变小?
当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小。
问题6 分析表中数据,结合已学知识,归纳分子晶体的物理性质,并说明原因。
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
某些分子晶体的熔点
分子晶体熔化、汽化属于物理变化,一般只破坏范德华力、氢键,不破坏化学键。范德华力(相对分子质量)、氢键相对化学键较弱。
(1)较低的熔点
(2)较小的硬度
分子
晶体
冰
性质
熔点低
硬度小
分子
分子间作用力
氢 键
范德华力
分子
密堆积
分子
非密堆积
干冰、碘、C60
性质
结构
分子晶体
1. SiCl4的分子结构与CCl4类似,对其做出如下推断:
①SiCl4晶体是分子晶体;②SiCl4熔点高于CCl4的熔点;③常温常压下SiCl4是气体。
其中正确的是( )
①②
2. 判断下列晶体是否属于分子晶体?
H2O 、O2 、 CO2 、 H2SO4 、乙醇、NaCl、Cu
√
√
√
√
√
╳
╳
(1)所有非金属氢化物:H2O 、
(2)部分非金属单质:O2 、
(3)部分非金属氧化物:CO2 、
(5)几乎所有的酸:H2SO4 、
(6)绝大多数有机化合物的晶体:乙醇、
H2S、 NH3 、HX 、CH4 等
H2 、 X2 、 P4 、S8 、C60 等
SO2 、 NO2 、 P4O6 、 P5O10等
HNO3 、H3PO4等
冰醋酸、蔗糖等
【典型的分子晶体】
(4)稀有气体
2Mg+CO2==2MgO+C
点燃
20世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷,因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
固学案P33—P34:T3、T4、T9 不写
物质 熔点/℃ 沸点/℃
CO2 -56.2 (在527 kPa下测得) -78.5
SiO2 1 723 2 230
干冰
SiO2
【导课】请结合分子晶体的性质,判断SiO2固体是否属于分子晶体?并说明理由。
单晶硅(Si)
金刚石(C)
二氧化硅(SiO2)
【问题1】组成共价晶体的粒子和粒子间的作用力是什么?
共价晶体
共价晶体
(3)常见的共价晶体
某些单质:硼(B)、金刚石(C)、硅(Si)、锗(Ge)和灰锡(Sn)
某些非金属化合物:碳化硅(SiC)、氮化硅(Si3N4)和二氧化硅(SiO2)
(1)组成的粒子:原子
(2)粒子间的作用力:共价键
金刚石晶体的结构特征
金刚石的多面体外形、晶体结构和晶胞示意图
顶点
面心
体内
【问题2】一个金刚石晶胞中,含有几个碳原子?
【问题3】金刚石中,每个碳原子与多少个碳原子成键?
碳原子采取什么杂化方式?
【问题4】金刚石中,1 mol C 形成的共价键数目是多少?
109°28
sp3
共价键
顶点
面心
体内
109°28
sp3
共价键
【问题5】从金刚石结构的角度解释金刚石熔点高,硬度大的原因。
C-C键参数 键长 154 pm 键能
347.7 kJ·mol-1
金刚石性质 熔点 >3 500 ℃ 硬度大
二氧化硅晶体的结构特征
金刚石晶体空间结构
低温石英晶体的空间结构模型
【问题6】二氧化硅晶体结构与金刚石晶体结构有什么相同点和不同点?
在低温石英的结构中,顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
石英的左、右型晶体
二氧化硅晶体中硅氧四面体螺旋结构
石英表
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
*硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是划痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。
某些共价晶体的熔点和硬度
【问题7】根据表中数据,归纳共价晶体的性质特点,并从结构角度解释原因。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
*硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是划痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。
某些共价晶体的熔点和硬度
【问题8】怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
金刚石
SiC
单晶硅
【问题9】从原子结构的角度判断金刚石、碳化硅和硅的熔点和硬度
共价晶体
共价
晶体
原子
共价键
键长
健角
键能
方向性
饱和性
用途
性质
熔点高
硬度大
非密堆积
结构
氮化硅(Si3N4)航天耐高温材料
碳化硅(SiC)砂轮
晶体的类型 分子晶体 共价晶体
概念
组成的粒子
作用力
熔点
硬度
分子晶体与共价晶体对比
晶体的类型 分子晶体 共价晶体
概念 以分子间作用力结合 相邻原子间以共价键结合
组成的粒子 分子 原子
作用力 分子间作用力 共价键
熔点 较低 较高
硬度 小 大
分子晶体与共价晶体对比
1.有下列几种晶体:
A.干冰 B.冰 C.水晶 D.金刚石
(1) 属于共价晶体的是 (填序号,下同)。
(2) 属于分子晶体的是 。
(3) 含化学键且受热熔化时化学键不发生变化的晶体是 ,
受热熔化时需克服共价键的晶体 是 。
(4) 晶体中存在氢键的是 。
A、B
C、D
A、B
C、D
B
【练一练】
2.比较SiO2、CO2、H2O的熔点,并总结比较物质的熔点的方法。
熔点:SiO2 > H2O > CO2
判断
晶体的类型
共价晶体
分子晶体
有氢键
只有
范德华力
>
>
判断
键能的大小
键能越大
熔点越高
判断
分子间的
作用力
相对分子质量大小
氢键的数
目多少
方 法
(1)依据组成晶体的粒子和粒子间的作用力判断
(2)依据性质判断
