5.1硫及其化合物 教案 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1硫及其化合物 教案 高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 518.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-29 20:26:20 | ||
图片预览



文档简介
课题:硫及其化合物
第1课时 硫与二氧化硫
上课时间: 月 日 星期: 节次:
课程标准:
1.结合真实情境中的应用实例或通过实验探究,了解硫的主要性质,认识其在生产中的应用。
2.结合真实情境中的应用实例或通过实验探究,了解二氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响。
3.能说明二氧化硫对环境的影响。
核心素养目标:
1.宏观辨识与微观探析:通过从结构分析硫及二氧化硫的性质,培养学生“宏观辨识与微观探析”的学科素养。
2.科学精神与社会责任:通过对二氧化硫的污染与防治的学习,培养学生“科学精神与社会责任”的学科素养。
教学重点:
SO2的化学性质
教学难点:
掌握二氧化硫性质和用途,区分SO2的漂白性、吸水性、脱水性
教学准备:
实验仪器和实验试剂:
【教学过程】
环节一、硫及其单质
1.硫——重要的非金属元素
(1)硫位于元素周期表中的第三周期第ⅥA族,硫原子最外层有6个电子,在化学反应中容易得到电子,形成-2价硫的化合物。硫元素的原子半径比氯原子半径大,硫原子得电子能力比氯原子弱,硫化氢的稳定性比氯化氢弱。硫元素的非金属性比氧元素弱,在富含氧气的地表附近的含硫化合物中,硫常显+4或+6价,氧为-2价。
2.硫单质
(1)物理性质:①单质硫俗称硫黄,是一种黄色晶体,质脆,易研成粉末。②难溶于水,微溶于酒精,易溶于二硫化碳。
(2)化学性质
写出下列反应的化学方程式
环节二、二氧化硫
1.实验探究
实验一:SO2的物理性质
现象:液面迅速上升,最后充满试管。
结论:SO2有刺激性气味,易溶于水。
实验二:SO2的化学性质
用水溶性实验所得溶液做下列实验
测定溶液的PH:
现象:pH试纸变红 结论:SO2的水溶液显酸性
滴加紫色石蕊溶液:
现象:溶液变红 结论:SO2的水溶液显酸性,不能漂白石蕊溶液
滴加品红溶液:
现象:振荡后溶液红色褪去,再加热溶液恢复红色 结论:SO2具有漂白性,但生成的无色物质不稳定
2.物理性质
颜色 状态 气味 毒性 密度 溶解性
无色 气体 刺激性气味 有毒 比空气大 易溶于水(1∶40)
3.化学性质
(1)从物质分类的方面分析SO2性质
正反应:化学上通常把向生成物方向进行的反应叫做正反应。
逆反应:向反应物方向进行的反应叫做逆反应。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
(2)从元素化合价变化角度分析SO2性质
(3)SO2的特性——漂白性
可使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。
【布置作业】
学法大视野P6效果测评
【教学反思】
课题:硫及其化合物
第2课时 硫酸
上课时间: 月 日 星期: 节次:
课程标准
1.通过实验探究,认识硫酸的主要性质,特别是浓硫酸的特性,认识其在生产中的应用。
2.掌握硫酸根离子的检验方法。
核心素养目标
1.证据推理与模型认知:能从物质类别和元素化合价角度认识硫酸的性质,培养学生“证据推理与模型认知”的学科素养。
2.科学探究与创新意识:通过实验探究硫酸的性质,培养学生“科学探究与创新意识”的学科素养。
重点:浓硫酸的三大特性(强氧化性、吸水性、脱水性)
难点:浓硫酸与金属单质、非金属单质、还原性物质的氧化还原理论的分析
教学准备:
实验仪器和实验试剂:
【教学过程】
环节一、硫酸
硫酸的工业制法
(1)由黄铁矿为原料制取硫酸各阶段的化学方程式:
①4FeS2+11O22Fe2O3+8SO2;
②2SO2+O22SO3;
③SO3+H2O===H2SO4。
(2)工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生水雾,影响SO3的吸收。
2.硫酸具有酸的共性
3.浓硫酸的特性
(1)吸水性
描述现象 蓝色的硫酸铜晶体变为白色的无水硫酸铜粉末
结论 浓硫酸具有吸水性
(2)脱水性
描述现象 蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并释放出有刺激性气味的气体
结论 浓硫酸具有脱水性
【归纳总结】吸水性与脱水性的区别
吸水性 脱水性
原理 浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水 浓硫酸能把有机物中氢、氧元素按水的组成比脱去,剩余黑色的炭
区别 物质中含有H2O 物质中不含有H2O,只含有氢元素和氧元素
应用 作干燥剂
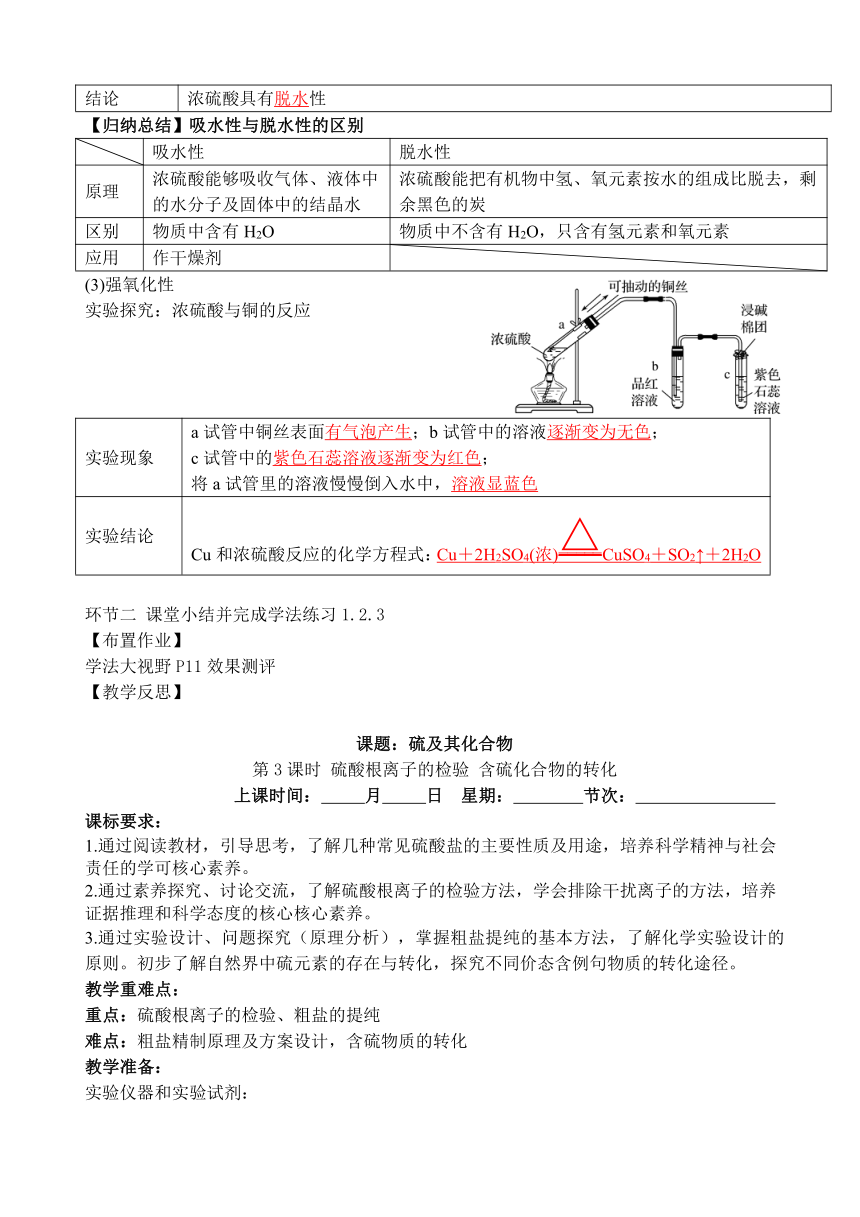
(3)强氧化性
实验探究:浓硫酸与铜的反应
实验现象 a试管中铜丝表面有气泡产生;b试管中的溶液逐渐变为无色; c试管中的紫色石蕊溶液逐渐变为红色; 将a试管里的溶液慢慢倒入水中,溶液显蓝色
实验结论 Cu和浓硫酸反应的化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
环节二 课堂小结并完成学法练习1.2.3
【布置作业】
学法大视野P11效果测评
【教学反思】
课题:硫及其化合物
第3课时 硫酸根离子的检验 含硫化合物的转化
上课时间: 月 日 星期: 节次:
课标要求:
1.通过阅读教材,引导思考,了解几种常见硫酸盐的主要性质及用途,培养科学精神与社会责任的学可核心素养。
2.通过素养探究、讨论交流,了解硫酸根离子的检验方法,学会排除干扰离子的方法,培养证据推理和科学态度的核心核心素养。
3.通过实验设计、问题探究(原理分析),掌握粗盐提纯的基本方法,了解化学实验设计的原则。初步了解自然界中硫元素的存在与转化,探究不同价态含例句物质的转化途径。
教学重难点:
重点:硫酸根离子的检验、粗盐的提纯
难点:粗盐精制原理及方案设计,含硫物质的转化
教学准备:
实验仪器和实验试剂:
【教学过程】
环节一、硫酸根离子的检验
1.硫酸根离子实验探究
实验操作 实验现象 离子方程式
加入BaCl2生成 ,再加入少量稀盐酸,白色沉淀
加入BaCl2生成 ,再加入少量稀盐酸, ,生成
2.硫酸根离子的检验方法
被检液取清液观察有无白色沉淀产生。先加稀盐酸的目的是防止CO、SO、Ag+干扰,再加BaCl2溶液,有白色沉淀产生,说明有SO,可能发生反应的离子方程式:CO+2H+===CO2↑+H2O、SO+2H+===SO2↑+H2O、Ag++Cl-===AgCl↓、Ba2++SO===BaSO4↓。注意盐酸和BaCl2溶液的加入顺序不可颠倒。
【名师点拨】SO检验的三大误区
误区1:只加可溶性钡盐,而不酸化 将导致CO、PO、SO等干扰离子判断成SO。因上述离子会产生BaCO3、Ba3(PO4)2、BaSO3白色沉淀
误区2:误将Ag+判断成SO 如向待测液中滴加BaCl2溶液,再加稀盐酸有白色沉淀便断定含SO。其错误是未注意溶液中不含SO,而含Ag+时也会产生同样的现象:Ag++Cl-===AgCl↓(白色)
误区3:误将SO判断成SO 如先用稀硝酸酸化,再加入BaCl2溶液或向待测液中滴加用稀盐酸酸化的Ba(NO3)2溶液生成白色沉淀,便误以为有SO。该错误是未注意NO在酸性环境中具有强氧化性,将SO氧化成SO而产生干扰
环节二 粗盐提纯原理与操作
1.除去粗盐中可溶性杂质的步骤
2.除去粗盐中可溶性杂质的化学方程式
杂质 加入的试剂 化学方程式
Na2SO4 BaCl2溶液 Na2SO4+BaCl2===BaSO4↓+2NaCl
MgCl2 NaOH溶液 MgCl2+2NaOH===Mg(OH)2↓+2NaCl
CaCl2 Na2CO3溶液 CaCl2+Na2CO3===CaCO3↓+2NaCl
【名师点拨】粗盐提纯时为使杂质离子完全除去,要加入过量的试剂,后续试剂要能够将前面所加的过量试剂除去,由此可知碳酸钠溶液要在氯化钡溶液之后加入,碳酸钠既要除去杂质钙离子还要除去过量的钡离子。
【当堂检测】
学法大视野上的习题
【布置作业】
学法大视野P14效果测评
【教学反思】
课题:硫及其化合物
第4课时 不同价态含硫物质的转化
上课时间: 月 日 星期: 节次:
教学目标:
1.通过阅读教材“资料卡片—自然界中硫的存在和转化”内容,了解含硫物质进入大气的主要途径,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
2.根据硫元素的不同价态,了解硫元素不同价态间的转化及反应条件的控制,理解硫及其化合物的相互转化原理,熟悉常见的化学方程式
3.通过实验探究,知道含不同价态硫元素的物质可以相互转化,并能设计实验进行探究或验证,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
教学重点、难点:
重点:不同价态含硫物质的转化及实验探究
难点:不同价态含硫物质的转化原理
【教学过程】
环节一自然界中硫的存在与转化
1.硫元素广泛存在于自然界中,是植物生长不可缺少的元素,组成生命体的蛋白质中含有硫元素。
2.自然界中游离态的硫存在于火山口附近或地壳的岩层里,煤中也含有少量硫。
3.自然界中化合态的硫广泛存在于硫酸盐、硫化物、火山喷发时释放的气体中、地下水里、动植物体内。
4.自然界中有丰富的含硫元素物质,如下图
(1)将以上含硫物质,填入下列“价—类”二维图中
(2)完成以上转化的化学方程式:
①H2SH2+S↓
②S+O2SO2
③2SO2+O22SO3
④SO3+H2O===H2SO4
⑤SO2+H2O??H2SO3
⑥2H2SO3+O2===2H2SO4
环节二 实验室中研究不同价态含硫物质的转化
1.转化原理
(1)硫元素常见价态及其转化关系
(2)通过氧化还原反应实现不同价态含硫物质的相互转化。
(3)低价态的硫向高价态转化时需加入氧化剂,高价态的硫向低价态转化时需加入还原剂。
2.实验设计
设计实验实现不同价态硫转化,遵循的原则是科学性、可行性、安全性和绿色化。
预期转化 选择试剂 实验操作和现象 实验结论
H2→ 二氧化硫、硫化氢、蒸馏水 将H2S和SO2通入水中,生成淡黄色沉淀(或溶液变浑浊) SO2与H2S反应生成单质硫
O2→
O2→ H2O4 二氧化硫、新制氯水、BaCl2溶液 将SO2通入新制氯水中,溶液浅黄绿色褪去;再向溶液中滴入氯化钡溶液,产生白色沉淀 二氧化硫在水中能被强氧化剂氧化为SO
H2SO4→ SO2 浓硫酸、铜片 加热铜片和浓硫酸的混合物,有刺激性气味气体生成 浓硫酸被金属铜还原为SO2
【当堂检测】
完成学法大视野练习题
【作业布置】
完成学法大视野效果测评习题
【教学反思】
第1课时 硫与二氧化硫
上课时间: 月 日 星期: 节次:
课程标准:
1.结合真实情境中的应用实例或通过实验探究,了解硫的主要性质,认识其在生产中的应用。
2.结合真实情境中的应用实例或通过实验探究,了解二氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响。
3.能说明二氧化硫对环境的影响。
核心素养目标:
1.宏观辨识与微观探析:通过从结构分析硫及二氧化硫的性质,培养学生“宏观辨识与微观探析”的学科素养。
2.科学精神与社会责任:通过对二氧化硫的污染与防治的学习,培养学生“科学精神与社会责任”的学科素养。
教学重点:
SO2的化学性质
教学难点:
掌握二氧化硫性质和用途,区分SO2的漂白性、吸水性、脱水性
教学准备:
实验仪器和实验试剂:
【教学过程】
环节一、硫及其单质
1.硫——重要的非金属元素
(1)硫位于元素周期表中的第三周期第ⅥA族,硫原子最外层有6个电子,在化学反应中容易得到电子,形成-2价硫的化合物。硫元素的原子半径比氯原子半径大,硫原子得电子能力比氯原子弱,硫化氢的稳定性比氯化氢弱。硫元素的非金属性比氧元素弱,在富含氧气的地表附近的含硫化合物中,硫常显+4或+6价,氧为-2价。
2.硫单质
(1)物理性质:①单质硫俗称硫黄,是一种黄色晶体,质脆,易研成粉末。②难溶于水,微溶于酒精,易溶于二硫化碳。
(2)化学性质
写出下列反应的化学方程式
环节二、二氧化硫
1.实验探究
实验一:SO2的物理性质
现象:液面迅速上升,最后充满试管。
结论:SO2有刺激性气味,易溶于水。
实验二:SO2的化学性质
用水溶性实验所得溶液做下列实验
测定溶液的PH:
现象:pH试纸变红 结论:SO2的水溶液显酸性
滴加紫色石蕊溶液:
现象:溶液变红 结论:SO2的水溶液显酸性,不能漂白石蕊溶液
滴加品红溶液:
现象:振荡后溶液红色褪去,再加热溶液恢复红色 结论:SO2具有漂白性,但生成的无色物质不稳定
2.物理性质
颜色 状态 气味 毒性 密度 溶解性
无色 气体 刺激性气味 有毒 比空气大 易溶于水(1∶40)
3.化学性质
(1)从物质分类的方面分析SO2性质
正反应:化学上通常把向生成物方向进行的反应叫做正反应。
逆反应:向反应物方向进行的反应叫做逆反应。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
(2)从元素化合价变化角度分析SO2性质
(3)SO2的特性——漂白性
可使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。
【布置作业】
学法大视野P6效果测评
【教学反思】
课题:硫及其化合物
第2课时 硫酸
上课时间: 月 日 星期: 节次:
课程标准
1.通过实验探究,认识硫酸的主要性质,特别是浓硫酸的特性,认识其在生产中的应用。
2.掌握硫酸根离子的检验方法。
核心素养目标
1.证据推理与模型认知:能从物质类别和元素化合价角度认识硫酸的性质,培养学生“证据推理与模型认知”的学科素养。
2.科学探究与创新意识:通过实验探究硫酸的性质,培养学生“科学探究与创新意识”的学科素养。
重点:浓硫酸的三大特性(强氧化性、吸水性、脱水性)
难点:浓硫酸与金属单质、非金属单质、还原性物质的氧化还原理论的分析
教学准备:
实验仪器和实验试剂:
【教学过程】
环节一、硫酸
硫酸的工业制法
(1)由黄铁矿为原料制取硫酸各阶段的化学方程式:
①4FeS2+11O22Fe2O3+8SO2;
②2SO2+O22SO3;
③SO3+H2O===H2SO4。
(2)工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生水雾,影响SO3的吸收。
2.硫酸具有酸的共性
3.浓硫酸的特性
(1)吸水性
描述现象 蓝色的硫酸铜晶体变为白色的无水硫酸铜粉末
结论 浓硫酸具有吸水性
(2)脱水性
描述现象 蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并释放出有刺激性气味的气体
结论 浓硫酸具有脱水性
【归纳总结】吸水性与脱水性的区别
吸水性 脱水性
原理 浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水 浓硫酸能把有机物中氢、氧元素按水的组成比脱去,剩余黑色的炭
区别 物质中含有H2O 物质中不含有H2O,只含有氢元素和氧元素
应用 作干燥剂
(3)强氧化性
实验探究:浓硫酸与铜的反应
实验现象 a试管中铜丝表面有气泡产生;b试管中的溶液逐渐变为无色; c试管中的紫色石蕊溶液逐渐变为红色; 将a试管里的溶液慢慢倒入水中,溶液显蓝色
实验结论 Cu和浓硫酸反应的化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
环节二 课堂小结并完成学法练习1.2.3
【布置作业】
学法大视野P11效果测评
【教学反思】
课题:硫及其化合物
第3课时 硫酸根离子的检验 含硫化合物的转化
上课时间: 月 日 星期: 节次:
课标要求:
1.通过阅读教材,引导思考,了解几种常见硫酸盐的主要性质及用途,培养科学精神与社会责任的学可核心素养。
2.通过素养探究、讨论交流,了解硫酸根离子的检验方法,学会排除干扰离子的方法,培养证据推理和科学态度的核心核心素养。
3.通过实验设计、问题探究(原理分析),掌握粗盐提纯的基本方法,了解化学实验设计的原则。初步了解自然界中硫元素的存在与转化,探究不同价态含例句物质的转化途径。
教学重难点:
重点:硫酸根离子的检验、粗盐的提纯
难点:粗盐精制原理及方案设计,含硫物质的转化
教学准备:
实验仪器和实验试剂:
【教学过程】
环节一、硫酸根离子的检验
1.硫酸根离子实验探究
实验操作 实验现象 离子方程式
加入BaCl2生成 ,再加入少量稀盐酸,白色沉淀
加入BaCl2生成 ,再加入少量稀盐酸, ,生成
2.硫酸根离子的检验方法
被检液取清液观察有无白色沉淀产生。先加稀盐酸的目的是防止CO、SO、Ag+干扰,再加BaCl2溶液,有白色沉淀产生,说明有SO,可能发生反应的离子方程式:CO+2H+===CO2↑+H2O、SO+2H+===SO2↑+H2O、Ag++Cl-===AgCl↓、Ba2++SO===BaSO4↓。注意盐酸和BaCl2溶液的加入顺序不可颠倒。
【名师点拨】SO检验的三大误区
误区1:只加可溶性钡盐,而不酸化 将导致CO、PO、SO等干扰离子判断成SO。因上述离子会产生BaCO3、Ba3(PO4)2、BaSO3白色沉淀
误区2:误将Ag+判断成SO 如向待测液中滴加BaCl2溶液,再加稀盐酸有白色沉淀便断定含SO。其错误是未注意溶液中不含SO,而含Ag+时也会产生同样的现象:Ag++Cl-===AgCl↓(白色)
误区3:误将SO判断成SO 如先用稀硝酸酸化,再加入BaCl2溶液或向待测液中滴加用稀盐酸酸化的Ba(NO3)2溶液生成白色沉淀,便误以为有SO。该错误是未注意NO在酸性环境中具有强氧化性,将SO氧化成SO而产生干扰
环节二 粗盐提纯原理与操作
1.除去粗盐中可溶性杂质的步骤
2.除去粗盐中可溶性杂质的化学方程式
杂质 加入的试剂 化学方程式
Na2SO4 BaCl2溶液 Na2SO4+BaCl2===BaSO4↓+2NaCl
MgCl2 NaOH溶液 MgCl2+2NaOH===Mg(OH)2↓+2NaCl
CaCl2 Na2CO3溶液 CaCl2+Na2CO3===CaCO3↓+2NaCl
【名师点拨】粗盐提纯时为使杂质离子完全除去,要加入过量的试剂,后续试剂要能够将前面所加的过量试剂除去,由此可知碳酸钠溶液要在氯化钡溶液之后加入,碳酸钠既要除去杂质钙离子还要除去过量的钡离子。
【当堂检测】
学法大视野上的习题
【布置作业】
学法大视野P14效果测评
【教学反思】
课题:硫及其化合物
第4课时 不同价态含硫物质的转化
上课时间: 月 日 星期: 节次:
教学目标:
1.通过阅读教材“资料卡片—自然界中硫的存在和转化”内容,了解含硫物质进入大气的主要途径,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
2.根据硫元素的不同价态,了解硫元素不同价态间的转化及反应条件的控制,理解硫及其化合物的相互转化原理,熟悉常见的化学方程式
3.通过实验探究,知道含不同价态硫元素的物质可以相互转化,并能设计实验进行探究或验证,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
教学重点、难点:
重点:不同价态含硫物质的转化及实验探究
难点:不同价态含硫物质的转化原理
【教学过程】
环节一自然界中硫的存在与转化
1.硫元素广泛存在于自然界中,是植物生长不可缺少的元素,组成生命体的蛋白质中含有硫元素。
2.自然界中游离态的硫存在于火山口附近或地壳的岩层里,煤中也含有少量硫。
3.自然界中化合态的硫广泛存在于硫酸盐、硫化物、火山喷发时释放的气体中、地下水里、动植物体内。
4.自然界中有丰富的含硫元素物质,如下图
(1)将以上含硫物质,填入下列“价—类”二维图中
(2)完成以上转化的化学方程式:
①H2SH2+S↓
②S+O2SO2
③2SO2+O22SO3
④SO3+H2O===H2SO4
⑤SO2+H2O??H2SO3
⑥2H2SO3+O2===2H2SO4
环节二 实验室中研究不同价态含硫物质的转化
1.转化原理
(1)硫元素常见价态及其转化关系
(2)通过氧化还原反应实现不同价态含硫物质的相互转化。
(3)低价态的硫向高价态转化时需加入氧化剂,高价态的硫向低价态转化时需加入还原剂。
2.实验设计
设计实验实现不同价态硫转化,遵循的原则是科学性、可行性、安全性和绿色化。
预期转化 选择试剂 实验操作和现象 实验结论
H2→ 二氧化硫、硫化氢、蒸馏水 将H2S和SO2通入水中,生成淡黄色沉淀(或溶液变浑浊) SO2与H2S反应生成单质硫
O2→
O2→ H2O4 二氧化硫、新制氯水、BaCl2溶液 将SO2通入新制氯水中,溶液浅黄绿色褪去;再向溶液中滴入氯化钡溶液,产生白色沉淀 二氧化硫在水中能被强氧化剂氧化为SO
H2SO4→ SO2 浓硫酸、铜片 加热铜片和浓硫酸的混合物,有刺激性气味气体生成 浓硫酸被金属铜还原为SO2
【当堂检测】
完成学法大视野练习题
【作业布置】
完成学法大视野效果测评习题
【教学反思】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
