化学人教版(2019)选择性必修2 2.3分子结构与物质性质(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3分子结构与物质性质(共34张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-30 00:00:00 | ||
图片预览



文档简介
(共34张PPT)
第二章 分子结构与性质
第三节 分子的结构与物质的性质
第 1-2 课 时
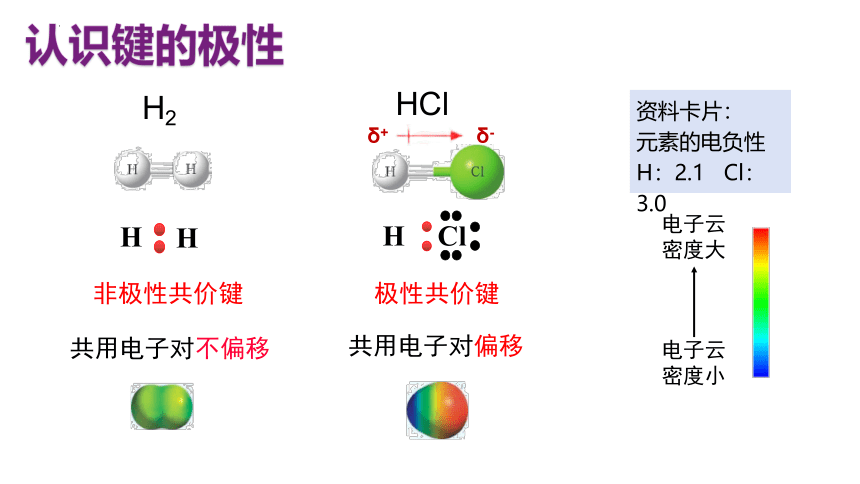
认识键的极性
H2
HCl
H
H
Cl
H
极性共价键
非极性共价键
共用电子对偏移
共用电子对不偏移
电子云
密度大
电子云
密度小
资料卡片:
元素的电负性
H:2.1 Cl:3.0
δ+
δ-
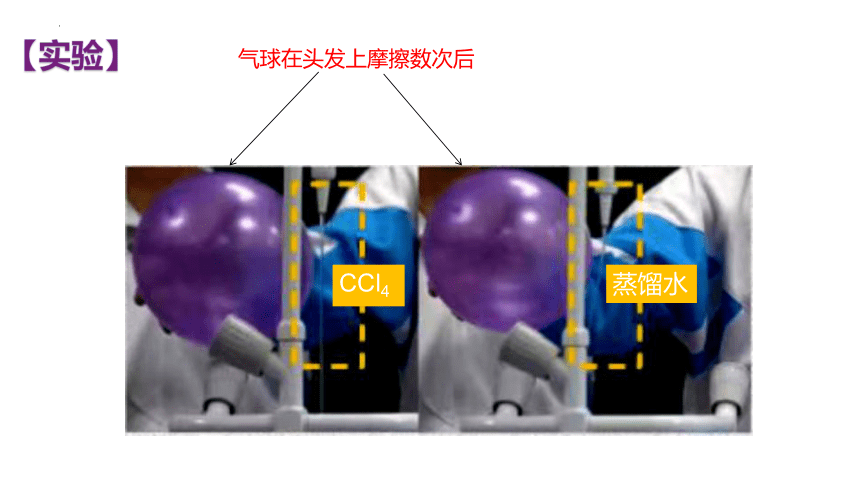
【实验】
CCl4
蒸馏水
气球在头发上摩擦数次后
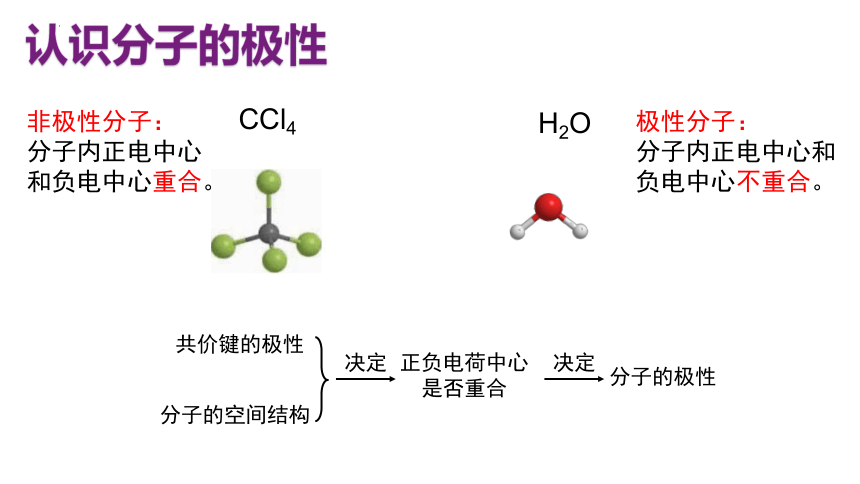
认识分子的极性
H2O
CCl4
非极性分子:
分子内正电中心和负电中心重合。
极性分子:
分子内正电中心和负电中心不重合。
分子的极性
分子的空间结构
共价键的极性
正负电荷中心是否重合
决定
决定
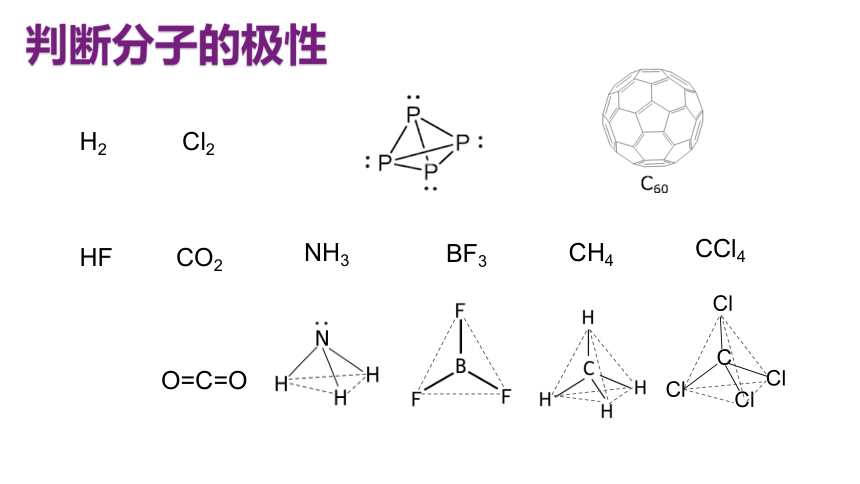
判断分子的极性
H2
Cl2
HF
CO2
CCl4
NH3
CH4
BF3
C
Cl
Cl
Cl
Cl
O=C=O
键的极性对化学性质的影响
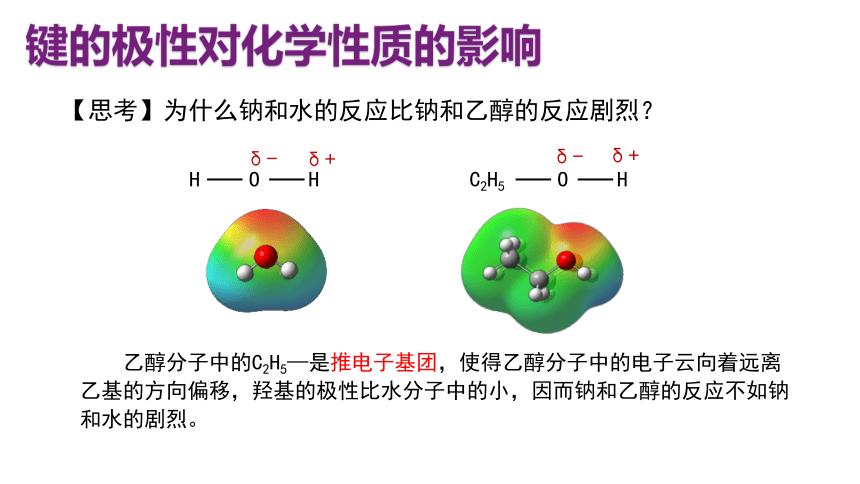
【思考】为什么钠和水的反应比钠和乙醇的反应剧烈?
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
pKa = -lgKa
pKa 越小,酸性越强
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
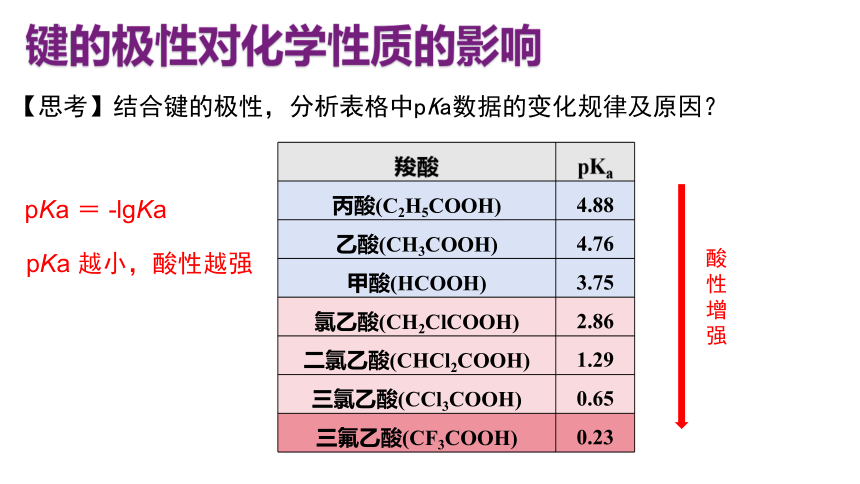
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考】结合键的极性,分析表格中pKa数据的变化规律及原因?
键的极性对化学性质的影响
酸
性
增
强
pKa = -lgKa
pKa 越小,酸性越强
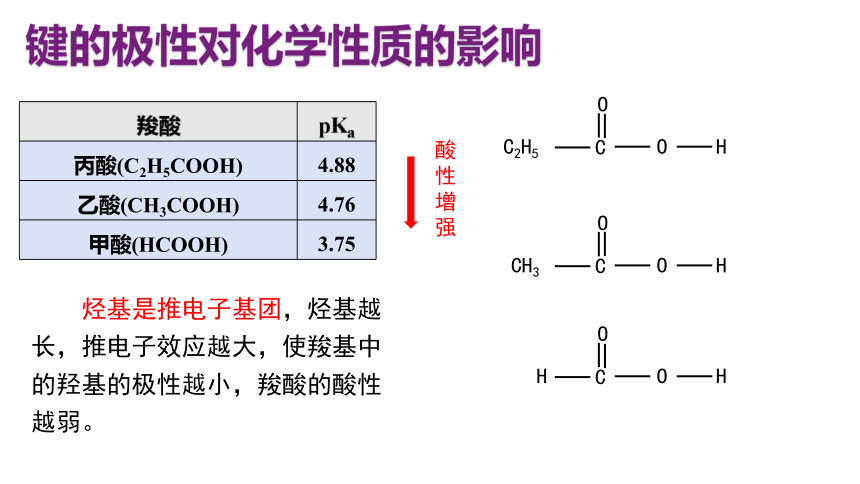
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
键的极性对化学性质的影响
酸
性
增
强
CH3
O
H
O
C
C2H5
O
H
O
C
H
O
H
O
C
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
酸
性
增
强
CH2
O
H
O
C
Cl
CH3
O
H
O
C
CH
O
H
O
C
Cl
Cl
C
O
H
O
C
Cl
Cl
Cl
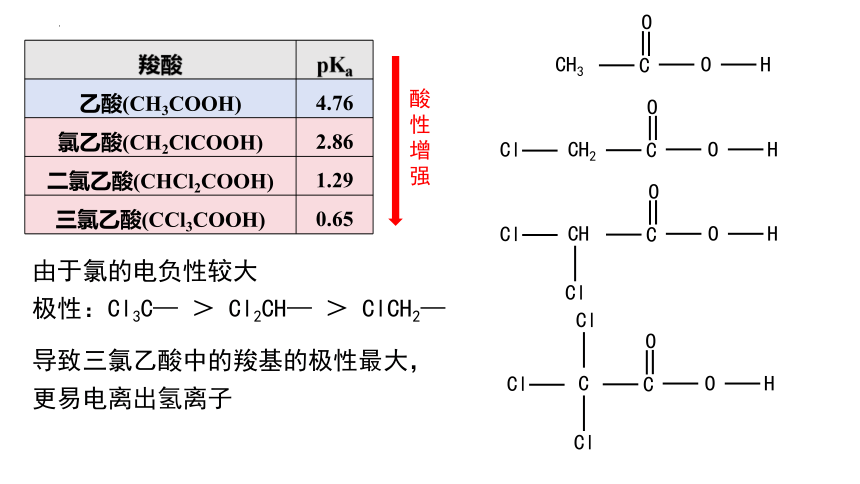
由于氯的电负性较大
极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,
更易电离出氢离子
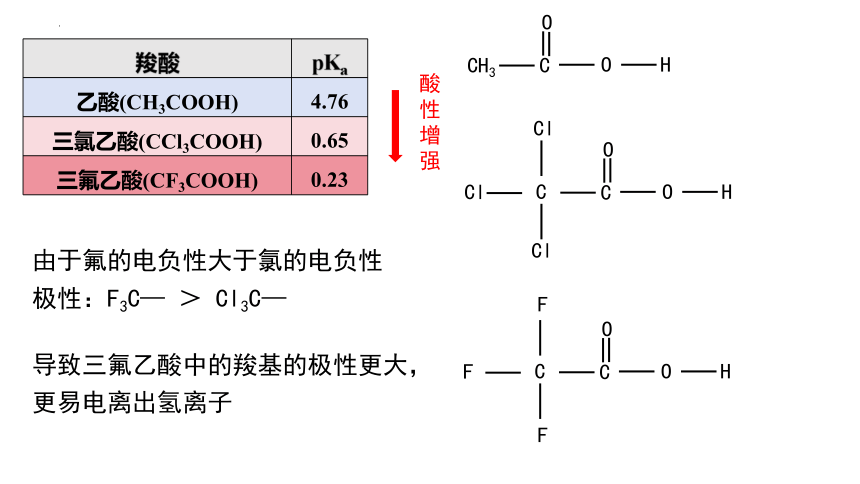
羧酸 pKa
乙酸(CH3COOH) 4.76
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
羧酸 pKa
乙酸(CH3COOH) 4.76
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
酸
性
增
强
CH3
O
H
O
C
C
O
H
O
C
Cl
Cl
Cl
C
O
H
O
C
F
F
F
由于氟的电负性大于氯的电负性
极性:F3C— > Cl3C—
导致三氟乙酸中的羧基的极性更大,
更易电离出氢离子
H2O (l)
H2O (g)
【思考】
是否为化学变化
有没有破坏化学键?
吸收能量克服的作用力?
水分子间存在分子间的作用力
分子间的作用力
范德华
荷兰物理学家范德华最早研究分子间作用力,所以最初也将分子间作用力称为范德华力。
1.范德华力
分子 HCl HBr HI Ar CO
431.8 366 298.7 无 745
21.14 23.11 26.00 8.50 8.75
力
(1)范德华力很弱,比化学键的键能小1~2个数量级
(2)分子结构相似,相对分子质量越大,范德华力越大
(3)相对分子质量相同或相近时,分子的极性越大,范德华力越大
分析表中数据,思考范德华力的大小有什么特点?
1.范德华力
分子 HCl HBr HI Ar CO
21.14 23.11 26.00 8.50 8.75
熔点/℃ -114.2 -86 -50.8 -189.2 -205
沸点/℃ -85 -67 -35.1 -185.9 -191.5
力
分子的极性越大
相对分子质量越大
范德华力
越大
物质的熔、沸点
越高
应用:预测第IVA族、第VIA族元素的氢化物的沸点相对大小
第VIA族:
【思考】为什么H2O的相对分子质量比H2S的小,
而沸点比H2S的高得多?
第IVA族:
2.氢键
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。
- - - - - -
467 11 18.8
氢键比化学键的键能小,不属于化学键,是除范德华力外的另一种分子间的作用力。
力
以冰晶体为例:
2.氢键
O—H
…
O
N—H
…
N
F—H
…
F
2.氢键
邻羟基苯甲醛(熔点-7 ℃)
对羟基苯甲醛(熔点115 ℃)
分
子
间氢
键
分
子
内
氢
键
能形成分子间氢键的物质,熔沸点升高
能形成分子内氢键的物质,会削弱分子间的作用力,熔沸点反常(降低)
化学键 范德华力 氢键
存在范围 分子内,原子间 分子之间 分子之间
作用力 强弱 较强 比化学键的键能小1~2个数量级 比化学键的键能小1~2个数量级
对物质性质的影响 主要影响 化学性质 主要影响物理性质(如熔、沸点) 主要影响物理性质
(如熔、沸点)
【小结】
键长
3.溶解性
用CCl4萃取碘水中的I2
极性分子
H2O
碘
非极性分子
CCl4
“相似相溶”
非极性溶质一般能溶于非极性溶剂,
而极性溶质一般能溶于极性溶剂。
名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
某些物质在293 K,100 g水中的溶解度
分子结构的相似性
3.溶解性
气体的溶解度(气体的压强为1.01×10 5 Pa,温度为293 K,在100 g水中的溶解度) 气体 溶解度/g 气体 溶解度/g
氨气 52.9 氢气 0.000 16
二氧化硫 11.28 甲烷 0.002 3
二氧化碳 0.169 氮气 0.001 9
氯气 0.729 氧气 0.004 3
(1)分子的极性
(4)形成氢键
(3)发生化学反应
(2)分子结构的相似性
(物质在水中的溶解性的影响因素)
尝试着将这两个分子叠合,它们能叠合吗?
两个分子互为镜像,但不能相互叠合
分子的手性
像这样具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子
搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,并思考二者是否是同种分子?
CH2ClBr
绕轴旋转
能叠合
互为镜像关系的分子能叠合,是同种分子
搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,并思考二者是否是同种分子?
CHFClBr
互为镜像关系的分子不能叠合,不是同种分子
绕轴旋转
不能叠合
分子的手性
同一个碳原子上连有四个不同的原子(基团)
互为镜像的分子在三维空间里不能叠合
互为手性异构体
*
*
*
*
*
用“ * ”标出分子中的手性碳原子
链接高考(全国甲卷)
分子中有_______个手性碳
5
*
*
*
*
*
原子
分子
物质
共价键
σ键
π键
键能
键长
键角
键的强弱
分子的空间结构
分子间的
作用力
范德华力
氢键
分子极性
相对分子质量
空间结构
VSEPR模型
预测
杂化轨道理论
解释
类 型
键 参 数
极 性:
极性键 非极性键
极性分子 非极性分子
分子的结构与性质
测定
红外光谱法
质谱法
应用:甲醛(HCHO)
中心原子的价层电子对(σ键电子对 + 孤电子对)
第二章 分子结构与性质
第三节 分子的结构与物质的性质
第 1-2 课 时
认识键的极性
H2
HCl
H
H
Cl
H
极性共价键
非极性共价键
共用电子对偏移
共用电子对不偏移
电子云
密度大
电子云
密度小
资料卡片:
元素的电负性
H:2.1 Cl:3.0
δ+
δ-
【实验】
CCl4
蒸馏水
气球在头发上摩擦数次后
认识分子的极性
H2O
CCl4
非极性分子:
分子内正电中心和负电中心重合。
极性分子:
分子内正电中心和负电中心不重合。
分子的极性
分子的空间结构
共价键的极性
正负电荷中心是否重合
决定
决定
判断分子的极性
H2
Cl2
HF
CO2
CCl4
NH3
CH4
BF3
C
Cl
Cl
Cl
Cl
O=C=O
键的极性对化学性质的影响
【思考】为什么钠和水的反应比钠和乙醇的反应剧烈?
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
pKa = -lgKa
pKa 越小,酸性越强
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
【思考】结合键的极性,分析表格中pKa数据的变化规律及原因?
键的极性对化学性质的影响
酸
性
增
强
pKa = -lgKa
pKa 越小,酸性越强
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
键的极性对化学性质的影响
酸
性
增
强
CH3
O
H
O
C
C2H5
O
H
O
C
H
O
H
O
C
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
酸
性
增
强
CH2
O
H
O
C
Cl
CH3
O
H
O
C
CH
O
H
O
C
Cl
Cl
C
O
H
O
C
Cl
Cl
Cl
由于氯的电负性较大
极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,
更易电离出氢离子
羧酸 pKa
乙酸(CH3COOH) 4.76
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
羧酸 pKa
乙酸(CH3COOH) 4.76
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
酸
性
增
强
CH3
O
H
O
C
C
O
H
O
C
Cl
Cl
Cl
C
O
H
O
C
F
F
F
由于氟的电负性大于氯的电负性
极性:F3C— > Cl3C—
导致三氟乙酸中的羧基的极性更大,
更易电离出氢离子
H2O (l)
H2O (g)
【思考】
是否为化学变化
有没有破坏化学键?
吸收能量克服的作用力?
水分子间存在分子间的作用力
分子间的作用力
范德华
荷兰物理学家范德华最早研究分子间作用力,所以最初也将分子间作用力称为范德华力。
1.范德华力
分子 HCl HBr HI Ar CO
431.8 366 298.7 无 745
21.14 23.11 26.00 8.50 8.75
力
(1)范德华力很弱,比化学键的键能小1~2个数量级
(2)分子结构相似,相对分子质量越大,范德华力越大
(3)相对分子质量相同或相近时,分子的极性越大,范德华力越大
分析表中数据,思考范德华力的大小有什么特点?
1.范德华力
分子 HCl HBr HI Ar CO
21.14 23.11 26.00 8.50 8.75
熔点/℃ -114.2 -86 -50.8 -189.2 -205
沸点/℃ -85 -67 -35.1 -185.9 -191.5
力
分子的极性越大
相对分子质量越大
范德华力
越大
物质的熔、沸点
越高
应用:预测第IVA族、第VIA族元素的氢化物的沸点相对大小
第VIA族:
【思考】为什么H2O的相对分子质量比H2S的小,
而沸点比H2S的高得多?
第IVA族:
2.氢键
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。
- - - - - -
467 11 18.8
氢键比化学键的键能小,不属于化学键,是除范德华力外的另一种分子间的作用力。
力
以冰晶体为例:
2.氢键
O—H
…
O
N—H
…
N
F—H
…
F
2.氢键
邻羟基苯甲醛(熔点-7 ℃)
对羟基苯甲醛(熔点115 ℃)
分
子
间氢
键
分
子
内
氢
键
能形成分子间氢键的物质,熔沸点升高
能形成分子内氢键的物质,会削弱分子间的作用力,熔沸点反常(降低)
化学键 范德华力 氢键
存在范围 分子内,原子间 分子之间 分子之间
作用力 强弱 较强 比化学键的键能小1~2个数量级 比化学键的键能小1~2个数量级
对物质性质的影响 主要影响 化学性质 主要影响物理性质(如熔、沸点) 主要影响物理性质
(如熔、沸点)
【小结】
键长
3.溶解性
用CCl4萃取碘水中的I2
极性分子
H2O
碘
非极性分子
CCl4
“相似相溶”
非极性溶质一般能溶于非极性溶剂,
而极性溶质一般能溶于极性溶剂。
名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
某些物质在293 K,100 g水中的溶解度
分子结构的相似性
3.溶解性
气体的溶解度(气体的压强为1.01×10 5 Pa,温度为293 K,在100 g水中的溶解度) 气体 溶解度/g 气体 溶解度/g
氨气 52.9 氢气 0.000 16
二氧化硫 11.28 甲烷 0.002 3
二氧化碳 0.169 氮气 0.001 9
氯气 0.729 氧气 0.004 3
(1)分子的极性
(4)形成氢键
(3)发生化学反应
(2)分子结构的相似性
(物质在水中的溶解性的影响因素)
尝试着将这两个分子叠合,它们能叠合吗?
两个分子互为镜像,但不能相互叠合
分子的手性
像这样具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子
搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,并思考二者是否是同种分子?
CH2ClBr
绕轴旋转
能叠合
互为镜像关系的分子能叠合,是同种分子
搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,并思考二者是否是同种分子?
CHFClBr
互为镜像关系的分子不能叠合,不是同种分子
绕轴旋转
不能叠合
分子的手性
同一个碳原子上连有四个不同的原子(基团)
互为镜像的分子在三维空间里不能叠合
互为手性异构体
*
*
*
*
*
用“ * ”标出分子中的手性碳原子
链接高考(全国甲卷)
分子中有_______个手性碳
5
*
*
*
*
*
原子
分子
物质
共价键
σ键
π键
键能
键长
键角
键的强弱
分子的空间结构
分子间的
作用力
范德华力
氢键
分子极性
相对分子质量
空间结构
VSEPR模型
预测
杂化轨道理论
解释
类 型
键 参 数
极 性:
极性键 非极性键
极性分子 非极性分子
分子的结构与性质
测定
红外光谱法
质谱法
应用:甲醛(HCHO)
中心原子的价层电子对(σ键电子对 + 孤电子对)
